胰島素受體亞型改變及相關通路活化在糖尿病小鼠腸上皮細胞過度增殖中的作用*
歐陽慧, 夏忠勝, 楊洪生, 于 濤, 盧錫基, 許稷豪, 陳其奎
(中山大學孫逸仙紀念醫院消化內科,廣東 廣州 510120)
?
胰島素受體亞型改變及相關通路活化在糖尿病小鼠腸上皮細胞過度增殖中的作用*
歐陽慧,夏忠勝,楊洪生,于濤△,盧錫基,許稷豪,陳其奎
(中山大學孫逸仙紀念醫院消化內科,廣東 廣州 510120)
[摘要]目的: 探討胰島素受體亞型改變及其相關下游通路活化情況在糖尿病小鼠腸上皮細胞異常增殖中的作用。 方法: 用腹腔注射鏈脲霉素的方法制作糖尿病小鼠模型,采用增殖細胞核抗原標記法比較糖尿病小鼠及對照組小鼠腸上皮細胞的增殖情況。利用RT-PCR法測定胰島素受體亞型表達比例在2組中的差異。采用real-time PCR及Western blot法分別從mRNA和蛋白質水平檢測2組之間胰島素受體相關通路各分子MEK1/2、ERK1/2、PI3K以及Akt的表達情況。 結果: 糖尿病組小鼠的小腸上皮細胞增殖指數顯著升高(P<0.05),且細胞中胰島素受體亞型IR-A/IR-B的比值也明顯升高(P<0.05)。糖尿病小鼠腸上皮細胞中MEK1、MEK2和ERK1/2的mRNA水平及磷酸化蛋白水平均高于對照組(P<0.05)。 結論: 糖尿病小鼠腸上皮細胞過度增殖可能與其中胰島素受體亞型IR-A/IR-B的比值增高及其相關MEK/ERK通路的激活有關。
[關鍵詞]糖尿病; 腸上皮細胞; 胰島素受體; 細胞增殖
近年來,我國糖尿病(diabetes mellitus,DM)的患病率迅速增長,而糖尿病腸病作為DM常見的并發癥之一也越來越受到關注。DM患者中有大約10%~20%具有消化道癥狀,主要表現為胃腸道的功能障礙,如腹脹、頑固性腹瀉和吸收不良等。越來越多的研究發現,糖尿病腸病患者的腸道除了功能異常,其腸上皮細胞(intestinal epithelial cells,IECs)還呈現出過度增殖的狀態,但其機制尚未完全闡明[1-2]。
胰島素受體(insulin receptors,IR)在體內廣泛分布于肝臟、脂肪、肌肉、腸道上皮等組織中,其結構與胰島素樣生長因子1受體相似,具有IR-A和IR-B 2個亞型,其亞型比例的改變與后續下游信號通路的活化密切相關[3-4]。近年來許多研究發現胰島素樣生長因子與細胞增殖、分化及多種腫瘤的發生有關,而IR是胰島素樣生長因子系統的重要組成部分,這提示著IR亞型比例的改變也可能在細胞增殖、分化及腫瘤的發生發展過程中也起著重要的作用[5-6]。然而,目前IR受體亞型比例改變對促進DM腸道上皮細胞增殖作用的研究報道較少,具體機制尚不明確。因此,本研究旨在觀察IR受體亞型的改變及其下游相關通路的活化情況與DM小鼠IECs過度增殖的關系。
材料和方法
1主要試劑
鏈脲霉素購自Sigma;EDTA和DTT購自上海碧云天生物技術有限公司;增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)、IR、相關MEK/ERK和PI3K/Akt通路中關鍵分子的多克隆抗體,HRP標記山羊抗兔IgG(H+L),U0126均購自CST;TRIzol?試劑盒購自Life Technology; mRNA逆轉錄試劑盒和RT-PCR試劑盒購自TaKaRa;ECL試劑盒購自Santa Cruz;其它生化試劑均為進口分裝或國產分析純;相關引物由上海生工生物工程技術服務有限公司根據設計合成。
2實驗動物
實驗動物為SPF級C57BL/6J小鼠,共40只,雌雄各半,鼠齡8周,體重19~20 g,購于中山大學實驗動物中心,實驗動物的所有實驗過程均在中山大學實驗倫理委員會的監督指導下完成,符合實驗動物倫理學要求。
3主要方法
3.1DM小鼠模型的建立及處理40只C57BL/6J小鼠隨機分為2組,一組為DM組(30只),另外一組為正常對照組(10只)。DM組小鼠給予腹腔內注射鏈脲霉素(70 mg/kg),每天1次,連續5 d,正常對照組給予相同體積的0.1 mol/L檸檬酸緩沖液腹腔注射,每天1次,連續5 d。小鼠血糖值隨機測得大于16.7 mmol/L至少超過3次,并持續穩定在該水平以上為DM小鼠造模成功[7]。于第10周時發現30只DM小鼠血糖仍維持在16.7 mmol/L以上,選取DM小鼠與正常對照小鼠各10只斷頸處死,沿腹部正中線切開腹腔,分離完整小腸(從幽門至回盲部)進行后續研究。
選取造模成功的DM小鼠20只,隨機分為二甲基亞砜(dimethyl sulfoxide,DMSO)組(10只)和U0126組(10只)。其中U0126為MEK激酶抑制劑,特異性抑制MEKK1激活,抑制MAPKs級聯反應,溶解于DMSO,經尾靜脈注射(4 d注射1次),連續10周。
3.2PCNA法測定腸上皮細胞增殖指數將4%多聚甲醛固定后的小腸組織進行石蠟包埋,制備組織切片。切片組織經常規脫蠟、水化,過氧化酶阻斷劑孵育10 min,非免疫羊血清孵育10 min,PCNA I抗(1∶250稀釋)4 ℃孵育過夜,II抗37 ℃室溫孵育30 min,鏈霉素抗生物素-過氧化物酶孵育10 min,DAB顯色5 min,磷酸鹽緩沖液終止顯色,蘇木素復染30 s,常規脫水、封片后置于顯微鏡下觀察。光鏡下觀察PCNA陽性細胞的位置及表達情況。在400倍的觀察條件下,計算每個視野中小腸隱窩內PCNA陽性細胞的數目。隨機選擇10個視野計數分析,取均值做后續統計。
3.3原代小鼠IECs的分離及鑒定去除小腸系膜,沿縱軸切開小腸,用預冷的無菌PBS清洗數次,加入分離液I(DPBS + 30 mmol/L EDTA + 1.5 mmol/L DTT),冰上放置20 min,之后將整段小腸轉移至分離液II(DPBS + 30 mmol/L EDTA)中,37 ℃水浴10 min,劇烈搖晃30 s,棄去殘留的腸段,將余下的液體以2 500 r/min離心5 min,沉淀重懸于10 mL的PBS中,重復該步驟2次。沉淀重懸液為所分離的小腸上皮細胞,在倒置顯微鏡下進行觀察。對上述分離到的原代小腸上皮細胞進一步消化,制備單細胞懸液, 以 CD24 作為 IECs 的表面標志,以 CD45 作為混雜的間質細胞的表面標志, 分別在 PE 及 APC 熒光抗體標記后,使用流式細胞儀分選CD24lowCD45-細胞組分。
3.4半定量RT-PCR及real-time PCR提取上述兩組IECs總RNA,采用分光光度法測定總RNA質量及濃度。各取0.5 μg總RNA,逆轉錄成cDNA。按照下述條件行IR的PCR分析(共35個循環):94 ℃ 30 s;59 ℃ 30 s;72 ℃ 1 min。回收PCR產物進行瓊脂糖凝膠電泳及半定量分析IR-A/IR-B的比值。采用2.5%瓊脂糖凝膠,電泳條件為90 V(恒壓)電泳30 min,結束后進行凝膠圖像記錄及分析。Real-time PCR按照試劑盒說明書進行,反應條件為95 ℃ 15 s;60 ℃ 1 min,共40個循環。以18S rRNA為內參照計算基因的相對表達量。PCR反應的引物序列見表1。
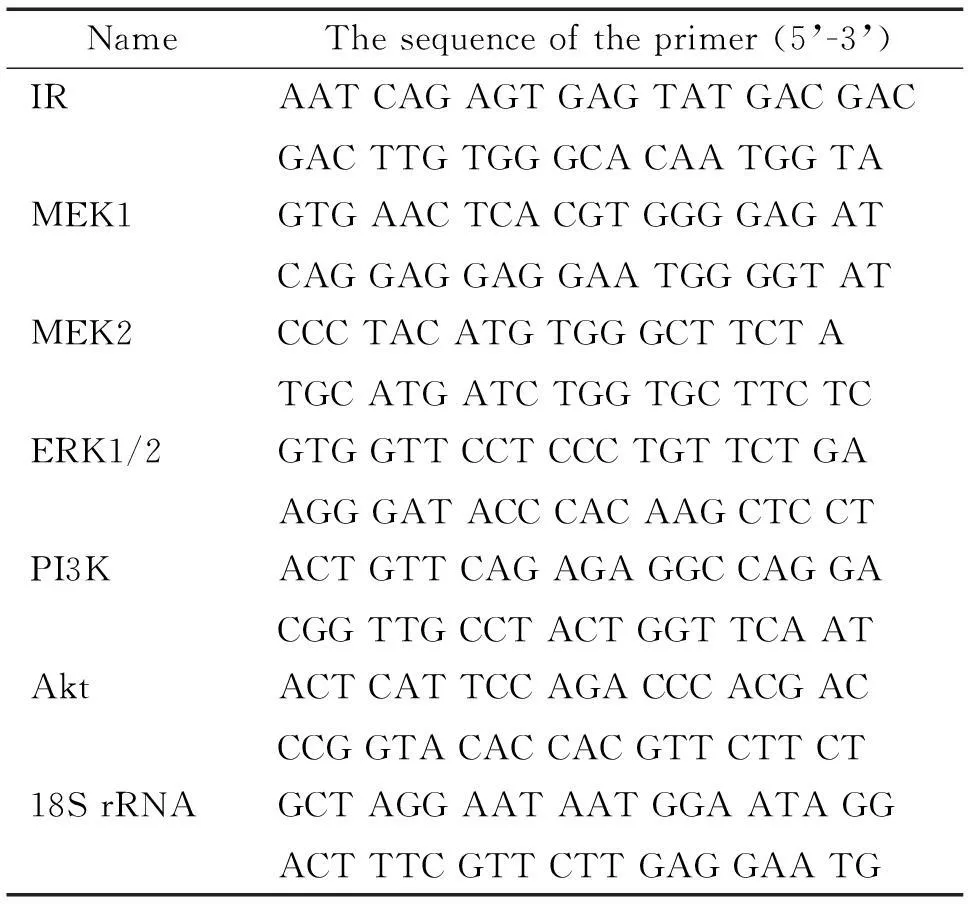
表1 PCR的引物序列
3.5Western blot實驗收集上述各組的IECs,用組織蛋白裂解液裂解細胞,置于冰上30 min,然后12 000 r/min離心20 min。用BCA法測定總蛋白濃度。定量后上樣,進行SDS-PAGE,然后以200 mA恒流電轉2 h后,用5%脫脂牛奶封閉1 h,加入I抗(IR、p-MEK、MEK、p-ERK、ERK、PI3K、p-Akt和Akt均為1∶1 000稀釋;β-actin為1∶5 000稀釋)4 ℃孵育過夜,TBST洗膜3遍,在HRP標記的II抗(1∶5 000稀釋)中室溫孵育1 h,TBST洗4遍,曝光、顯影與定量分析。
4統計學處理
用SPSS 13.0統計軟件進行分析。計量資料采用均數±標準差(mean±SD)表示,兩組間均數比較采用獨立樣本的t檢驗。以P<0.05為差異有統計學意義。
結果
1DM小鼠小腸上皮增殖過度
采用免疫組化染色的方法對DM組及對照組小鼠小腸上皮表達PCNA的情況進行了測定。結果顯示,DAB染色陽性的細胞主要分布于兩組小腸上皮隱窩的底部及下段。與對照組小鼠相比,DM小鼠小腸上皮組織PCNA增殖指數顯著升高,見圖1。
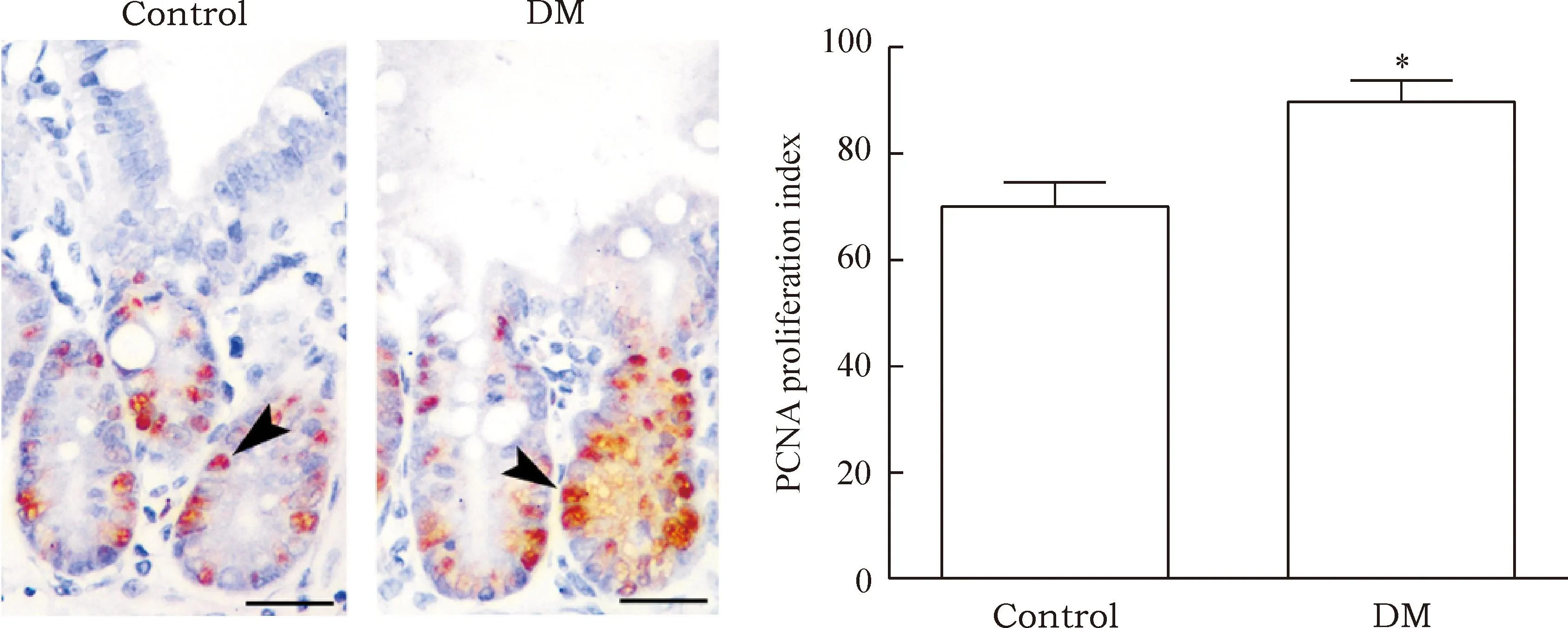
Figure 1.Abnormal proliferation of IECs in the DM mice (PCNA immunohistochemical staining,×400, scale bar=25 μm). The arrow heads indicate PCNA positive cells.Mean±SD.n=10.*P<0.05vscontrol group.
圖1DM小鼠小腸上皮組織出現增殖過度的改變
2原代小鼠IECs的鑒定
采用EDTA分離及差異離心法分離到的原代小鼠IECs組分中含有大量隱窩細胞及絨毛。流式細胞技術的檢測結果顯示,原代分離的小鼠IECs中CD24lowCD45-細胞比例為10.99%,見圖2。
3DM小鼠原代IECs中IR表達上調及IR亞型比例改變
Western blot實驗結果顯示,DM組小鼠小腸上皮表達IR的蛋白質水平顯著高于對照組(P<0.05)。RT-PCR結果顯示,DM小鼠的原代IECs內IR亞型IR-A/IR-B的比值高于正常對照小鼠(P<0.05),見圖3。
4DM小鼠小腸上皮內IR下游相關通路MEK/ERK及PI3K/Akt的變化
MEK/ERK及PI3K/Akt通路是IR下游重要的相關信號通路。結果顯示,DM組小腸上皮內MEK1、MEK2和ERK1/2的mRNA水平表達均較正常對照組明顯升高(P<0.05)。蛋白質水平上,DM組小腸上皮內磷酸化狀態的p-MEK1/2及p-ERK1/2與其總的表達水平的比值也較正常組明顯升高(P<0.05),見圖4A、B。
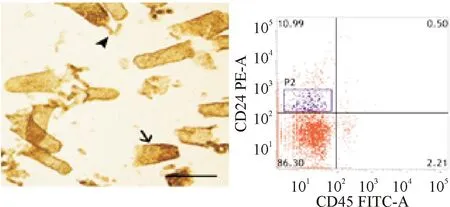
Figure 2.The identification of primary IECs of mice (×400,scale bar=25 μm).The arrow head indicates intestinal crypt cell, while the arrow indicates intestinal villus cell.
圖2原代小鼠IECs的鑒定
另一下游通路的重要分子PI3K和Akt的mRNA水平在DM組和對照組小腸上皮內的表達之間無顯著的統計學差異。蛋白質水平上,PI3K、Akt及p-Akt的水平在兩組間的差異無統計學顯著性,見圖4C、D。
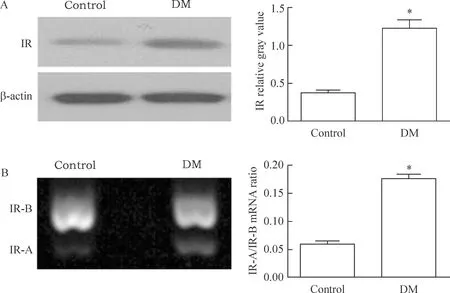
Figure 3.The IR protein expression (A) and IR-A/IR-B mRNA ratio (B) in the IECs of DM mice. Mean±SD.n=10.*P<0.05vscontrol group.
圖3DM小鼠IEC高表達IR及IR亞型比例改變
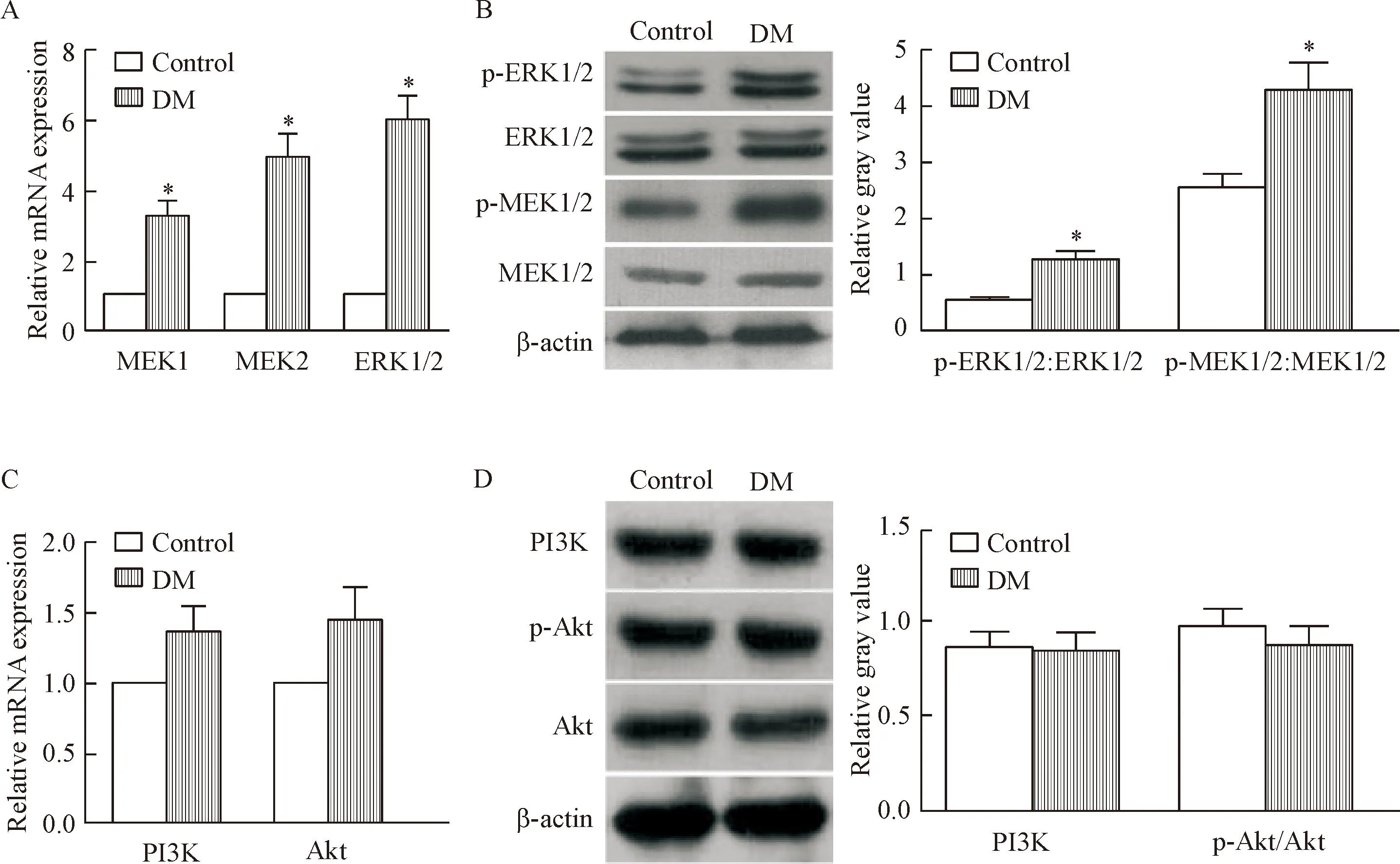
Figure 4.The activation of MEK/ERK (A,B) and PI3K/Akt(C,D) pathways in the IECs of DM mice. Mean±SD.n=10.*P<0.05vscontrol group.
圖4IR下游相關通路MEK/ERK及PI3K/Akt的活化情況
5U0126對糖尿病小鼠IECs中MEK/ERK通路的影響及其對糖尿病小鼠IECs異常增殖的影響
U0126是MEK激酶抑制劑,特異性抑制MEKK1激活,抑制MAPKs級聯反應。Western blot結果顯示,U0126組小鼠小腸上皮內磷酸化狀態的p-MEK1/2及p-ERK1/2與其總蛋白水平的比值也較DMSO組明顯升高(P<0.05)。免疫組化顯示,與DMSO小鼠相比,U0126組小鼠小腸上皮組織的PCNA增殖指數顯著降低(P<0.05),見圖5。
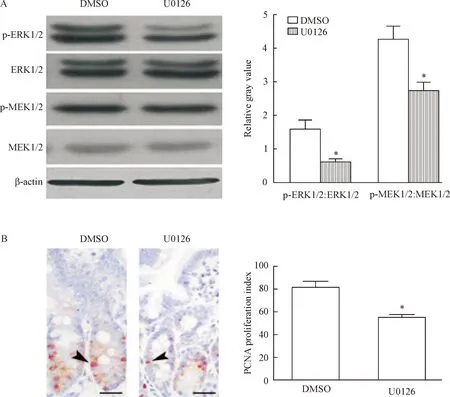
Figure 5.Down-regulation of the MEK/ERK pathway by U0126 (A) normalized the abnormal proliferation (B) of IECs in DM mice (PCNA immunohistochemical staining,×400, scale bar=25 μm). Mean±SD.n=10.*P<0.05vsDMSO group.
圖5U0126對糖尿病小鼠IECs中MEK/ERK通路的影響及其對糖尿病小鼠IECs異常增殖的影響
討論
糖尿病腸病作為糖尿病患者常見并發癥之一,其發病機制可能為內臟神經疾患、腸道的運動功能失常、腸道菌群失調、腸道激素分泌紊亂等。此外,Sano等及本研究組均發現,糖尿病患者除了表現出胃腸功能障礙的臨床表現,還存在罹患腸道腫瘤的風險增加及結腸上皮過度增殖的現象[7-9]。這些研究提示了糖尿病患者腸道上皮增殖過度也是一個重要的病理改變,但其具體的機制尚未完全闡明。
本次研究以本研究組既往成果為基礎,采用PCNA標記法評價DM小鼠及對照組小鼠小腸上皮細胞的增殖情況。結果顯示,DM小鼠小腸上皮組織中PCNA陽性細胞均位于隱窩下段及底部,同時,增殖指數明顯高于正常對照小鼠,進一步證實了DM小鼠腸道存在增殖過度的現象[7]。目前,DM導致腸上皮細胞異常增殖的具體機制未明,過去的研究發現,胰高血糖素樣肽-2(glucagon-like peptide-2, GLP-2)在DE腸上皮異常增殖過程中起著重要的作用[10]。另有研究也發現,腸上皮隱窩中的Paneth細胞分泌的EGF可在局部作用于臨近的腸上皮干細胞并促進后者的增殖和分化[11]。DM狀態下腸上皮細胞的異常增殖是個很復雜的過程,上述提到的研究成果可能只是其機制的一部分,其具體機制尚有待進一步的研究。
IR屬于酪氨酸激酶超家族,由2個α亞基和2個β亞基共同組成四聚體跨膜糖蛋白。IR有2種亞型:缺少外顯子11的IR-A和包含外顯子11的IR-B,這兩者由IR轉錄蛋白選擇性剪切而來[12]。胰島素與IR胞外的α亞基結合后,激活IR的酪氨酸激酶自身磷酸化,然后通過2條主要信號通路發揮生物學作用:(1) PI3K/Akt通路,PI3K由一個調節亞基p85和一個催化亞基p110組成,通過磷酸肌醇依賴性激酶1使Akt活化,激活Akt下游一些酶的活化,如GSK-3、蛋白激酶C等,參與蛋白質的合成和細胞的增殖、分化;(2) MEK/ERK通路。IR活化后可以激活Ras,Ras是一個具有GTP酶活性的GTP結合蛋白,和GTP結合后,活化的Ras可募集激活甘/絲氨酸激酶Raf至細胞膜,繼而激活MEK激酶,再進一步磷酸化甘氨酸/絲氨酸殘基激酶ERK1/2,ERK1/2轉移至細胞核內調節細胞增殖相關基因的轉錄,以控制蛋白合成和細胞生長[13]。這2條通路是IR發揮其生物學效應的主要途徑。
為進一步闡明DM小鼠IECs出現過度增殖的機制,我們對IR受體亞型的表達及下游的MEK/ERK、PI3K/Akt通路進行了測定。結果顯示,IR-A/IR-B的比值在DM組顯著增高,這一表達特征與其在一些高度增殖狀態的細胞中表達的情況相一致,如乳腺癌、結腸癌、肺癌等[14]。而接下來對于IR下游2條主要與細胞增殖有關通路活化情況的研究表明,與對照組相比,DM小鼠IECs中MEK/ERK通路的活化狀態顯著升高,而PI3K/Akt通路卻與對照組水平一致,無明顯改變。進一步的研究結果表明,利用U0126抑制MEK/ERK通路能有效降低DM小鼠IEC的異常增殖。這一結果提示,在DM小鼠IECs增殖過度的過程中IR亞型改變(IR-A亞型上調)所激發的下游通路是MEK/ERK通路,這一通路的激活直接引起了DM小鼠IECs的過度增殖,相反,另外一條通路——PI3K/Akt通路在DM中并未受到激活,說明其與這一病理改變關系不大。然而,更深入的調控機制還需要在今后的研究中進一步完善。
綜上所述,DM小鼠小腸上皮出現了IR亞型比例的改變(IR-A亞型相對上調),這一改變可能通過激活下游的MEK/ERK通路導致小腸上皮出現增殖過度,而使用MEK/ERK通路抑制劑U0126能有效抑制這種異常增殖,這一結果為臨床上DM患者腸道腫瘤高發的研究提供了實驗基礎。
[參考文獻]
[1]Rayner CK, Horowitz M. Gastrointestinal motility and glycemic control in diabetes: the chicken and the egg revisited?[J]. J Clin Invest, 2006, 116(2):299-302.
[2]Zhao J, Yang J, Gregersen H. Biomechanical and morphometric intestinal remodelling during experimental diabetes in rats[J]. Diabetologia, 2003, 46(12): 1688-1697.
[3]Ullrich A, Bell JR, Chen EY, et al. Human insulin receptor and its relationship to the tyrosine kinase family of oncogenes [J]. Nature, 1985, 313(6005):756-761.
[4]Taguchi A, White MF. Insulin-like signaling, nutrient homeostasis, and life span[J]. Annu Rev Physiol, 2008, 70:191-212.
[5]Pandini G, Frasca F, Mineo R, et al. Insulin/insulin-like growth factor I hybrid receptors have different biological characteristics depending on the insulin receptor isoform involved[J]. J Biol Chem, 2002, 277(42):39684-39695.
[6]萬璟,李小毛,舒珊榮,等. 慢病毒介導的靶向沉默胰島素樣生長因子1型受體的siRNA對人子宮內膜癌細胞遷移和侵襲能力的影響[J]. 中國病理生理雜志, 2012, 28(8):1352-1357.
[7]Sano T, Ozaki K, Kodama Y, et al. Prevention of proliferative changes of forestomach mucosa by blood glucose control with insulin in alloxan-induced diabetic rats[J]. Cancer Sci, 2009, 100(4): 595-600.
[8]Li JY, Yu T, Xia ZS, et al. Enhanced proliferation in colorectal epithelium of patients with type 2 diabetes correlates with beta-catenin accumulation[J]. J Diabetes Complications, 2014, 28(5): 689-697.
[9]Ebina Y, Ellis L, Jarnagin K, et al. The human insulin receptor cDNA: the structural basis for hormone-activated transmembrane signalling[J]. Cell, 1985, 40(4): 747-758.
[10]Fischer KD, Dhanvantari S, Drucker DJ, et al. Intestinal growth is associated with elevated levels of glucagon-like peptide 2 in diabetic rats[J]. Am J Physiol, 1997, 273(4 Pt 1):E815-E820.
[11]Sato T, van Es JH, Snippert HJ, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330):415-418.
[12]Sciacca L, Prisco M, Wu A, et al. Signaling differences from the A and B isoforms of the insulin receptor (IR) in 32D cells in the presence or absence of IR substrate-1[J]. Endocrinology, 2003, 144(6): 2650-2658.
[13]Min XH, Yu T, Qing Q, et al. Abnormal differentiation of intestinal epithelium and intestinal barrier dysfunction in diabetic mice associated with depressed Notch/NICD transduction in Notch/Hes1 signal pathway[J]. Cell Biol Int, 2014, 38(10):1194-1204.
[14]Slaaby R, Schaffer L, Lautrup-Larsen I, et al. Hybrid receptors formed by insulin receptor (IR) and insulin-like growth factor I receptor (IGF-IR) have low insulin and high IGF-1 affinity irrespective of the IR splice variant[J]. J Biol Chem, 2006,281(36):25869-25874.
(責任編輯: 盧萍, 羅森)
MEK/ERK pathway activated by changing insulin receptor isoform is associated with abnormal proliferation of intestinal epithelial cells in diabe-tic mice
OUYANG Hui, XIA Zhong-sheng, YANG Hong-sheng, YU Tao, LU Xi-ji, XU Ji-hao, CHEN Qi-kui
(DepartmentofGastroenterology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:yutao2014@126.com)
[ABSTRACT]AIM: To investigate the role of insulin receptor (IR)-A/IR-B ratio and the downstream pathway in abnormal proliferation of intestinal epithelial cells (IECs) in diabetic mice. METHODS: Diabetes mouse models were induced by intraperitoneal streptozocin injection. The proliferating cell nuclear antigen (PCNA) proliferation rates in the small intestine tissue were evaluated by immunohistochemical methods. The expression of IR isoforms was detected by RT-PCR. To ensure that the downstream pathways of IR are involved, real-time PCR and Western blot were performed to detect the expression of MEK1/2, ERK1/2, PI3K and Akt. RESULTS: In diabetic mice, the PCNA proliferation rates were higher than those in control group (P<0.05), and a high ratio of IR-A/IR-B was detected in the IECs (P<0.05). The mRNA expression of MEK1, MEK2, ERK1/2 and their phosphorylated protein levels in the diabetic mice were significantly higher than those in control group (P<0.05). CONCLUSION: The over-proliferation of IECs in the diabetic mice is associated with high IR-A/IR-B ratio and up-regulation of IR/MEK/ERK pathway.
[KEY WORDS]Diabetes mellitus; Intestinal epithelial cells; Insulin receptor; Cell proliferation
[文章編號]1000- 4718(2016)05- 0874- 06
[收稿日期]2015- 11- 09[修回日期] 2016- 01- 11
*[基金項目]國家自然科學基金資助項目(No.81370475)
通訊作者△Tel: 020-81332598; E-mail: yutao2014@126.com
[中圖分類號]R363
[文獻標志碼]A
doi:10.3969/j.issn.1000- 4718.2016.05.018
雜志網址: http://www.cjpp.net

