內生菌次生代謝產物提高玉米滲透脅迫抗性的表達譜分析
王娜龔娜劉國麗馬曉穎楊鎮楊濤
(1. 遼寧省農業科學院植物營養與環境資源研究所遼,沈陽 110161;2. 遼寧省農業科學院微生物工程中心,沈陽 110161)
內生菌次生代謝產物提高玉米滲透脅迫抗性的表達譜分析
王娜1龔娜2劉國麗2馬曉穎2楊鎮2楊濤2
(1. 遼寧省農業科學院植物營養與環境資源研究所遼,沈陽 110161;2. 遼寧省農業科學院微生物工程中心,沈陽 110161)
利用基因芯片技術對10% PEG 滲透脅迫下植物內生菌次生代謝產物處理的玉米進行差異基因表達譜分析。結果顯示,檢測到的差異表達基因共計441個,其中上調表達基因147個,下調表達基因294個,參與21條代謝通路。采用晶芯生物分子功能注釋系統 V 3.0(MAS)將差異表達基因進行GO功能分類,其中45%基因參與各種生物學過程;18%基因與生成各種細胞組分有關;36%基因編碼產物則與執行各種分子功能有關;1%與GenBank 中功能未知序列相對應。KEGG 代謝分析表明差異表達基因廣泛涉及基礎物質代謝、能量代謝、次生代謝及信號轉導途徑。表達譜分析結果表明,在滲透脅迫下次生代謝產物對玉米的影響是一個多基因參與、多個生物途徑協同調控的過程。
內生真菌;玉米;滲透脅迫;基因表達譜
我國玉米約2/3是旱作種植,從播種到收獲整個生育期都可遭遇干旱[1]。干旱使玉米減產25%-30%,甚至絕收,成為影響我國玉米產量的第一限制因素[2,3]。近幾年,植物內生菌次生代謝產物因具有促進作物生長、增強抗逆性、抗病蟲害及對環境友好等優點,引起廣泛重視,已成為國內外研究的熱點。因此應用植物內生菌次生代謝產物提高玉米滲透脅迫抗性,將是改善以干旱為主的非生物脅迫的重要手段,同時闡明次生代謝產物提高玉米滲透脅迫抗性的機制是抗旱育種和栽培技術改良的理論基礎。基因芯片是一種檢測基因差異表達的高通量技術[4]。目前,此技術已成功應用于非生物脅迫下擬南芥、玉米、水稻的功能基因組研究[5]。本研究采用基因芯片技術研究滲透脅迫下植物內生菌次生代謝產物對玉米基因表達的影響。
1 材料與方法
1.1 材料
植物內生菌次生代謝產物由本實驗室提供;供試玉米雜交種為新奇518。
采用水培實驗,將次生代謝產物包衣的種子置于10% PEG-6000 溶液中培養,晝夜溫度控制在26/18℃,3次重復。2葉期時取玉米根系0.5 g,液氮中保存,用于提取總 RNA。
1.2 方法
1.2.1 總RNA的提取 取100 mg根系于液氮中迅速研磨,至預冷離心管中,加1 mL Trizol 試劑,振蕩30 s,室溫放置5 min,加200 μL 三氯甲烷,振蕩15 s,室溫放置3 min。4℃(下同),12 000 r/min離心10 min,取上清液加等體積異丙醇混勻,室溫放置 10 min,12 000 r/min離心10 min,棄上清液。沉淀用1 mL 75%乙醇清洗,12 000 r/min離心5 min。棄上清,室溫放置5 min。沉淀溶于 30 μL RNasefree 的水中,-80℃保存備用。用紫外分光光度計和甲醛變性凝膠電泳檢測RNA 樣品的質量。
1.2.2 探針的制備 采用RNeasyMinElute Cleanup Kit純化 總RNA, 采 用One-cycl e cDNA Synthesis Kit將RNA反轉錄為dscDNA,該cDNA純化由GeneChip Sample Cleanup Module來 完 成。 根 據GeneChip IVTLabeling Kit將純化的cDNA制備為生物素標記的cRNA。生物素標記的cRNA于94℃保溫,35 min進行片段化處理,片段化的cRNA即為雜交探針備用。
1.2.3 雜交及洗滌 取適量片段化的cRNA 與試驗芯片(experi-mentalchip)進行雜交,16 h,60 r/min 旋轉。洗脫和染色于Affymetrix公司的Genechipfluidics station 洗滌工作站中進行。
1.2.4 數據檢測 采用GeneChip Scanner3000高分辨率掃描儀掃描染色后的芯片,掃描所得數據利用 Affymetrix Gene Chip Operating Software Version1.4軟件進行處理。然后對芯片上的數據用 Robust Multichip Analysis(RMA)方法進行歸一化,最后篩選出 Ratio≥2 或≤0.5 的基因作為差異表達基因。
1.2.5 數據分析 應用晶芯生物分子功能注釋系統(Capital-Bio Molecule Annotation System,MAS)以及NCBI 數據庫(http://www.ncbi.nlm.nih.gov)分析篩選的差異表達基因。
2 結果
2.1 總RNA質量檢測
用Trizol 法提取玉米根尖總RNA。甲醛變性凝膠電泳檢測,結果(圖1)顯示,RNA條帶清晰,完整性較好,28S∶18S rRNA條帶亮度大于或接近2∶1,總量≥8 μg,A260/A280≥1.80(表1),樣品純度、總量及完整性均符合表達譜芯片實驗要求。

表1 總RNA檢測結果
2.2 芯片數據分析
2.2.1 差異表達基因的篩選 采用Affymetrix Gene Chip Operating Software Version1.4軟件統計芯片雜交數據,通過分析Cy3、Cy5兩種熒光信號強度,可獲得雜交信號強度的散點圖。芯片上每一個基因點的雜交信號就會通過一個數據點顯示(圖2)。Ratio值為各點(Cy5,Cy3)的坐標比值。一般設定 Cy5/Cy3的正常比值(Ratio)在 0.5-2.0 之間,即圖中黑點。Ratio≥2.0 為上調基因,圖中紅點;Ratio≤0.5 為下調基因,圖中綠點。采用RMA歸一化方法篩選差異表達基因,結果顯示Ratio>2和<0.5的差異基因共441個,其中上調147個,下調294個(圖2)。在上調基因中Ratio>3.0的22個,Ratio>4.0的6個,下調基因中Ratio < 0.4的基因104個,Ratio < 0.3的基因29個。表2中列舉了部分表達量變化較大的重要基因及其功能描述。

圖1 總RNA電泳圖
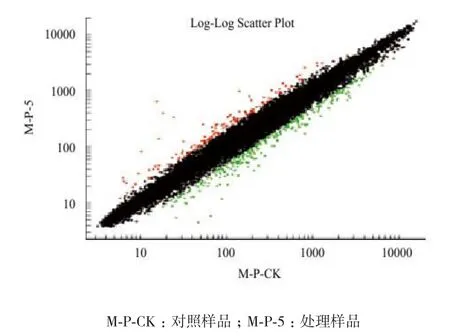
圖2 雜交信號散點圖

表2 表達量變化較大的基因
2.2.2 差異表達基因的GO分類 通過Gene Ontology(簡稱GO)體系對處理與對照間差異表達的441個基因進行功能分類與注釋。如圖3所示,其中參與各種生物學過程(biological process)的基因占45%;與生成各種細胞組分(celluar component)有關的基因占18%;編碼產物則與執行各種分子功能(molecularfunction)有關的基因占36%;與GenBank中功能未知序列(other items)相對應的基因占1%,這些基因所起的作用還需進一步研究。按其生物學功能可分為21類(圖4),其中與分子功能相關基因包括轉運體活性(占2.27%)、結合反應(占9.98%)、催化反應(占21.09%)等共3個類別;細胞組分主要表現為膜關閉內腔(占0.23%)、細胞器部分(占10.88%)、細胞器(占10.88%)、細胞組分(占16.10%)、細胞(占16.33%)、復雜大分子(占6.35%)等共6個類別;生物學過程主要表現在定位的建立(占5.22%)、發育過程(占3.85%)、定位(占5.44%)、多細胞的生物過程(占3.63%)、生殖過程(占0.45%)、繁殖(占0.68%)、應激反應(占3.63%)、生物過程調節(占4.99%)、生物調節(占5.22%)、新陳代謝(占21.77%)、生理過程(占34.47%)、細胞過程(占33.33%)等共12個類別,這說明滲透脅迫下植物內生菌次生代謝產物處理玉米后引起許多生理生化過程的變化。比較各功能類型中基因的數量發現,與催化反應、新陳代謝、生理過程、細胞過程相關基因占絕大多數。從表達基因的數量來看,與膜關閉內腔、生殖過程、繁殖相關的3類基因僅表現為上調表達,而與復雜大分子相關的基因僅表現為下調表達;而其余各功能類型基因,均為下調表達基因的數量多于上調。說明滲透脅迫下植物內生菌次生代謝產物處理玉米后,引起根系中基因表達量下調較多。

圖3 差異表達基因功能分類

圖4 上、下調差異表達基因的功能分類
2.2.3 代謝途徑的變化情況 利用KEGG 數據庫對篩選出的441個差異表達基因進行功能注釋和分類,確定其參與的主要代謝途徑(pathway)。結果(圖5)顯示,差異表達基因分布在21個代謝途徑中,全部為下調代謝途徑。這些差異表達基因廣泛涉及能量代謝、次生代謝及基礎物質代謝等。與蛋白、糖類和核酸等3類生物大分子代謝相關的途徑共占總量的66.7%,輔酶代謝相關的途徑占14.3%,氧化磷酸化、次生代謝和信號轉導相關途徑所占比例相對較低。如圖5所示,滲透脅迫下植物內生菌次生代謝產物引起玉米根系各個代謝途徑中基因數量變化較小而p-Value值差異非常顯著。p-Value值越小說明這條代謝途徑受影響越顯著。其中蛋白酶體、蛋氨酸代謝、甘氨酸、絲氨酸和蘇氨酸代謝、糖酵解和糖異生受影響最為顯著,檸檬酸循環(TCA循環)、嘧啶代謝、嘌呤代謝受影響最不顯著。
3 討論
在干旱、鹽堿等滲透脅迫條件下,植物通過改變基因表達,調控代謝途徑等作出響應。本研究通過對差異表達基因的分析,表明在滲透脅迫下次生代謝產物對玉米的影響是一個多基因參與、多個生物過程協同調控的過程,基因表達量的變化可能是調控的主要方式,同時基因表達量差異較大的基因也不能忽略。本研究采用基因芯片技術,在玉米根系中共檢測到17 556個基因,其中差異表達的基因441個,包括147個上調基因,294個下調基因,說明滲透脅迫下次生代謝產物引起玉米根系基因的表達發生了變化。利用KEGG數據庫進行查詢,結果表明這些基因參與了21條生物學代謝通路,說明次生代謝產物通過多個生物過程協同作用來調控玉米適應滲透脅迫。

圖5 下調代謝途徑
在滲透脅迫下,植物為了能繼續生存,從3個層次上做出相應調整,最終適應環境:調控正常生長發育;控制造成的傷害和修復;重新均衡體內狀況[6]。由于脅迫所產生的活性氧,它們損傷植物的蛋白質、膜脂及細胞組分等,是導致植物損傷的一個重要原因。參與抗氧化保護 反應的酶類主要有谷胱甘肽轉移酶(GST),谷胱甘肽氧化酶(GPOX),過氧化物酶(POD),超氧化物歧化酶(SOD),過氧化氫酶(CAT)等。其中GST是主要成員,可與內源或外源有害物質結合,使其分解,或形成易溶于水的物質,排出體外,從而達到 解毒的目的[7,8]。Shimabukuro等[9]于1970年最先報道因除草劑形成的氧脅迫能誘導玉米中GST大量表達,使除草劑阿特津脫毒,激發植物的防御反應。Gallé等[10]用PEG處理小麥,耐旱小麥中GST的活性高于不耐旱小麥,不同品種小麥GST基因均呈上調表達。戚元成等[11]報道,過量表達谷胱甘肽轉移酶基因可提高轉基因擬南芥抗旱能力。本研究處理組谷胱甘肽轉移酶13 Glutathione transferase13(GST),上調表達且表達量是對照的7.926 2倍,表明滲透脅迫下次生代謝 產物影響了玉米體內GST的表達。鋅依賴水解酶類(Zn-dependent hydrolases,including glyoxylases)廣泛存在于高等植物,參與植物發育調控、免疫應答及非生物逆境脅迫響應等多個方面[12]。本研究處理組鋅依賴水解酶類上調表達且表達量是對照的3.256 6倍,表明滲透脅迫下次生代謝產物影響了玉米體內鋅依賴水解酶類的表達。非特異性脂質轉移蛋白(nonspecific lipid-transfer protein,nsLTPs)是一類廣泛存在于植物中的堿性小蛋白,參與許多生物進程,如磷脂轉移、生殖發育、病原菌防 御和非生物脅迫反應[13]。本研究處理組nsLTPs上調表達且表達量是對照的3.218 7倍,表明滲透脅迫下次生代 謝產物影響了玉米體內nsLT Ps的表達。在滲透脅迫下,次生代謝產物還引起了大量假設蛋白表達量的變化。其中,hypothetical protein LOC100277838上調表達且表達量是對照的40.270 2倍,它是由Robert E. Sharp實驗室在干 旱脅迫下選取玉米根部構建標 準化文庫時獲得,位于第8條染色體上[14]。hypothetical protein LOC100272329上調表達且表達量是對照的21.432 8倍,具有泛素硫酯酶活性,參與泛素依賴蛋白分解代謝生物過程,位于第4條染色體上[15]。hypothetical protein LOC100191831上調表達且表達量是對照的6.798 6倍,由Schna ble等[15]于2009年進行玉米全基因組測序時獲得,位于第9條染色體上。雖然干旱脅迫下次生代謝產物僅引起玉米根部2.51%基因的表達量發生變化,但這些差異表達基因表現出廣泛的功能多樣性。
4 結論
本研究采用基因芯片技術,滲透脅迫下在次生代謝產物處理的玉米根系中共檢測到差異表達的基因441個,包括147個上調基因,294個下調基因。通過GO體系對這些差異基因進行功能分類,其中45%基因參與各種生物學過程;36%基因編碼產物則與執行各種分子功能有關;18%基因與生成各種細胞組分有關;1%與GenBank中功能未知序列相對應,這些基因所起的作用還需進一步研究。利用KEGG數據庫進行查詢,結果表明這些差異基因參與了21條生物學代謝通路,包括基礎物質代謝、能量代謝、次生代謝及信號 轉導等。
[1]葛淑娟, 孫愛清, 劉鵬, 等. 玉米響應滲透脅迫的數字基因表達譜分析[J]. 作物學報, 2014, 40(7):1164-1173.
[2]Campos H, Cooper M, Habben JE, et al. Improving drought tolerance in maize:a view from industry[J]. Field Crops Res, 2004, 90:19-34.
[3]卜令鐸, 張仁和, 常宇, 等. 苗期玉米葉片光合特性對水分脅迫的響應[J]. 生態學報, 2010, 30(5):1184-1191.
[4]霍金龍, 苗永旺, 曾養志. 基因芯片技術及其應用[J]. 生物技術通訊, 2007, 18(2):329-332.
[5]陳郁. 基因芯片數據分析及在植物基因組研究中的應用[J].氨基酸和生物資源, 2008, 30(1):33-36.
[6]Zhu JK. Salt and drought stress signal transduction in plants[J]. Annu Rev Plant Biol, 2002, 53:247-273.
[7]王金. 玉米耐旱突變體18-599M谷胱甘肽硫轉移酶的突變鑒定[D]. 雅安:四川農業大學, 2009:29.
[8]王麗萍, 戚元成, 張世敏, 等. 鹽地堿蓬GST基因的克隆、序列分析及其表達特征[J]. 植物生理與分子生物學報, 2002, 28(2):133-136.
[9]Edwards R, Dixon DP. Herbicides and their mechanisms of action[M]//Cobb AH, Kirkwood RC. Sheffie ld:Sheffield Academic Press, 2000:33-71.
[10]Gallé á, Csiszár J, Benyó D, et al. Changes of glutathione S-transferase activities and geneexpression in Triticum aestivum during polyethylene-glycolinduced osmotic stress[J]. Acta Biologica Szegediensis, 2005, 49(1-2):95-96.
[11]戚元成, 張小強, 劉衛群, 等. 過量表達谷胱甘肽轉移酶基因對轉基因擬南芥抗旱能力的影響[J]. 植物生理學通訊, 2008, 44(2):268-270.
[12]劉迪林. 趙普艷. 植物基質金屬蛋白酶的研究進展[J]. 西北植物學報, 2013, 33(3):636-642.
[13]Wei KF, Zhong XJ. Non-specific lipid transfer proteins in maize[J]. BMC Plant Biol, 2014, 14:281.
[14]Bohnert H, Sharp RE, Springer GK, et al. Functional genomics of root growth and root signaling under drought[J]. NSF Grant, 2002:DBI-0211842.
[15]Schnable PS, Ware D, Fulton RS. The B73 maize genome:complexity, diversity, and dynamics[J]. Science, 2009, 326(5956):1112-1115.
(責任編輯 李楠)
Expression Profile Analysis of Maize Resistance Under Osmotic Stress Induced by Secondary Metabolites of Endophytes
WANG Na1GONG Na2LIU Guo-li2MA Xiao-ying2YANG Zhen2YANG Tao2
(1. Institute of Plant Nutrients and Environmental Resources,Liaoning Academy of Agricultural Sciences,Shenyang 110161;2. Center of Microbial Engineering,Liaoning Academy of Agricultural Sciences,Shenyang 110161)
Genechip technology was used to analyze the expression profile of differential genes in corn treated by metabolites of endophyte under 10% PEG osmotic stress. The results showed that there were 441 differentially expressed genes identified in this study including 147 upregulated genes and 294 down-regulated genes,participating in 21 metabolic pathways. The genes with differential expressions were classified by GO-ranking methods through CapitalBio Molecule Annotation System V 3.0(MAS). Among them 45% participated in various biological processes,18% were related to synthesis of cellular components,the coded products of 36% genes were related to performing a variety of molecular function,and 1% corresponded with other unknown sequences in GenBank. Thus the role of these genes still needs further study. Pathways analysis using the KEGG pathway database showed the differentially expressed genes broadly were involved in basic metabolism,energy metabolism,secondary metabolism and signal transduction pathways. The expression profile analysis indicate that the effects of secondary metabolites on corn under osmotic stress are synergistical processes by many genes in many pathways.
endophyte;maize;osmotic stress;gene expression profile
10.13560/j.cnki.biotech.bull.1985.2016.07.013
2015-10-16
遼寧省農業科技攻關項目(2011215005),遼寧省科學事業公益研究基金項目(2013002002)
王娜,女,碩士,研究方向:植物內生菌;E-mail:wnsxh1999@126.com
楊濤,男,博士,研究方向:農業微生物;E-mail:yangtaolaas@sina.cn

