角蛋白單體獲得及誘導S.maltophilia DHHJ產角蛋白酶研究
朱 茜, 王 娟, 曹張軍
東華大學化學化工與生物工程學院,上海 201620
角蛋白單體獲得及誘導S.maltophiliaDHHJ產角蛋白酶研究
朱茜,王娟,曹張軍*
東華大學化學化工與生物工程學院,上海 201620
摘要:可降解羽毛微生物能以羽毛粉為唯一營養源生長,而羽毛粉是一種大顆粒的不溶性底物,不能直接進入細胞內作為營養源同時作為一級信使來誘導酶基因表達。本文通過化學還原法水解羽毛得到可溶性羽毛角蛋白溶液,利用電泳和質譜驗證其分子量約10 kD,為角蛋白單體。分別以該可溶性羽毛角蛋白及角蛋白單體酶解片段為誘導源,在無誘導源、羽毛粉為對照的情況下,測定72 h內嗜麥芽窄食單胞菌(S. maltophilia)DHHJ產生的角蛋白酶的酶活。在無誘導源時,角蛋白酶基因表現本底表達(0.5 U/mL);培養基中添加羽毛粉及角蛋白單體時,角蛋白酶表達量高,分別可達15 U/mL和20 U/mL。并且角蛋白單體酶解片段誘導酶表達較低(2.3 U/mL)。該結果初步表明,水溶性角蛋白單體作為信號源與細菌細胞接觸或進入細胞內,控制角蛋白酶基因表達。該結果為細菌降解角蛋白分子機制研究奠定基礎。
關鍵詞:角蛋白酶; 嗜麥芽窄食單胞菌; 可溶性角蛋白; 生化機制
禽類所產羽毛除了少部分作為紡織原料等外,大部分作為廢棄物直接丟棄處理(全球每年廢棄量在幾百萬噸以上[1]),其實羽毛可降解為可溶性蛋白及氨基酸,廣泛應用于動物飼料[2]、醫藥、食品、日化等行業,對于資源、能源匱乏的當今世界具有十分重要的科學意義和應用價值[3]。產角蛋白酶的微生物構成的生物煉制較之傳統水解法具有諸如反應條件溫和、產物回收率高、環境友好、可節省能源等眾多優點。不僅使固體廢棄物得到有效利用,保護了人類賴以生存的生態環境,還可將其生物降解為多肽及氨基酸等高附加值產品,更加符合循環經濟的理念和建立節約型社會的戰略要求。
生物煉制效率及投入產出比是制約該工藝應用的重要瓶頸,而掌握降解機理并利用該機理提高降解效率是解決這一問題的關鍵。表達角蛋白酶的微生物可在不溶于水的羽毛為唯一生長源生長,但是羽毛成分是以什么方式怎么樣進入微生物細胞并誘導酶基因表達,這一步驟機制還不清楚。
本實驗室前期從長期堆積腐爛羽毛的土壤中分離到一株高效降解羽毛細菌L1,經鑒定該菌株為嗜麥芽窄食單胞菌(Stenotrophomonasmaltophilia)[4],并且對其產生的角蛋白酶的理化性質進行了一定的研究[5]。該菌降解羽毛是胞外及胞內酶協同作用結果,另一方面,角蛋白酶同時具有蛋白酶與二硫鍵還原酶活性[6]。角蛋白是一種大顆粒的不溶性底物,而不溶性底物不可能直接將表達信號傳遞到胞內,因此角蛋白應該以一種成份進入細胞并起動降解機制,因此我們通過還原法將羽毛角蛋白降解成單一分子量的可溶性角蛋白溶液,進行有關其機制的進一步研究/嘗試尋找其誘導產酶的片段。
1實驗材料與方法
1.1實驗材料
1.1.1供試細菌
S.maltophiliaDHHJ由本課題組提供。
1.1.2羽毛粉(雞毛粉)
市場收集白色生雞毛,洗凈后于80 ℃烘干48 h,剪刀剪碎后,用粉碎機粉碎,備用。
1.1.3溶解液
溶解液一:尿素2 mol/L 焦亞硫酸鈉0.125 mol/L SDS 0.05 mol/L
溶解液二:尿素4 mol/L 焦亞硫酸鈉0.25 mol/L SDS 0.1 mol/L
溶解液三:尿素8 mol/L 焦亞硫酸鈉0.5 mol/L SDS 0.2 mol/L
1.1.4培養基
增殖培養基:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,pH 7.5,蒸餾水100 mL。
無氮5×M9鹽溶液:Na2HPO4·7H2O 6.4 g,KH2PO41.5 g,NaCl 0.25 g,pH 7.5,蒸餾水100 mL。
無氮M9培養基:將20 mL 5×M9鹽溶液稀釋至98 mL滅菌后,加入已滅菌的1 mol/L MgSO40.2 mL,1 mol/L CaCl20.01 mL,20%葡萄糖 2 mL。
羽毛粉發酵培養基:無氮M9溶液100 mL,羽毛粉2 g。
角蛋白單體發酵培養基:用角蛋白單體溶液(473.57 μg/mL)將5×M9鹽溶液稀釋至100 mL,0.22 μm濾器過濾除菌。
角蛋白酶解片段發酵培養基:用角蛋白單體酶解片段溶液將5×M9鹽溶液稀釋至100 mL,0.22 μm濾器過濾除菌。
1.2實驗方法
1.2.1還原法制備水溶性角蛋白溶液
水溶性角蛋白的制備參考Vasconcelos[7](2008)的方法:分別稱取洗凈烘干的羽毛粉1 g,加入10 mL 1.1.3所述三種溶解液,混合均勻后,分別置于60 ℃,70 ℃和80 ℃的恒溫水浴鍋中反應30 min,用8層紗布過濾,除去羽毛粉殘渣后,離心(10 000 r/min)15 min,取上清液在蒸餾水中透析3天,每天換4次水,離心后上清為淺黃色透明羽毛角蛋白溶液。
1.2.2水溶性角蛋白分子量測定
SDS-聚丙烯酰胺凝膠電泳:采用15%(質量分數)的自制分離膠、5%(質量分數)的自制濃縮膠和不連續的緩沖液系統,加樣品15 μL,電壓由100 V換至150 V,采用考馬斯亮藍染色法進行測定。樣品中羽毛角蛋白帶的分子量由它的相對遷移率與標準分子量相比較確定。
質譜:4 800plusMALDI TOF/TOFTM質譜儀,檢測可溶性角蛋白分子量。
1.2.3蛋白質含量的測定
采用考馬斯亮藍法測蛋白質含量。
1.2.4角蛋白單體酶解片段的制備
用1 mol/L的NaOH將自制水溶性角蛋白溶液的pH調至7.5,用0.22 μm濾器將100 mL自制水溶性角蛋白過濾除菌,在其中加入過濾除菌的20 mg/mL的蛋白酶K 10 mL,于58 ℃反應16 h。再將其置于95 ℃水浴10 min,使蛋白酶K失活。通過電泳檢驗是酶切完全,再用酶切后的水溶性角蛋白制備角蛋白酶解片段發酵培養基。
1.2.5角蛋白酶活力的測定
從羽毛粉蛋白胨平板上挑取單菌落接種于含5 mL增殖培養基的試管中,于160 r/min、35 ℃培養12 h~16 h后,再以1%接種量,加入50 mL增殖培養基中,于160 r/min、35℃培養至OD600=0.8,為種子液。將種子液以10%的接種量,分別接種于50 mL增殖培養基、50 mL羽毛粉發酵培養基、50 mL水溶性角蛋白發酵培養基及50 mL角蛋白酶解片段發酵培養基中,于160 r/min、35 ℃培養,分別在一定時間取3 mL發酵液,于 10 000 r/min 4 ℃離心10 min,取上清即為粗酶液。將粗酶液密封置于4 ℃冰箱待測酶活。
角蛋白酶活力的測定方法參考Gradisar[8],并在此基礎上稍作修改。取1 mL粗酶液加入2 mL 0.05 mol/L Tris-HCl緩沖液,然后加入10 mg羽毛粉,在40 ℃恒溫水浴鍋中反應,定時取出用力震蕩,1 h后加入2 mL 10% TCA終止反應。4 ℃離心15 min,取上清液于280 nm波長處測定其吸光度(A280)。反應前即加TCA的處理用作對照。
酶活定義:A280值每增加0.1為1 unit(U)。重復3次取平均值。
2結果與討論
2.1角蛋白單體的制備
2.1.1SDS-PAGE
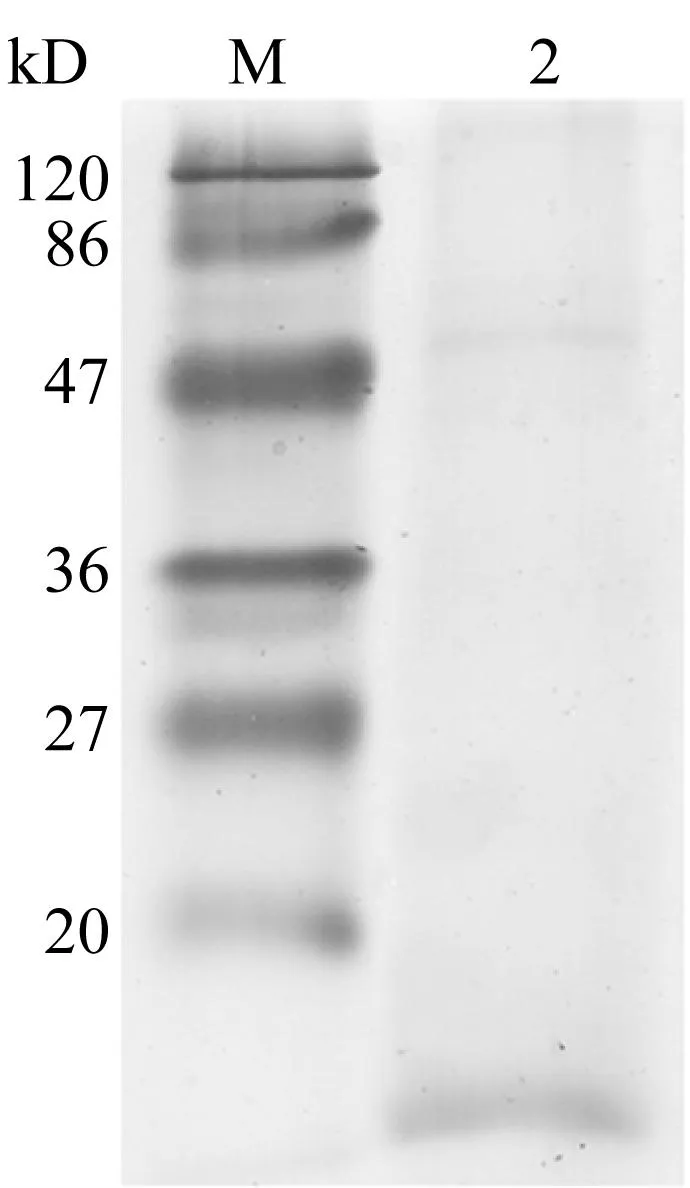
通過不同濃度的溶解液以及反應時的不同溫度降解羽毛,均在10 kD左右有一條帶存在,該條帶與角蛋白單體分子量一致[9]。溶解液一在60 ℃降解30 min時,僅有10 kD左右的條帶的存在(圖1a),即得到單一分子量的角蛋白。而在其它條件下均會得到其他雜帶(圖1b,1c)。這可能是由于角蛋白中存在大量的二硫鍵,容易發生交聯,而交聯的條件可能和角蛋白的濃度及溫度等有關。為了得到分子量單一的角蛋白,選用60 ℃,溶解液一的條件制備角蛋白單體(WP)。
Ayutthaya等[10]同樣通過還原法降解羽毛得到的蛋白電泳條帶顯示,存在大量的10 kD左右的角蛋白以及少量18 kD及30 kD左右分子量的角蛋白。其反應條件為65 ℃,5 h,且溶解液配比與本文不同。溶解液的配比、反應時間及反應溫度的差別,會影響羽毛降解中得到的角蛋白的分子量的分布。筆者在實驗中還發現不同來源羽毛在用還原法生產水溶性角蛋白時,分子量分布也會有少量差異。Vasconcelos等[7]利用溶解液三在100 ℃降解羊毛角蛋白30 min,得到更多分子量更大的蛋白,只有少量小于14.4 kD。Lusiana等[11]降解人類頭發及指甲得到的蛋白條帶集中于42 kD及52 kD附近。羊毛、頭發、指甲主要為α-角蛋白,羽毛為β-角蛋白,這可能是由于α-角蛋白及β-角蛋白形成高級結構時聚合程度或形成鍵不同引起的差異。

(a)
(b)

(c)
2.1.2質譜(MALDI TOF-MS)
參考不同溶解條件SDS-PAGE結果,對羽毛于溶解液一中,60 ℃反應30 min,溶解所得水溶性產物透析進一步質譜分析確定其純度及準確分子量,結果顯示其有一個峰(圖2),分子量為10 104 Da,其他分子量區段都沒有峰值。這與之前SDS-PAGE(圖1a)結果一致。與Molly等[12],Presland等[13],Greenwold等[14]之前報道得到的角蛋白單體分子量基本相同,可以確定,通過該工藝能夠穩定得到分子量均一的角蛋白單體。
利用考馬斯亮藍法測定WP的濃度,測得水解透析后WP的濃度為473.57 μg/mL(標準曲線參數y=0.0367x+0.0822,其R2=0.9996)。
2.2不同底物誘導S.maltophiliaDHHJ產酶的影響
分別以含羽毛粉、角蛋白單體、酶解角蛋白單體的M9及牛肉膏蛋白胨培養基培養S.maltophiliaDHHJ菌株產角蛋白酶(圖3a, 3b)。從圖3a可以看出,在12 h內,含角蛋白單體、羽毛粉誘導源及不含誘導源培養基均檢測到低水平酶活表達,基因表達水平差異不明顯。從圖3b可以看出,羽毛粉及角蛋白單體為誘導源誘導S.maltophiliaDHHJ菌株產酶, 36 h后編碼角蛋白基因開始大量表達,酶活上升,48 h后酶活最高(分別為15 U/mL和20 U/mL)。而酶解角蛋白單體、牛肉膏蛋白胨中只檢測到微量的酶活,為角蛋白酶的本底表達。Malviya等[15]研究表明直到半數以上的角蛋白被分解,才能檢測到顯著的角蛋白酶活力,與本文結果一致,這一現象產生的原因有待于進一步研究。
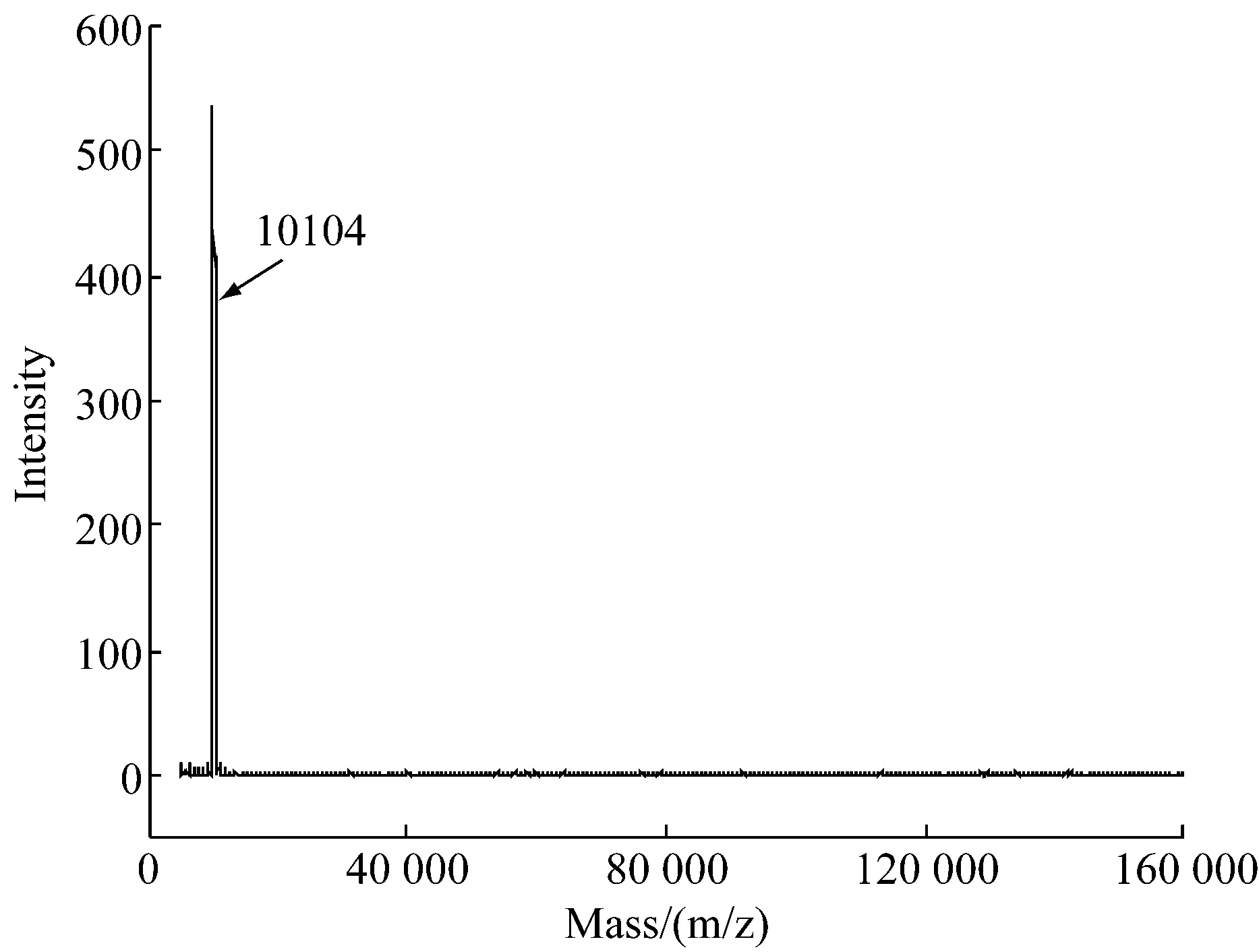
圖2 水解角蛋白質譜圖
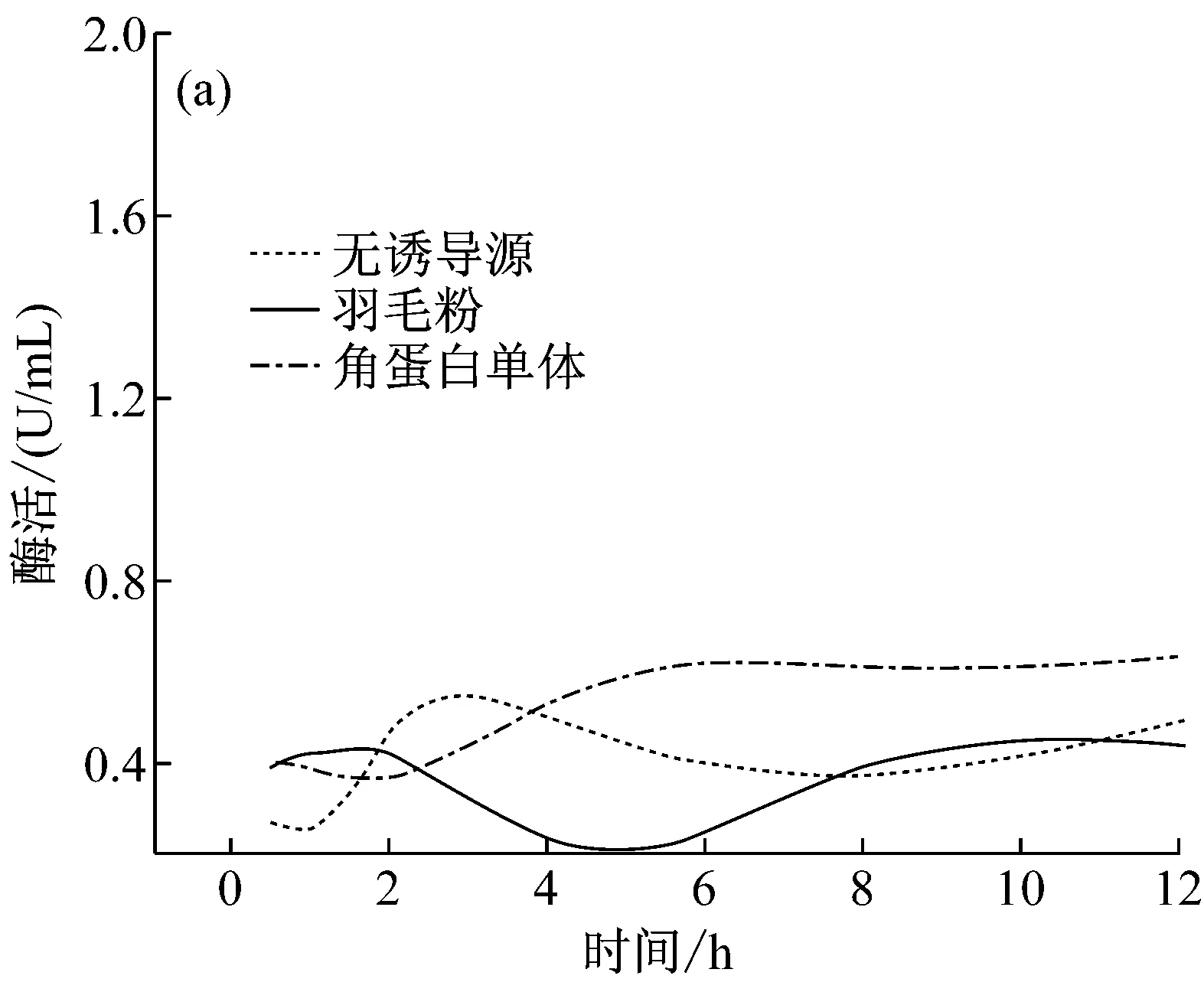
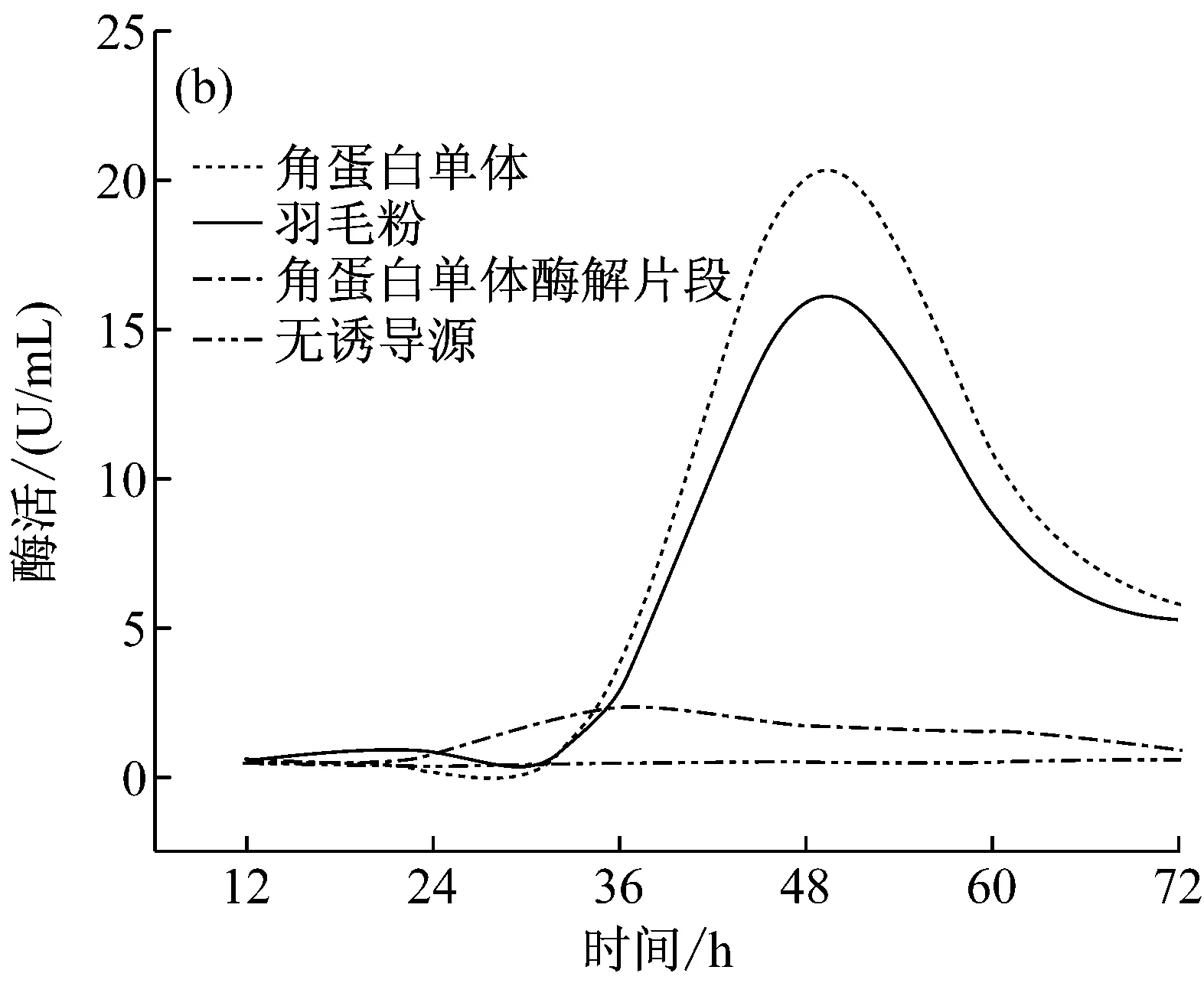
圖3 不同底物誘導S. maltophilia DHHJ
從圖3b中可看出,角蛋白酶切片段雖然也能誘導S.maltophiliaDHHJ產酶,但是其酶活值大大降低,低于2.5 U/mL,是角蛋白單體誘導該菌產酶的1/8左右。且酶活峰值出現在36 h。這很可能是由于蛋白酶K的酶切位點具有廣泛性,酶切后的角蛋白成為了易于利用的肽段,大部分的肽段失去了其對S.maltophiliaDHHJ結合位點結合并將信號轉導入細胞,啟動細菌細胞角蛋白降解相關基因的作用。但是仍然有少部分肽段能與S.maltophiliaDHHJ結合位點結合,誘導角蛋白酶基因的表達。另一方面,也有可能雖然酶切后在SDS-PAGE中雖沒有看到角蛋白單體存在,但仍可能會有痕量角蛋白單體存在,誘導酶基因表達。
3結論
本文利用化學還原法制備了水溶性羽毛角蛋白溶液,并且通過SDS-PAGE和質譜驗證其為角蛋白單體,分子量為10 kD左右;分別測定且比較了無誘導源、羽毛粉為誘導源、自制的水溶性羽毛角蛋白為誘導源和水溶性角蛋白酶切片段為誘導源這四種情況下的S.maltophiliaDHHJ產生的角蛋白酶的酶活。發現水溶性羽毛角蛋白與羽毛粉一樣可以誘導S.maltophiliaDHHJ產生角蛋白酶,而更小分子的角蛋白單體酶解片段雖能誘導產酶,但酶活很低。由此我們可以水溶性羽毛角蛋白這種單一可控性高的誘導源來替代羽毛粉,進行之后的S.maltophiliaDHHJ降解角蛋白機制的相關研究。
參考文獻
[1]Brandelli A. Bacterial keratinases: Useful enzymes for bioprocessing agroindustrial wastes and beyond. Food Bioprocess Technol, 2008, 1(2): 105-116.
[2]Latshaw JD, Musharaf N, Retrum R. Processing of feather meal to maximize its nutritional value for poultry. Anim Feed Sci Technol, 1994, 47(3-4): 179-188.
[3]李江, 姚斌, 范云六. 微生物角蛋白酶的分子生物學研究進展. 工業微生物, 2006, 36(3): 37-42.
[4]Cao ZJ, Zhang Q, Wei DK,etal. Characterization of a novel Stenotrophomonas isolate with high keratinase activity and purification of the enzyme. J Ind Microbiol Biotechnol, 2009, 36(2): 181-188.
[5]龔潤, 蔣晶君, 曹張軍等.StenotrophomonasmaltophiliaDHHJ角蛋白酶特性及酶促動力學研究. 工業微生物, 2013, 43(3): 67-71.
[6]張啟, 王晶, 曹張軍等. 嗜麥芽窄食單胞菌 (Stenotrophomonasmaltophilia) DHHJ 分解角蛋白的生化機制初探. 河北農業大學學報, 2008, 31(2): 70-73.
[7]Vasconcelos A, Freddi G, Cavaco-Paulo A. Biodegradable materials based on silk fibroin and keratin. Biomacromolecules, 2008, 9(4): 1299-1305.
[8]Gradisar H, Kern S, Friedrich J. Keratinase of doratomyces microsporus. Appl Microbiol Biotechnol, 2000, 53(2): 196-200.
[9]Presland RB, Gregg K, Molloy PL,etal. Avian keratin genes .1. A molecular analysis of the structure and expression of a group of feather keratin genes. J Mol Biol, 1989, 209(4): 549-559.
[10]Ayutthaya SI, Tanpichai S, Wootthikanokkhan J. Keratin extracted from chicken feather waste: Extraction, preparation, and structural characterization of the keratin and keratin/biopolymer films and electrospuns. J Polym Environ, 2015, 23(4): 506-516.
[11]Lusiana, Reichl S, Mueller-Goymann CC. Keratin film made of human hair as a nail plate model for studying drug permeation. Eur J Pharm Biopharm, 2011, 78(3): 432-440.
[12]Molloy PL, Powell BC, Gregg K,etal. Organisation of feather keratin genes in the chick genome. Nucleic Acids Res, 1982, 10(19): 6007-6021.
[13]Presland RB, Whitbread LA, Rogers GE. Avian keratin genes. II. chromosomal arrangement and close linkage of three gene families. J Mol Biol, 1989, 209(4): 561-576.
[14]Greenwold MJ, Sawyer RH. Genomic organization and molecular phylogenies of the beta (β) keratin multigene family in the chicken (Gallusgallus) and zebra finch(Taeniopygiaguttata): Implications for feather evolution. BMC Evol Biol, 2010, 10(1): 1-15.
[15]Malviya HK, Rajak RC, Hasija SK. Synthesis and regulation of extracellular keratinase in three fungi isolated from the grounds of a gelatin factory, Jabalpur, India. Mycopathologia, 1992, 120(1): 1-4.
A preliminary study on biochemical mechanism of degrading keratins byStenotrophomonasmaltophiliaDHHJ
ZHU Qian, WANG Juan, CAO Zhang-jun
College of Chemistry, Chemical Engineering and Biotechnology,Donghua University,Shanghai 201620
AbstractFeather powder is large and insoluble. It cannot express signals directly to intracellular. The soluble feather keratin was obtained by chemical reduction method to hydrolyze feather, which was monomer with a molecular weight of 10 kD verified by SDS-PAGE and mass spectrometry. The enzyme activities of keratinase produced by Stenotrophomonas maltophilia DHHJ within 72 h were measured under the following 4 conditions: no induced source, soluble feather keratin as induced source, keratin digested fragment as induced source and feather powder as induced source. The enzyme activities of keratinase was quite low without induced source. When the induced source existed, Stenotrophomonas maltophilia DHHJ was induced to produce keratinase. Both the feather powder and soluble feather keratin could induce higher enzyme activities of keratinase(15 U/mL and 20 U/mL, respectively). While the keratin enzymatic fragment could only induce lower enzyme activities of keratinase (2.3 U/mL).
Key wordskeratinase; Stenotrophomonas maltophilia; soluble feather keratin; biochemical mechanism
doi:10.3969/j.issn.1001-6678.2016.02.003
基金項目:國家自然科學基金資助課題(31570106)。
作者簡介:朱茜(1989~),女,碩士研究生。Tel.:13524117651;E-mail: zhuqian_1125@163.com。
*通訊作者:曹張軍,男,副教授,zhjcao@dhu.edu.cn。

