季也蒙假絲酵母胞外多糖的分離純化及抗氧化活性研究
孫曉萌, 王 上, 叢麗娜, 李 成, 董 亮
大連工業大學 生物工程學院, 遼寧 大連 116034
季也蒙假絲酵母胞外多糖的分離純化及抗氧化活性研究
孫曉萌,王上,叢麗娜*,李成,董亮
大連工業大學 生物工程學院, 遼寧 大連 116034
摘要:對一株源于海參腸道的季也蒙假絲酵母產胞外多糖進行分離純化并對其抗氧化活性進行研究。采用乙醇沉淀、Sevag除蛋白等方法得到胞外粗多糖EPS。EPS經Sepharose強陰離子交換層析分離后,分別得到3個組分EPS1、EPS2和EPS3,對抗氧化活性較高的EPS2采用Sephacryal凝膠過濾層析進行純化,得到1個單一組分EPS2-1,采用氣相色譜法分析其單糖組成,并驗證其抗氧化活性。結果表明:EPS2-1是由木糖、甘露糖、葡萄糖和半乳糖組成的;它具有較強的抗氧化活性,當其濃度為0.36 mg/mL時,對羥基自由基的清除率可達100%,明顯高于同濃度下Vc對羥基自由基的清除率14.42%;當EPS2-1濃度為0.60 mg/mL時,對超氧陰離子自由基的清除率可達53.22%;同時EPS2-1表現出一定的還原力。研究證明該活性多糖具有很好的應用潛力,值得進一步研究開發。
關鍵詞:季也蒙假絲酵母; 胞外多糖; 分離純化; 抗氧化活性; 組成分析
多糖是由多個單糖或其衍生物聚合而成的大分子物質,對調節細胞的各種生命活動有著重要作用。多糖具有廣泛的藥理學活性,如免疫調節作用、抗腫瘤、抗病毒、抗衰老等作用,有些多糖還具有抗放射損傷、抗化學劑、降血糖、降血脂等作用[1,2],對人體健康有很大的促進作用,因而越來越引起學術界的廣泛關注。微生物多糖是細菌、真菌和藍藻等微生物在代謝過程中產生的具有多種生物活性的高聚物[3],以胞壁多糖、胞內多糖和胞外多糖3種形式存在。微生物多糖具有安全無毒、理化性質獨特、易與菌體分離及可通過深層發酵實現工業化生產等優良特性而倍受關注。與動植物多糖相比,微生物多糖生產周期短、成本低廉、不受季節、地域和病蟲害條件的限制,具有較強的市場競爭力和廣闊的發展前景[4]。
近年來,隨著對陸地微生物的大量開發,人們紛紛將目光投向海洋。海洋微生物處于低溫、高鹽、高壓、寡營養的特殊環境,具有產生結構新穎、功能獨特的新型活性多糖的潛力[5]。Yang等[6,7]從中國黃海沉積物中分離到的絲狀真菌PhomaherbarumYS4108獲得胞外多糖,其由半乳糖、葡萄糖、鼠李糖、甘露糖和葡萄糖醛酸構成,并具有很強的抗氧化活性。郭守東等[8]從愛德華氏細菌Edwardsiellatarda分離得到兩種甘露聚糖,抗氧化活性實驗表明低分子質量多糖的抗氧化活性更強,它們都具有一定清除羥基自由基的能力。孫海紅等[5]從海洋放線菌THW-7A分離鑒定出的兩種胞外多糖,皆具有清除超氧陰離子自由基和抗脂質過氧化的能力。
海洋微生物多糖的研究主要集中在海洋細菌多糖,有關海洋酵母多糖的研究還較少。本研究以實驗室從海參腸道中篩選出的季也蒙假絲酵母作為出發菌株生產并提取胞外多糖,充分利用色譜分離純化技術、各種化學分析方法和先進的現代儀器分析技術對其胞外多糖進行分離純化,并進一步對胞外多糖的單糖組成及抗氧化活性進行研究,為今后發現結構新穎、活性更強的新型多糖奠定基礎。
1材料與方法
1.1材料
1.1.1菌種
HS-J9季也蒙假絲酵母(Candidaguilliermind)由本實驗室分離篩選并保藏。
1.1.2培養基
活化培養基 (g/L) :葡萄糖20,蛋白胨 20,酵母膏 10,pH自然,121 ℃濕熱滅菌20 min。發酵培養基 (g/L) :葡萄糖20,蛋白胨10,硫酸銨15,磷酸二氫鉀2.5,pH 6.6~6.7,121 ℃濕熱滅菌20 min。
1.2方法
1.2.1菌種的活化及發酵培養
將保藏菌種接種至活化培養基中,于28 ℃,160 r/min條件下搖床震蕩培養12 h ~16 h,活化后的種子液以4%的接種量接種至發酵培養基中,于相同條件下搖床震蕩培養48 h。
1.2.2胞外多糖的提取
采用醇沉法對胞外多糖進行粗提。將發酵液離心10 min(12 000 r/min,4 ℃)去除菌體沉淀,收集上清液,加入3倍體積的95%乙醇,于4 ℃條件下醇沉過夜。緩慢棄掉部分上清液,將剩余懸濁液離心,收集沉淀并用適量蒸餾水溶解,加入1/4體積Sevag試劑除去蛋白質,上清液再次醇沉。將懸濁液離心,收集沉淀并用適量蒸餾水溶解,選用3 500 Da透析袋對其進行透析,24 h后過0.22 μm濾膜除雜除菌,超濾濃縮后冷凍干燥即得粗多糖EPS。
1.2.3離子交換層析法分離粗多糖
采用Q Sepharose Fast Flow 強陰離子交換層析對粗多糖EPS進行初步分離。用蒸餾水平衡柱,上樣后,用0~2 mol/L的NaCl溶液在室溫下進行線性梯度洗脫,流速為1 mL/min,用部分收集器每5分鐘收集一管,用苯酚-硫酸法檢測各管OD490nm值,繪制洗脫曲線。分別收集主峰進行透析脫鹽,過濾膜除雜除菌,超濾濃縮后凍干備用。
1.2.4胞外多糖對羥基自由基清除能力的測定
采用Fenton反應測定胞外多糖EPS1、EPS2和EPS3對羥基自由基的清除能力。參考劉鳳等[9]的實驗方法,略作改動。清除率計算如下:[(A樣品-A空白) /(A對照-A空白)]×100%。
1.2.5胞外多糖對超氧陰離子自由基清除能力的測定
采用鄰苯三酚自氧化法測定胞外多糖EPS1、EPS2和EPS3對超氧陰離子自由基的清除能力。參考Cheng等[10]的實驗方法,略作改動。清除率計算如下:[(ΔA對照-ΔA樣品)/ΔA對照]×100%。
1.2.6胞外多糖還原力的測定
采用普魯士藍法測定胞外多糖EPS1、EPS2和EPS3的還原力。參考郭巧玲等[11]的實驗方法,略作改動。吸光度代表多糖的還原力。
1.2.7凝膠過濾層析法純化胞外多糖單組份
采用Sephacryl S-300 High Resolution凝膠過濾層析對胞外多糖EPS2做進一步純化。流動相為0.2 mol/L NH4HCO3溶液,流速為0.3 mL/min,柱溫為4 ℃,用部分收集器每13分鐘收集一管,用苯酚-硫酸法檢測各管OD490 nm值,繪制洗脫曲線。合并主峰進行透析脫鹽,過濾膜除雜除菌,超濾濃縮后凍干備用。
1.2.8胞外多糖單糖組成的分析
選用4 mol/L三氟乙酸對胞外多糖EPS2-1進行水解,采用糖腈乙酸酯衍生法對胞外多糖水解得到的單糖樣品衍生后進行氣相色譜分析,分析其單糖組成。參考楊靜等[12]的實驗方法進行衍生化,略作改動。以肌醇六乙酸酯為內標,選取的標準單糖分別為鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖。
1.2.9胞外多糖抗氧化活性驗證
分別采用Fenton反應,鄰苯三酚自氧化法和普魯士藍法對胞外多糖EPS2-1的抗氧化活性進行驗證,以Vc作為對照。
2結果與討論
2.1胞外多糖的提取
采用乙醇沉淀、Sevag除蛋白、冷凍干燥等方法得到了胞外粗多糖EPS,稱其質量得到產率。分別采用苯酚-硫酸法和考馬斯亮藍法檢測多糖純度及蛋白質含量,各項指標如表1所示。
2.2胞外多糖EPS的分離
胞外多糖EPS經Sepharose強陰離子交換層析進行線性梯度洗脫,以OD490nm值和NaCl濃度對洗脫體積作圖,繪制洗脫曲線。如圖1所示,從圖中可見共分離得到3個組分,分別命名為EPS1、EPS2和EPS3。

表1 粗多糖EPS的理化性質及產率
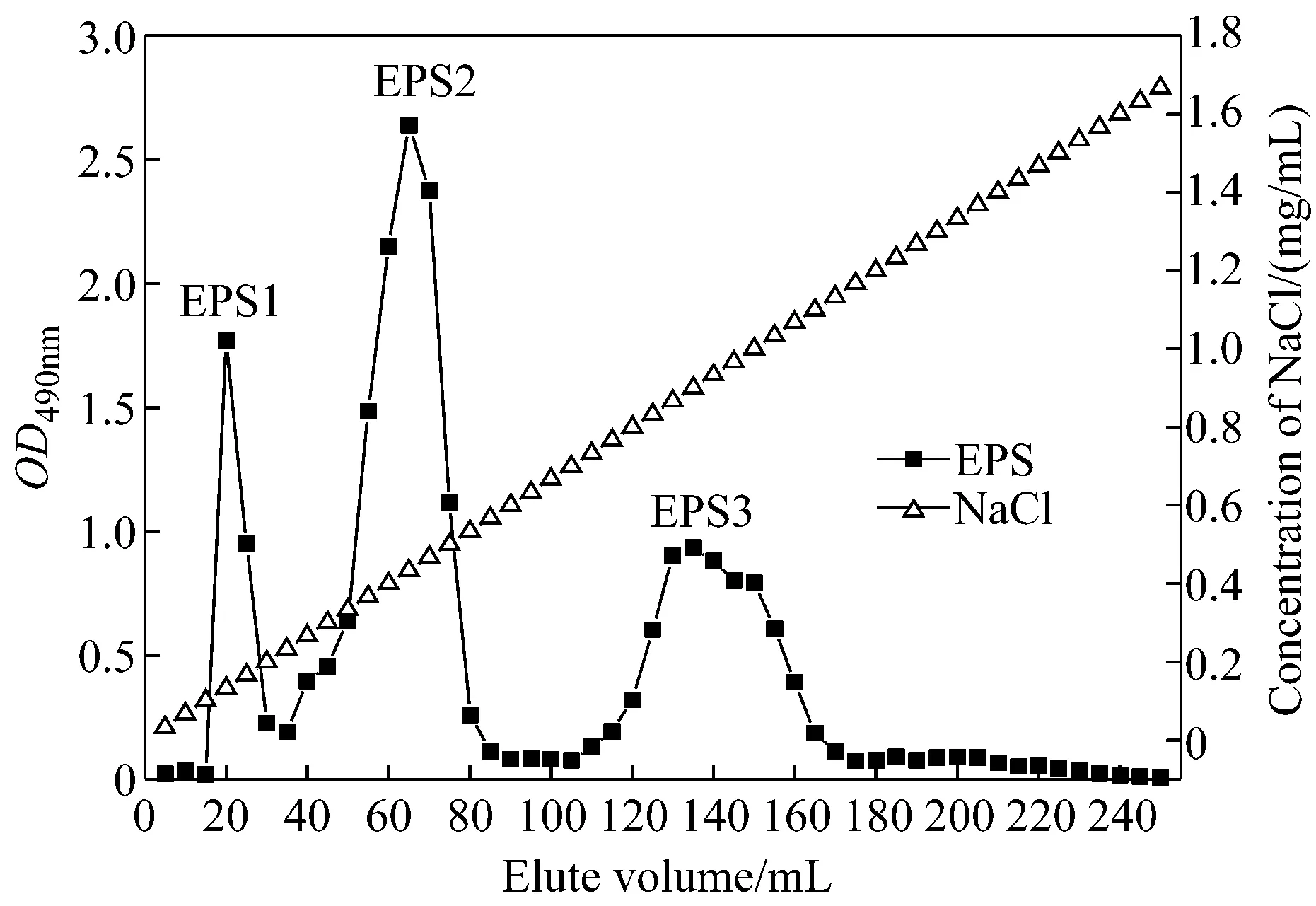
圖1 EPS的Q Sepharose F. F. 線性洗脫曲線
2.3胞外多糖EPS1、EPS2和EPS3對羥基自由基清除能力的測定
羥基自由基是一種氧化能力很強的自由基,對生物組織具有較強的危害,它可以通過多種方式與細胞內生命物質作用,使其遭受損傷和破壞[13]。以羥基自由基的清除率對EPS1、EPS2和EPS3的濃度作圖。結果如圖2所示,隨著多糖樣品濃度的增加清除羥基自由基的能力也逐漸增強,其中多糖EPS2的變化率最大,EPS3次之。當多糖樣品濃度達到0.20 mg/mL時,多糖EPS1、EPS2和EPS3對羥基自由基的清除率分別為40.40%、86.87%和70.71%。
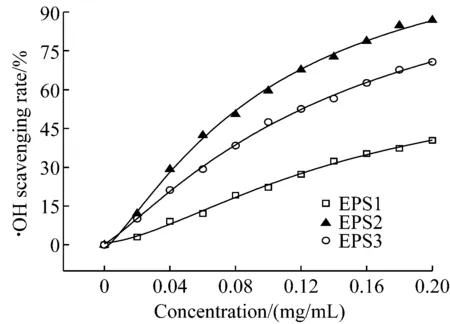
圖2 EPS1、EPS2和EPS3對羥基自由基的清除率
在所測濃度范圍內,它們對羥基自由基的清除能力按照從強到弱的順序是:EPS2>EPS3>EPS1,且多糖EPS2明顯高于EPS1和EPS3。
2.4胞外多糖EPS1、EPS2和EPS3對超氧陰離子自由基清除能力的測定
超氧陰離子自由基是生物體系中自由基的根源,除了本身有毒害外,它可通過歧化反應產生具有細胞毒性的H2O2和羥基自由基,導致細胞DNA和細胞膜的損傷[14]。以超氧陰離子自由基的清除率對EPS1、EPS2和EPS3的濃度作圖。結果如圖3所示,在0.05 mg/mL ~0.30 mg/mL濃度范圍內,多糖EPS1、EPS2和EPS3均表現出一定的清除超氧陰離子自由基的能力,并且隨著多糖濃度的增加而增強。當多糖樣品濃度達到0.30 mg/mL時,多糖EPS1、EPS2和EPS3對超氧陰離子自由基的清除率分別為24.18%、29.23%和19.15%。在所測濃度范圍內,它們對超氧陰離子自由基的清除能力按照從強到弱的順序是:EPS2>EPS1>EPS3,且多糖EPS2明顯高于EPS1和EPS3。
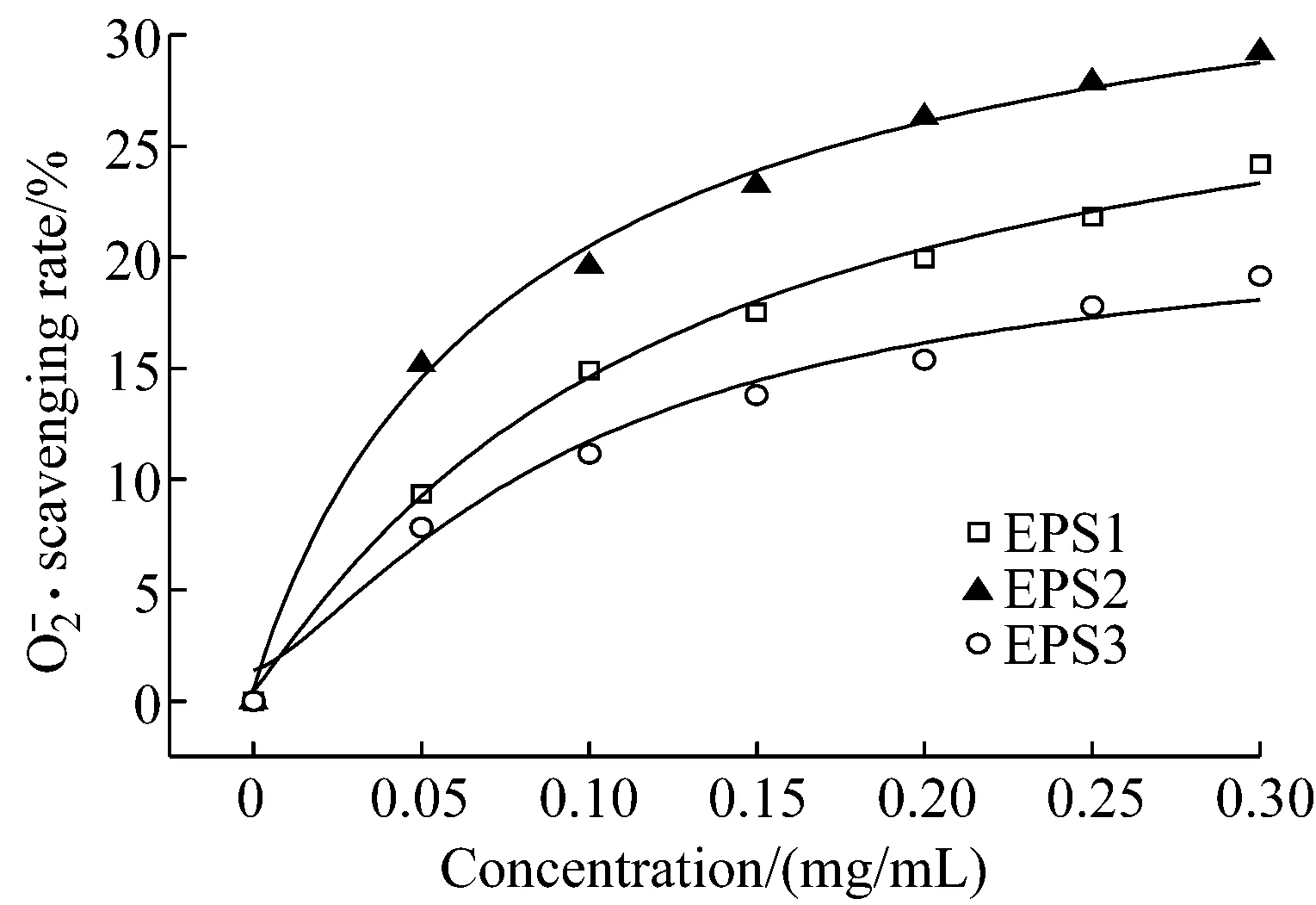
圖3 EPS1、EPS2和EPS3對超氧陰離子
2.5胞外多糖EPS1、EPS2和EPS3還原力的測定
還原力是表示抗氧化物質提供電子能力的重要指標,可以通過提供電子使自由基變為穩定的物質,以中斷自由基的連鎖反應[15]。相關研究證實,還原力越強,抗氧化性越強,因此,可通過測定還原力來說明其抗氧化活性的大小。以EPS1、EPS2和EPS3的OD700 nm對濃度作圖,吸光度代表多糖的還原力。結果如圖4所示, 3種多糖的還原力均不是很強,但隨著多糖濃度的增加,還原力逐漸增大。當多糖濃度為0.18 mg/mL時,多糖EPS1、EPS2和EPS3在700 nm處的吸光度值分別為0.118、0.080和0.093,在所測濃度范圍內,多糖EPS1的還原力最大,EPS3次之。
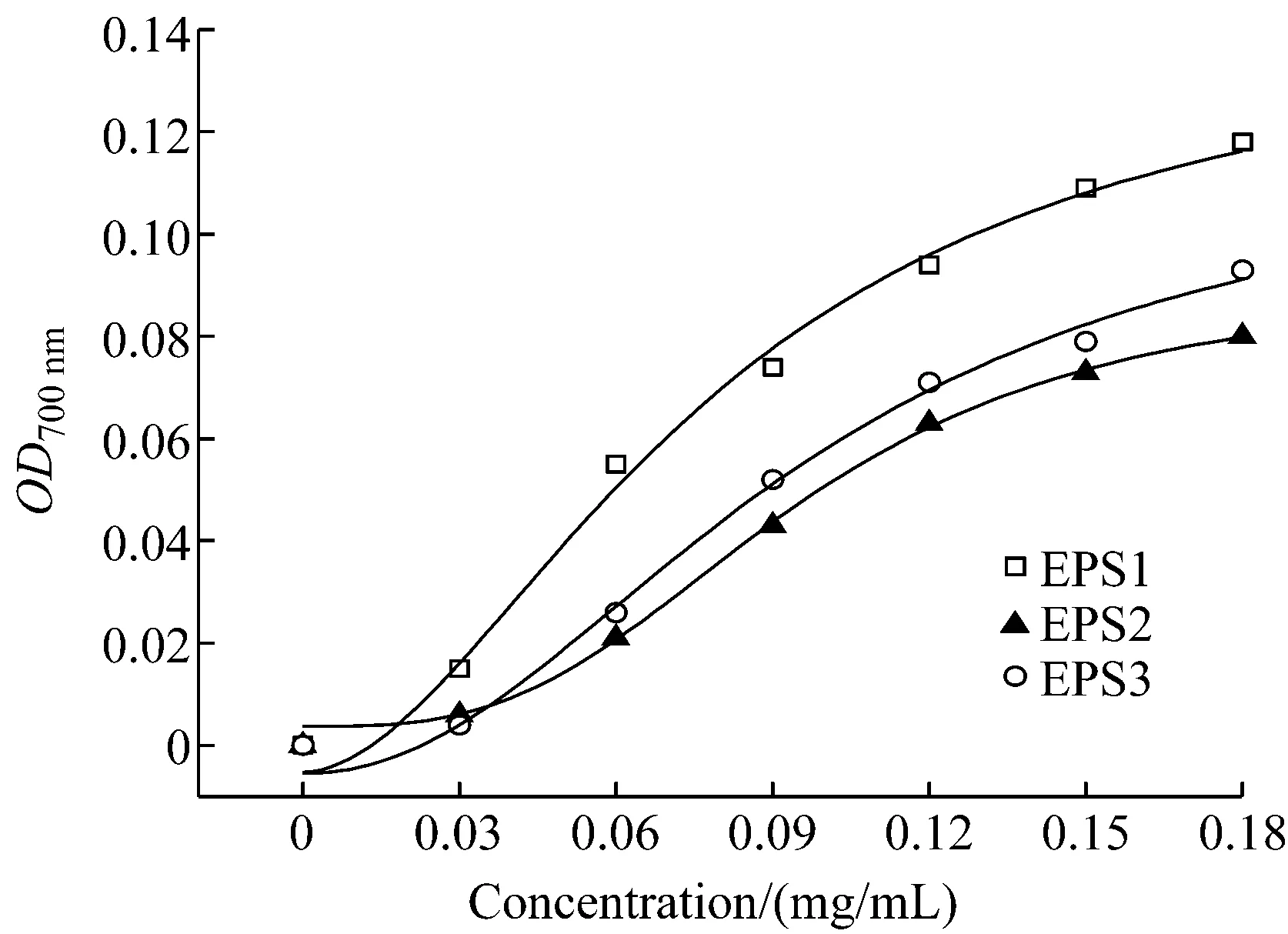
圖4 EPS1、EPS2和EPS3的還原力
2.6胞外多糖EPS2的純化
綜合以上實驗,選取抗氧化活性較高的胞外多糖EPS2做進一步純化和分析。EPS2經Sephacryl凝膠過濾層析進行純化,以OD490 nm值對洗脫管數作圖,繪制洗脫曲線。如圖5所示,洗脫后只得到1個單一組分,命名為EPS2-1。
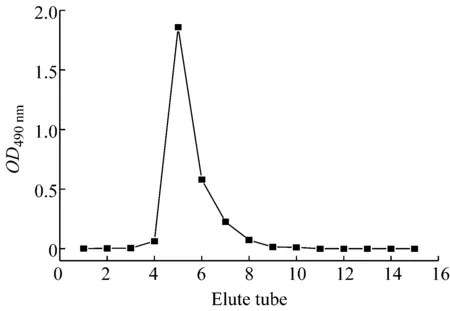
圖5 EPS2的Sephacryl S-300 HR洗脫曲線
2.7胞外多糖EPS2-1單糖組成分析
標準單糖和胞外多糖EPS2-1水解樣品的氣相色譜圖如圖6所示。根據各種標準單糖的保留時間可知圖6-A中的7個主峰從左至右依次為鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖和內標物。對比圖6-A和圖6-B可知,胞外多糖EPS2-1是由木糖、甘露糖、葡萄糖和半乳糖組成的,采用內標法定量分析可得木糖:甘露糖:葡萄糖:半乳糖的摩爾比為1∶35.98∶1.22∶1.68。
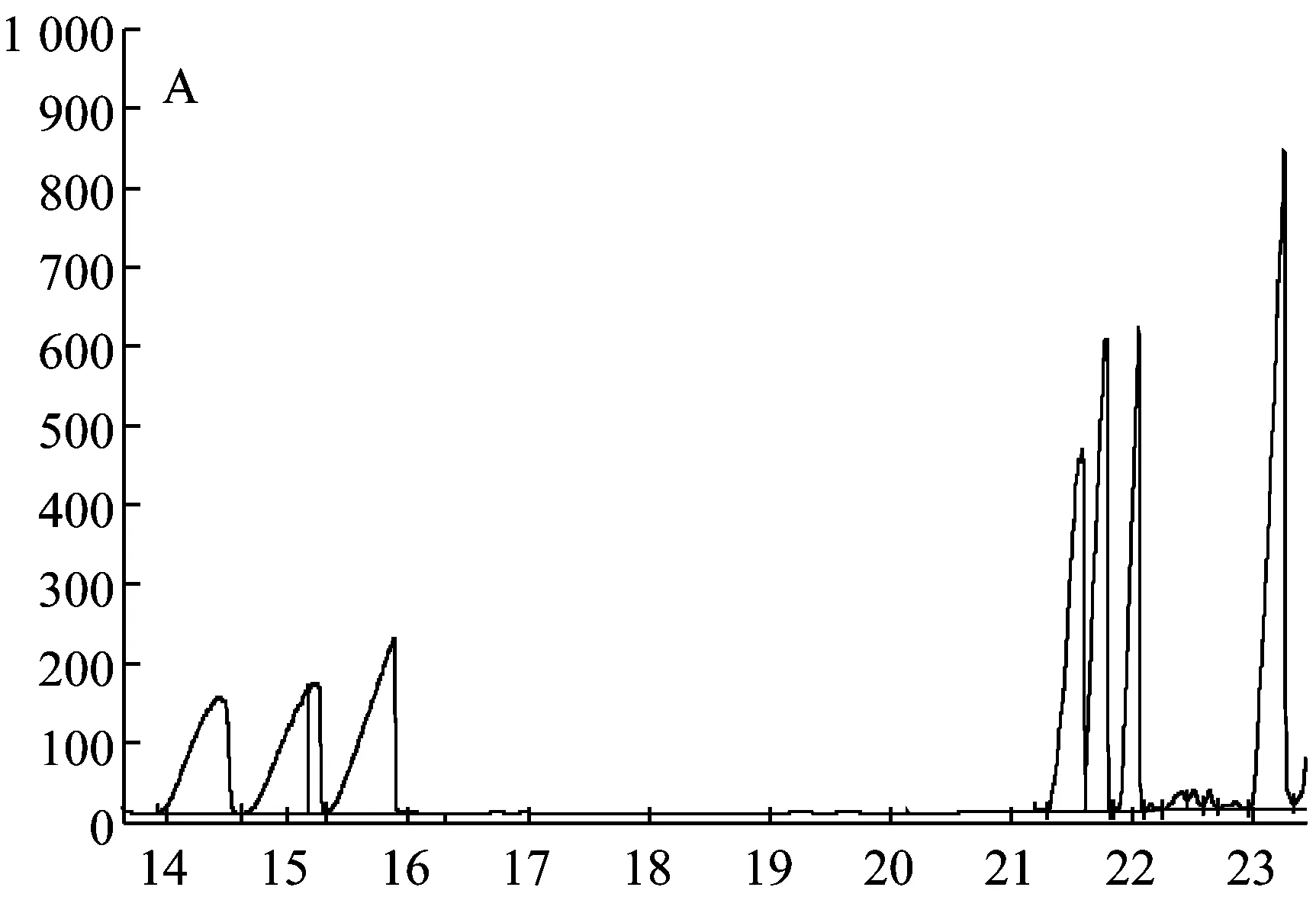
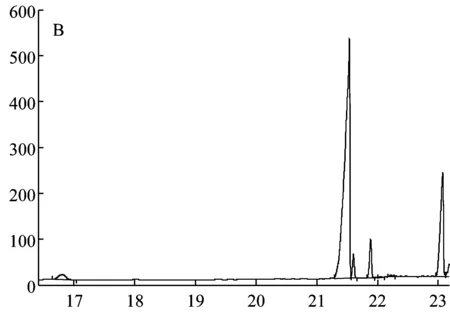
圖6 6種標準單糖(A)和EPS2-1(B)的氣相色譜圖
2.8胞外多糖EPS2-1抗氧化活性驗證
對胞外多糖EPS2-1的抗氧化活性進行驗證,以Vc作為對照,結果如圖7所示。由圖7-A可見,多糖EPS2-1清除羥基自由基的能力要明顯高于Vc,并且隨著濃度的增大清除率有大幅的增加,當EPS2-1濃度為0.36 mg/mL時,清除率可達100%,而此時Vc對羥基自由基的清除率僅為14.42%。由圖7-B可見,雖然多糖EPS2-1對超氧陰離子自由基的清除能力不及Vc,但其仍具有較強的清除超氧陰離子自由基的能力,并且清除率隨濃度的增加而增大,當EPS2-1濃度為0.60 mg/mL時,清除率可達53.22%。由圖7-C可見,相對于Vc而言,多糖EPS2-1的還原力較低,但其仍具有一定的還原力,并且隨著濃度的增加還原力緩慢增大,當EPS2-1濃度為0.36 mg/mL時,代表還原力大小的OD700 nm值為0.175。
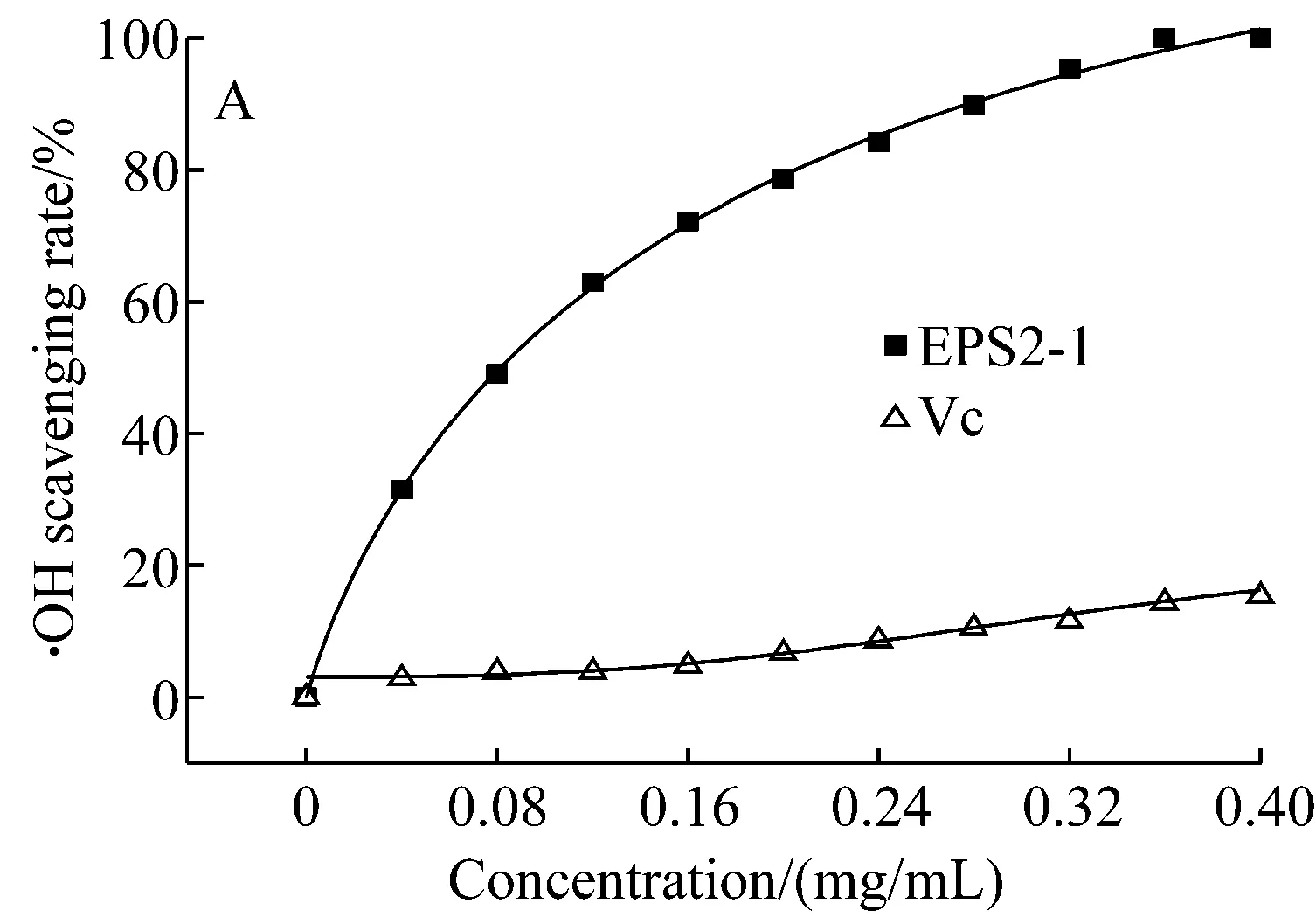
A. 羥基自由基清除率
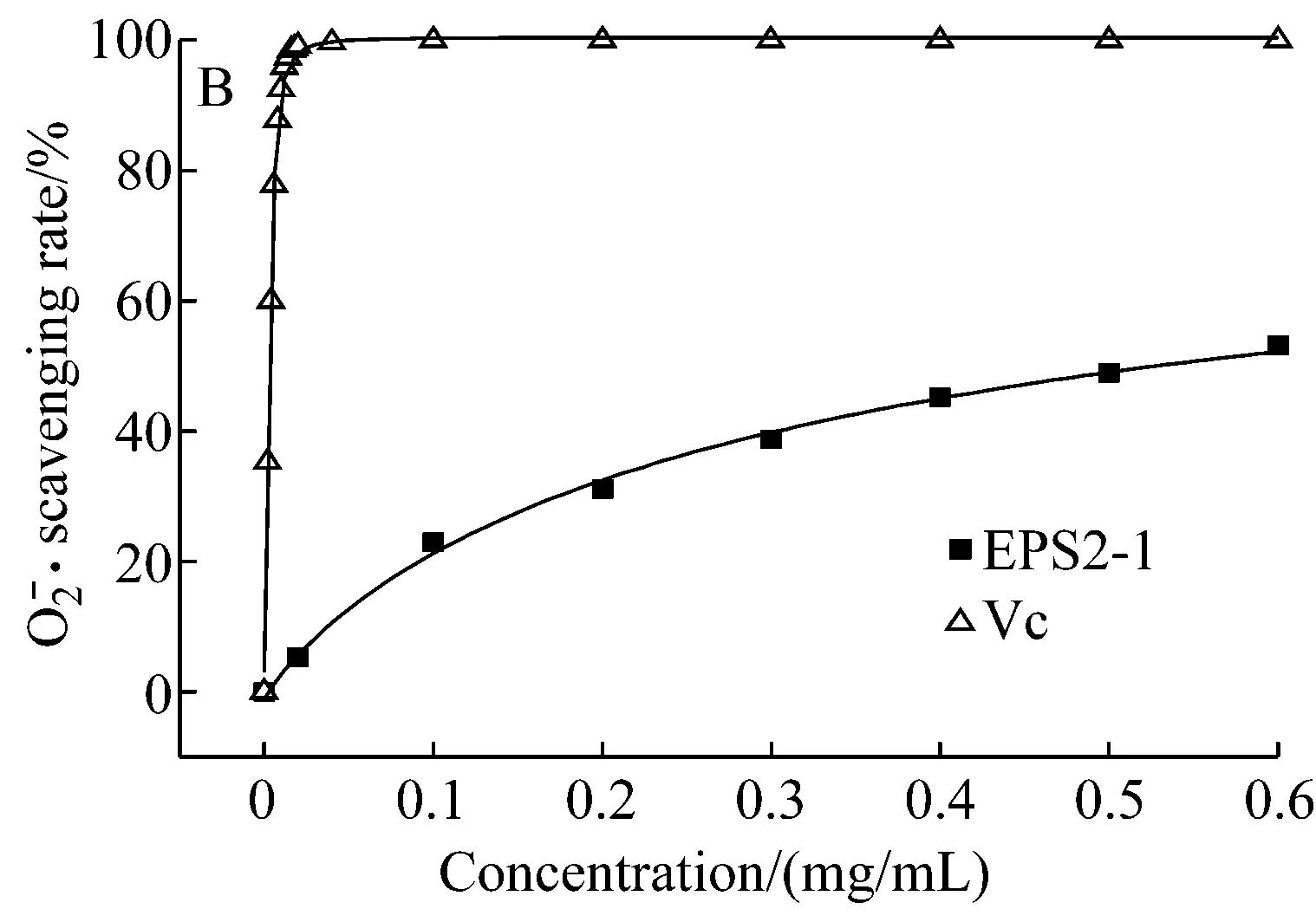
B. 超氧陰離子自由基清除率
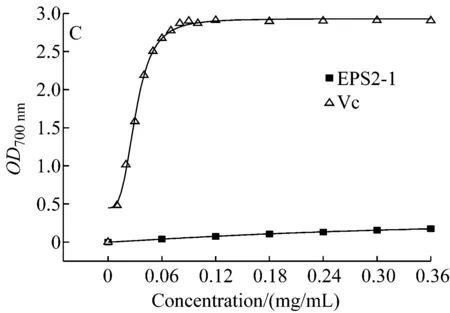
C. 還原力
3結論
自由基是生物體新陳代謝過程中產生的一類可單獨存在,具有高度氧化活性,帶有一個或幾個未配對電子的分子或原子,其化學性質相當活潑[16]。在正常情況下,體內自由基的產生和清除處于動態平衡之中,當自由基的存在超出機體防護系統所具有的清除能力,就會直接或間接的引起蛋白質變性、酶失活、多糖降解、DNA鏈斷裂、生物膜結構損傷、細胞解體乃至機體病變和死亡[17]。自由基被稱為“萬病之源”,其中羥基自由基和超氧陰離子自由基是最主要的形式,是機體代謝中產生的極為活躍的自由基。本研究中純化后的季也蒙假絲酵母胞外多糖EPS2-1具有明顯的抗氧化活性,對羥基自由基和超氧陰離子自由基的清除能力很強,當其濃度為0.36 mg/mL時,對羥基自由基的清除率可達100%,明顯高于同濃度下Vc對羥基自由基的清除率14.42%;當EPS2-1濃度為0.60 mg/mL時,對超氧陰離子自由基的清除率可達53.22%;同時EPS2-1表現出一定的還原力。因此,多糖EPS2-1作為天然抗氧化劑具有良好的應用前景,值得進一步研究開發。
參考文獻
[1]何朝勇,王立為.多糖的免疫調節作用綜述 [J].安徽中醫學院學報,2002,21(4):62-64.
[2]趙琳靜,宋小平,黎方雅.多糖及其衍生物抗氧化性質的研究進展 [J].上海工程技術大學學報,2008,22(1):44-47.
[3]劉汝冰,賈薇,蔣蕓等.微生物多糖WL-26深層發酵工藝的優化 [J].工業微生物,2008,38(6):43-48.
[4]郭敏,張寶善,金曉輝.微生物發酵生產多糖的研究進展 [J].微生物學通報,2008,35(7):1084-1090.
[5]孫海紅,毛文君,錢葉苗等.海洋微生物活性胞外多糖的研究進展 [J].海洋科學,2011,35(11):134-137.
[6]Yang XB,Gao XD,Han F,etal.Sulfation of a polysaccharide produced by a marine filamentous fungusPhomaherbarumYS4108 alters its antioxidant poperties in vitro [J].Biochimica et Biophysica Acta,General Subjects,2005,1725(1):120-127.
[7]Yang XB,Gao XD,Han F,etal.Purification,characterization and enzymatic degradation of YCP,a polysaccharide from marine filamentous fungusPhomaherbarumYS4108 [J].Biochimie,2005,87(8):747-754.
[8]Guo SD,Mao WJ,Han Y,etal.Structural characteristics and antioxidant activities of the extracellular polysaccharides produced by marine bacteriumEdwardsiellatarda[J].Bioresource Technology,2010,101(12):4729-4732.
[9]劉鳳,葉淑紅,王際輝等.海洋假單胞菌pf-6胞外多糖吸濕保濕和抗氧化性研究 [J].食品工業科技,2011,32(11):68-71.
[10]Cheng YK,Li L,Meng ZK,etal.Component analysis and free radicals scavenging activity ofPhysalisalkekengiL.polysaccharide [J].Science Direct,2008,24(2):167-170.
[11]郭巧玲,謝建華,楊學敏等.菠蘿多糖抗氧化功能的研究 [J].農學學報,2012,2(3):50-53.
[12]楊靜,丁重陽,顧正華等.以豆漿為培養基的三種藥食用真菌發酵過程多糖變化的研究 [J].工業微生物,2015,45(5):17-22.
[13]王宗君,廖丹葵.茶樹菇多糖抗氧化活性研究 [J].食品研究與開發,2010,31(1):50-54.
[14]Dreher D,Junor AF.Role of oxygen free radicals in cancel development [J].European Journal of Cancer,1996,32(1):30-35.
[15]Duh PD,Du PC,Yen GC.Action of methanolic extract of mung BEAN hulls as inhibitors of peroxidation and non-lipid oxidative damage [J].Food and Chemical Toxicology,1999,37(11):1055-1061.
[16]方允輝,榮梁.自由基生物學的理論與應用 [M].北京:科學出版社,2002.
[17]Marx JL.Oxygen free radicals linked to many diseases [J].Science,1987,235(4788):529-531.
Isolation, purification and antioxidant activity of exopolysaccharides fromCandidaguilliermind
SUN Xiao-meng, WANG Shang, CONG Li-na, LI Cheng, DONG Liang
School of Biological Engineering, Dalian Polytechnic University, Dalian 116034
AbstractIn order to study the antioxidant activity in vitro, the exopolysaccharides were extracted from the culture of Candida guilliermind isolated from sea cucumber intestine. The fermentation liquor was treated with ethanol and sevag reagent to get the exopolysaccharides (EPS). Then three components (EPS1, EPS2, EPS3) were separated by Sepharose anion exchange chromatography. The antioxidant activity of EPS2 was found more potent compared to the other two components. The purified exopolysaccharides (EPS2-1) were obtained by Sephacryal chromatography. Gas chromatography was employed for the component analysis of EPS2-1 and the antioxidant activity of EPS2-1 was verified in vitro.The results indicated that EPS2-1 was composed of xylose, mannose, glucose and galactose. Moreover, EPS2-1 possessed the strong antioxidant activity. The scavenging rate of ·OH radical could reach to 100% when the EPS2-1 concentration was 0.36 mg/mL. This result was much higher than that of Vc (14.42%) at the same concentration. When the EPS2-1 concentration reached to 0.60 mg/mL, the scavenging rate of was about 53.22%. Meanwhile, the EPS2-1 also had some reducing power. Based on above results, these active polysaccharides had more application potential for further study and development.
Key wordsCandida guilliermind; exopolysaccharides; isolation purification; antioxidant activity; component analysis
doi:10.3969/j.issn.1001-6678.2016.02.005
基金項目:遼寧省教育廳重點實驗室(LZ2014029),遼寧省研究生教育創新計劃項目(2014-154),國家海洋食品工程技術研究中心開放實驗室(2012FU125X03)。
作者簡介:孫曉萌(1990~),女,碩士研究生。E-mail:158674545@qq.com。 *通訊作者: 叢麗娜(1962~),女,教授。E-mail:linacong@163.com。

