藤倉赤霉(Gibberellafujikuroi)分子生物學及發酵工程研究進展
李 超, 楊佳羽, 劉 佳, 朱廷恒
浙江工業大學生物工程學院, 杭州 310004
藤倉赤霉(Gibberellafujikuroi)分子生物學及發酵工程研究進展
李超,楊佳羽,劉佳,朱廷恒*
浙江工業大學生物工程學院, 杭州 310004
摘要:赤霉素是最重要的植物生長調節劑之一,工業化生產是由絲狀真菌藤倉赤霉發酵產生。近20年來,隨著分子生物學技術的發展,對藤倉赤霉赤霉素生物合成途徑中相關基因的分子鑒定和表達調控等研究取得了顯著的進展,赤霉素生物合成途徑的分子生物學基本研究清楚,使得利用基因工程和代謝工程技術進行赤霉菌改良、提高赤霉素發酵水平成為可能。本文對藤倉赤霉中赤霉素合成機理及其表達調控、關鍵酶基因功能、外源基因轉化系統、發酵技術、利用基因工程技術進行改造等方面的研究進展進行綜述。
關鍵詞:藤倉赤霉; 分子機理; 生物合成; 基因表達調控; 發酵
水稻惡苗病原菌藤倉赤霉(Gibberellafujikuroi)在1917年首次被Sawada等從被感染的水稻種子中分離出來,該菌以產生赤霉素(Gibberellins, GAs)而聞名,如GA3、GA4、GA7、GA9等[1]。赤霉素是一種由高等植物、部分真菌和細菌產生的重要的二萜類植物激素。目前,在自然界中已有超過130種赤霉素烷類化合物被發現[2]。其中一些赤霉素可控制植物種子萌發、莖的伸長、開花誘導和果實的生長等過程[3],其中GA3作為藤倉赤霉最主要的赤霉素產物已在農業中廣泛應用。而GA4、GA7由于生物活性與GA3不同,并且發酵產量更低,因此其市場價格也更加昂貴[4]。藤倉赤霉除了能合成多種赤霉素,還被發現能產生多種有用的次級代謝產物。Linnemannstons等和Studt等通過研究pks4基因的功能和序列分析證明藤倉赤霉可產生比卡菌素和鏈紅菌素這兩種聚酮化合物[5-6]。Bearder等發現一些真菌毒素,如鐮刀菌素也是其次級代謝產物[7]。
由于赤霉素在農業上的巨大潛力,對藤倉赤霉的開發與應用進行了大量的研究。近20年來,隨著分子生物學技術的發展和應用,對藤倉赤霉赤霉素合成途徑的研究取得了突破性的進展。Tudzynski等在1998年通過構建篩選赤霉菌cDNA文庫的方法發現了涉及赤霉素合成的基因簇[8]。此后,赤霉素合成途徑中所有的相關基因都被克隆出來,這些基因所編碼的酶的特性也被逐一鑒定[9]。這不僅為研究赤霉素生物合成途徑中復雜的調控機制提供了依據,也為通過基因工程手段改造代謝途徑增加產量奠定了基礎。
1赤霉素生物合成的分子機理
1.1赤霉素生物合成途徑
經過30多年的研究,藤倉赤霉中赤霉素的生物合成途徑已經被研究清楚(圖1),其中各種中間代謝產物也已闡明[9-10]。赤霉素的生物合成始于羥甲基戊二酰輔酶A,其在3-羥基-3-甲基-戊二酰CoA(HMG-CoA)還原酶的催化生成甲羥戊酸(MVA),甲羥戊酸經異戊二烯基焦磷酸(IDP)、香葉基焦磷酸后(GDP),由法尼基焦磷酸(FDP)合成酶催化成FDP;而后FDP在香葉基香葉基焦磷酸(GGDP)合成酶的作用下生成GGDP。隨后,GGDP在一種雙功能酶——古巴焦磷酸(CPP)、內根-貝殼杉烯合成酶(CPS/KS)的催化下,經兩步反應由古巴焦磷酸(CPP)轉化成內根-貝殼杉烯。該步驟被認為是赤霉素合成途徑中第一個關鍵性的限速步驟[11-12]。高度疏水的內根-貝殼杉烯在多功能細胞色素P450-4單氧酶的催化下,經由貝根-貝殼杉烯醇、內根-貝殼杉烯醛轉化成內根-貝殼杉烯酸[13]。內根-貝殼杉烯酸在多功能細胞色素P450-1單氧酶的催化下,經由7β-羥基-貝殼杉烯酸、GA12-醛、GA14-醛,轉化成GA14[14]。GA14由細胞色素P450-2單氧酶催化轉化為GA4[15],而GA4既可在1,2-去飽和酶的作用下轉化成GA7,又可在P450-3作用下轉化為GA1。最后,GA7在P450-3的作用下轉化成GA3[16]。
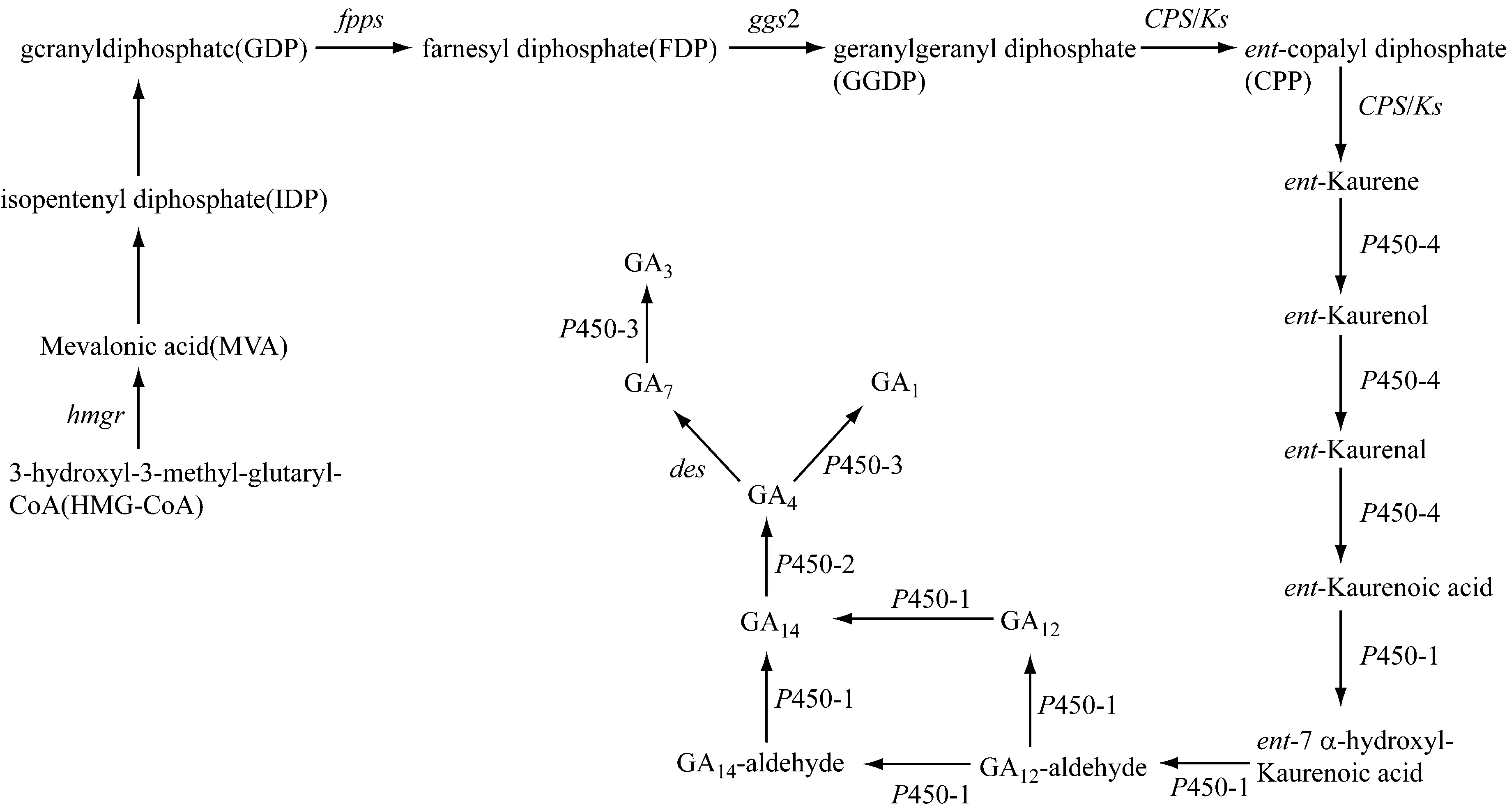
圖1 藤倉赤霉中赤霉素合成途徑[10]
1.2赤霉素生物合成途徑中涉及的基因
赤霉素生物合成途徑基因主要分成兩部分[9-10]:類異戊二烯途徑基因、GAs合成基因。HMG-CoA還原酶基因(hmgr)、FDP合成酶基因(fpps)、香葉基香葉基焦磷酸合成酶基因(ggs2)三個在真菌和植物中高度保守的類異戊二烯途徑基因的表達水平并不受光、pH、碳氮源濃度影響[17-19]。相比之下,真菌中控制GA合成部分的7個基因除了ggs2之外,cps/ks、des、p450-4、p450-3、p450-2、p450-1與植物相比同源性卻并不高。Tudzynski等利用差異基因篩選、限制酶介導的基因重組、PCR技術克隆了這些基因。同時又利用染色體步移法確定這7個基因緊密連鎖,且存在于藤倉赤霉同一條染色體上[20]。
1.3赤霉素合成基因的功能
藤倉赤霉中GAs合成相關的這7個基因組成了一個基因簇,但各自轉錄方向并不一樣(圖 2)。Des基因位于該基因簇最左側含有一個長1 029bp的開放閱讀框,編碼GA4去飽和酶,催化GA4轉化為GA3的反應,此基因的表達受到高濃度氮源的抑制[16]。P450-4位于des右側,編碼多功能細胞色素P450-4單氧酶,該酶催化內根-貝殼杉烯到內根-貝殼杉烯酸的3步氧化反應[13]。P450-1位于P450-4的右側,編碼多功能細胞色素P450-1單氧酶,該酶主要催化內根-貝殼杉烯酸到GA14的4步反應:7β-羥基化、氧化C-6位收縮B環、3β-羥基化、氧化C-7位,還可將赤霉素生物合成途徑內的中間產物內根-貝殼杉烯酸和內根-7α-羥基-內殼杉烯酸分別催化成kaurenolides和fujenoic acids[14]。P450-1和P450-4兩個基因在基因簇中緊密相連,且共用一個啟動子,轉錄方向相反。P450-2位于P450-1的下游,編碼多功能細胞色素P450-2單氧酶,該酶在藤倉赤霉中主要通過催化GA14C-20位氧化將其轉化為GA4,同時還涉及少量GA12C-20位氧化將其轉化為GA9的反應[15]。Ggs2編碼香葉基香葉基焦磷酸(GGDP)合成酶催化法尼基焦磷酸(FDP)轉化成GGDP。cps/ks編碼一個雙功能的酶——古巴焦磷酸(CDP)、內根-貝殼杉烯合成酶(CPS/KS),催化兩步環化反應,使GGDP轉化成內根-貝殼杉烯。而cps/ks與ggs2兩者緊密連鎖,共用一個839 bp的啟動子,這樣可能更利于GGDP合成酶特異性地為CPS/ks提供GGDP[21]。然而在高等植物中,這兩步催化反應由兩個不同的酶分別催化完成。P450-3位于基因簇最右側,是藤倉赤霉中赤霉素合成途徑最后一個基因,含2個開放式閱讀框,該基因編碼細胞色素P450-3單氧酶,催化GA7到GA3和GA4到GA1的反應[16]。
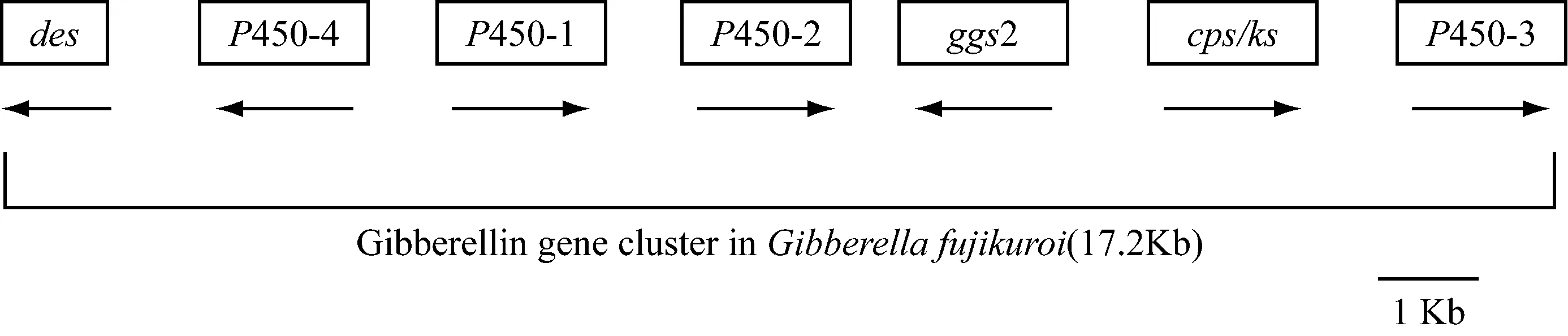
圖2 藤倉赤霉中赤霉素生物合成基因簇[10]
2外源基因轉化系統
建立一個高效的的藤倉赤霉遺傳轉化系統,對赤霉菌分子遺傳學研究、赤霉素生物合成分子機理研究、基因工程改造都至關重要。自1973年Mishra等[22]首次報道粗糙鏈孢霉(Neurospora crassa)的轉化以來,絲狀真菌遺傳轉化系統的研究發展非常迅速。藤倉赤霉的遺傳轉化系統也已經建立,包括限制酶介導的整合技術體系(restriction enzyme mediated integration,REMI)[23]和農桿菌介導的轉化體系(Agrobacteriumtumefaciensmediated transformation, ATMT)[24]。
2.1載體系統
在REMI技術中,需要制備藤倉赤霉原生質體作為外源基因的受體細胞。原生質體的轉化載體主要有兩種構建方式,采用細菌質粒構建轉化載體和采用融合PCR技術(fusion PCR)構建基因大片段。1991年,Sanchez-Fernandez等[25],用1-甲基-3-硝基-1-亞硝基胍處理野生型藤倉赤霉,得到一株不能在以硝酸鹽為唯一氮源的培養基上生長的突變株SG140(niaD11-)。隨后,以含完整黑曲霉(Aspergillusniger)硝酸還原酶基因(niaD)的質粒pSTA10為基礎,通過營養缺陷互補篩選轉化子,構建了第一個藤倉赤霉的轉化系統。但其轉化效率偏低,僅為1~2個轉化子/μg DNA。1992年,Brückner B 等[26]構建了以構巢曲霉(A.nidulans)鳥氨酸氨甲酰轉移酶基因argB為篩選標記的載體,雖然篩選效率有所提高,但轉化率并沒有明顯的提高。1996年,Tudzynski 等[27]分離并克隆了藤倉赤霉硝酸還原酶基因(niaD),構建了一個可用于轉化niaD基因缺陷菌株niaD57的粘粒載體pGFniaD,轉化頻率高達200個轉化子/μgDNA。
在ATMT體系中,需要構建雙源載體,對完整或部分脫壁的細胞為受體進行外源基因轉化。1998年,de Groot等[24]建立了赤霉菌的農桿菌介導的轉化方法,以農桿菌Ti質粒為基礎構建了一個包含潮霉素抗性基因、gpd啟動子、trpC終止子的雙元載體pUR5750。該方法大大提高了藤倉赤霉外源基因的轉化率,可產生300~7 200個轉化子/107個原生質體。目前,由于融合PCR技術采用可在不需要內切酶消化和連接酶處理的條件下實現DNA片段的體外鏈接,避免了繁瑣的傳統載體構建步驟,已被廣泛應用于各種真菌轉化載體的構建。Yu J等[28]利用該方法在真菌中成功敲除31個基因,并且順利地將超過10個基因與一個啟動子相融合。
2.2轉化方法
在藤倉赤霉工程菌的構建過程中,轉化是最關鍵的步驟之一。1991年,Leslie等采用醋酸鋰介導法,成功將外源基因導入藤倉赤霉孢子中,可得到1~2個轉化子/μgDNA[29]。但該方法轉化效率偏低,且目前赤霉素工業生產用菌株都是經過誘變育種的不產孢的突變菌株。Sanchez-Fernandez等[25]以CaCl2-PEG介導法將含硝酸還原酶基因(niaD)的質粒pSTA10順利導入藤倉赤霉突變株SG140原生質體中,可得1~2個轉化子/μg DNA,該方法此后又逐步得到改進[27]。農桿菌可通過侵染,將Ti質粒中的T-DNA導入絲狀真菌孢子或原生質體內,并使這部分DNA隨機整合到真菌基因組上。de Groot等[24]利用農桿菌這一性質,構建雙元載體成功轉化了多種曲霉、木霉等絲狀真菌,其轉化頻率比傳統轉化方法高600倍。國內,郝麗梅等[30]也報道了農桿菌介導的藤倉赤霉轉化方法,但是農桿菌介導的真菌轉化以孢子為受體的轉化率較高,以菌絲為受體的轉化率卻較低。2013年,朱廷恒等[31]首次利用電擊法轉化赤霉菌原生質體,結果證明電壓為0.8~1.0 kV時赤霉菌原生質體的轉化率最高,可得18個轉化子/μgDNA。該方法操作步驟少,過程相對簡單,可應用于藤倉赤霉基因工程研究。
3赤霉素生物合成基因的表達調控
絲狀真菌次級代謝產物的合成有著極其復雜的調控機制,涉及到如碳/氮源、溫度、pH、光照、活性氧、有毒化合物等外界環境因素對真菌細胞的刺激,調控基因的表達,合成途徑中相關基因的轉錄激活和表達翻譯等[32]。而外界環境刺激對絲狀真菌次級代謝的調控主要通過調控因子來實現。大多數調控因子含有如鋅指結構域、α-螺旋-環-α-螺旋、亮氨酸拉鏈等DNA結合蛋白結構,通過特異性識別并結合靶基因啟動子序列調控結構基因的表達[33]。
在藤倉赤霉代謝途徑的研究過程中,發現高濃度的氮源(硝酸鹽、氨態鹽)、葡萄糖會降低赤霉素合成的產量[34],且一些赤霉素合成抑制劑如陽離子絡合物、含氮的雜環化合物、類α-酮戊二酸化合物、16,17-二氫-GAs等也能抑制赤霉菌中赤霉素的合成[35]。其中高濃度氮源對赤霉素合成的抑制效果尤為明顯[36]。1999年,Tudzynski等[37]首次克隆了藤倉赤霉氮代謝相關基因areA-GF,該基因與粗糙鏈孢霉基因nit-2、構巢曲霉基因areA等氮代謝調控基因有很高的同源性,并編碼一個含有972個氨基酸殘基的蛋白質。而這些基因表達蛋白質內含有一個同源性高達98%的鋅指DNA結合域。同時,Tudzynski等又通過同源重組和同源互補實驗證明,areA-GF的缺失會導致藤倉赤霉無法利用除銨鹽和谷氨酸鹽外的氮源,且赤霉素產量也大幅降低。2003年,Mihlan等[38]的研究表明,赤霉素雖然是不含氮的二萜類化合物,但areA-GF編碼的蛋白質可直接結合在cps/ks、des、p450-4、p450-2、p450-1、ggs2這六個可被氮調節的基因的啟動子區域上。因此,當areA-GF缺失將導致這六個基因的表達水平急劇降低。而p450-3是此基因簇中唯一不受氮源調控的基因[16]。在構巢曲霉(A.nidulans)和粗糙鏈孢霉(N.crassa)中,AREA和NIT2在翻譯后直接與nmr表達的基因結合,因此還受到nmr基因的調控[39-40]。Mihlan等通過對藤倉赤霉中nmr的敲除和超表達證明,該基因對氮代謝及赤霉素生物合成的抑制并不劇烈[38]。除此之外,藤倉赤霉谷氨酰胺合成酶基因glnA-GF的敲除導致赤霉素和比卡菌素生物合成的大幅下降,暗示glnA-GF也有可能涉及該菌的氮代謝調控[41]。
在構巢曲霉中,meaB編碼bZIP的一個轉錄因子,該轉錄因子可影響氮調控基因的表達[42]。在氮源充足的情況下,MeaB通過與nmrA啟動子上保守序列結合激活nmrA的表達,從而間接地影響AreA的活性[43]。在赤霉菌中,meaB的轉錄調控方式與A.nidulans有所不同。meaB由兩個轉錄子組成,meaBL在氮源充足的環境下以依賴AreA的方式起主導作用,而meaBS在氮源受到限制的環境下以同樣的方式起主導作用。在氮源受限的條件下,meaB的敲除導致如赤霉素合成基因、比卡菌素合成基因等受氮源調控的基因表達量大幅增加。當meaA和areA被雙敲除,GA合成基因不再表達,而比卡菌素合成基因表達量大幅增加。因此,meaB與areA互相合作介導藤倉赤霉的氮代謝調控,但meaB的調控功能并不能代替areA[44]。Studt等[45]證明,cAMP介導的G蛋白信號傳導途徑對藤倉赤霉次級代謝過程有重要調控作用,其中赤霉素的合成依賴于有火星的腺苷酸環化酶和PKA2,而這種調控并不涉及G蛋白的α亞基。此外,近年來有研究證明,全局調控基因如Velvet、組蛋白甲基轉移酶基因LaeA、fSge1有激活赤霉素合成相關基因的作用[44][46]。
4藤倉赤霉基因工程改造
在赤霉素合成的分子生物學基礎上,可以通過基因工程手段進行赤霉菌改良,從而調控赤霉素的不同組份、比例、產量等。Tudzynski等[16]對藤倉赤霉赤霉素合成途徑末端兩個基因des、P450-3進行敲除,以得到只生產GA4或GA7的工程菌株。結果發現,des敲除株不再產生GA3與GA7,而GA1與GA4則大幅增加,兩者合成比例約為5∶1。而P450-3敲除株不再生產GA3與GA1,同時GA4與GA7的產量較野生型菌株大幅增加,此結果與藤倉赤霉紫外突變株6314(P450-3 884 bp處帶一個點突變)一致,因此該菌株可作為生產GA4+7的工程菌。當des與P450-3兩者都被敲除,敲除株只生產GA4,并且其產量比野生型高7~8倍。Wiemann等[47]將藤倉赤霉磷酸泛酰巰基乙酰轉移酶編碼基因ppt1敲除,導致聚酮化合物合酶(PKSs)和非核糖體縮氨酸合酶(NRPSs)活性喪失,與這兩種酶相關的下游次級代謝反應均不再進行,因此代謝流向赤霉素合成途徑轉移,使GAs產量大幅增加。為了顯著提高藤倉赤霉GAs合成效率,2013年Tudzynski等[1]在野生型或6314基礎上將合成途徑中hmgr、fpps、ggs2、cps/ks等幾個關鍵酶基因進行超表達。結果顯示,在同等培養條件下hmgr和fpps的超表達反而導致赤霉素產量下降,這可能是由于上游前體物質的增加激活了途徑中的反饋抑制。而將6314菌株中ggs2進行超表達后發現,赤霉素總產量提高135%。由于ggs2與cps/ks共用一個啟動子,因此同時將兩者進行超表達,結果赤霉素總產量提高近54%。Hmgr表達的酶由兩個部分組成,分別為含8個跨膜區域的疏水性N端和一個親水性的C端,而N端跨膜域被懷疑與反饋抑制相關。因此在6314的基礎上敲除hmgr的N端序列,超表達hmgr的C端序列,最后赤霉素總產量相比6314提高了260%。目前,對于藤倉赤霉基因工程改造方面的研究還很少,且在提高赤霉素產量方面的成果也并不顯著,因此該方向有待發展。
5藤倉赤霉生產赤霉素的發酵技術
目前利用赤霉菌的工業化大規模發酵,全世界每年可生產超過25噸赤霉素,市場價值高達1億美元。工業化的赤霉素生產技術以液態發酵為主,也有固態發酵的報道。科學界在提高赤霉素發酵產量和降低生產成本上投入了大量研究[9]。但還存在著產量偏低、成本過高、后期分離難度過大等原因。目前,在發酵方法方面,既對傳統的液體發酵技術、固體發酵技術進行改進,也嘗試如固定化發酵技術這樣的新技術。
5.1液體深層發酵技術
長久以來,工業上一直采用藤倉赤霉的液體深層發酵技術生產赤霉素,但產量通常受到產物反饋抑制、化學分解、菌株退化等原因的限制[48]。1995年Hollman等[49]首次使用持續萃取發酵技術,在發酵過程中持續地將發酵液從發酵罐中泵入一個交叉流微濾裝置進行過濾。濾液則被泵入裝有65%Genapol和35%水的萃取塔中進行萃取,而濾出的微生物被回收并加入發酵罐重新利用。該方法赤霉素產量為520 mg/L,但從一定程度上降低了產物的反饋抑制。同時,液體深層發酵技術還受到許多外界因素的影響,如pH、溫度、光照、通氧、碳氮比等[50]。當pH在3.5~5.0之間,溫度25 ℃時,GA3的發酵產量可達到最大;當pH在6~7之間,溫度超過32 ℃時,發酵液中GA4、GA7的積累量會增加[51-52]。由于赤霉素的生物合成受到高濃度氮的抑制,所以保持培養基中低濃度的氮源有利于赤霉素產量的提高[53-54]。而高濃度的葡萄糖對赤霉素的合成有明顯的抑制作用[55],葡萄糖的抑制機理目前還不清楚。碳源的選擇對赤霉素的發酵產量至關重要,有研究表明以麥芽糖、甘露糖、丙三醇、半乳糖等代替葡糖糖作為碳源可增加GA3產量[56]。由于赤霉素的生物合成是在類異戊二烯途徑的基礎上進行的,因此也有研究表明在培養基中添加植物油可增加GA3的產量[57]。一些如牛乳清粉、糖蜜、甜菜渣等工業廢料也可作為碳源,用于赤霉素的發酵生產[58]。有報道證明,以貽貝加工廢棄物作為原料液體深層發酵生產赤霉素,產量可達3 g/L[59]。
5.2赤霉素的固態發酵技術
固態發酵技術(SSF)指利用不溶性的原料作為營養源和物理支持物,使微生物在較低水活度的環境下大量繁殖并生產目的產物。工業上生產微生物次級代謝產物,固態發酵技術相較于深層液體發酵技術有著更高的產量,且需要的能量更少,下游處理工藝更簡單,大大節省了生產成本[60]。因此,目前固態發酵技術在赤霉素的生產領域也受到了廣泛的關注。而赤霉素固態發酵主要受到底物投加方法、環境條件、營養因子、固體支持物種類等因素的影響[50]。1987年,Kumar等[61]通過實驗證明玉米麩、麥麩、米糠、木薯粉等廉價原料也可作為固態發酵GA3的原料,且GA3的產量比普通深層液態發酵高1.6倍。1996年,Bandelier等[62]首次在一種無菌小規模反應器(50 L)中,通過分批補料固態發酵的方法以含50%干物質的小麥麩為原料生產赤霉素GA3,測得GA3產量高達3 g/Kg。近幾年,有研究發現固態發酵培養基中水活度也是影響因素之一。2005年,Corona等[63]以小麥麩和可溶性淀粉作為有機基質研究不同水活度對赤霉素固態發酵產量的影響,結果發現當水活度為0.99的最適條件下,GA3產量可達(4.5~5.0)g/Kg。一些惰性載體如離子交換樹脂,也被嘗試著作為藤倉赤霉生長和赤霉素生產的支持物,結果發現其最大生物量達到40 mg/g,赤霉素GA3的產量則可達到0.73 mg/g[64]。麻風樹的種子富含油,當油被榨出后剩下的麻風樹種子餅也可被作為發酵生產赤霉素的原料,且可大幅度提高產量。有報道指出,以麻風樹種子餅作為底物進行液態深層發酵時,保持最佳物理參數,GA3產量最高可達15 g/L;而作為固態發酵底物時,最高產量史無前例地達到了105 g/Kg[65]。
5.3固定化赤霉菌發酵技術
近幾年,固定化細胞發酵技術以其獨特的優勢越來越多地被應用于赤霉素的生產。通過藤倉赤霉菌絲的固定化可以獲得較高的細胞密度,并且提高傳質速率,有利于保持高生產率;固定化細胞生長消耗的底物更少,且底物補加過程可控性更高從而提高底物利用率[66]。不同的固定化方法對藤倉赤霉的穩定性和赤霉素產量都有不同影響,一些聚合材料如聚氨酯、角叉菜膠、海藻酸鹽被報道可用于藤倉赤霉的固定化[50]。Kumar等[67]以海藻酸鈉或卡拉膠凝膠珠固定藤倉赤霉菌絲,在一個倒置的圓錐形流態化生物反應器中進行反復分批發酵,結果發現由于培養基的重復使用、固態化細胞不穩定導致GA3的產量反而低于液體發酵20%。有研究證明,將藤倉赤霉細胞附著于被親水性羥乙基丙烯酸酯和疏水性三甲基丙烯酸酯共聚物覆蓋的聚合纖維載體之上,連續發酵12批次的循環超過84天,赤霉素產量穩定地維持在210 mg/L[68]。2000年,Escamilla等[69]以聚半乳糖醛酸鈣固定化藤倉赤霉,并優化了培養基中PH、碳氮比、米粉濃度、溫度等因素,在一個流態化反應器中進行分批發酵,最終GA3產量高達3.9 g/L。以硅藻土珠子作為材料固定藤倉赤霉細胞,在7L的無菌發酵罐中進行反復分批發酵,赤霉素產量是同樣條件下液體發酵的3倍。而發酵過程中添加的棉籽餅粉濃度可對赤霉素產量及操作穩定性產生很大影響,當棉籽餅粉與葡萄糖在培養基中含量達到1∶10時,赤霉素產量達到最大,固定化細胞穩定性達到最高[66]。國內,陳九武[70]等建立了聚乙烯醇水凝膠的固定化方法,并與海藻酸鈣凝膠進行了比較,發現該凝膠在機械輕度、使用壽命、貯存穩定性等方面均更優秀。因此,可將該方法應用于各種真菌的固定化發酵。藤倉赤霉固定化發酵與上述液態發酵和固態發酵相比雖然有很多優勢,但在大規模發酵生產赤霉素上遭遇了很多問題,如菌種變異、固定化細胞穩定性不高、發酵過程控制困難等。因此,藤倉赤霉的最佳固定化方法和發酵規模的擴大還有待研究。
6結束語
赤霉素作為能有效調控植物生長發育的主要激素,其生物合成無論在植物還是微生物中都受到嚴格的調控。相比高等植物和可生產赤霉素的細菌,藤倉赤霉的赤霉素生物合成機理已被研究得較為清楚。赤霉素的生物合成途徑中的大部分基因的序列、功能特征也通過定點敲除、同源重組、互補等手段被深入地研究。這對在分子水平上系統地認識赤霉素生物合成途徑中的酶、調控方式、中間代謝產物、代謝調節機理有極大的幫助,同時也為利用基因工程手段獲得高產菌株提供了可能。目前一些與赤霉素生物合成相關的基因表達調控過程已被初步研究。但氮代謝抑制的分子機制并不清楚,是否存在其他調控基因有待進一步地研究。還有途徑中涉及調控的各基因之間的作用機制和轉錄因子識別方式也有待解釋清楚。
目前,通過改良傳統發酵技術,可在一定程度上提高赤霉素產量。但隨著農業上對赤霉素日益增長的需求,通過如菌種選育、培養基優化、發酵技術改良等方法并不能大幅地提高赤霉素產量、簡化下游操作。因此,利用基因工程技術對赤霉素生物合成途徑進行分子改造,從而得到產量高、赤霉素種類單一的工程菌株勢必成為研究赤霉菌的趨勢。
參考文獻
[1]Albermann S, Linnemannstons P, Tudzynski B. Strategies for strain improvement inFusariumfujikuroi: overexpression and localization of key enzymes of the isoprenoid pathway and their impact on gibberellin biosynthesis. Applied Microbiology and Biotechnology, 2013, 97(7): 2979-2995.
[2]Bomke C, Tudzynski B. Diversity, regulation, and evolution of the gibberellin biosynthetic pathway in fungi compared to plants and bacteria. Phytochemistry, 2009, 70(15-16): 1876-1893.
[3]Hooley R. Gibberellins: perception, transduction and responses. Plant Molecular Biology, 1994, 26(5): 1529-1555.
[4]Lale G, Gadre R. Enhanced production of gibberellin A4 (GA4) by a mutant ofGibberellafujikuroiin wheat gluten medium. Journal of Industrial Microbiology &Biotechnology, 2010, 37(3): 297-306.
[5]Linnemannstons P, Schulte J, Prado MD,etal. The polyketide synthase genepks4 fromGibberellafujikuroiencodes a key enzyme in the biosynthesis of the red pigment bikaverin. Fungal Genetics and Biology, 2002, 37(2): 134-148.
[6]Studt L, Wiemann P, Kleigrewe K,etal.Biosynthesis of Fusarubins Accounts for Pigmentation ofFusariumfujikuroiPerithecia. Applied and Environmental Microbiology, 2012, 78(12): 4468-4480.
[7]Barrero AF, Sanchez JF, Oltra JE,etal. Fusarin-C and 8z-Fusarin-C fromGibberellafujikuroi. Phytochemistry, 1991, 30(7): 2259-2263.
[8]Tudzynski B, Holter K. Gibberellin biosynthetic pathway inGibberellafujikuroi: evidence for a gene cluster. Fungal Genetics and Biology, 1998, 25(3): 157-170.
[9]Tudzynski B. Biosynthesis of gibberellins inGibberellafujikuroi: biomolecular aspects. Applied Microbiology and Biotechnology, 1999, 52(3): 298-310.
[10]Tudzynski B. Gibberellin biosynthesis in fungi: genes, enzymes, evolution, and impact on biotechnology. Applied Microbiology and Biotechnology, 2005, 66(6): 597-611.
[11]Hedden P, Kamiya Y. Gibberellin biosynthesis: Enzymes, genes and their regulation. Annu Rev Plant PhysPlant Mol. Biol., 1997, 48: 431-460.
[12]Sun TP, Kamiya Y. Regulation and cellular localization ofent-kaurene synthesis. Physiol Plantarum, 1997, 101(4): 701-708.
[13]Tudzynski B, Hedden P, Carrera E,etal. The P450-4 gene ofGibberellafujikuroiencodesent-kaurene oxidase in the gibberellin biosynthesis pathway. Applied and Environmental Microbiology, 2001, 67(8): 3514-3522.
[14]Rojas MC, Hedden P, Gaskin P,etal.The P450-1 gene ofGibberellafujikuroiencodes a multifunctional enzyme in gibberellin biosynthesis. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(10): 5838-5843.
[15]Tudzynski B, Rojas MC, Gaskin P,etal. The gibberellin 20-oxidase ofGibberellafujikuroiis a multifunctional monooxygenase. The Journal of Biological Chemistry, 2002, 277(24): 21246-21253.
[16]Tudzynski B, Mihlan M, Rojas MC,etal. Characterization of the final two genes of the gibberellin biosynthesis gene cluster ofGibberellafujikuroi:desandP450-3 encode GA4 desaturase and the 13-hydroxylase, respectively. The Journal of Biological Chemistry, 2003, 278(31): 28635-28643.
[17]Homann V, Mende K, Arntz C,etal. The isoprenoid pathway: Cloning and characterization of fungalFPPSgenes. Current Genetics, 1996, 30(3): 232-239.
[18]Mende K, Homann V, Tudzynski B. The geranylgeranyl diphosphate synthase gene ofGibberellafujikuroi: isolation and expression. Molecular &General Genetics: MGG, 1997, 255(1): 96-105.
[19]Woitek S, Unkles SE, Kinghorn JR,etal. 3-Hydroxy-3-methylglutaryl-CoA reductase gene ofGibberellafujikuroi: Isolation and characterization. Current Genetics, 1997, 31(1): 38-47.
[20]李紅民, 賈敬芬, 梅興國. 赤霉菌分子生物學研究進展. 微生物學報, 2004, 44(4): 552-555.
[21]Domenech CE, Giordano W, Avalos J,etal. Separate compartments for the production of sterols, carotenoids and gibberellins inGibberellafujikuroi. Eur J Biochem, 1996, 239(3): 720-725.
[22]Mishra NC, Tatum EL. Non-Mendelian inheritance of DNA-induced inositol independence inNeurospora. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70(12): 3875-3879.
[23]Linnemannstons P, Voss T, Hedden P,etal. Deletions in the gibberellin biosynthesis gene cluster ofGibberellafujikuroiby restriction enzyme-mediated integration and conventional transformation-mediated mutagenesis. Applied and Environmental Microbiology, 1999, 65(6): 2558-2564.
[24]de Groot MJA.Agrobacteriumtumefaciens-mediated transformation of filamentous fungi. Nat Biotechnol, 1998, 16(11): 1074.
[25]Sanchez-Fernandez R, Unkles SE, Campbell EI,etal. Transformation of the Filamentous FungusGibberellafujikuroiUsing theAspergillusnigerniaDGene Encoding Nitrate Reductase. Molecular & General Genetics, 1991, 225(2): 231-233.
[26]Bruckner B, Unkles SE, Weltring K,etal. Transformation ofGibberellafujikuroi: Effect of theAspergillusnidulansAMA1 Sequence on Frequency and Integration. Current genetics, 1992, 22(4): 313-316.
[27]Tudzynski B, Mende K, Weltring K-M,etal. TheGibberellafujikuroiniaDgene encoding nitrate reductase: isolation, sequence, homologous transformation and electrophoretic karyotype location. Microbiology, 1996, 142(Pt 3): 533-539.
[28]Yu JH, Hamari Z, Han KH,etal. Double-joint PCR: a PCR-based molecular tool for gene manipulations in filamentous fungi. Fungal Genetics and Biology, 2004, 41(11): 973-981.
[29]Leslie JF, Dickman MB. Fate of DNA Encoding Hygromycin Resistance after Meiosis in Transformed Strains ofGibberellafujikuroi(Fusariummoniliforme). Applied and Environmental Microbiology, 1991, 57(5): 1423-1429.
[30]郝麗梅, 龔偉, 梅興國等. 一種農桿菌介導的赤霉菌CCRC3.572的轉化方法. 生物技術通訊, 2006(6): 888-890.
[31]朱廷恒, 易佳煒, 王渭霞等. 赤霉菌原生質體外源基因高效轉化方法研究. 浙江工業大學學報, 2013, 41(5): 482-485.
[32]Brakhage AA. Regulation of fungal secondary metabolism. Nat Rev Microbiol, 2013, 11(1): 21-32.
[33]Garvie CW, Wolberger C. Recognition of specific DNA sequences. Mol. Cell, 2001, 8(5): 937-946.
[34]Rodrigues C, Vandenberghe LPD, de Oliveira J,etal. New perspectives of gibberellic acid production: a review. Crit Rev Biotechnol, 2012, 32(3): 263-273.
[35]Rademacher W. Growth retardants: Effects on gibberellin biosynthesis and other metabolic pathways. Annu Rev Plant Phys Plant Mol. Biol., 2000, 51(4): 501-531.
[36]Munoz GA, Agosin E. Glutamine Involvement in Nitrogen Control of Gibberellic Acid Production inGibberellafujikuroi. Applied and Environmental Microbiology, 1993, 59(12): 4317-4322.
[37]Tudzynski B, Homann V, Feng B,etal. Isolation, characterization and disruption of the areA nitrogen regulatory gene ofGibberellafujikuroi. Molecular &General Genetics:MGG, 1999, 261(1): 106-114.
[38]Mihlan M, Homann V, Liu TWD,etal. AREA directly mediates nitrogen regulation of gibberellin biosynthesis inGibberellafujikuroi, but its activity is not affected by NMR. Molecular Microbiology, 2003, 47(4): 975-991.
[39]Andrianopoulos A, Kourambas S, Sharp JA,etal. Characterization of theAspergillusnidulansnmrAgene involved in nitrogen metabolite repression. Journal of Bacteriology, 1998, 180(7): 1973-1977.
[40]Jarai G, Marzluf GA. Analysis of conventional andinvitrogenerated mutants of nmr, the negatively acting nitrogen regulatory gene ofNeurosporacrassa. Molecular & General Genetics: MGG, 1990, 222(2-3): 233-240.
[41]Teichert S, Schonig B, Richter S,etal. Deletion of theGibberellafujikuroiglutamine synthetase gene has significant impact on transcriptional control of primary and secondary metabolism. Molecular Microbiology, 2004, 53(6): 1661-1675.
[42]Polley SD, Caddick MX. Molecular characterisation ofmeaB, a novel gene affecting nitrogen metabolite repression inAspergillusnidulans. FEBS Lett, 1996, 388(2-3): 200-205.
[43]Wong KH, Hynes MJ, Todd RB,etal. Transcriptional control ofnmrAby the bZIP transcription factor MeaB reveals a new level of nitrogen regulation inAspergillusnidulans. Molecular Microbiology, 2007, 66(2): 534-551.
[44]Wagner D, Schmeinck A, Mos M,etal. The bZIP Transcription Factor MeaB Mediates Nitrogen Metabolite Repression at Specific Loci. Eukaryot Cell, 2010, 9(10): 1588-1601.
[45]Studt L, Humpf HU, Tudzynski B. Signaling governed by G proteins and cAMP is crucial for growth, secondary metabolism and sexual development inFusariumfujikuroi. PloS one, 2013, 8(2): e58185.
[46]Michielse CB, Studt L, Janevska S,etal. The global regulator FfSge1 is required for expression of secondary metabolite gene clusters but not for pathogenicity inFusariumfujikuroi. Environ Microbiol, 2015, 17(8): 2690-2708.
[47]Wiemann P, Albermann S, Niehaus EM,etal. The Sfp-Type 4'-Phosphopantetheinyl Transferase Ppt1 ofFusariumfujikuroiControls Development, Secondary Metabolism and Pathogenicity. PloS one, 2012, 7(5): e37519.
[48]O'Donnell K, Cigelnik E, Nirenberg HI. Molecular systematics and phylogeography of theGibberellafujikuroispecies complex. Mycologia, 1998, 90(3): 465-493.
[49]Hollmann D, Switalski J, Geipel S,etal. Extractive Fermentation of GibberellicAcid byGibberellafujikuroi. J Ferment Bioeng, 1995, 79(6): 594-600.
[50]Shukla R, Srivastava AK, Chand S. Bioprocess strategies and recovery processes in gibberellic acid fermentation. Biotechnol Bioproc Eng, 2003, 8(5): 269-278.
[51]Borrow A, Brown S, Jefferys EG,etal. The Effect of Varied Temperature on the Kinetics of Metabolism ofGibberellafujikuroiin Stirred Culture. Canadian Journal of Microbiology, 1964, 10(3): 445-466.
[52]Borrow A, Brown S, Jefferys EG,etal. The Kinetics of Metabolism ofGibberellafujikuroiin Stirred Culture. Canadian Journal of Microbiology, 1964, 10(3): 407-444.
[53]Bruckner B, Blechschmidt D. Nitrogen Regulation of Gibberellin Biosynthesis inGibberellafujikuroi. Applied Microbiology and Biotechnology, 1991, 35(5): 646-650.
[54]Silva EME, Dendooven L, Reynell JAU,etal. Morphological development and gibberellin production by different strains ofGibberellafujikuroiin shake flasks and bioreactor. World J Microb Biot, 1999, 15(6): 753-755.
[55]Bruckner B. Regulation of Gibberellin Formation by the FungusGibberellafujikuroi. Ciba F Symp, 1992, 171(171): 129-143.
[56]Darken MA, Jensen AL, Shu P. Production of gibberellic acid by fermentation. Applied Microbiology, 1959, 7: 301-303.
[57]Gancheva V, Dimova T, Kamenov K,etal. [Biosynthesis of gibberellins. III. Optimization of the nutrient medium for gibberellin biosynthesis by using mathematical methods to plan experiments]. Acta Microbiologica Bulgarica, 1984, 14: 80-84.
[58]Cihangir N, Aksoz N. Production of gibberellic acid byAspergillusnigerusing some food industry wastes. Acta Microbiologica Polonica, 1996, 45(3-4): 291-297.
[59]Pastrana LM, Gonzalez MP, Murado MA. Production of Gibberellic Acid from Mussel Processing Wastes in Submerged Batch Culture. Bioresource Technol, 1993, 45(3): 213-221.
[60]Robinson T, Singh D, Nigam P. Solid-state fermentation: a promising microbial technology for secondary metabolite production. Applied Microbiology and Biotechnology, 2001, 55(3): 284-289.
[61]Kumar PKR, Lonsane BK. Gibberellic acid by solid state fermentation: Consistent and improved yields. Biotechnology and Bioengineering, 1987, 30(2): 267-271.
[62]Bandelier S, Renaud R, Durand A. Production of gibberellic acid by fed-batch solid state fermentation in an aseptic pilot-scale reactor. Process Biochem, 1997, 32(2): 141-145.
[63]Corona A, Saez D, Agosin E. Effect of water activity on gibberellic acid production byGibberellafujikuroiunder solid-state fermentation conditions. Process Biochem, 2005, 40(8): 2655-2658.
[64]Gelmi C, Perez-Correa R, Gonzalez M,etal. Solid substrate cultivation ofGibberellafujikuroion an inert support. Process Biochem, 2000, 35(10): 1227-1233.
[65]Rangaswamy V. Improved Production of Gibberellic Acid byFusariummoniliforme. Journal of Microbiology Research, 2012, 2(3): 51-55.
[66]Kim CJ, Lee SJ, Chang YK,etal. Repeated-batch culture of immobilizedGibberellafujikuroiB9 for gibberellic acid production: An optimization study. Biotechnol Bioproc Engineering, 2006, 11(6): 544-549.
[67]Kumar PKR, Lonsane BK. Immobilized growing cells ofGibberellafujikuroiP-3 for production of gibberellic acid and pigment in batch and semi-continuous cultures. Applied Microbiology & Biotechnology, 1988, 28(6): 537-542.
[68]Lu ZX, Xie ZC, Kumakura M. Production of Gibberellic Acid inGibberellafujikuroiAdhered onto Polymeric Fibrous Carriers. Process Biochem, 1995, 30(7): 661-665.
[69]Escamilla EM, Dendooven L, Magana IP,etal. Optimization of gibberellic acid production by immobilizedGibberellafujikuroimycelium in fluidized bioreactors. J Biotechnol, 2000, 76(2-3): 147-155.
[70]陳九武, 趙學慧,吳思方. 固定化細胞合成酯類載體的研究. 工業微生物, 1997,27(3): 27-31.
Advances in molecular biology and fermentation technology ofGibberellafujikuroi
LI Chao,YANG Jia-yu,LIU Jia,ZHU Ting-heng
Institute of biological engineering, Zhejiang university of technology, Hangzhou 310004
AbstractGibberellins (GAs), produced by fermentation of filamentous fungi Gibberella fujikuroi, is one of the most important plant hormones. With the developments of molecular biology techniques over the past 20 years, remarkable progresses were made in molecular identification and expression regulation of genes involved in gibberellin biosynthesis. Based on these progresses, the genetic engineering and metabolic engineering techniques for improving this fungus and enhancing the GAs fermentation level could be carried out. In this paper, the advances in GAs synthesis mechanism, expression regulation mechanisms, function of key enzyme genes, transformation system, fermentation technology and genetic engineering techniques about Gibberella fujikuroi were summarized.
Key wordsGibberella fujikuroi; molecular mechanisms; biosynthesis; expression regulation; fermentation
doi:10.3969/j.issn.1001-6678.2016.02.009
基金項目:浙江省新苗人才計劃(編號2013R403048)。
作者簡介:李超(1989~),男,碩士研究生。E-mail:563297356@qq.com。 *通訊作者: 朱廷恒,博士。Tel:86-571-88320741,E-mail:thzhu@zjut.edu.cn。

