來源于大腸桿菌的NMN轉移酶的克隆表達與酶學性質研究
段琳琳, 李紅梅
上海理工大學醫療器械與食品學院,上海 200093
來源于大腸桿菌的NMN轉移酶的克隆表達與酶學性質研究
段琳琳,李紅梅*
上海理工大學醫療器械與食品學院,上海 200093
摘要:在生物體內,NMN(煙酰胺單核苷酸)轉移酶能夠催化NMN生成NAD。本研究通過構建重組表達質粒pET30α(+)-Nmnat,成功實現來源于大腸桿菌的NMN轉移酶基因(Nmnat)的原核表達。從大腸桿菌基因組中克隆得到的NMN轉移酶基因長度為1 245 bp,所編碼的重組酶分子量 45 kDa。對重組酶的酶學性質進行分析,結果顯示該酶最適反應溫度和pH分別為37 ℃和7.5。4 ℃下,該酶的熱失活半衰期可長達990.2 min。Mn2+、Fe2+對該酶的酶活的激活作用顯著,而EDTA對酶活能造成明顯的抑制作用。酶動力學分析結果顯示,該酶對底物NMN催化的Km和Vmax分別為16.89 mmol/L和2.46 μmol/(L·min)。該NMN轉移酶基因在大腸桿菌宿主中的成功表達,為NAD生物合成應用研究奠定了基礎。
關鍵詞:大腸桿菌; NMN轉移酶; 克隆表達; 酶學性質
煙酰胺腺嘌呤二核苷酸(NAD,簡稱輔酶I),作為一種轉遞質子輔酶[1],參與生物體內的多種 氧化反應,如細胞物質代謝、能量合成、細胞DNA修復等[2-3],在細胞生命活動起著至關重要的作用[4-5]。在生物代謝途徑中, NAD的合成主要以煙酰胺單核苷(NMN) 和ATP為前體,在NMN轉移酶催化作用下,生成NAD和焦磷酸鹽。
研究發現NMN轉移酶是唯一一種能夠催化細胞核內NAD合成的生物酶,其類型有3種,分別是Nmnat1、Nmnat2和Nmnat3,且其分子量大小,性質以及特征隨著在組織細胞中的分布位置不同出現差異[6-7]。NMN轉移酶對細胞的存活也十分重要,可以降低對由基因引起的軸突變性[8-11],加快真核細胞的有絲分裂, 從而降低生物細胞的衰老和死亡[12],也可作為生物藥劑的靶標用于提高抗腫瘤藥物的生物活性[13-14]。
目前NMN轉移酶研究主要集中于酶活測定、酶分子結構、催化反應機制和體內代謝途徑等方面,而對酶基因進行重組表達的報道卻相對較少[15]。本文運用PCR技術從大腸桿菌中獲取NMN轉移酶基因,構建表達NMN轉移酶的重組菌,以期獲得具有良好催化性能的NMN轉移酶,并對重組酶的酶學性質進行研究,為NAD生物合成應用奠定基礎。
1材料與方法
1.1材料
1.1.1菌株、質粒和試劑
大腸桿菌BL21(DE3)、質粒pET30α(+)由實驗室保存。
1.1.2工具酶和試劑
TaqDNA聚合酶、限制性內切酶BamHI和NdeI、T4DNA連接酶、蛋白質標準分子量、DNA標準分子量購于TaKaRa公司。異丙基硫代-β-D-半乳糖苷(IPTG)購自上海生工生物工程公司。其他試劑均為國產分析純。
1.1.3培養基
種子培養基:采用LB培養基。磷酸鹽緩沖液(g/L):KH2PO423.1,K2HPO4125.4。121 ℃下滅菌20 min。發酵培養基:采用TB培養基。121 ℃下滅菌20 min。冷卻至60 ℃后再添加磷酸鹽緩沖液。固體培養基中加2%的瓊脂。培養基中按需添加終濃度為30 μg/mL的硫酸卡那霉素。
1.2方法
1.2.1NMN轉移酶基因的克隆
以大腸桿菌的基因組DNA為模板(GI:61676796),設計引物PCR擴增NMN轉移酶(Nmnat)編碼基因。上游引物P1:5’-CATCATATG TAGTCCTTATGCCTCCTCT-3;下游引物P2:5’-GTAGGATCCTAGAGCTGTC CGGAGAAGGTCT-3’,引物兩端分別引入BamHI和NdeI酶切位點,具體操作參見文獻[16]。PCR擴增條件:95 ℃,3 min,50 ℃,2 min, 72 ℃,1 min,35個循環,72 ℃延伸2 min。PCR產物跑電泳切膠回收目的片段。
1.2.2大腸桿菌表達載體的構建
將目的基因片段用BamHI和NdeI雙酶切后切膠回收,再與雙酶切后切膠回收的pET30α(+)載體片段在16 ℃下連接過夜,連接產物轉化E.coliBL21(DE3)感受態細胞,涂布抗性平板,37 ℃下培養過夜。挑取陽性轉化子提質粒并送上海生工測序,含正確克隆序列的質粒命名為pET30α(+)-Nmnat。
1.2.3目的基因在大腸桿菌中的誘導表達
將含有重組表達質粒pET30α(+)-Nmnat的E.coliBL21(DE3)單菌落接種于10 mL的LB液體管(含30 μg/mL的硫酸卡那霉素)中,37 ℃,200 r/min振蕩培養過夜,然后以1%接種量接入100 mL TB液體培養基(含30 μg/mL硫酸卡那霉素)中,37 ℃,200 r/min振蕩培養至OD600為0.5~0.7時,加入IPTG誘導劑至終濃度30 μg/mL,在25 ℃下誘導表達8 h,離心收集菌體用50 mmol/L的磷酸鹽緩沖溶液(pH 7.5)重懸,冰上超聲破碎(4 s,間隔6 s,60次,功率300 W),然后4 ℃,12 000 r/min下離心20 min去除細胞碎片,取上清進行SDS-PAGE分析并測酶活。
1.2.4SDS-PAGE分析
制備10%的分離膠和5%的濃縮膠,在80 V和120 V的電壓下進行不連續垂直平板電泳,凝膠用考馬斯亮藍染色。
1.2.5NMN轉移酶活力測定
NAD酶活力的檢測原理:

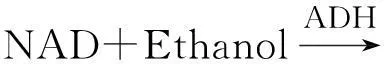
反應體系:1 mol/L pH 7.5 Tris-HCl緩沖液,300 mmol/L NMN,50 mmol/L ATP,50 mmol/L Mn2+,乙醇2%,適量酶液,7U的ADH(乙醇脫氫酶),混勻,置37 ℃水浴中振蕩反應2 h,加0.155 mol/L的EDTA終止酶反應,5 min后冰浴冷卻,8 000 r/min下離心1 min,上清液在340 nm處測定吸光值,以OD340代表NMN轉移酶酶活力大小。酶活單位(U)定義:37 ℃,pH 7.5條件下,1 min催化1 μmol NMN所需的酶量。比酶活用U/mg或U/g表示。
1.2.6重組酶性質分析
酶的最適溫度研究:分別于20 ℃、30 ℃、37 ℃、45 ℃、50 ℃、55 ℃、60 ℃、70 ℃、80 ℃下測定酶活,確定酶的最適反應溫度。
酶的熱失活曲線與失活動力學和熱力學參數計算:
將酶分別置30 ℃、37 ℃、50 ℃下保溫,每隔30 min冰浴冷卻離心取樣測定殘余酶活,繪制酶熱失活曲線。根據公式(1)~(3)計算出熱失活速率常數Ki、半衰期t1/2和吉布斯自由能ΔG。
(1)
失活半衰期公式t1/2=ln2/Ki
(2)
吉布斯自由能的計算公式[15]為
ΔG=-2.303RTlg(Kih/KBT)
(3)
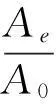
酶的最適pH研究:在不同pH(pH 4.0~10.0,1 mol/L的緩沖液)下測定酶活,確定酶的最適反應pH。
酶的pH穩定性:酶在37 ℃下,1 mol/L的緩沖液(pH 4.0~10.0)中保溫2 h后冰浴冷卻5 min測定殘余酶活。
金屬離子和EDTA對酶活力的影響:在最適反應溫度和最適反應pH下,分別添加不同金屬離子和EDTA(終濃度50 mmol/L),分別測定其對酶促反應的影響。以不加金屬離子或EDTA作為對照。
反應動力學常數Km及Vmax的測定:調整反應體系中底物NMN的濃度為1 mmol/L、2 mmol/L、3 mmol/L、4 mmol/L和5 mmol/L,測定NMN轉移酶的酶活,根據底物濃度和相應的反應初速率,用Michaelis-Menten方程計算米氏常數Km和最大反應速率Vmax值。
2結果與分析
2.1目的基因克隆和重組表達質粒構建
從大腸桿菌基因組中PCR擴增出NMN轉移酶編碼基因,陽性轉化子提取質粒雙酶切驗證(圖1),正確者送測序,結果顯示克隆片段長1 245 bp,與大腸桿菌的Nmnat基因序列同源性為99%,表明重組表達質粒構建成功。
將重組質粒pET30α(+)-Nmnat轉入E.coliBL21(DE3)感受態細胞中,進行目的基因誘導表達,將表達后的細胞破碎液上清進行SDS-PAGE分析。如圖2所示,以空載質粒為對照,在45 kDa處出現特征條帶,且與目標蛋白的理論計算值吻合,說明目的基因在大腸桿菌宿主中成功實現了異源表達。
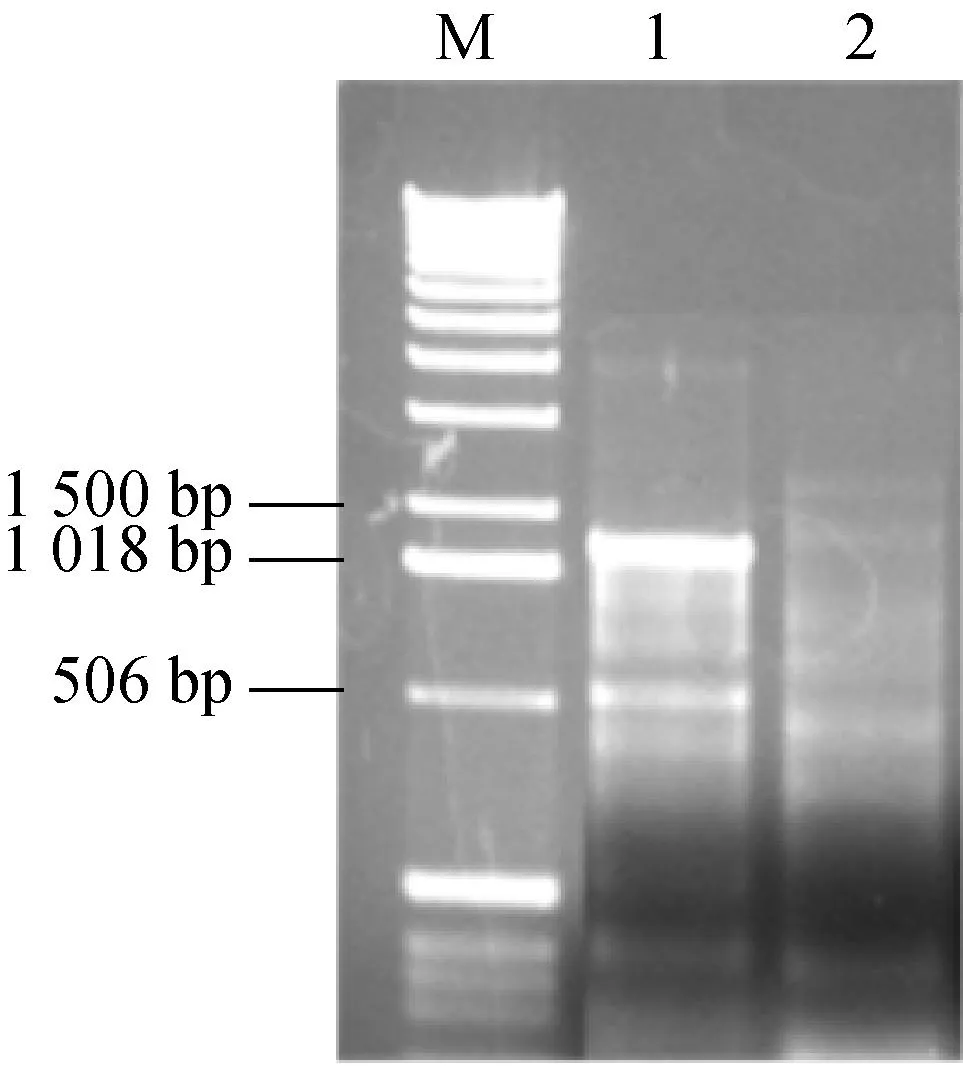
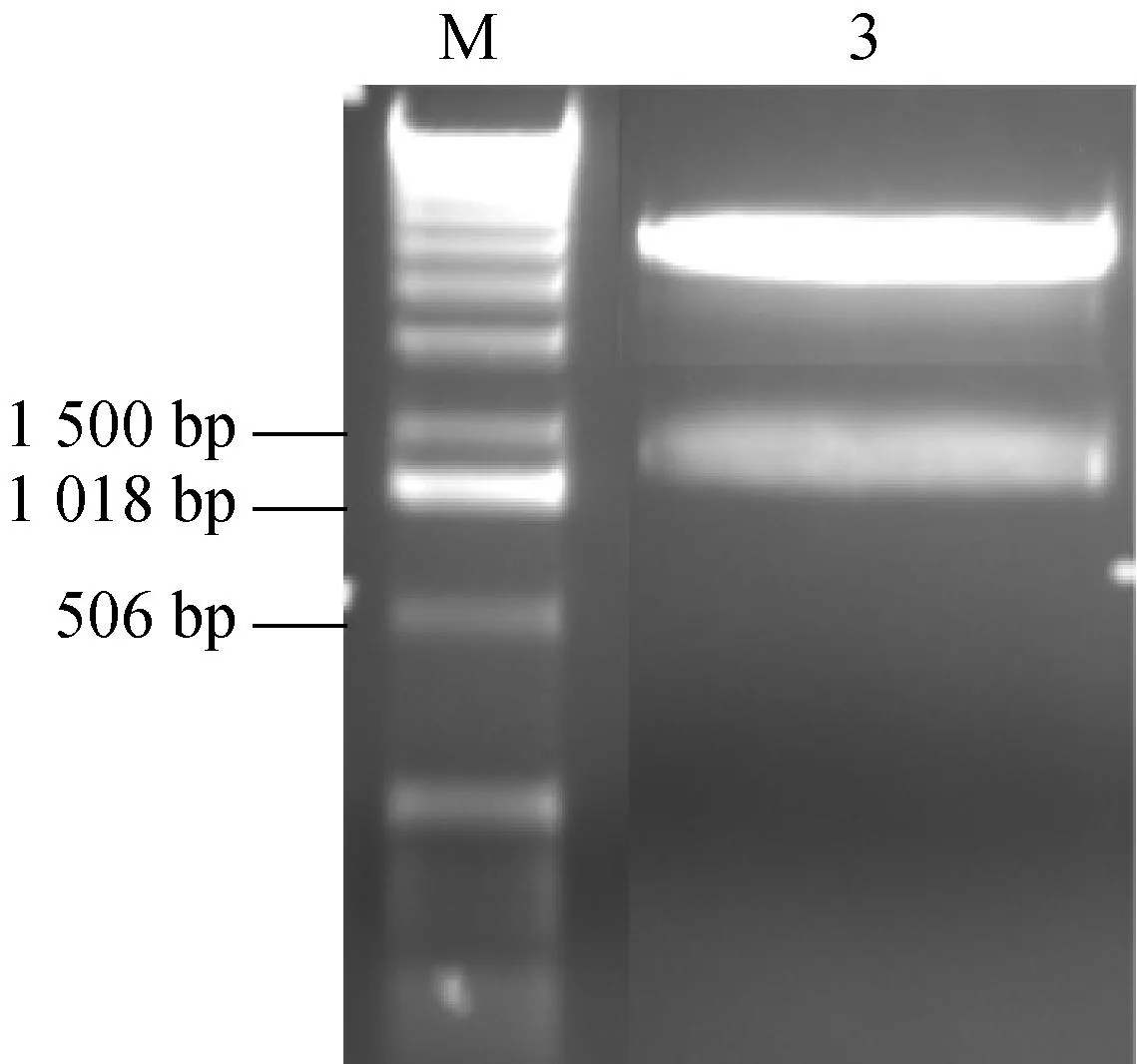
M: DNA相對分子質量標準;1:PCR產物;2:陰性對照;3:重組表達質粒pET30α(+)-Nmnat經BamHI和NdeI雙酶切后的產物
圖1瓊脂糖電泳檢測DNA
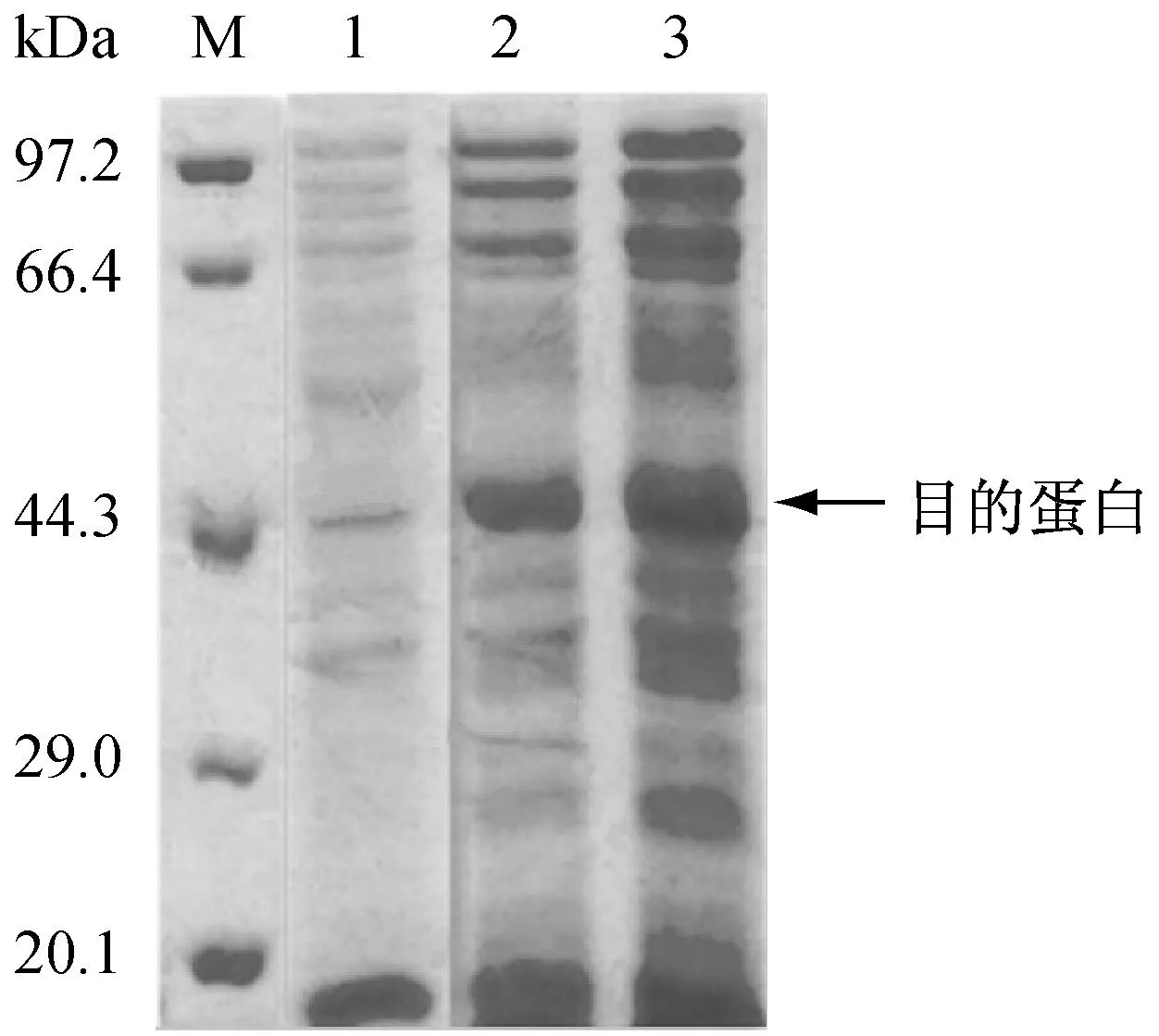
泳道M:蛋白質相對分子質量標準;泳道1:E.coliBL21(DE3)經超聲破碎后的上清;泳道2:稀釋10倍誘導表達8 h后,含pET30α(+)的E.coliBL21(DE3)經超聲破碎后的上清;泳道3:稀釋5倍誘導表達8 h后,含pET30α(+)-Nmnat的E.coliBL21(DE3)經超聲破碎后的上清
圖2目的基因在E.coliBL21(DE3)中的表達
2.2重組酶的酶學性質研究
2.2.1重組酶的最適反應溫度
如圖3所示,在20 ℃~37 ℃內,隨溫度升高,酶活性逐漸升高;當反應溫度超過37 ℃,酶活性迅速下降。因此確定該酶最適反應溫度為37 ℃,與已報道的其它來源的NMN轉移酶的最適溫度相同[ 17-18]。
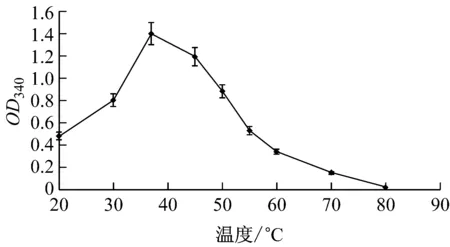
圖3 重組酶的最適反應溫度
2.2.2重組NMN轉移酶的熱失活動力學和熱力學分析
結果如圖4和圖5所示。從圖中可看出,重組NMN轉移酶的失活符合一級失活反應規律。熱失活速率常數和半衰期自由(ΔG)的結果如表1所示。該酶在4 ℃時半衰期長達990.2 min,而60 ℃時,酶的穩定性較差,半衰期僅為2.5 min。文獻數據顯示,吉布斯自由能的數值大小與酶的熱穩定性相關。ΔG越高,代表酶的穩定性越好[15]。因此,從吉普斯自由能角度可發現,在20 ℃、30 ℃、37 ℃時,重組NMN轉移酶的ΔG較高,這也進一步說明,在低溫時該酶的穩定性較好,當溫度高于37 ℃時,ΔG開始降低,表明該酶的穩定性下降。
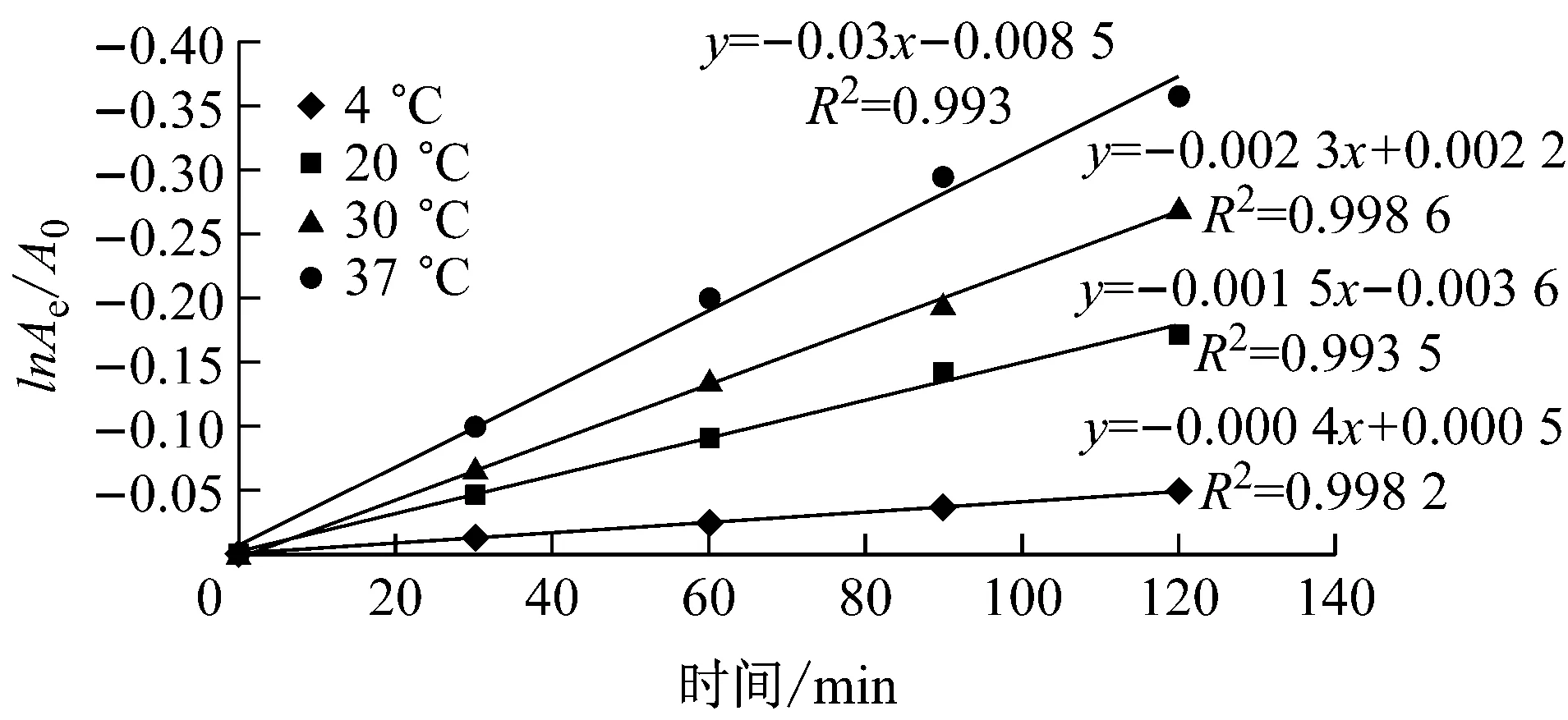
縱坐標:相對殘留酶活力的對數;曲線斜率:熱失活的一級速率常數Ki
圖4重組NMN轉移酶的熱穩定性
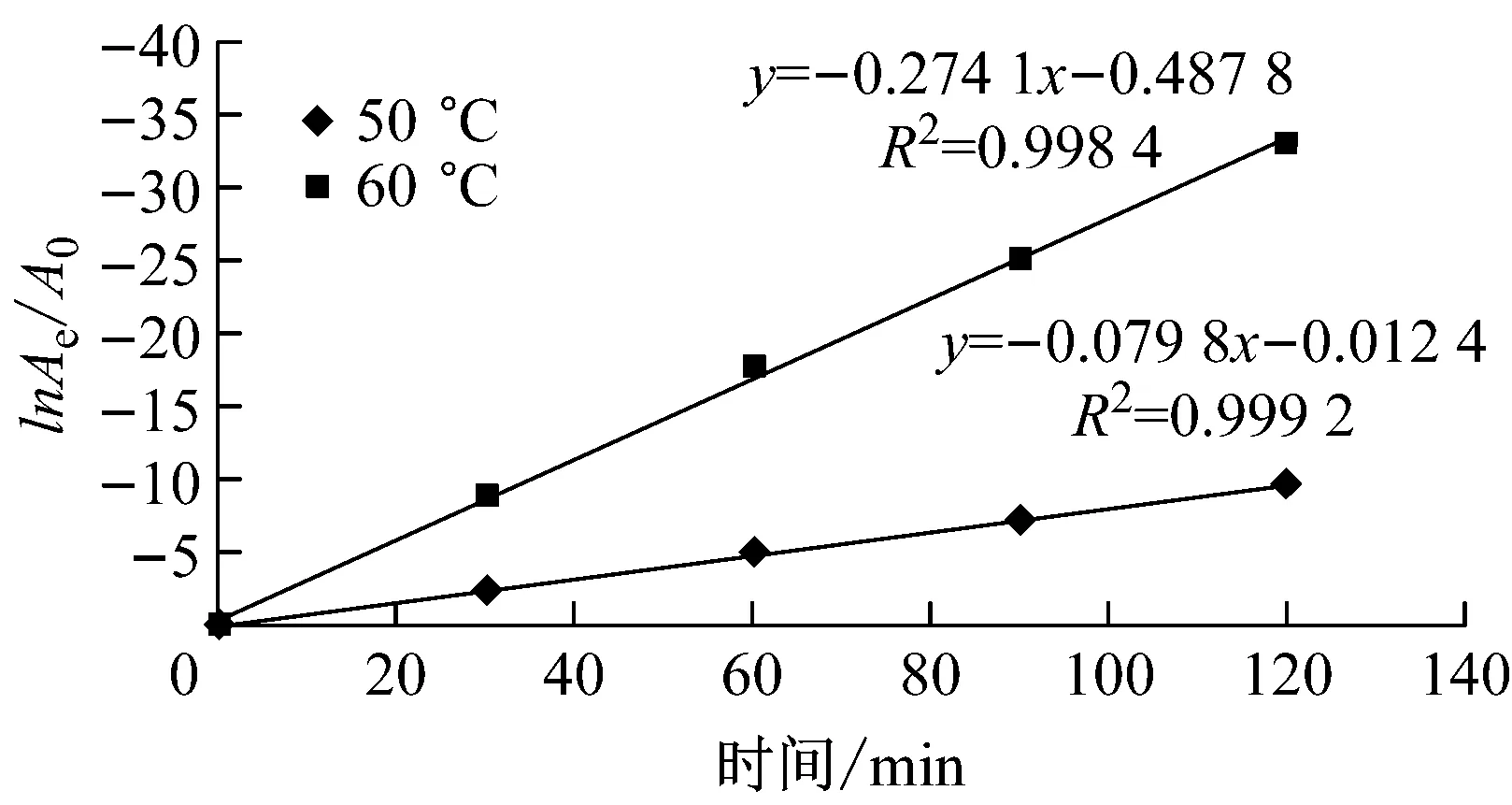
ln Ae/A0:相對酶活力的對數;曲線斜率:熱失活的一級速率常數Ki
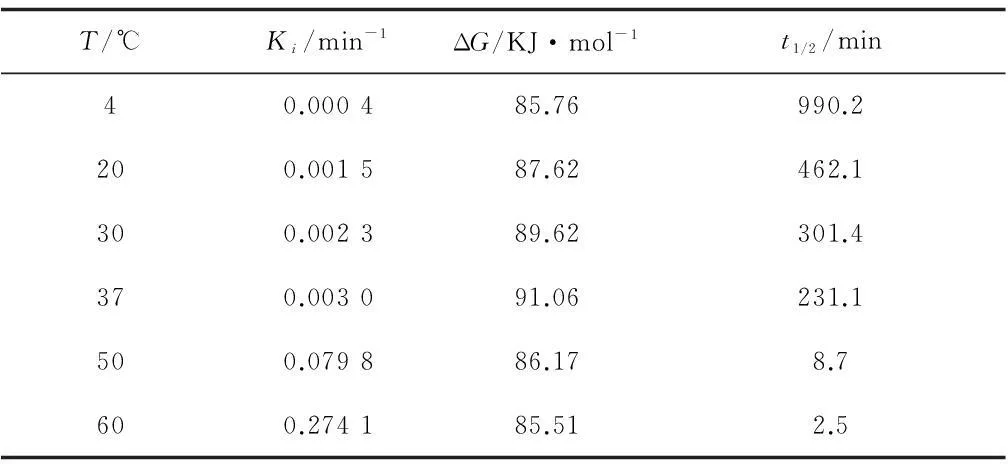
T/℃Ki/min-1ΔG/KJ·mol-1t1/2/min40.000485.76990.2200.001587.62462.1300.002389.62301.4370.003091.06231.1500.079886.178.7600.274185.512.5
2.2.3重組酶的最適反應pH
環境pH可影響酶催化活性位點上相關基團的解離及底物的解離狀態,進而影響酶的催化性能。本研究考察了該重組NMN轉移酶在不同的pH值下催化NMN轉化為NAD的變化情況。如圖6所示,重組酶最適反應pH為7.5,當pH大于8時酶活迅速降低。該重組酶的最適反應pH與炭疽桿菌細胞NMN轉移酶最適pH相同[19]。
2.2.4重組NMN轉移酶的pH穩定性
反應體系的pH可以影響酶的空間構象和穩定性[19]。重組NMN轉移酶的pH穩定性如圖7所示,pH 7.0~8.0時酶的穩定性較好,酶活性保持在80%以上;當pH低于5.5或高于9時,酶的活性明顯降低。這可能是由于在偏酸或偏堿的環境中,重組酶的空間構象發生改變,導致酶活降低。
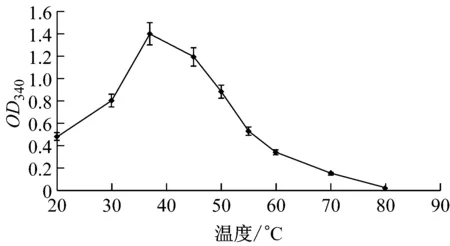
圖6 重組NMN轉移酶的最適反應pH
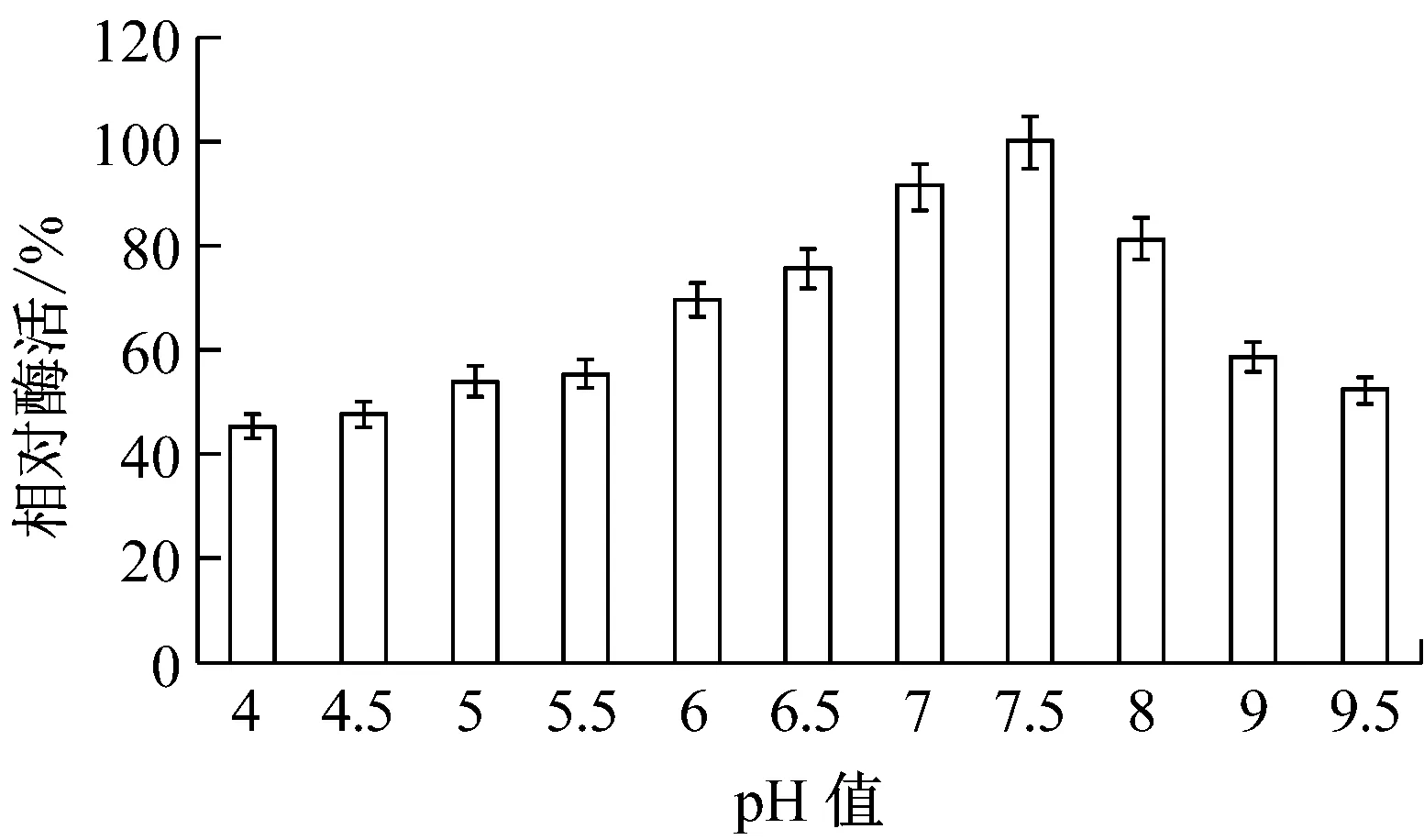
圖7 pH對重組NMN轉移酶穩定性的影響
2.2.5金屬離子及EDTA對酶活的影響
某些酶需要金屬離子作為輔助因子[20]。本研究考察了不同的金屬離子及EDTA對酶活的影響。如圖8所示,Fe2+和Mn2+能顯著提高重組NMN轉移酶的活性;而Ca2+、Zn2+、Mg2+對酶活促進作用不明顯;Fe3+起抑制酶活的作用;當在反應體系中添加金屬螯合劑EDTA,酶活顯著下降。
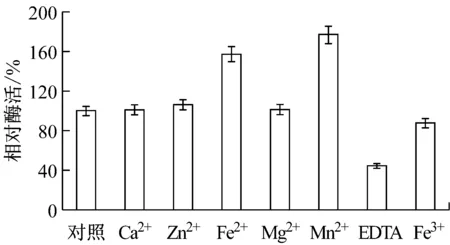
圖8 金屬離子及EDTA對酶活的影響
2.2.6重組NMN轉移酶的反應動力學常數測定
本研究采用雙倒數法測定重組NMN轉移酶的Km及Vmax,結果如圖9所示。該重組酶的Km為16.89 mmol/L。該重組酶的Km值與來源于哺乳動物細胞核內的NMN轉移酶的Km接近[2],但低于來源于人體組織的NMN轉移酶的Km[7]及來源于炭疽桿菌細胞的NMN轉移酶的Km[18](表2)。
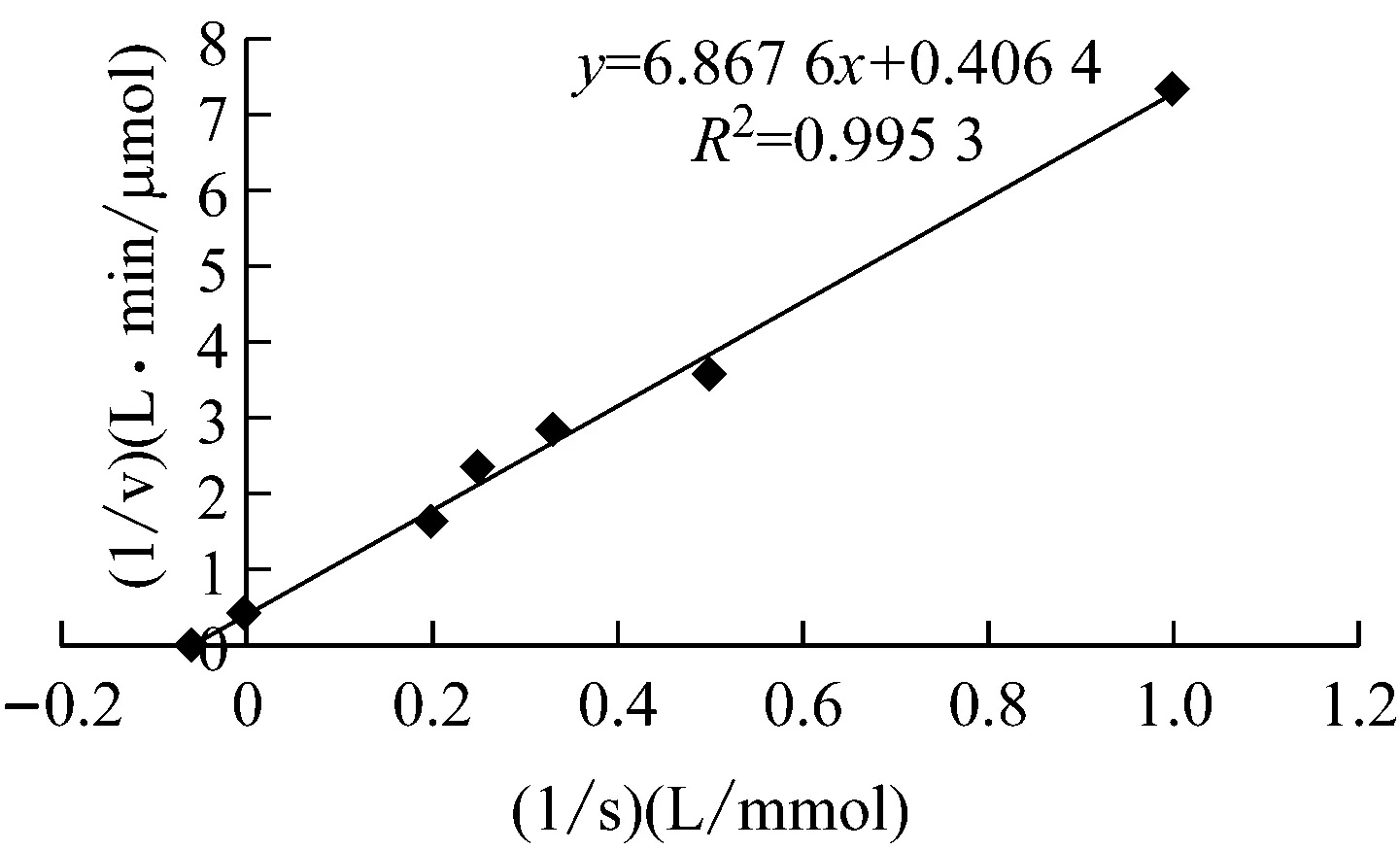
圖9 重組NMN轉移酶的反應動力學常數測定

來源最適反應pH最適反應溫度/℃Kcat/s-1Km分子量Mr/kDa大腸桿菌7.53712.1316.8945哺乳動物細胞核人體啤酒酵母炭疽桿菌細胞7.56.0-9.05.0-9.07.53737373710.73--16.22±2/20.67±1.914.660.023/0.091-0.5435[2]31.9/34.4[7]48[17]49[18]
3結論
(1) 本研究利用基因工程技術將重組表達質粒pET30α(+)-Nmnat轉入E.coliBL21(DE3)中進行目的基因的異源表達。SDS-PAGE分析顯示,經IPTG誘導8 h后,目的基因成功表達,重組酶分子量45 kDa。
(2) NMN轉移酶有三種同源體,不同來源的性質差異顯著。本文深入研究來源于大腸桿菌的重組NMN轉移酶的酶學性質,重組酶最適反應溫度和pH分別為37 ℃、7.5。Mn2+和Fe2+對該酶具有明顯的激活作用,而EDTA則可以顯著抑制酶活性。另外,通過動力學分析熱失活常數、pH穩定性及酶動力學參數測定,以及與不同來源的NMN轉移酶進行比較,結果表明,該重組酶對底物NMN的親和力水平與來源于哺乳動物細胞核的NMN轉移酶相近,但遠低于來源于人體的NMN轉移酶,后續可考慮采用蛋白質工程技術進一步增強該酶的底物親和力。
本研究成功構建了能高效表達大腸桿菌NMN轉移酶的基因工程菌,并對該重組酶的酶學性質進行了系統研究,為后續NAD生物合成提供了有價值的技術參考。
參考文獻
[1]Penberthy WT. Nicotinamide adenine dinucleotide biology and disease.CurrPharmaceut Design, 2009,15: 1-2.
[2]呂小群,張偌瑜,徐學文等. 煙酰胺單核苷酸腺苷轉移酶的表達、純化及活性測定[J].第二軍醫大學學報, 2010,11(31):1251-1254.
[3]Koubova J. Guarente L. How does calorie restriction work.GeneDev, 2003,17(3):313-321.
[4]Hassanain HH, Chon SY, Gupta SL. Differential regulation of human indoleanine 2,3-dioxygenase gene expression by interferons-gamma and-alpha. Analysis of the regulatory reginon of the gene and identification of an interferon-gamma-inducible DNA-binding factor.J Biol Chem,1993,268(7):5077-5084.
[5]Yahata N,Y uasa S,Araki T. Nicotinamide mononucleotide adenylyltransferase expression in mitochondrial matrix delays wallerian degeneration. J Neurosci, 2009, 29: 6276-6284.
[6]Zhang T, Berrocal JG, Frizzell KM,etal. Enzymes in the NAD+salvage pathway regulate sirt1 activity at target gene promoter. J Biol Chem, 2009,284: 20408-20417.
[7]Berger F, Lau C, Ziegler M. Regulation of poly(ADP - ribose) polymerase1 activity by the phosphorylation state of the nuclear nad biosynthetic enzyme NMN adenylyltransferase 1. PNAS,2007,104: 3765-3770.
[8]Nadia Raffaelli, Leonardo Sorci, Adolfo Amici,etal. Identification of a novel human nicotinamide mononucleotide adenylyltransferase.Biochemical and Biophysical Research Communications, 2002, 297: 835-840.
[9]Barile M, Passarella S, Danese G,etal. Rat liver mitochondria can synthesize nicotinamide adenine dinucleotide from nicotinamide mononucleotide and ATP via a putative matrix nicotinamide mononucleotide adenylyltransferase. Biochem Mol Biol Int,1996, 38(2):297-306.
[10]Arau jo WL, Nunes-Nesi A, Trenkamp S,etal. Inhibition of 2-oxoglutarate dehydrogenase in potato tuber suggests the enzyme is limiting for respiration and confirms its importance in nitrogen assimilation. Plant Physiol, 2008, 148(4):1782-1796.
[11]Burgos ES, Schramm VL. Weak coupling of ATP hydrolysis to the chemical equilibrium of human nicotinamide phosphoribosyl-transferase. Biochemistry, 2008,47(42):11086-11096.
[12]Berger F, Lau C, Dahlmann M,etal. Subcellular compart-mentation and differential catalytic properties of the three human nicotinamide mononucleotide adenylyltransferase Isoform. J Biol Chem, 2005,280(43):36334-36341.
[13]Magni G, Amici A, Emanuelli M,etal. Enzymology of NAD+homeostasis in man.CellMol Life Sci,2004,61(1):19-34.
[14]Berger F, Lau C, Dahlmann M,etal. Subcellular compart-mentation and differential catalytic properties of the three hum-annicotinamide mononucleotide adenylyltransferase isoforms[J].J Biol Chem, 2005,280(43):36334-36341.
[15]Thierry L, CharlesG, Georges F. Psychrophilicenzymes:Re-vising the thermodynamic parameters of activation may explain local flexibility.BiochimBiophysActa,2000,1543(1):1-10.
[16]Sambrook J, Frisch EF, Maniatis T. Molecular Cloning. A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989.
[17]Monica Emanuelli, Francesco Carnevali, Maria Lorenzi,etal.Identification and characterization of YLR328W, the Saccharomyces cerevisiae structural gene encoding NMN adenylyltransferase.Expression and characterization of the recombinant enzyme.FEBS Letters,1999,455:13-17.
[18]Valerie C Sershon, Bernard D, Santarsiero,etal. Mesecar Kinetic and X-Ray Structural Evidence for Negative Cooperativity in Substrate Binding to Nicotinate Mononucleotide Adenylyl-transferase (NMAT) from Bacillus anthracis J. Mol. Biol,2009, 385: 867-888.
[19]Catello Di Martino, Maria Luigia Pallotta. Mitochondria-localized NAD biosynthesis by nicotinamide mononucleotide adenylyl-transferase in Jerusalem artichoke (Helianthus tuberosus L.) heterotrophic tissues.Planta, 2011, 234:657-670.
[20]陳清西.酶學及其研究技術[M]. 廈門: 廈門大學出版社, 2010.
Cloning, expression and characterization of NMNadenylyltransferase fromEscherichiacoli
DUAN Lin-lin, LI Hong-mei
University of Shanghai for Science and Technology, School of Medical Instrument and Food Engineering, Shanghai 200093, China
AbstractNMN (Nicotinamide mononucleotide) adenylyltransferase can catalyze NMN to generate NAD in vivo. The gene encoding NMN adenylyltransferase was amplified from the genomic DNA of E. coli and was overexpressed in E. coli BL21(DE3) by using the recombinant expression plasmid pET30a(+). The results showed that a gene fragment of 1 245 bp and its encoding protein of 45 kDa were obtained. The optimal reaction temperature and pH of recombinant enzyme was 37 ℃ and 7.5, respectively. The thermo-inactivation half-life of the enzyme at 4 ℃ was up to 990.2 min. Mn2+and Fe2+stimulated the enzyme, while EDTA remarkably suppressed the enzyme activity. When NMN was used as substrate, Km and Vmaxof the enzyme were 16.89 mmol/L and 2.46 μmol/(L·min), respectively. The successful overexpression of NMN adenylyltransferase gene in E. coli could lay the foundation for application of NAD through biosynthesis method.
Key wordsEscherichia coli; NMN adenylyltransferase; cloning and expression; enzymatic properties
doi:10.3969/j.issn.1001-6678.2016.02.006
作者簡介:段琳琳(1990~),女,碩士研究生。研究方向: 微生物資源綜合利用。E-mail: duanlinlin0303@163.com。 *通訊作者:李紅梅,博士,碩士生導師。Tel:021-55271117,E-mail:sunnysand@126.com。

