高產Monacolin K純種紅曲培養條件的研究
郭曉旭, 袁朝琪, 李國瑩, 余曉斌
江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇無錫 214122
高產Monacolin K純種紅曲培養條件的研究
郭曉旭,袁朝琪,李國瑩,余曉斌*
江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇無錫 214122
摘要:本實驗對已有的十株紅曲霉菌株進行純種制曲,篩選出一株生長良好、Monacolin K含量高、不產桔霉素、產色素能力強及糖化酶活力相對較高的紅曲霉菌株。以大米為原材料,采用液固聯合制曲法,通過單因素實驗對純種紅曲的培養條件進行優化。結果表明,固體培養基初始含水量為45%,接種量為8%,變溫培養紅曲時,紅曲霉M-7所得純種紅曲最佳,其Monacolin K含量高達243 μg/g,色價450 U/g,糖化酶活力4 289 U/g。與優化之前比較,Monacolin K含量提高了37.2%。
關鍵詞:紅曲霉; 純種紅曲; 液固聯合; Monacolin K
紅曲霉是我國最早用于食品加工的有益真菌之一,主要應用于釀酒、制醋、著色和中藥制品等[1]。紅曲是紅曲霉屬經固態發酵制備而成的紫紅色米曲,起源于中國,有一千多年的歷史,是一種傳統發酵產品。在中國,紅曲大部分產自福建、臺灣、浙江等地,其中以福建古田紅曲最為著名。許多中藥典集中有記載紅曲具有活血調氣、健脾燥胃等功效,主要用于醫治婦女產后惡血不凈、食積飽脹等癥。紅曲因其純天然的保健特性,應用范圍極廣,包括食品類(酒類、肉制品、食醋、醬油等)、醫藥類(中醫藥、功能性保健品)、化妝品、飼料添加劑等[2]。
紅曲中含有紅曲霉產生的多種代謝產物,包括紅曲色素,Monacolin K,γ-氨基丁酸等[3]。20世紀70年代,日本遠藤章等[4]從紅曲霉培養液中發現并分離得到能夠抑制膽固醇合成的Monacolin K類活性物質,之后幾年又陸續發現Monacolin K 的結構類似物Monacolin L、J、X、M及其衍生物等,研究發現此類物質同樣具有降低膽固醇、降血糖和血壓、防癌等功效,但活性均不如Monacolin K[5]。目前國內外對Monacolin K的研究一般都處于實驗室階段,還沒有完全將其應用于功能性保健品的開發。
本實驗主要對篩選得到的紅曲霉進行純種制曲,采用液固聯合制曲法[6,7],以MonacolinK含量為主要指標,同時參考色價,糖化酶活力等,確定純種紅曲的最佳培養條件[8],以期為Monacolin K的工業化生產提供理論依據和技術支持。
1材料與方法
1.1材料
10株紅曲霉菌株,分別編號為M1-M10(由酶工程與技術實驗室保存);
大米(市售);
1.2實驗室自制純種紅曲工藝流程

1.3純種紅曲中各指標的測定
1.3.1Monacolin K含量測定
采用高效液相色譜法:色譜柱 ZORBAX SB C18(5 m ×250 mm×4.6 mm);流動相 甲醇∶磷酸∶水=385∶0.14∶115(v∶v);紫外檢測器波長 238 nm;柱溫20 ℃;流速 1 mL/min[9]。
1.3.2桔霉素的測定
采用高效液相色譜法:色譜柱 Eclipse XDB Reversed-phaseC18(5 m ×250 mm×4.6 mm);流動相 水∶乙腈= 65∶35(v∶v)(磷酸調pH為2.5);紫外檢測器波長 254 nm;流速 1 mL/min;柱溫28 ℃[10]。
1.3.3色價的測定
采用分光光度法,505 nm處測定紅曲的色價,以70%乙醇溶液為空白對照[11]。
1.3.4紅曲糖化酶活力測定
1 g固體樣品(或1 mL液體樣品),置于40 ℃,PH 4.6的條件下,1 h分解可溶性淀粉產生1 mg葡萄糖,即為1個酶活力單位,以U/g表示。紅曲糖化酶活力的測定采用3,5-二硝基水楊酸(DNS)法[12]。
2結果與討論
2.1較優紅曲霉菌株的篩選
將實驗室10株紅曲霉菌株純種制曲得到成熟的紅曲米。測定各菌株所制成紅曲的Monacolin K含量、桔霉素含量、色價及糖化酶活力,從中選出優良菌株。
2.1.1不同菌株制曲后產Monacolin K和桔霉素的測定
測定各菌株所制成純種紅曲的Monacolin K和桔霉素含量,結果如表1所示。
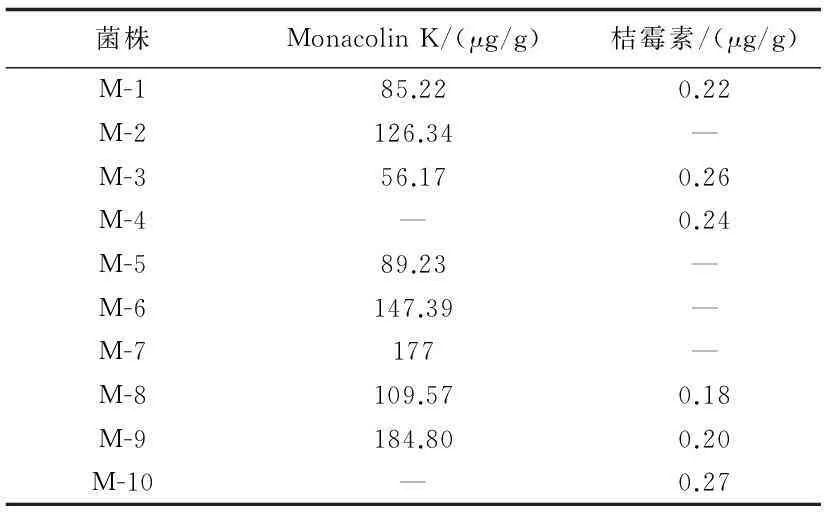
表1 不同菌株產Monacolin K和桔霉素情況的比較
注:“—”表未檢出。
由表1可知,在10株菌株中,有8株含有Monacolin K,其中紅曲霉M-2、M-6、M-7、M-8及M-9發酵產Monacolin K量相對較高,但是M-8及M-9號菌株產生桔霉素。綜合考慮,選擇紅曲霉M-2、M-6及M-7作為下一步的研究對象。
2.1.2制曲后紅曲質量、色價及糖化酶活力鑒定
對紅曲霉M-2、M-6及M-7進行純種制曲,觀察紅曲的生長狀況,并對其色價和糖化酶活力進行測定,結果見表2。
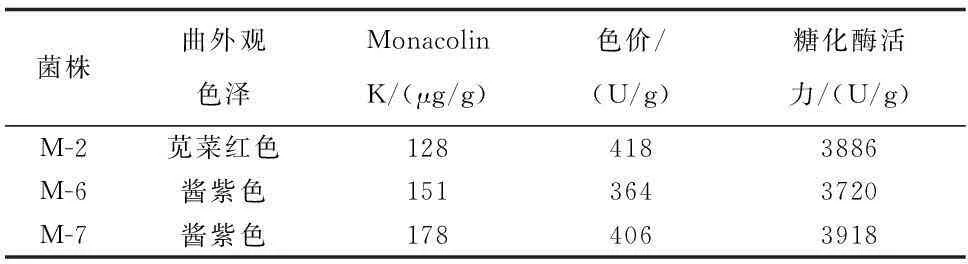
表2 不同菌株制曲后質量、色價和糖化酶活力比較
如表2所示,所選三株紅曲霉所制紅曲色澤深紅,米粒斷面亦呈紅色,且各菌株產色素能力和糖化酶活力相差不多,但紅曲霉M-7產Monacolin K的能力最強,達178 μg/g。綜合考慮,選擇M-7為最佳的紅曲霉。
2.2純種紅曲培養條件的優化
以Monacolin K含量、色價和糖化酶活力為指標,優化M-7菌株純種制曲時各項工藝的參數,從而制得質量上佳的紅曲。
2.2.1紅曲培養初始含水量的確定
固態發酵培養基的含水量是影響紅曲霉生長的重要因素之一。水份含量過高,使氧氣的供應受到抑制,反之則會使紅曲霉的生長受到影響。故研究培養基初始不同含水量對紅曲霉生長的影響,確定培養基最佳的初始含水量。
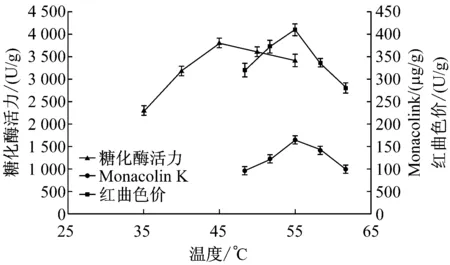
圖1 初始含水量對紅曲Monacolin K含量、
由圖1觀察發現,隨著培養基初始含水量的增加,色價、Monacolin K含量及糖化酶活力逐漸增長,當培養基的初始含水量大于45%時,色價、Monacolin K含量及糖化酶活力漸漸降低,同時明顯觀察到紅曲處于黏濕的環境中。紅曲的色價、Monacolin K含量及糖化酶活力隨著水分含量的升高會受到抑制,可能是高濃度的水份含量使培養基透氣性變差而不利于紅曲霉的次級代謝。綜合紅曲培養過程中Monacolin K含量、糖化酶活力及紅曲色價的變化,45%的初始含水量為最佳選擇。
2.2.2紅曲培養溫度的確定
溫度是Monacolin K合成的關鍵因素。低溫(20 ℃~25 ℃)有利于紅曲霉產生Monacolin K,高溫(30 ℃~35 ℃)則適合紅曲霉的生長[13]。比較不同培養溫度對紅曲產Monacolin K的影響,確定紅曲的培養溫度,結果見圖2。
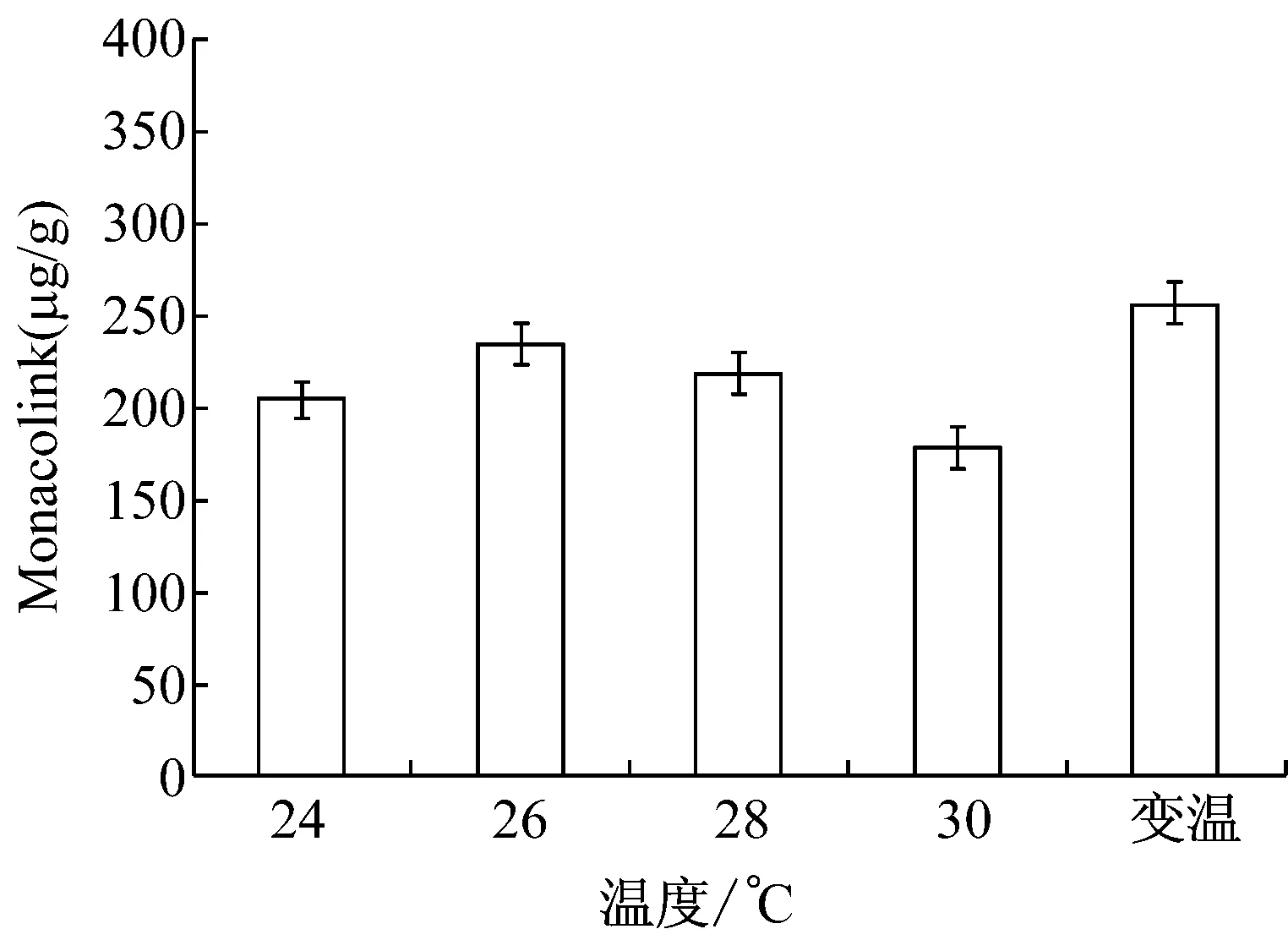
圖2 溫度對M-7產Monacolin K的影響
由圖2可以看出,在恒溫培養中,紅曲霉M-7產Monacolin K的最適溫度是26 ℃,產量達232.8 μg/g,而在變溫培養下(30 ℃7 d,23 ℃5 d),紅曲Monacolin K產量可高達248 μg/g。因此,變溫培養為最佳的培養方式。
2.2.3紅曲培養時間的確定
將M-7菌株純種制曲,在紅曲培養過程中分別在3 d、5 d、7 d、9 d、10 d、11 d、l2 d、13 d、14 d測定其Monacolin K含量、糖化酶活力及紅曲色價,從而確定最佳培養時間。
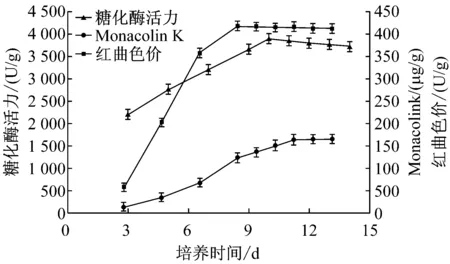
圖3 培養時間對紅曲Monacolin K含量、
從圖3觀察發現,隨著紅曲培養時間不斷增加,Monacolin K的含量持續增加,同時糖化酶活力和紅曲色價也逐漸增加。Monacolin K的含量在第12 d達到最大后趨于穩定;糖化酶活力在第10 d達到最高值后下降;同時紅曲色價在第9 d達到最高,之后趨于穩定。結合各種指標的變化趨勢,確定紅曲的最佳發酵時間為12 d。
2.2.4紅曲霉液體接種量的確定
將紅曲霉液體種子液分別以2%、4%、6%、8%、10%的接種量接種于大米固體培養基中,測定成熟紅曲米的Monacolin K含量、糖化酶活力及其色價。
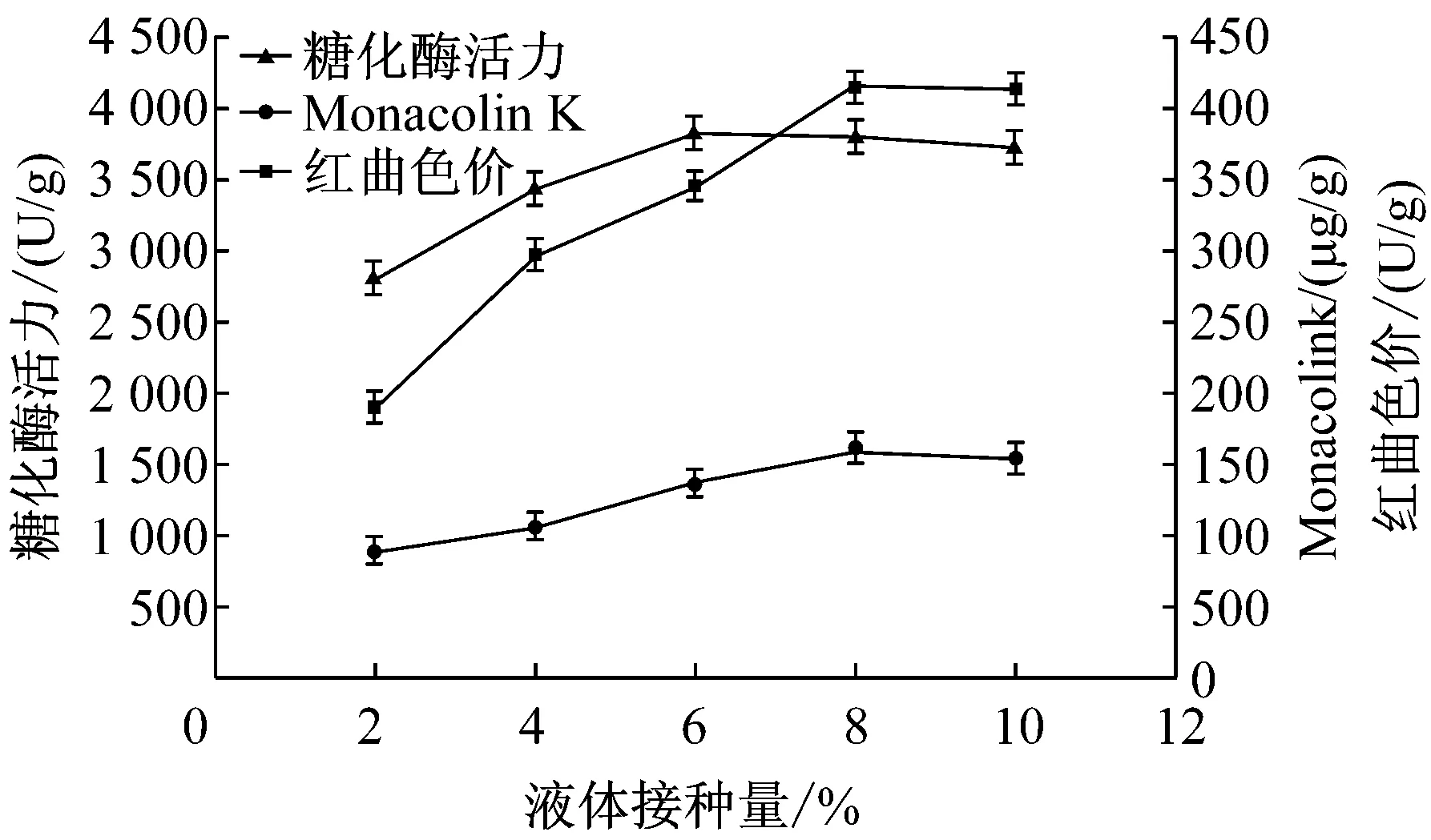
圖4 接種量對紅曲Monacolin K含量、
從圖4可以看出,隨著接種量的增加,所制成紅曲的Monacolin K含量、糖化酶活力及色價均增加。當接種量到達8%時,Monacolin K含量和色素含量均達到最高值并且趨于穩定,同時在接種量為6%時糖化酶活力達到最大,隨后緩慢下降,綜合各方面綜合考慮,最佳接種量為8%較適宜。
2.3最佳發酵條件的驗證實驗
在優化了純種紅曲的培養條件之后,做三組平行實驗,驗證在最優發酵條件下的Monacolin K產量、色價及糖化酶活力,結果見表3。

表3 最優條件驗證實驗
從表3可以看出,在最優發酵條件下,M-7固態發酵的Monacolin K產量達到243 μg/g,比優化之前Monacolin K的產量提高37.2%;色價為450 U/g,提高7.6%;糖化酶活力為4 289 U/g,提高4%。
3結論
1. 對已有的十株紅曲霉菌株進行純種制曲,對比各菌株制曲后產Monacolin K、色價、糖化酶活力及產桔霉素的能力,從中篩選出一株生長良好、Monacolin K含量高、不產桔霉素、產色素能力強及糖化酶活力相對較高的紅曲霉菌株。最后篩選得到M-7菌株。利用紅曲霉M-7制得的純種紅曲,出曲后色澤深紅,米粒斷面亦呈深紅色,不產桔霉素,Monacolin K含量為178 μg/g,糖化酶活力高達3 918 U/g,色價406 U/g。
2. 對紅曲霉M-7進行純種制曲,并對其培養條件的參數進行優化,以大米為原材料,采用液固聯合制曲法,固體培養基的初始含水量為45%、紅曲霉液體接種量為8%,同時變溫培養紅曲,成熟紅曲米粒飽滿、呈醬紫色且米粒斷面亦呈深紅色,Monacolin K含量高達243 μg/g,色價450 U/g,糖化酶活力4 289 U/g,Monacolin K含量、色價及糖化酶活力分別比優化之前提高了37.2%、7.6%、4%。
參考文獻
[1]張治剛,馬歌麗. 紅曲霉菌的應用現狀及發展前景[J]. 食品科技, 2007,(8): 5-8.
[2]傅金泉. 我國紅曲生產與應用的現狀及發展前景[J]. 食品與發酵工業, 1995,(5): 76-79.
[3]卓林霞. 紅曲的研究概況及其產品的前景展望[J]. 輕工科技, 2012,(2): 8-9.
[4]Su YC, Wang JJ, Lin TT,etal. Production of the secondary metabolites gamma-aminobutyric acid and monacolin K byMonascus[J]. Journal of Industrial Microbiology and Biotechnology, 2003, 30(1): 41-46.
[5]Endo A, Hasumim K, Negishi S. Monacolins J and L, new inhibitors of cholesterol biosynthesis produced byMonascusruber[J]. J Antibiot, 1985, 38(3):420-422.
[6]信亞文, 鄭允權, 石賢愛等. 紅曲霉菌液相培養高產色素低產桔霉素代謝調控研究[J]. 工業微生物, 2011, 41(1): 46-47.
[7]張朝暉, 王圓, 周立平等. 不產桔霉素的紅曲霉菌種深層發酵生產莫納可林K[J]. 工業微生物, 2005, 35(4): 1-4.
[8]李霞姣, 許贛榮. 紅曲菌利用生物柴油廢液生產紅曲色素[J]. 工業微生物, 2009, 39(2): 28-33.
[9]許贛榮, 陳蘊, 虞慧玲等. 高效液相色譜法測定紅曲莫納可林及桔霉素—如何防治色素的干擾[J]. 食品與發酵工業, 2002, 28(10): 59-64.
[10]許贛榮, 李鳳琴, 陳蘊等. 紅曲霉桔霉素的檢測方法及紅曲霉產桔霉素的判別方法[J]. 微生物學通報, 2004,(3): 16-20.
[11]馬歌麗, 孫浩, 韓甜甜等. 紅曲色素液體發酵研究[J]. 鄭州輕工業學院學報(自然科學版), 2013, 28(5): 11-15.
[12]羅惠波, 王毅, 邊名鴻等. 麩曲糖化酶活力測定方法探討[J]. 四川理工學院學報(自然科學版), 2014, 27(3): 6-9.
[13]Yu LJ, Zhang HX, Xie YH,etal. Optimization of fermentation conditions for higher Monacolin K production byMonascuspurpureus[J]. Advanced Materials Research, 2013, 784(1): 397-402.
Study on cultivation conditions for pure red starter with high-yielding monacolin K
GUO Xiao-xu, YUAN Zhao-qi, LI Guo-ying, YU Xiao-bin
Key Lab of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology,iangnan University, Wuxi, Jiangsu 214122, China
AbstractThe pure red starters with screening monascus preserved by laboratory were made and then the strain, which was citrinin-free, with high-yielding pigment, glucoamylase activity and monacolin K was selected. Furthermore, the culture conditions of the red starter were optimized through single factor experiments, which used liquid-solid union to make red starter with rice as raw material. The results showed that the mature red starter made with monascus M-7 looked best under the conditions of the original water content of 45%, monascus liquid quantity of 8% and cultivating at different temperature. Monacolin K content was up to 243 μg/g, the pigment yield was 450 U/g and glucoamylase activity was 4 289 U/g. After optimization, monacolin K content was improved 37.2%.
Key wordsmonascus; pure red starter; liquid-solid union; monacolin K
作者簡介:郭曉旭(1989~),女,碩士研究生,E-mail: dfgxx880101@163.com。 *通訊作者:余曉斌(1965~),男,博士,教授,E-mail: xbyu@jiangnan.edu.cn。

