熒光快檢法用于工藝用水微生物檢測的研究
李培玨, 侯晨曄, 李 勇, 孫 冰
1. 上海微創醫療器械(集團)有限公司, 上海 201203;2. 復旦大學生命科學學院, 上海 200433
熒光快檢法用于工藝用水微生物檢測的研究
李培玨1,2,侯晨曄1*,李勇1,孫冰1
1. 上海微創醫療器械(集團)有限公司, 上海 201203;2. 復旦大學生命科學學院, 上海 200433
摘要:為考察熒光快檢法用于測定水中微生物的可行性,使用6種常見試驗菌,比較用傳統膜過濾法和熒光快檢法對微生物計數的應用。結果表明使用熒光快檢法的培養時間,金黃色葡萄球菌17 h,大腸埃希菌15 h,枯草芽孢桿菌16 h,白色念珠菌36 h,黑曲霉51 h,銅綠假單胞菌19 h,所有菌種回收率都大于70%,且通過分析顯著性水平表明這兩種方法無顯著性差異。實驗結果證明,熒光快檢法可用于水中微生物的檢測,可大大縮短培養周期,且檢測結果準確。
關鍵詞:工藝用水; 熒光染色; 微生物快檢; 膜過濾法
對于食品、制藥、醫療器械等行業,工藝用水在其整個生產過程中通常是一個重要的原輔料,其微生物的含量通常直接影響產品的質量。目前水中微生物計數方法通常采用膜過濾法[1]或者直接接種法[2],這類傳統計數方法檢測結果可靠,且易于操作,但是由于需要培養微生物至其形成肉眼可見菌落后才能進行計數,因此微生物的培養時間短則2 d,長至14 d。使用傳統微生物計數方法由于其檢測時間過長,導致檢測結果滯后,不利于及時了解水中微生物狀況,影響企業對微生物污染控制的時效性,會由于無法及時發現問題并采取糾正措施而增加產品的潛在微生物污染風險,甚至導致大量產品的報廢,造成企業的巨大經濟損失[3]。因此選用一種準確、靈敏、快速的微生物檢測方法是目前企業所需要解決的重要且迫切的問題。
隨著微生物學的迅速發展,不斷有新的微生物檢驗技術被引入,來縮短微生物的培養時間[4-6]。本實驗所選用的熒光快檢法結合了熒光染色法和薄膜過濾法,使用的設備為EZ-FLUO快速微生物檢測系統。該方法采用酶促反應熒光染色技術,整個檢測過程不破壞微生物細胞。其標記試劑在細胞外,本身是不發熒光的,但轉移進入活的微生物體內后,能被微生物的新陳代謝所利用,從而產生能被激發產生熒光的反應產物,隨著產物的積累(產物本身不能被細胞主動轉移出體外),熒光的量達到能被讀數器所識別就能被準確的計數。
本實驗中通過對六種常見微生物的傳統膜過濾法和熒光快檢方法的實驗對比,以確定熒光快檢法用于測定水中微生物的可行性。
1材料與方法
1.1設備
EZ-FLUOTM快速微生物檢測系統:Merck Millipore;
三聯過濾系統:Merck Millipore;
生物安全柜:SY-08-056,上海博迅實業有限公司;
生化培養箱:SPX-150BS-II,上海新苗醫療器械制造有限公司;
霉菌培養箱:MJ-160BS-II,上海新苗醫療器械制造有限公司;
立式蒸汽壓力滅菌器:CL-32L,ALP。
1.2菌種
金黃色葡萄球菌(Staphylococcusaureus) (CMCC(B)26003);大腸埃希菌(EscherichiaColi) (CMCC(B) 44102);枯草芽孢桿菌(Bacillussubtilis) (CMCC(B)63501);白色念珠菌(Candidaalbicans) (CMCC(F)98001);黑曲霉(Aspergillusniger) (CMCC(F)98003);銅綠假單胞菌(Pseudomonasaeruginosa) (CMCC(B)10104)。
以上菌種均為BioBall定量菌株:生物梅里埃公司。
1.3試劑及培養基
熒光染色液:Merck Millipore;
氯化鈉:國藥集團化學試劑有限公司;
營養瓊脂培養基:廣東環凱微生物科技有限公司;
玫瑰紅鈉瓊脂培養基:廣東環凱微生物科技有限公司。
1.4方法
1.4.1試驗組設計
每次試驗需進行以下三個試驗組的數據統計。
F組:熒光快檢組,按縮短的培養時間,進行熒光讀數,所計得的菌落數;
V組:恢復生長組,熒光快檢組的濾膜,經過熒光讀數后,轉移到新鮮培養基,繼續培養至傳統方法的時間點,進行肉眼觀察,所計得的菌落數;
T組:傳統對照組,按傳統方法的時間培養,進行肉眼觀察,所計得的菌落數;
陰性對照組:取稀釋菌液所用生理鹽水1 mL和沖洗用0.1%蛋白胨水溶液200 mL,過濾,每完成一組F組,V組或T組,均需附加一份陰性對照平皿。
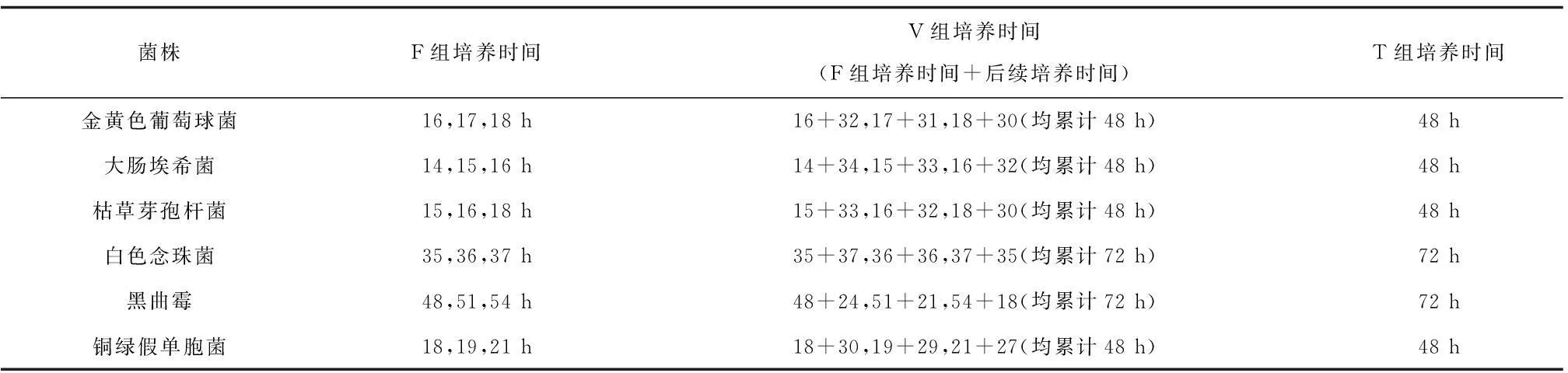
表1 快檢時間耐用性試驗中標準菌株的F組,V組和T組的培養時間
取各個標準菌株的培養物,制備成約0~100 cfu/mL濃度范圍的菌液。進行微生物過濾,培養和計數,每種菌株均選取三個不同快檢時間點進行熒光染色計數。對于每個時間條件, F、V和T各組均測試5份平行的平板。
1.4.2熒光快檢法操作步驟
-將實驗菌液過濾至濾膜上
-將濾膜轉移至固體培養基,培養至特定時間(F組培養時間)
-將濾膜再次轉移至含有染色劑的培養皿上
-培養30 min,染色劑底物被酶切
-通過讀數器讀取熒光數量(即為F組讀數)
-將濾膜重新轉移至新鮮固體培養基上重新培養至特定時間(V組培養時間)后,菌落計數(即為V組讀數)
1.4.3傳統膜過濾法操作步驟
-將實驗菌液過濾至濾膜上
-將濾膜轉移至固體培養基,培養至特定時間(T組培養時間)
-菌落計數(即為T組讀數)
1.4.4數據處理
1.4.4.1回收率考察
熒光快檢組(F組)的單塊平板回收率計算如下:
F組單塊平板回收率=F組每塊平板菌落數/T組平均菌落數×100%
以此得出1組共5份F單塊平板回收率;三個快檢時間點對應獲得三組的F單塊平板回收率結果。
恢復生長組(V組)數據同法處理:
V組單塊平板回收率=V組單塊平板菌落數/T組平均菌落數×100%
回收率不得低于70%。
1.4.4.2方差分析
在三個不同快檢時間試驗條件下,對各試驗菌的F組或V組單塊平板回收率進行比較,三組數據之間進行方差分析的多重比較(即Tukey法),確定其差異性。
2結果與討論
2.1熒光快檢法的熒光強度
在三個不同培養條件下,所有F組的平板均能表現出較好的發光強度。
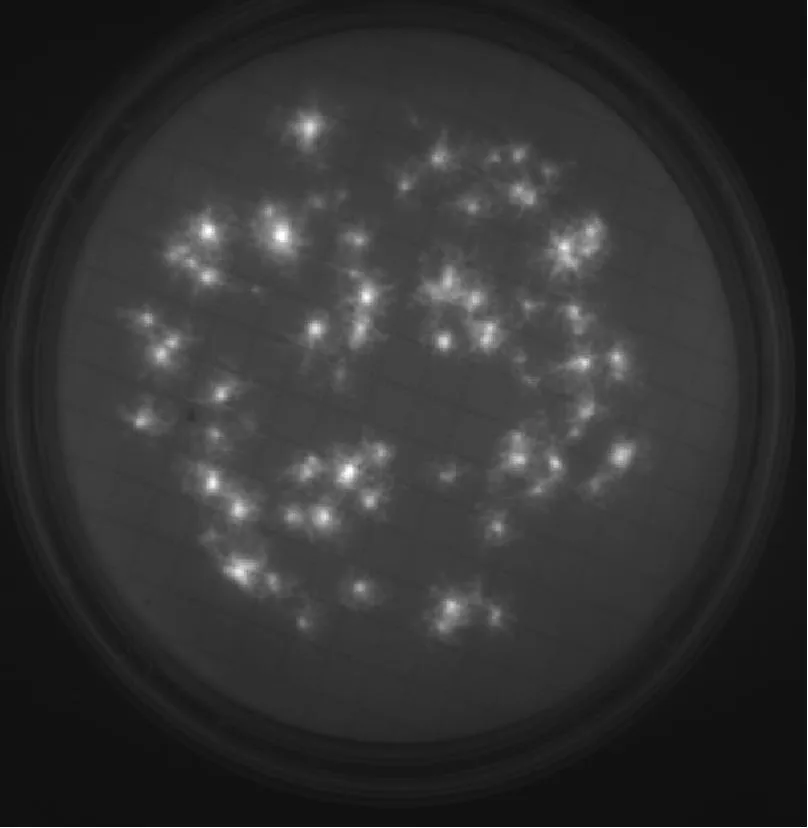
6種微生物在設定的F組中間培養時間條件下,即:金黃色葡萄球菌培養17 h、大腸埃希菌培養15 h、枯草芽孢桿菌培養16 h、白色念珠菌培養36 h、銅綠假單胞菌培養19 h、黑曲霉培養51 h,F組的熒光圖見圖1和圖2。
從圖中可看出:
① 金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、白色念珠菌經過設定的F組中間培養時間培養后,通過EZ-FLUO讀數器能看出清晰可辨的亮點,通過計亮點的數量可容易地進行菌落計數。
② 銅綠假單胞菌經過19 h培養后,通過EZ-FLUO讀數器看出的亮點大卻不夠清晰,發光強度不均勻。但從圖中可看出,若增加培養時間,菌落變大則發光強度也隨之增強,從而導致熒光點相互重疊,并不利于進行熒光點計數。因此認為19 h是較為合理的銅綠假單胞菌培養時間。
③ 黑曲霉經過51 h培養后,可以看出菌絲也出現了熒光,盡管發光強度比除銅綠假單胞菌外的其余4種微生物稍差,但是仍可通過EZ-FLUO讀數器進行計數。考慮到增加培養時間可能出現菌絲過多而相互交集導致最終計數困難,因此認為51 h是較為合理的黑曲霉培養時間。
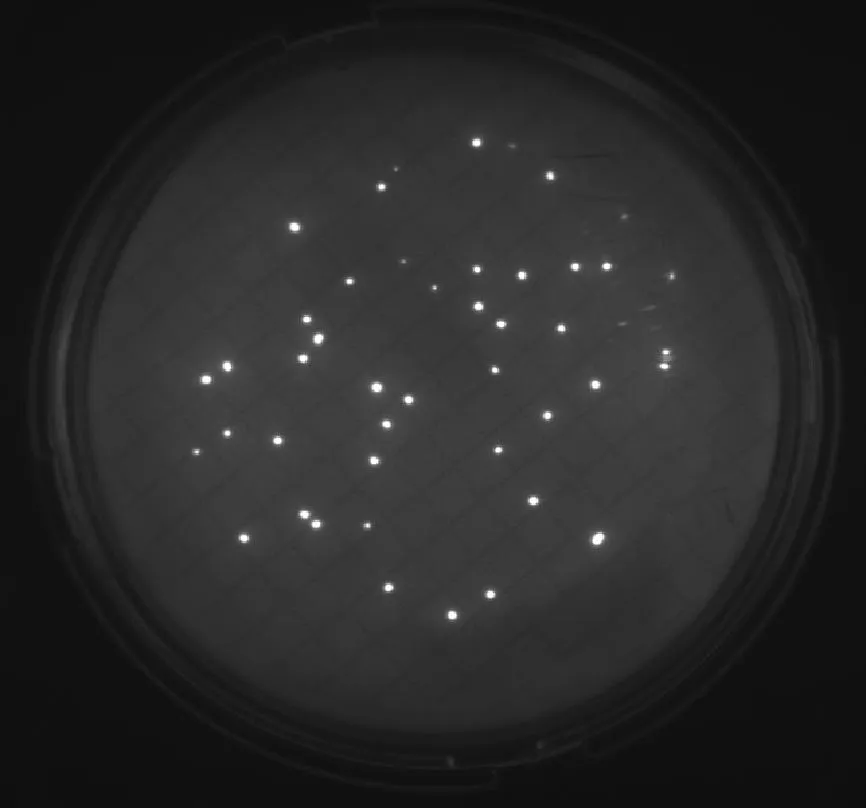
金黃色葡萄球菌培養17 h

大腸埃希菌培養15 h
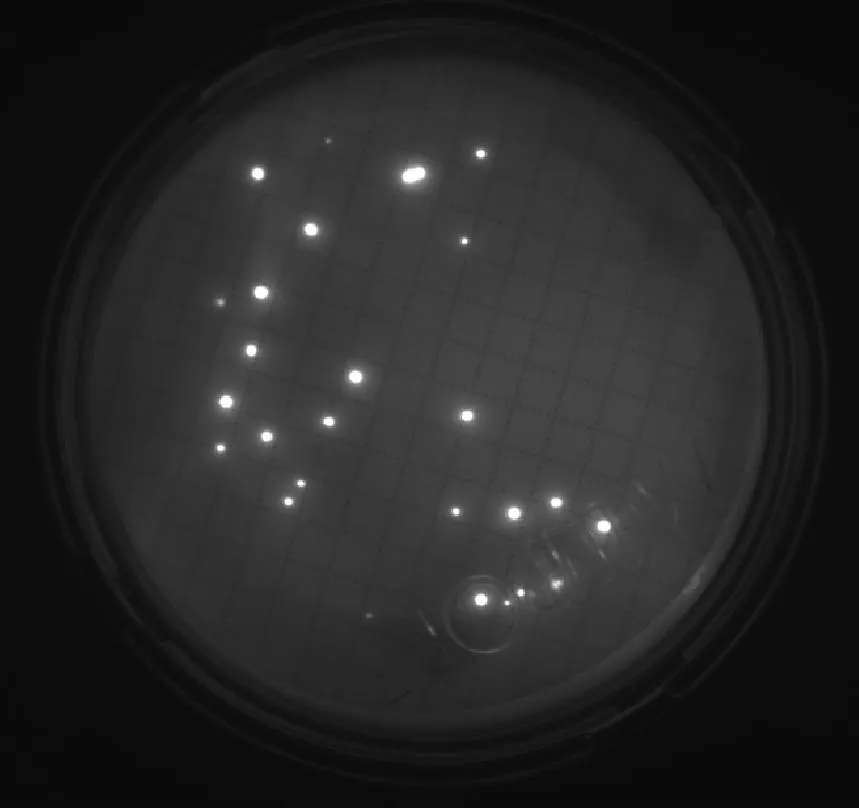
枯草芽孢桿菌培養16 h
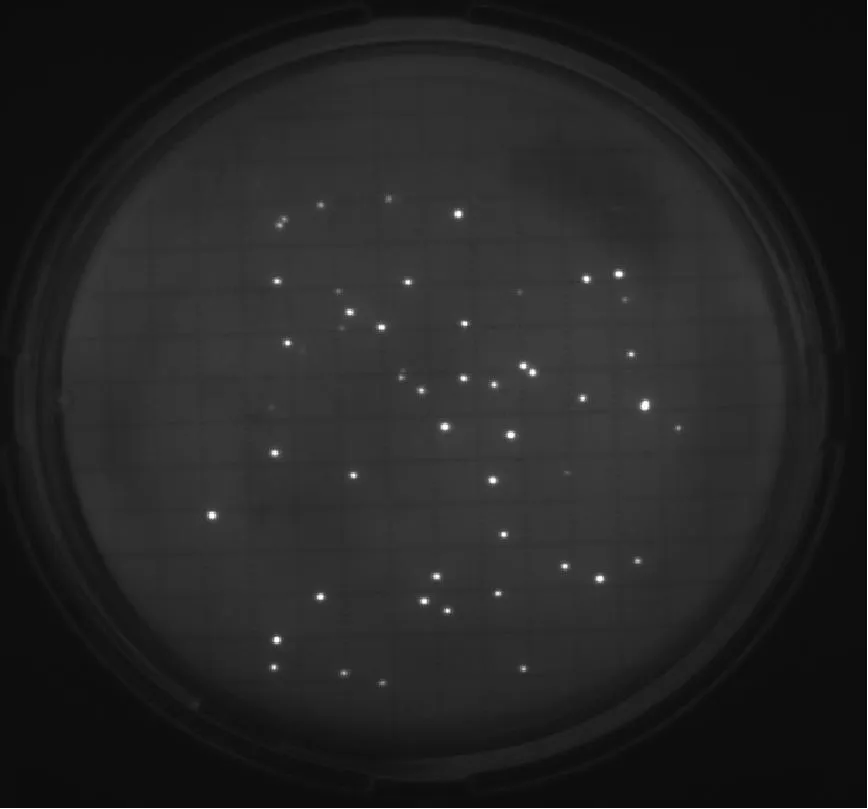
白色念珠菌培養36 h
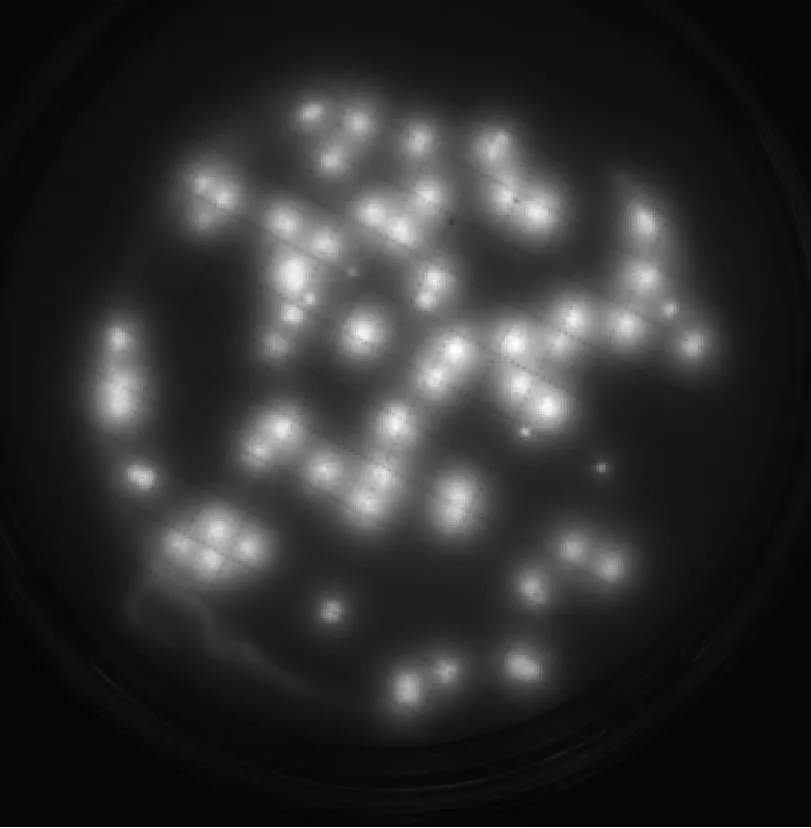


銅綠假單胞菌培養19 h
圖2銅綠假單胞菌、黑曲霉熒光圖
2.2回收率和方差分析
6種微生物的所有F組或V組的單塊平板回收率均大于70%。各組的單塊平板回收率經正態分布檢驗,均服從正態分布;在三個不同快檢時間試驗條件下,各試驗菌的F組或V組單塊平板回收率進行比較,三組數據之間進行方差分析的多重比較,即Tukey法,經計算任意兩總體均值差的置信區間,此區間均包含0,故任意兩總體均值無顯著差異。
各菌種回收率的結果見表2~7:
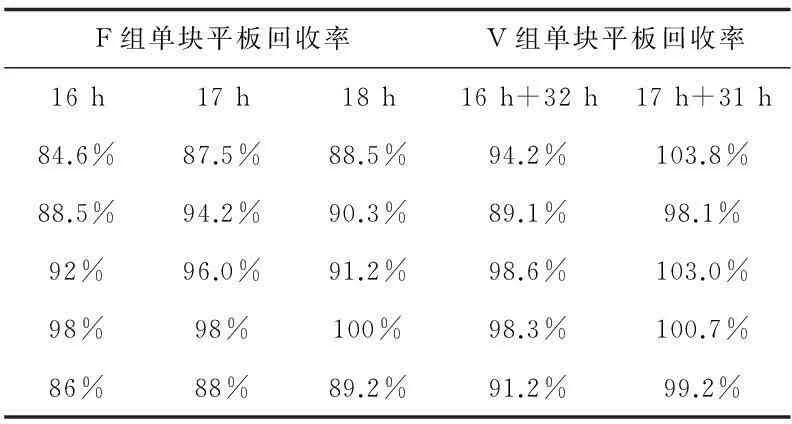
表2 金黃色葡萄球菌回收率
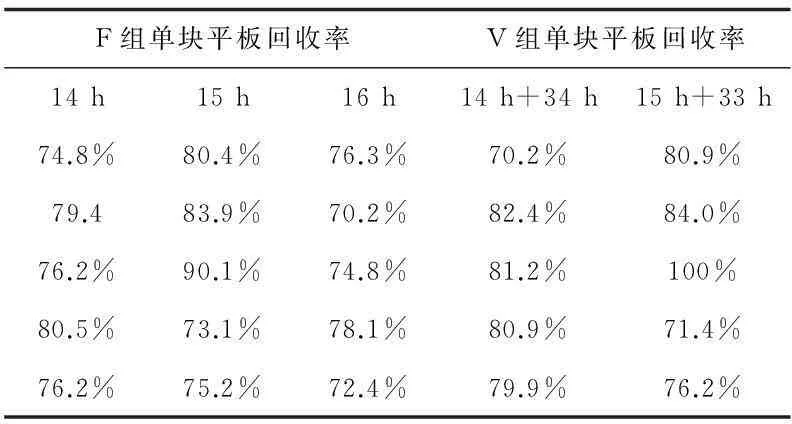
表3 大腸埃希菌回收率
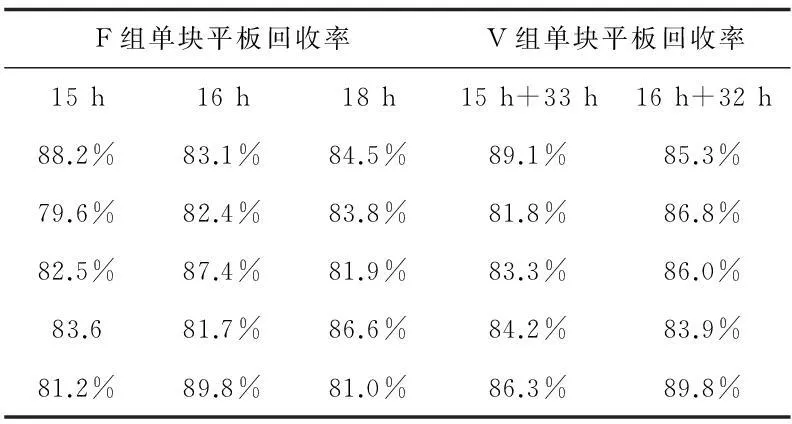
表4 枯草芽孢桿菌回收率
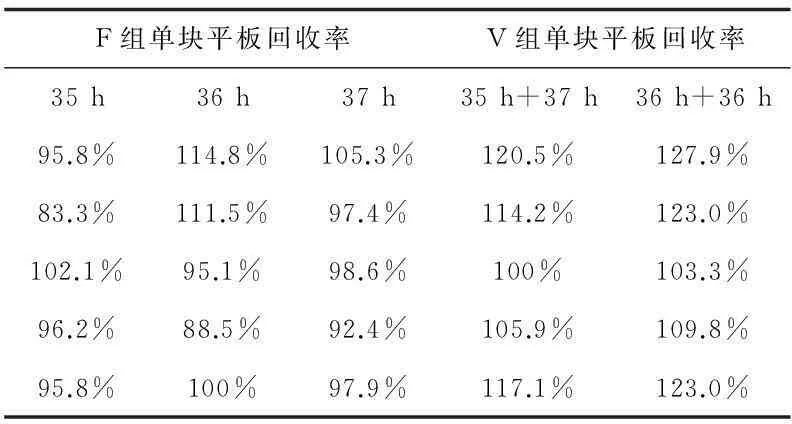
表5 白色念珠菌回收率
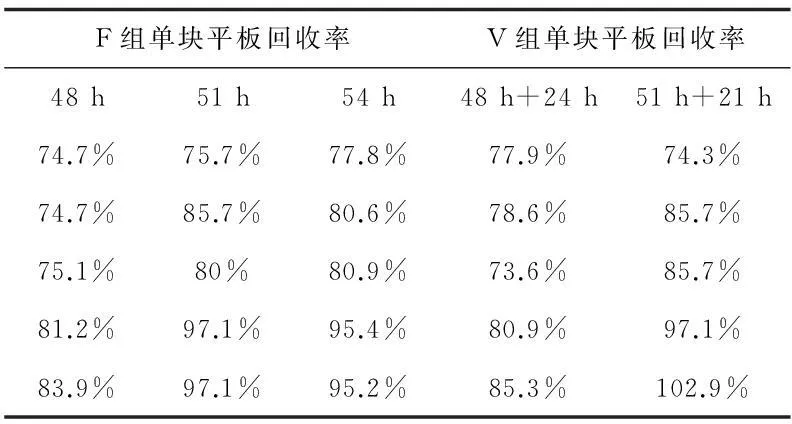
表6 黑曲霉回收率
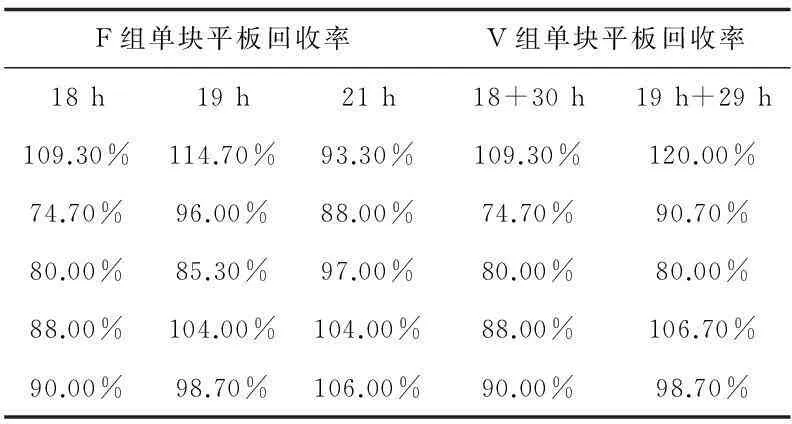
表7 銅綠假單胞菌回收率
3結論
通過對6種常見試驗菌株的熒光快檢法與傳統膜過濾法的檢測對比,可以看出在設定的培養時間條件下,回收率均大于70%,且沒有顯著性差異。
從熒光計數效果來看,金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、白色念珠菌的發光強度易被計數。銅綠假單胞菌經過19 h培養后,發光效果略差于以上4種微生物,但如繼續培養,則發光強度增加的同時菌落也將逐漸變大,菌落過度交集反而不利于熒光計數,因此認為19 h是較為合理的銅綠假單胞菌的培養時間。黑曲霉經過51 h培養后,可以看出菌絲也出現了熒光,盡管發光強度較弱,但仍可計數,若增加培養時間可能出現菌絲過多而相互交集導致最終計數困難,因此認為51 h是較為合理的黑曲霉培養時間。
因此,使用熒光快檢法,金黃色葡萄球菌培養17 h,大腸埃希菌培養15 h,枯草芽孢桿菌培養16 h,白色念珠菌培養36 h,黑曲霉培養51 h,銅綠假單胞菌培養19 h,可滿足檢測要求。
近年,微生物快速檢測法越來越多地應用于食品、制藥、醫療器械等行業中[7-10]。將該快檢法應用與工藝用水的微生物計數中,可大大縮短傳統的培養周期,很好的解決了微生物測試結果的滯后性,能快速發現結果是否有異常,降低了生產的風險。
參考文獻
[1]中國藥典委員會. 中華人民共和國藥典[M]. 二部. 北京: 中國醫藥科技出版社,2010. 附錄107-附錄116.
[2]GB/T 5750.12-2006 生活飲用水檢驗方法微生物指標[S]. 北京: 中國標準出版社,2007.
[3]Meder H,Baumstummler A,Rouillon S,etal. Detection of Microbial Contaminants in Water Samples Using the Milliflex?Quantum System[J]. Bioprocess International, 2010, 8(7): 63-65.
[4]朱艷靜,李宇. 測定菌體濃度的簡便方法[J].工業微生物,2006,36(4):47-49.
[5]吳清平,孫永,蔡芷荷等. 快速測試片在食品微生物檢測中的應用[J].中國衛生檢驗雜志,2006,16(5):635-637.
[6]劉炳智,朱蓓,王濤. 微生物快速檢驗最新進展[J].食品研究與開發,2003,24(2):89-92.
[7]連英姿,董雪,李勇等. ATP生物發光技術快速檢測水中細菌的研究[J].中國衛生檢驗雜志,2007,17(10):1859-1860.
[8]廖如燕,陳胤瑜,華志濤等. ATP生物熒光檢測法快速檢測水細菌無菌的評價[J]. 旅行醫學科學,2011,17(2):5-11.
[9]余輝,馬麗麗,毛冠男等. 飲用水微生物的安全快速檢測[J]. 微生物學通報,2012,39(8):1171-1178.
[10]Hammes F, Berney M, Wang YY,etal. Flow-cytometric total bacterial cell counts as a descriptive microbiological parameter for drinking water treatment processes[J]. Water Research,2008,42(1/2):269-277.
Detection of microbiological contaminants in process water by fluorescence-based rapid detection method
LI Pei-jue1,2, HOU Chen-ye1, LI Yong1, SUN Bing1
1. Shanghai Microprot Medical(Group)Co.Ltd, Shanghai 201203, China;2. School of Life Sciences Fudan University. Shanghai 200433, China
AbstractThe application of fluorescent-based rapid detection method for microbiological contaminants in water was investigated, and then compared with the the membrane filtration method with six different test strains. The results showed that the culturing time by fluorescent rapid detection method were as follows: Staphylococcus aureus 17 h, Escherichia coli 15 h, Bacillus subtilis 16 h, Candida albicans 36 h, Aspergillus niger 51 h, Pseudomonas aeruginosa 19 h; recoveries of all the strains were more than 70%. The significance level indicated that there was no significant difference between two methods. The results showed that the fluorescence-based rapid detection method could be used in the microbial tests for water with advantages of greatly shortened culture period and accurate test result.
Key wordsprocess water; fluorescence staining; rapid detection of microorganism; membrane filtration method
作者簡介:李培玨(1983~),女,碩士在讀,工程師。E-mail:pelldgei@163.com。 *通訊作者: 侯晨曄(1986~),女,碩士,工程師。電話:021-38954600-3291,E-mail:cyhou@microport.com。

