LTB4、TRPV1及CGRP在急性膽源性胰腺炎中的表達意義
夏炳杰 陳思羽 黃會云 陳玉 張濤#(桂林醫學院附屬醫院 廣西桂林5400;廣西中醫藥大學附屬瑞康醫院 南寧5300)
?
LTB4、TRPV1及CGRP在急性膽源性胰腺炎中的表達意義
夏炳杰1陳思羽2黃會云2陳玉2張濤2#
(1桂林醫學院附屬醫院廣西桂林54100;2廣西中醫藥大學附屬瑞康醫院南寧530011)
摘要:目的:通過檢測LTB4、TRPV1及CGRP等指標的變化,分析LTB4-TRPV1信號活化在急性膽源性胰腺炎中的作用。方法:取清潔級SD大鼠60只,隨機分為正常組、模型組和TRPV1拮抗劑組。采用膽胰管開口十二指腸結扎法制備重癥胰腺炎模型,術后3 h,除正常組外,其余兩組開始分組給藥,術后12 h,處死全部大鼠,腹主動脈取血并收集胰腺組織備測。用光鏡檢測胰腺組織超微結構變化,用ELISA技術檢測LTB4變化,用Real-time PCR技術檢測TRPV1、CGRP變化。結果:正常組胰腺呈淺粉紅色;模型組見胰腺壞死、出血,部分可見腹水,腹水含血,光鏡下見胰腺腺體結構紊亂,小葉間隔明顯增大,腺體實質內可見大片凝固性壞死并伴有出血,壞死灶及周圍有大量炎細胞浸潤;TRPV1拮抗劑組胰腺組織充血水腫較模型組減輕,未見腹水,光鏡下胰腺實質可見少許壞死、出血及少量炎性細胞浸潤,其組織病理學評分較模型組下降,有統計學意義,P<0.05。模型組見血淀粉酶、LTB4表達明顯上升;TRPV1拮抗劑組血淀粉酶、LTB4表達亦增高但低于模型組,較模型組有統計學意義,P<0.05;模型組胰腺組織TRPV1、CGRP mRNA表達上升;TRPV1拮抗劑組TRPV1、CGRP mRNA表達亦增高但低于模型組,與模型組比較有統計學意義,P<0.05。結論:內源性LTB4活化TRPV1信號在膽道梗阻性胰腺炎中可能發揮至關重要的作用,阻斷TRPV1信號轉導將為急性胰腺炎的治療提供新的思路。
關鍵詞:急性膽源性胰腺炎;白三烯B4;瞬時電位香草酸亞型受體1;降鈣素基因相關肽;表達
急性胰腺炎(Acute Pancreatitis,AP)是一種以胰酶激活和胰腺自身組織消化為主要特征的化學性炎癥,伴或不伴有其他器官功能改變的疾病[1]。臨床可分為輕癥、中度重癥及重癥三大類,其中重癥死亡率為10%~30%。共同通道學說、酒精、暴飲暴食、高血脂、藥物及特異性因素被看作是AP的可能致病因素[2]。近來研究發現,胰腺初級感覺神經元的激活能導致炎性神經肽的釋放,一方面可加強疼痛信號傳遞,另一方面又可引起胰腺內血漿外滲和中性粒細胞大量浸潤,胰腺初級感覺神經元中瞬時電位香草酸亞型受體1(Transient Receptor Potential Vanilloid Channel-1,TRPV1)通道的活化在重癥胰腺炎中的作用不容忽視[3~4]。我們課題組基于上述研究進展,結合前期工作基礎,在共同通道學說的指導下,采用膽胰管結扎法制備AP模型,觀察白三烯B4(Leukotriene B4,LTB4)-TRPV1通路中相關指標的變化,探討LTB4、TRPV1、降鈣素基因相關肽(Calcitonin Gene Related Peptide,CGRP)在AP中的地位和作用。現報告如下:
1 材料
1.1實驗動物取SPF級雄性SD大鼠60只,體重(300±20)g,許可證號:SCXK(湘)2009-0004,動物合格證號:HNASLKJ20102130,購自湖南斯萊爾克實驗動物中心。分為正常組、模型組、TRPV1拮抗劑組,每組20只。
1.2試劑及儀器
1.2.1試劑Capsazepine(貨號C-191)購自美國SIGMA公司,10%福爾馬林、氫氧化鈉、甲醛、無水乙醇購自博仁生物科技有限公司,液氮由廣西醫科大學第一附屬醫院氧氣中心站提供,二甲苯、Harris蘇木精液、伊紅染色液、1%鹽酸酒精PBS、0.9%生理鹽水、10%水合氯醛、手術器械、研缽、直灌胃針、金屬夾、石蠟油、一次性注射器(1 ml、5 ml、10 ml)、Eppendorf管(0.5 ml、1.5 ml)購自南寧天地揚生物試劑公司,ELISA試劑盒、LTB4購自博仁生物科技有限公司,逆轉錄試劑盒(Revert Aid First Strand cDNA Synthesis Kit)及TRPV1、CGRP引物均由廣州吉坤生物工程技術有限公司提供,FS Universal SYBR Grenn Mas由廣州聚研生物公司提供。
1.2.2儀器Axiovert200倒置相差顯微鏡(德國Zeiss公司)、SZ-93自動雙重純水蒸餾器(上海亞榮生化儀器廠)、TP1020自動脫水機、RM2135型Leica切片機、HI1210型Leica攤片機、HI1220型Leica烘片機、EG1160Leica自動包埋機、PTC-220多通道PCR擴增儀(美國MJ公司)、Power/Pac300電泳儀(美國BIO-RAD公司)、Gel doc2000凝膠成像分析系統(美國BIO-RAD公司)、LXJ-IIB低速大容量離心機(上海安亭儀器廠)、5810R高速低溫離心機(德國Eppendorf Centrifuge公司)、ABI3900臺式高通量DNA合成儀、垂直電泳儀及轉移系統(美國BIO-RAD公司)。
2 方法
2.1模型制備及分組干預參照文獻報道[5],所有雄性SD大鼠60只,在恒溫(23±2)℃、恒濕(50± 10)%、晝夜循環(12 h:12 h)條件下適應性喂養7 d。除正常組外,模型組采用膽胰管結扎術,即在膽胰管開口十二指腸壁縫合結扎;TRPV1拮抗劑組術前0.5 h先予TRPV1拮抗劑100 μmol/kg腹腔注射預處理,繼而采用膽胰管結扎術,即在膽胰管開口十二指腸壁縫合結扎。術后3 h,正常組同步飼養;模型組予以等劑量生理鹽水腹腔注射;TRPV1拮抗劑組予以Capsazepine 100 μmol/kg腹腔注射3次,間隔2 h。12 h后,處死全部大鼠,腹主動脈取血,拮取胰腺分別置于液氮、中性甲醛、電鏡固定液中備用。
2.2指標檢測
2.2.1大鼠的胰腺組織病理學取病變處胰腺組織,常規固定、石蠟切片、HE染色,普通光鏡下觀察胰腺的病理組織學改變情況并攝片。
2.2.2大鼠的血淀粉酶、LTB4表達應用干化學法檢測血清淀粉酶的變化,實驗步驟嚴格按試劑盒說明書操作。應用ELISA技術檢測大鼠的血LTB4表達變化,實驗步驟嚴格按試劑盒說明書操作。
2.2.3大鼠的胰腺組織TRPV1、CGRP表達應用實時熒光定量PCR法(Real-time PCR)檢測胰腺組織TRPV1、CGRP mRNA表達。具體步驟:組織總RNA提取-Primer5.0軟件設計引物,逆轉錄cDNA-Real time PCR反應體系擴增,目的基因相對mRNA表達水平的計算分析。見表1。

表1 大鼠TRPV1、CGRP及GAPDH引物序列
2.3統計學分析應用SPSS16.0統計軟件進行分析,計量數據用(x±s)表示,符合正態分布的資料采用單因素方差分析(ANOVA)檢驗,非正態分布資料采用Mann-Whitney U秩和檢驗。P<0.05為差異有統計學意義。
3 結果
3.1大鼠的胰腺組織病理學變化參照Rongione胰腺組織病理學評分,正常組胰腺見胰腺呈淺粉紅色;模型組大鼠見胰腺壞死、出血,部分可見腹水,腹水含血,光鏡下見胰腺腺體結構紊亂,小葉間隔明顯增大,腺體實質內可見大片凝固性壞死并伴有出血,壞死灶及周圍有大量炎細胞浸潤;TRPV1拮抗劑組大鼠胰腺組織充血水腫較模型組減輕,未見腹水,光鏡見胰腺腺體結構紊亂,實質可見少許壞死、出血及少量炎性細胞浸潤,其組織病理學評分較模型組下降,差異有統計學意義,P<0.05。
3.2大鼠的血清淀粉酶及LTB4表達變化模型組見血清淀粉酶、LTB4表達明顯上升,TRPV1拮抗劑組見血清淀粉酶、LTB4表達較模型組低,差異均有有統計學意義,P<0.05。見表2。
表2 大鼠血清淀粉酶、LTB4表達變化(±s)

表2 大鼠血清淀粉酶、LTB4表達變化(±s)
注:與模型組比較,*P<0.05。
組別 n 淀粉酶(IU) LTB4(ng/ml)正常組模型組TRPV1拮抗劑組20 20 20 23.12±8.93*5 672.65±189.54 2 134.54±121.69*11.76±6.54*489.32±22.76 231.25±16.78*
3.3大鼠的胰腺組織TRPV1、CGRP mRNA表達變化模型組胰腺組織TRPV1、CGRP表達增高,TRPV1拮抗劑組胰腺組織TRPV1、CGRP表達增高但低于模型組,經比較差異有統計學意義,P<0.05。見表3。
表3 大鼠的胰腺組織TRPV1、CGRP mRNA表達(±s)
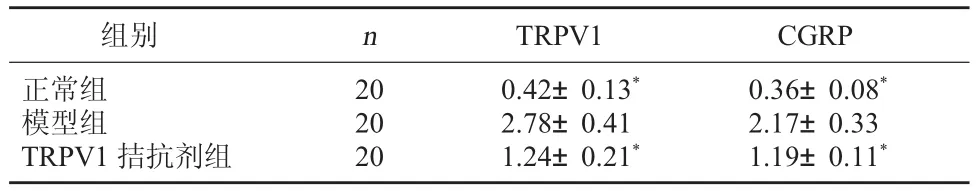
表3 大鼠的胰腺組織TRPV1、CGRP mRNA表達(±s)
注:與模型組比較,*P<0.05。
組別 n TRPV1 CGRP正常組模型組TRPV1拮抗劑組20 20 20 0.42±0.13*2.78±0.41 1.24±0.21*0.36±0.08*2.17±0.33 1.19±0.11*
3.4TRPV1、CGRP熒光定量PCR法檢測結果見圖1。
圖1 TRPV1、CGRP熒光定量PCR溶解曲線及擴增曲線
4 討論
正常情況下,合成的胰酶絕大部分是無活性的酶原,當胰液進入十二指腸后,在腸激酶的作用下,首先激活胰蛋白酶原,形成胰蛋白酶,從而激活其他各種胰消化酶原轉化為有生物活性的消化酶,對食物進行消化;病理情況下,各種病因導致腺泡內胰酶原激活,引起胰腺自身消化而并發一系列嚴重連鎖反應,最終導致AP發生[6]。AP發病過程中,產生一系列炎癥介質如白三烯、氧自由基、血管活性物質并釋放,引起胰腺微循環障礙,胰腺缺血壞死,緩激肽、TRPV1等使炎癥持續[7],即所謂“胰酶激活-胰腺自行消化-炎癥級聯反應-二次打擊-胰腺缺血壞死-全身炎癥反應綜合征”。
脂氧合酶作為一種強烈炎性介質,在膽源性胰腺炎發生、全身炎癥反應綜合征中有重要作用。研究發現LTB4及其受體與胰腺炎關系密切,兩種LTB4受體亞型在胰腺炎發病時其表達顯著高于正常胰腺組織,LTB4受體拮抗劑腹腔注射預處理,具有明確緩解小鼠實驗性胰腺炎的效應[8~9]。本研究結果亦提示,急性胰腺炎大鼠的白三烯B4、TRPV1及CGRP表達呈上升趨勢,與胰腺炎病理學改變呈正相關;而予以TRPV1拮抗劑處理后大鼠白三烯B4、TRPV1 及CGRP表達較模型組明顯下降,胰腺組織病理積分亦呈下降趨勢,這表明TRPV1介導AP的地位不容忽視。TRPV1作為配體門控非選擇性陽離子通道,是一種多型信號探測器及多種疼痛刺激的整合器,其編碼基因位于17p13染色體,編碼一種由838個氨基酸組成的蛋白質,主要表達在胰腺、結腸上皮及皮膚組織的初級神經元,存在于細胞膜或胞內細胞器膜上,可以被辣椒素、熱刺激、H+離子、脂氧合酶產物激活[10]。TRPV1去極化初級神經元可導致中樞及靶器官外周神經遞質釋放增加,這些神經遞質具有促炎性介質的效用,包括速激肽、SP,導致炎癥級聯反應,參與胰腺炎的發病[11]。研究指出,TRPV1基因敲除的大鼠對于傷害性熱刺激的反應明顯減低,炎癥反應減弱,痛覺行為消失,并
阻斷促分泌素,干擾胰腺炎的發生[12]。近來研究提示,新生乳鼠予以辣椒刺激,破壞辣素受體表達初級神經元后,無論是促分泌素-誘導胰腺炎,還是膽道梗阻胰腺炎都得到明顯改善;采用TRPV1抑制劑預處理后,亦可降低急性胰腺炎的傷害性刺激即改善胰腺炎的發生、發展[13~14]。
由此,我們推測胰膽管梗阻后導致LTB4分泌增加,LTB4導致胰腺內源性初級神經元TRPV1膜表達增加,TRPV1去極化神經元級聯反應放大,導致傷害性刺激傳遞至脊髓,引起疼痛,繼而CGRP等肽類物質釋放增加,引起全身炎癥反應綜合征。總之,內源性LTB4活化TRPV1信號可能在膽道梗阻性胰腺炎中發揮了至關重要的作用,阻斷TRPV1信號轉導將為急性胰腺炎的治療提供新的思路。
參考文獻
[1]McNabb-Baltar J,Ravi P,Isabwe GA,et al.A population-based assessment of the burden of acute pancreatitis in the United States[J]. Pancreas,2014,43(5):687-691
[2]O’Connor OJ,Buckley JM,Maher MM.Imaging of the complications of acute pancreatitis[J].AJR Am J Roentgenol,2011,197(3):375-381
[3]Schwartz ES,La JH,Scheff NN,et al.TRPV1 and TRPA1 antagonists prevent the transition of acute to chronic inflammation and pain in chronic pancreatitis[J].J Neurosci,2013,33(13):5603-5611
[4]AnderssonE,AnsariD,AnderssonR.Majorhaemorrhagic complications of acute pancreatitis [J].Br J Surg,2010,97 (9): 1379-1384
[5]Oz HS,Lu Y,Vera-Portocarrero LP,et al.Gene expression profiling and endothelin in acute experimental pancreatitis [J].World J Gastroenterol,2012,18(32):4257-4269
[6]Barreto SG,Saccone GT.Pancreatic nociception--revisiting the physiology and pathophysiology [J].Pancreatology,2012,12 (2): 104-112
[7]Liddle RA.The role of Transient Receptor Potential Vanilloid1 (TRPV1) channels in pancreatitis [J].Biochim Biophys Acta, 2007,1772(8):869-878
[8]Wick EC,Hoge SG,Grahn SW,et al.Transient receptor potential vanilloid 1, calcitonin gene-related peptide, and substance P mediate nociception in acute pancreatitis [J].Am J Physiol Gastrointest Liver Physiol,2006,290(5):G959-969
[9]Wu Y,Liu Y,Hou P,et al.TRPV1 channels are functionally coupled with BK(mSlo1) channels in rat dorsal root ganglion (DRG) neurons [J].PLoS One,2013,8(10):e78203
[10]Schwartz ES,Christianson JA,Chen X,et al.Synergistic role of TRPV1 and TRPA1 in pancreatic pain and inflammation [J]. Gastroenterology,2011,140(4):1283-1291
[11]Nisar A,Malik AH,Zargar MA.Atropa acuminata Royle Ex Lindl. blunts production of pro-inflammatory mediators eicosanoids., leukotrienes, cytokines in vitro and in vivo models of acute inflammatory responses[J].J Ethnopharmacol,2013,147(3):584-594
[12]Nathan JD,Peng RY,Wang Y,et al.Primary sensory neurons: a common final pathway for inflammation in experimental pancreatitis in rats [J].Am J Physiol Gastrointest Liver Physiol,2002,283 (4): G938-946
[13]Ozkan E,Akyüz C,Sehirli AO,et al.Montelukast, a selective cysteinyl leukotriene receptor 1 antagonist, reduces cerulein-induced pancreatic injury in rats[J].Pancreas,2010,39(7):1041-1046
[14]Vigna SR,Shahid RA,Nathan JD,et al.Leukotriene B4 mediates inflammation via TRPV1 in duct obstruction-induced pancreatitis in rats[J].Pancreas,2011,40(5):708-714
●臨床研究●
Expression and Significance of LTB4, TRPV1 and CGRP in Acute Biliary Pancreatitis
XIA Bing-jie1, CHEN Si-yu2, HUANG Hui-yun2, CHEN Yu2, ZHANG Tao2#
(1The Affiliated Hospital of Guilin Medical College, Guilin, Guangxi54100; 2The Affiliated Ruikang Hospital of Guangxi University of Traditional Chinese Medicine, Nanning530011)
Abstract:Objective: Through the detection of the changes of leukotriene B4 (LTB4), transient receptor potential vanilloid channel-1 (TRPV1) and calcitonin gene related peptide (CGRP) to analyze the role of LTB4-TRPV1 signal activation in acute biliary pancreatitis. Methods: 60 SD rats were randomly divided into normal group, model group, and TRPV1 antagonist group. The acute pancreatitis model was established by biliary and pancreatic duct with the duodenum ligation. 3 hours after the surgery, the model group and TRPV1 antagonist group were given different drugs, except the normal group. 12 hours after the surgery, all rats were killed, took blood from the abdominal aorta and collected pancreatic tissue for measure. The changes of pancreatic tissue ultra structure were detected by light microscope, the changes of LTB4 were detected by ELISA technique, and the changes of TRPV1 and CGRP were detected by PCR Real-time technique. Results: The pancreas appears light pink in normal group, the pancreas in blank group appears necrosis and hemorrhage, ascites containing with blood. There are pancreatic gland disorders, increased interlobular septa, gland parenchyma necrosis and hemorrhage, inflammatory cell infiltrating in pancreatic tissue under light microscope. Detected by light microscope, the TRPV1 antagonist group rats appear little pancreatic parenchyma necrosis and hemorrhage and little inflammatory cell infiltrating in pancreatic tissue. Compared with blank group, the pancreatic tissue hyperemia and edema was relieved, no ascites. The histopathology score is decreased than those in blank group, P<0.05. The serum amylase and LTB4 expression of the model group increased significantly, while the blood amylase and LTB4 expression of the TRPV1 antagonist group decreased, compared with the model group have statistical significance, P<0.05. The pancreatic tissue’s TRPV1 and CGRP mRNA expression in model group increased, while the TRPV1 antagonist group’s decreased, the difference was statistically significant, P<0.05. Conclusion: The endogenous LTB4 activation TRPV1 signal may play a crucial role in biliary obstructive pancreatitis, so blocking TRPV1 signal transduction will provide new ideas for treating acute pancreatitis.
Key words:Acute biliary pancreatitis; Leukotriene B4; Transient receptor potential vanilloid channel-1; Calcitonin gene related peptide; Expression
#通訊作者:張濤,E-mail:zhangxuan271@aliyun.com
中圖分類號:R657.51
文獻標識碼:B
doi:10.13638/j.issn.1671-4040.2016.02.001
收稿日期:(2016-11-16)

