人組蛋白去乙酰化酶11的克隆表達與生物信息學分析
(漯河醫學高等專科學校,河南 漯河 462000)
乙酰化是組蛋白共價修飾的一種方式。可逆的組蛋白乙酰化修飾發生在核心組蛋白N端的賴氨酸殘基上,分別由組蛋白乙酰基轉移酶(HAT)和組蛋白去乙酰化酶(HDACs)催化完成。HAT提高乙酰化水平,相反的HDACs則降低乙酰化水平[1]。HDACs是一個大家族,在哺乳細胞中已發現18個成員,根據其與酵母蛋白同源性被分為四類[2]。Ⅰ類HDACs包括HDAC1-3和HDAC8,與酵母蛋白Rpd3同源,主要存在于細胞核中,在各種組織細胞中都有表達[3]。Ⅱ類HDACs包括HDAC4-7,HDAC9和HDAC10,與酵母蛋白Hda1同源,穿梭于細胞質和細胞核之間,只在部分組織中有表達[4]。Ⅲ類HDACs與酵母蛋白Sir2同源,被稱作Sirtuins。成員有7個:SIRTl-SIRT7[5],在細胞核和細胞質中都存在。HDAC11是Ⅳ類HDAC的唯一成員[6]。Ⅰ類、Ⅱ類和Ⅳ類HDAC被稱作經典HDACs,經典HDACs和Sirtuins催化機制不同:經典HDACs為鋅離子依賴性蛋白[7],Sirtuins為尼克酰胺腺苷酸(NAD)依賴性蛋白[8]。除了組蛋白外HDACs也能作用于非組蛋白,比如轉錄因子[9],從而間接影響這些轉錄因子所調控的基因的表達,因此HDACs在調控多種細胞進程中扮演了重要角色。相關研究表明,HDACs與癌癥的發生有關[10]。目前,伏立諾他等HDAC抑制劑(HDACi)作為抗腫瘤藥物進入臨床并表現出了良好的治療效果,但是現在大部分的HDACi為廣譜型抑制劑,廣譜HDACi可能會引起多種副作用,比如凝血障礙、心律失常等[11],這主要是因為HDACs存在多種亞型,因此針對亞型選擇性的HDACi已經成為現在研究的一個熱點。HDAC11是HDAC家族發現最晚的一個成員,也是研究最少的一個成員,本文通過克隆表達HDAC11并對HDAC11的序列,二級結構等進行預測分析希望對以后HDAC11的研究工作提供幫助。
一、材料與方法
1.材料
HDAC11序列(登錄號:NM_024827.3)和引物交由生工生物合成,載體pGEX-6P-1為實驗室保存,大腸桿菌菌株DH(5α)和BL21(DE3)感受態細胞購自北京全式金生物公司。EcoRⅠ,BamHⅠ和T4連接酶購自fermentas,DNA marker和Protein Marker購自全式金,質粒小提試劑盒和膠回收試劑盒購自萊科百奧。
2.方法
2.1 hdac11 基因的擴增
利用primer 5.0設計引物。引物為正向-CG GGATCC ATGCTACACACAACCCAGCTGT ACC, 反 向 -CG GAATTC TCAGGGCACTGCAGGGGGAA,引物交由生工生物合成。以合成的HDAC11序列為模版進行 PCR擴增,參數為:94℃預變性10min;94℃ 30s,60℃ 30s,72℃1.5min,30個循環;72℃終延伸10min。擴增產物用1%瓊脂糖凝膠電泳回收。
2.2 重組質粒的構建與鑒定
將回收的目的片段與pGEX-6P-1載體分別用EcoRⅠ和BamHⅠ雙酶切,并將酶切產物按一定比例16℃連接5h。將連接產物轉化到大腸桿菌DH(5α)感受態細胞,氨芐青霉素篩選陽性克隆,對陽性克隆做雙酶切鑒定和測序鑒定。
2.3 重組蛋白的表達
將測序正確的重組質粒轉化到大腸桿菌BL21(DE3)感受態細胞中。挑取單克隆于含氨芐青霉素的LB培養基中培養,OD600=0.6時,加入IPTG使其終濃度為0.1 mM/L,16℃誘導表達12h,離心收集菌體。用PBS重懸菌體沉淀,超聲破碎后高速離心,取上清和沉淀制樣跑膠分析目的蛋白的表達形式。
2.4 HDAC11的生物信息學分析
利用ProtParam和Protscale對HDAC11的氨基酸序列及理化性質進行分析,blast在線分析HDAC11的同源性,SOPMA對其二級結構進行預測,NetPhos和SUMOplot對其進行翻譯后修飾預測。
二、結果與分析
1.目的蛋白的克隆表達
1.1 重組質粒的構建及鑒定
構建的重組質粒用EcoRⅠ和BamHⅠ做雙酶切鑒定,獲得4900bp的載體片段和約1000bp的目的基因片段,結果表明成功構建重組質粒。
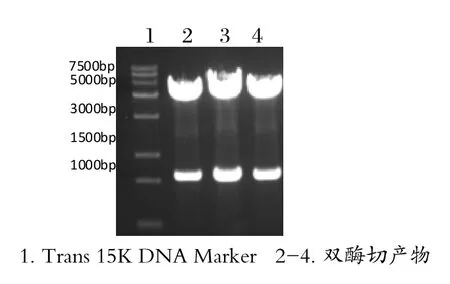
圖1 重組質粒的雙酶切鑒定
1.2 重組蛋白的表達
將重組質粒轉入大腸桿菌BL21(DE3)中,經IPTG誘導后收集菌體,SDS-PAGE檢測結果顯示,加入IPTG誘導后,轉入重組質粒的菌株總蛋白提取物中出現一條分子量約為65kD的蛋白條帶,與重組HDAC11蛋白大小相符,表明重組表達載體經IPTG誘導后目的蛋白得到表達。但HDAC11蛋白主要以包涵體形式存在。
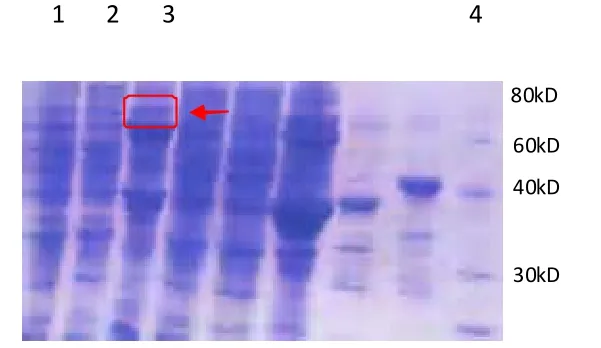
圖2 表達蛋白的SDS-PAGE分析
2.HDAC11的生物信息學分析
2.1 HDAC11的氨基酸序列及理化性質分析
ProtParam分析表明HDAC11(UniProtKB:Q96DB2)共含有347個氨基酸殘基,含量較高的是亮氨酸(10.1%)、甘氨酸(8.4%)、纈氨酸(7.8%)和精氨酸(7.8%),含量較少的氨基酸有半胱氨酸(0.6%)、色氨酸(1.4%)等。將人 HDAC11 的氨基酸序列與小鼠(UniProtKB/Swiss-Prot:Q91WA3.1),食蟹猴(UniProtKB/Swiss-Prot:Q9GKU5.2)的 HDAC11 序列進行比較發現同源性均達到90%以上。將人源HDAC11與人源HDAC1-HDAC10蛋白進行同源性比較,結果表明HDAC11與其他HDAC蛋白的同源性均不高,其與HDAC1具有31%的最高同源性,與HDAC5的同源性最低,為21%。HDAC11的分子式為C1763H2786N490O501S10,分子量為39183,酸性氨基酸有44個,堿性氨基酸有44個,理論等電點7.17為中性蛋白。在溶液中的不穩定指數為39.1,根據蛋白質的不穩定指數在40以下為穩定蛋白的標準推測該蛋白為穩定蛋白。脂肪系數為96.05。
2.2 HDAC11的二級結構預測
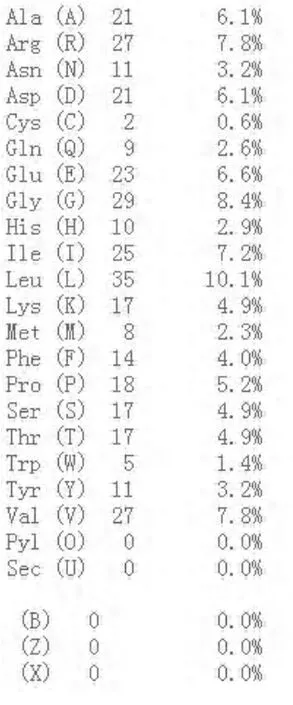
圖3 HDAC11的氨基酸組成分析
利用SOPMA在線軟件對HDAC11蛋白的二級結構進行預測,結果表明:該蛋白的二級結構中α-螺旋的比例最高,達到37.75%,無規卷曲次之,為30.26%,延伸鏈和β-轉角所占比例分別為19.88%和12.10%。因此α-螺旋和無規卷曲是該蛋白的主要二級結構元件。含量最高的α-螺旋主要分布于氨基酸殘基的43-66、76-92、154-170、232-247四個區域,無規卷曲、延伸鏈和β-轉角則不均勻地分布于整個蛋白質多肽鏈中。
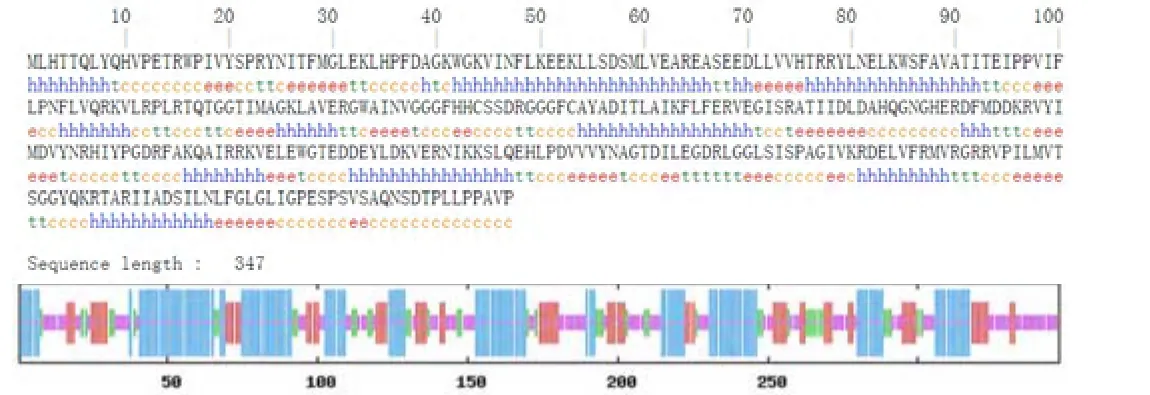
圖4 HDAC11的二級結構分析
2.3 HDAC11的翻譯后修飾預測
利用NetPhos對HDAC11蛋白進行磷酸化修飾預測,結果發現該蛋白擁有9個絲氨酸,2個蘇氨酸和1個酪氨酸共12個潛在的磷酸化位點。利用SUMOplot對其進行SUMO化修飾預測,結果表明HDAC11有兩個評分較高的修飾位點,分別為K280和K50。
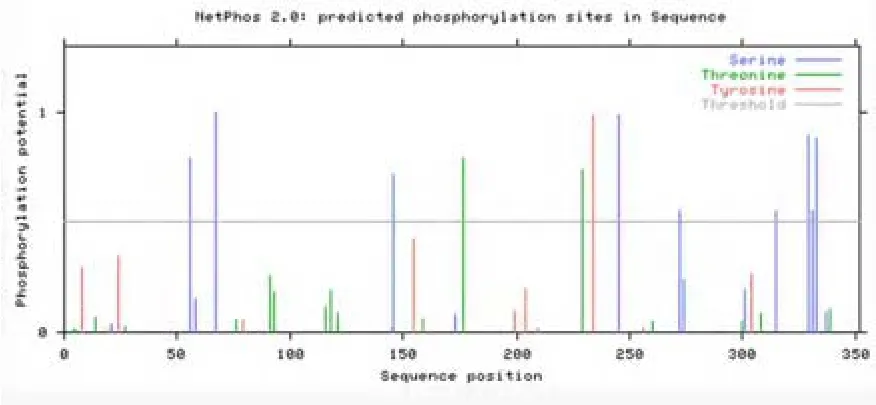
圖5 HDAC11的磷酸化位點分析
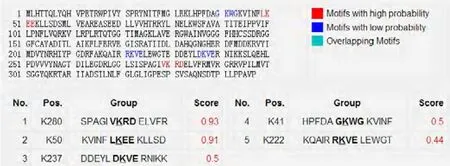
圖6 HDAC11的SUMO化位點分析
三、討論
本研究將hdac11基因構建到原核表達載體pGEX-6P-1中,轉化入大腸桿菌BL21(DE3)中進行表達,目的蛋白有表達,但是以包涵體的形式存在。外源基因在大腸桿菌中的高表達常常導致形成無活性的包涵體,目前減少包涵體形成主要有兩種策略:①降低蛋白合成速度比如降低誘導劑濃度和誘導溫度[12];②加入促進可溶性表達的生長添加劑[13]。對于已經形成包涵體的蛋白可通過將包涵體蛋白體外復性得到生物活性蛋白。另外本文利用生物信息學軟件如ProtParam、ProtScale、SOPMA等對HDAC11的序列,理化性質、二級結構等進行了分析預測。對HDAC11的氨基酸和理化性質分析可知,HDAC11在人、小鼠和食蟹猴中的序列非常保守,而HDAC11與其他家族成員的同源性非常低,相比較而言HDAC11更接近于Ⅰ類HDACs。對HDAC11的二級結構預測后發現無規卷曲和α-螺旋的比例較高,無規卷曲結構比較松散并隨環境而改變,常構成酶活性部位和蛋白質特異的功能部位。另外HDAC11可能存在12個磷酸化位點,已有多篇文獻報道HDAC1-HDAC10的10個蛋白均含有磷酸化位點,比如HDAC1 的 S421[14]、HDAC6 的 S1035[15]、HDAC7 的 T286[16]、HDAC8 的 S39[17]等,這些修飾可能會影響酶的活性或蛋白的定位。Ⅱa類HDACs在細胞內的定位主要是由核的輸入輸出信號和14-3-3蛋白調控,HDAC4、5、7、9含有三個保守的14-3-3結合位點,結合14-3-3后會以一種磷酸化依賴的方式將HDACs留在細胞質中[17]。比如HDAC4的S350被磷酸化后與14-3-3的結合力增強[18],HDAC5的S259和S498被磷酸化后會促進蛋白從細胞核輸出到細胞質[19],因此對于Ⅱa類HDACs來說磷酸化影響了蛋白的定位。HDAC1的S421和S423被磷酸化后會促進酶活性及與NuRD及SIN3復合物的相互作用[14],而HDAC8的S39被磷酸化后會降低酶活性[17],對于HDAC11來說,磷酸化可能影響了它的酶活性。另外HDAC11還含有潛在的SUMO化修飾位點,對于HDACs家族而言,已有文獻報道HDAC1、3、4、6和 9有 SUMO化修飾[20,21],HDAC1的 K444和 K476被修飾后酶的活性增強[21],SUMO化可能也影響了HDAC11的活性。
四、結論
本研究一方面將該基因構建到原核表達載體pGEX-6P-1中進行目的蛋白表達,結果以包涵體形式表達,另一方面利用生物信息學軟件分析了該蛋白的氨基酸序列、理化性質、二級結構、磷酸化位點等,為進一步了解該蛋白的結構與功能以及組蛋白去乙酰化酶家族成員之間的差異打下基礎。
[1]Murr R.Interplay between different epigenetic modifications and mechanisms.Adv Genet,2010,70:101-41.
[2]Xu WS,Parmigiani RB,Marks PA.Histone deacetylase inhibitors:molecular mechanisms of action.Oncogene,2007,26:5541-52.
[3]Gregoretti IV,Lee YM,Goodson HV.Molecular evolution of the histone deacetylase family:functional implications of phylogeneticanalysis.J Mol Biol,2004,338:17-31.
[4]Marks PA,Dokmanovic M.Histone deacetylase inhibitors:discovery and development as anticancer agents.Exp Opin Invest Drugs,2005,14:1497-511.
[5]Blander G,Guarente L,The Sir2 family of protein deacetylases[J].Annu Rev Biochem,2004,73:417-435.
[6]Mottet D,Castronovo V.Histone deacetylases:target enzymes for cancer therapy.Clin Exp Metastasis,2008,25:183-9.
[7]Codd R,Braich N,Liu J,et al,Pakchung AA.Zn(II)-dependent histone deacetylase inhibitors:suberoylanilide hydroxamic acid and trichostatin A.Int J Biochem Cell Biol,2009,41:736-9.
[8]Neugebauer RC,Sippl W,Jung M.Inhibitors of NAD+dependent histone deacetylases(sirtuins).Curr Pharm Des,2008,14:562-73.
[9]Yang XJ,Seto E.The Rpd3/Hda1 family of lysine deacetylases:from bacteria and yeast to mice and men.Nat Rev Mol Cell Biol,2008,9:206-18.
[10]Yang XJ,Gregoire S .Class II histone deacetylases:from sequence to function,regulation,and clinical implication.Mol Cell Biol,2005,25:2873 2884
[11]O.Bruserud,C.Stapnes,E.Ersvaer,B.et al.Ryningen,Histone deacetylase inhibitors in cancer treatment:a review of the clinical toxicity and the modulation of gene expression in cancer cell.Curr.Pharm.Biotechnol,2007,8:388-400.
[12]Xie Y,Wet laufer D B .Control of aggregation in protein refolding :the temperature leap tactic .Protein Sci,1996,5(3):517-523
[13]Georgious G,Valax P .Expression of correctly folded proteins in E .coli .Curr Opin Biot echnol,1996,7(2):190-197
[14]Pflum MK,Tong JK,Lane WS,et al.Histone deacetylase 1 phosphorylation promotes enzymatic activity and complex formation.J Biol Chem.2001,?276(50):47733-41.
[15]Bian Y,Song C,Cheng K,et al.An enzyme assisted RP-RPLC approach for in-depth analysis of human liver phosphoproteome.J Proteomics,2014?,96:253-62.
[16]Dephoure N,Zhou C,Villén J,?et al.A quantitative atlas of mitotic phosphorylation.Proc Natl Acad Sci U S A,2008,105(31):10762-7.
[17]Somoza JR,Skene RJ,Katz BA,?et al.Structural snapshots of human HDAC8 provide insights into the class I histone deacetylases.Structure,2004,12(7):1325-34
[18]Wang AH,Kruhlak MJ,Wu J,?et al.Regulation of histone deacetylase 4 by binding of 14-3-3 proteins.Mol Cell Biol,2000,20(18):6904-12
[19]McKinsey TA,Zhang CL,Olson EN.Activation of the myocyte enhancer factor-2 transcription factor by calcium/calmodulin-dependent protein kinase-stimulated binding of 14-3-3 to histone deacetylase 5.Proc Natl Acad Sci U S A,2000,97(26):14400-
[20]David G,Neptune MA,DePinho RA.SUMO-1 modification of histone deacetylase 1(HDAC1)modulates its biological activities.J Biol Chem.2002,277(26):23658-63.
[21]Petrie K,Guidez F,Howell L,et al.The histone deacetylase 9 gene encodes multiple protein isoforms.J Biol Chem,2003,278(18):16059-72.

