轉移相關基因干擾對肝癌轉移潛能的影響
黃楚恒,李天然,黃曉斌,蔡立杰,盧光明,李延軍
?
·論著·
轉移相關基因干擾對肝癌轉移潛能的影響
黃楚恒1,李天然2,黃曉斌1,蔡立杰1,盧光明3,李延軍3
目的通過干擾高轉移潛能肝癌細胞(MHCC97-H)中的骨橋蛋白(OPN)、腫瘤增殖性因子腫瘤生長因子β1(TGFβ1)基因,使之減少OPN、TGFβ1表達,觀察MHCC97-H轉移能力的變化情況。方法對MHCC97-H細胞行OPN、TGFβ1基因干擾,qPCR法檢測干擾效果。MHCC97-H細胞遷移細胞學實驗采用transwells法。肺轉移動物模型制作方法:裸鼠尾靜脈注射各組細胞,含細胞數5×106個/只,隔天連續注射3次,2周后觀察肺臟組織。離體肺臟組織標本制作,DAPI 染核處理10 min,甘油PBS 封片,置于熒光顯微鏡下觀察。免疫熒光法檢測裸鼠動物模型整合素αvβ3 表達。結果經基因干擾后MHCC97-H表達OPN和TGFβ1明顯降低(P<0.05)。細胞學實驗顯示與對照組比較,經OPN和TGFβ-1干擾組MHCC97-H細胞遷移數量明顯減少(P<0.01)。動物模型實驗顯示與對照組比較,OPN和TGFβ1干擾組肺組織中肝癌細胞較少,定量分析顯示OPN和TGFβ1干擾組肺臟組織中肝癌細胞IOD值明顯低于對照組(P<0.05)。OPN和TGFβ1干擾組與對照組比較整合素 αvβ3表達IOD值差異無統計學意義(P>0.05)。結論經OPN和TGFβ1基因干擾的MHCC97-H細胞肺轉移能力有明顯的下降,尤其是TGFβ1基因干擾組下降更加明顯,但經OPN和TGFβ1基因干擾的MHCC97-H細胞表達整合素αvβ3能力無變化,整合素αvβ3介導參與了OPN和TGFβ1共同作用肝癌轉移行為的變化。
肝癌,轉移;骨橋蛋白;腫瘤生長轉化因子;整合素
肝癌的轉移行為是影響肝癌預后的關鍵因素之一,多種生物學因子參與到了肝癌的轉移過程中。復旦大學肝癌研究所構建的具有不同轉移潛能的肝癌模型成為研究肝癌轉移行為的有效手段,具有高轉移潛能肝癌細胞(MHCC97-H)肺轉移率100%。本課題研究組主要關注對肝癌轉移潛能的生物干預,為尋找合適的生物治療靶點提供依據。前期通過基因工程技術對自體骨髓間充質干細胞(autologous bone marrow mesenchymal stem cells,BMSC)進行改造,使其增加轉移性相關因子骨橋蛋白(osteopontin, OPN)基因表達、腫瘤增殖性因子腫瘤生長因子β1(transforming growth factor β,TGFβ1)基因的表達,觀察經基因改造的BMSC對具有不同轉移潛能肝癌的影響情況,研究結果顯示外源性生物活性因子可以促進肝癌細胞的增殖和轉移[2-3]。因此,減少生物活性因子的表達,可能起到抑制腫瘤轉移和增殖的作用。本研究通過抑制MHCC97-H中的OPN、TGFβ1基因,使之減少OPN、TGFβ1表達,觀察肝癌細胞轉移能力的變化情況。
1 材料與方法
1.1實驗儀器及試劑冰凍切片機(HM525 NX型,Thermo公司),正置熒光顯微鏡(BX43 型, OLYMPUS 公司),冰箱(BCD-211KD3 型, TCL公司),輪轉式切片機(RM2235 型,LEICA 公司),病理組織漂烘儀(tec 2500 型,常州市郝思琳儀器設備有限公司),轉盤式掃描共聚焦顯微鏡(OLYMPUS公司DSU),冰箱(BCD-211KD3 型, TCL公司),電熱恒溫鼓風干燥箱(101-3 型,上海錦屏儀器有限公司),隔水式恒溫培養箱(PYX-DHS500BS-Ⅱ型,上海躍進醫療器械有限公司)。鼠多克隆整合素αvβ3抗體(santa,批號:L2206),工作濃度為1∶50;驢抗兔熒光二抗(Life,批號:1531671,激發/發射波長:490/520 nm),工作濃度為1∶800;檸檬酸抗原修復液(pH6.0,福州邁新生物技術有限公司);二甲苯(成都市科龍化工試劑廠);無水乙醇(成都市科龍化工試劑廠);DAPI(sigma,吸收波長/發射波長:358/461 nm)。DMEM 培養基(Gibco公司),胎牛血清(FBS,BI公司),青(p)-鏈霉素(s)(100×P.S.雙抗菌素,杭州昊天生物技術有限公司),胰蛋白酶(trypsin,gibco公司),磷酸鹽緩沖液(PBS,國藥化學試劑有限公司)。1.2實驗動物及飼養條件實驗用BALB/c雄性裸小鼠均由上海斯萊克實驗動物有限責任公司提供,生產許可證號為SCXK(滬)2012-0002,SPF級,動物質量合格證號為0205939,購入時動物體重為20 g左右。飲用水為滅菌二級超純水,飲用水質量符合中華人民共和國國家標準《生活飲用水衛生標準》(GB5749-2006)的規定。實驗動物房使用許可證號為SYXK(浙)2015-0008,飼養環境:溫度范圍20~25 ℃,相對濕度范圍40%~70%。裸小鼠試驗前在動物房環境中適應6 d。維持飼料由上海斯萊克實驗動物有限公司提供,執行標準GB14924.3-2010《實驗動物配合飼料營養成分》。
1.3實驗方法1.3.1MHCC97-H基因干擾方法本課題組前期結果顯示MHCC97-H高表達轉移相關基因OPN和增殖相關基因TGFβ1,因此,本研究對兩種基因分別進行干擾。實驗方法:腺病毒載體的構建,TGFβ1 siRNA1序列:G ̄T ̄G ̄G ̄A ̄G ̄C ̄T ̄G ̄T ̄A ̄C ̄C ̄A ̄G ̄A ̄A ̄A ̄T ̄; OPN siRNA1序列:GAGGAGTTGAATGGTGCATAC,合成PAGE膠純化的oligo序列,載體用BamH I,EcoR I雙酶切,切膠回收,退火獲得目的片斷shRNA3’和5’的單鏈,目的片段shRNA與載體連接反應,轉化后的TGFβ1及OPN shRNA平板挑菌,測序。重組腺病毒TGFβ1&SPP1 shRNA腺病毒:制備重組質粒,重組腺病毒載體的包裝,收毒及擴增,TGFβ1及OPN shRNA腺病毒檢驗。病毒感染MHCC97-H細胞。qPCR檢測基因干擾前后TGFβ1及OPN表達情況,步驟包括:① Trizol-離心柱法提取細胞總RNA:收集約106個細胞,裂解,離心。② RNA純度的測定和RNA的定量:以相應溶劑為對照,取2 μL RNA溶液于Merinton SMA4000檢測,觀察A260/A280、A260/A230比值及連續波長吸收峰,并計算RNA溶液濃度,判斷RNA提取質量。③ 逆轉錄。④ 熒光定量PCR擴增。
1.3.2MHCC97-H細胞遷移實驗設MHCC97-H空白對照組、MHCC97-H基因干擾陰性對照組(native contrast, NC)、MHCC97H TGFβ1基因干擾組、MHCC97-H OPN基因干擾組,用 10%FBS 1×P.S. DMEM 培養基, 37 ℃,5%CO2培養箱孵育培養。取生長對數期各組MHCC97-H細胞,0.25% Trypsin +0.02%EDTA 消化離心,計數后,以 5 ×104/well密度分組鋪 24 孔板上室,下室加入DMEM培養基,繼續培養,48 h 后, PBS 清洗 1 次,用4%多聚甲醛固定10 min,取出,用棉簽擦去上室非遷移細胞,移去transwells,倒置,風干,在24孔板中加入200 μL 0.1%結晶紫,把小室放入其中,室溫孵育10 min,取出,PBS清洗3次,隨機取3個視野,照相,計數,統計結果。1.3.3動物模型分組①肝癌肺轉移模型動物模型共 32 個樣本,具體分組為: GFP基因陰性對照組、 OPN基因干擾組、TGFβ1基因干擾組和空白對照組,每組均 8 個樣本。②裸鼠整合素(integrin)αvβ3 表達實驗共15個樣本,具體分組為:基因陰性對照(native contrast,NC)組、OPN基因干擾和TGFβ1基因干擾組,每組均5個樣本。
1.3.4肝癌肺轉移動物模型制作方法參考文獻方法進行。收集處于對數生長期的MHCC97-H空白對照細胞株、MHCC97-H陰性對照細胞株、MHCC97-H OPN干擾細胞株,1000 rpm 離心5 min,調整細胞濃度至2.5×107個/mL,制備單細胞懸液。32只裸鼠分別自尾靜脈注射0.2 mL,含細胞數5×106個/只,注射后按壓30 s,防止細胞懸液從針孔流出,隔天連續注射3次,2周后觀察肺臟組織,復制肺轉移移植瘤模型。
1.3.5肝癌肺轉移腫瘤標本制作切片方法步驟包括4%甲醛固定3~5 d,修塊,脫水,透明處理,浸蠟,石蠟包埋,6 μm切片,DAPI 染核10 min,甘油PBS 封片,置于熒光顯微鏡下觀察。
1.3.6免疫熒光法檢測裸鼠動物模型整合素(integrin)αvβ3 表達①二甲苯脫蠟,梯度酒精分步復水:二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、100%乙醇Ⅰ5 min、100%乙醇Ⅱ5 min、95%乙醇5 min、 80%乙醇5 min、PBS 洗3×3 min。②抗原修復:置0.01M 枸櫞酸緩沖液(pH 6.0)中微波修復,自然冷卻至室溫,PBS 沖洗3×3 min。③滴加一抗,4 ℃孵育過夜,PBS 水洗3×3 min。④滴加二抗,37 ℃孵育60 min,PBS 沖洗3×5 min。⑤DAPI 染核,室溫10 min。⑥甘油PBS 封片,共聚焦顯微鏡觀察。免疫熒光呈綠色為陽性表達。
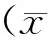
2 結 果
2.1MHCC97-H細胞基因干擾前后TGFβ1及OPN表達結果以β-Action作為內參照基因,以空白對照組(基因干擾前)作為對照基因進行標準化后相對定量,結果見表1。
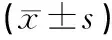
表1 TGFβ1及OPN基因干擾前后MHCC97-H細胞表達
2.2transwells法遷移MHCC97-H細胞計數結果實驗組中MHCC97-H NC組遷移細胞數為(129.29±12.32)個,MHCC97-H OPN組遷移細胞數為(72.39±11.32)個,MHCC97-H TGFβ-1組遷移細胞數為(39.12±9.65)個,空白對照組MHCC97-H遷移細胞數為(225.45±17.46)個。結果顯示,與對照組MHCC97-H比較,經OPN、TGFβ-1基因干擾MHCC97-H細胞組及陰性對照組,細胞遷移數量組間比較差異具有統計學意義(P<0.01),表明經基因干擾后細胞遷移數量明顯減少,尤其是MHCC97-H OPN和MHCC97-H TGFβ1干擾組細胞遷移數量減少為著(P<0.01)。
2.3高轉移肝癌(MHCC97-H)動物模型肺轉移情況熒光成像結果(圖1)結果顯示,空白對照組和陰性對照組肺臟組織中腫瘤細胞較多,OPN干擾組和TGFβ1對照組肺組織中腫瘤細胞與空白對照組比較較少,表明經基因干擾MHCC97-H腫瘤肺轉移潛能下降。為進一步定量觀察肺組織細胞中肝癌細胞的轉移情況,利用Image J軟件對病理切片中肝癌細胞的熒光強度進行定量分析,以細胞積分光密度(integrated option density,IOD)作為定量指標,見圖2。

圖1 MHCC97-H腫瘤動物模型肺組織轉移情況熒光成像(腫瘤細胞呈紅色,肺組織細胞核呈藍色)
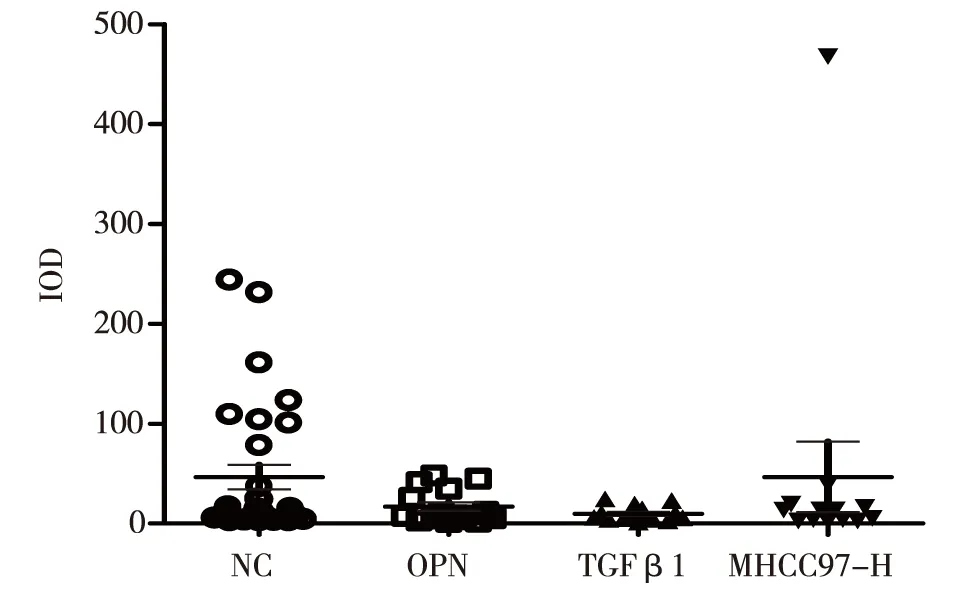
NC: 陰性對照組;OPN:OPN基因干擾組;TGFβ1:TGFβ1基因干擾組;MHCC97-H空白對照組圖2 肺臟組織中轉移性肝癌細胞熒光成像定量分析
利用Image J軟件對肺臟中肝癌細胞的熒光強度進行定量分析,結果顯示,兩組實驗組(OPN干擾組和TGFβ1基因干擾組)與空白對照組和陰性基因對照組比較肝癌細胞IOD值較低(P<0.05),表明經OPN和TGFβ1基因干擾后轉移能力相減弱,與鏡下觀察結果一致。
2.4經基因修飾的MHCC97-H動物模型病理切片轉移相關因子整合素αvβ3熒光成像表達整合素αvβ3免疫熒光陽性顯色綠色為陽性(圖3)。
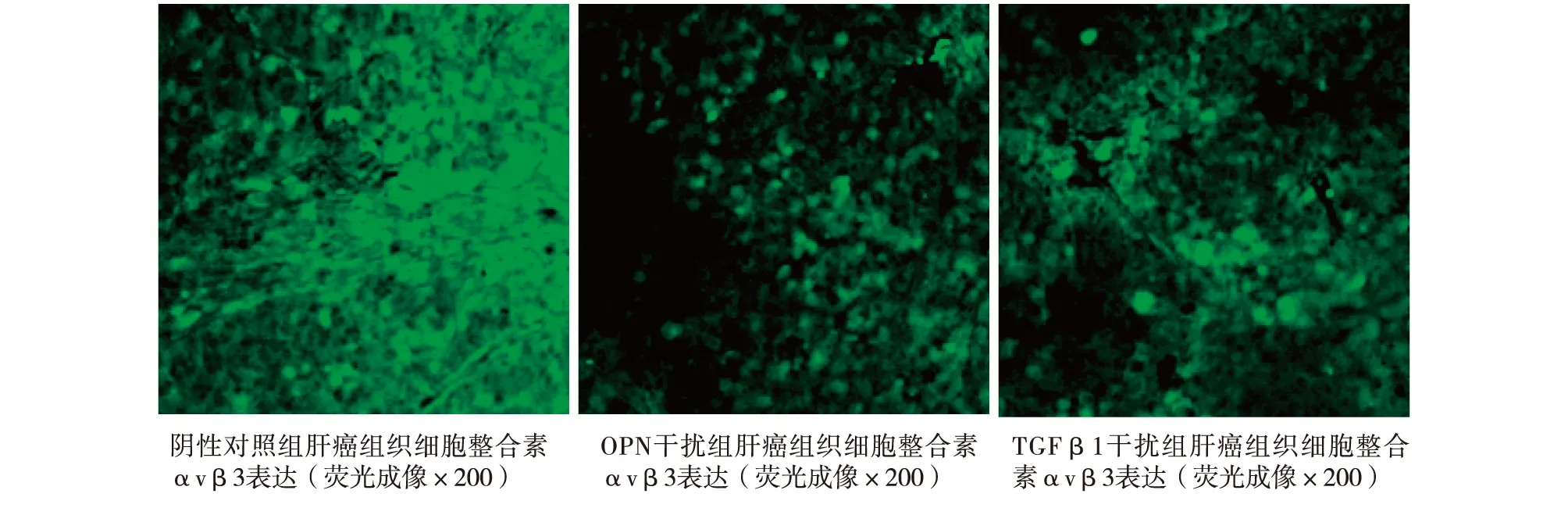
圖3 經基因修飾的MHCC97-H動物模型轉移相關因子整合素αvβ3熒光成像表達
由鏡下可見,兩組基因干擾組與對照組比較表達綠色熒光肝癌細胞密度明顯減少。利用Image J軟件對肺臟中肝癌細胞表達整合素αvβ3的熒光強度進行定量分析,結果顯示,細胞IOD值在三組之間差異無統計學意義(P>0.05),表明經OPN和TGFβ1基因干擾的肝癌細胞表達整合素αvβ3能力無變化(圖4)。
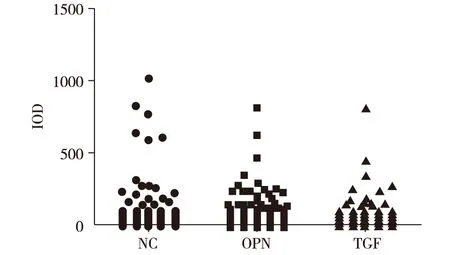
OPN:OPN基因干擾組;TGFβ1:TGFβ1基因干擾組;NC:陰性對照組 圖4 肺臟組織中肝癌細胞表達整合素αvβ3熒光成像定量分析
3 討 論
肝癌是我國常見的惡性腫瘤,死亡率占惡性腫瘤的第3位,轉移和復發是肝癌預后差的主要原因[6-7]。人肝癌細胞株MHCC97-H是具有高轉移潛能的肝癌細胞株,其肺轉移能力達到100%,該細胞株是研究肝癌肺轉移的最佳模型。肝癌的轉移行為與多種因素有關,肝癌侵襲轉移是一個多基因、多步驟、多因素參與的復雜過程,涉及癌細胞間以及癌細胞與宿主微環境間復雜的相互作用。
本課題組注意到OPN是一種分泌型磷酸化糖蛋白,其分子結構中含有RGD(Arg-Gly-Asp)多肽序列。OPN通過與整合素αvβ3或CD44結合,參與細胞粘附、信號傳導、運動等重要的生物學過程,但具體的機制仍在研究之中。研究發現,OPN在伴轉移的肝癌組織中顯著高表達,提示OPN參與了肝癌的轉移行為,通過阻斷OPN的表達可以延緩肝癌的轉移。另外,TGFβ1是參與腫瘤的增值、侵襲轉移重要生物因子,在肝癌的增殖和轉移中轉化生長因子與肝癌的發生、進展有關[10]。因此,本研究在前期研究的基礎上,通過基因工程技術干擾MHCC97-H中OPN和TGFβ1基因,減少兩種生物活性因子表達,觀察對MHCC97-H細胞及肝癌模型轉移能的影響。
細胞學水平觀察采用transwells法進行,模擬組織的基底膜結構。腫瘤實現轉移突破基底膜是最為關鍵的一步,突破基底膜的能力代表腫瘤的轉移能力。動物模型水平主要是復制高轉移潛能肝癌細胞的肺轉移模型,通過尾靜脈注射經基因干擾前后的MHCC97-H細胞,40 d后觀察肝癌的肺轉移情況。本實驗細胞學實驗結果和動物模型實驗結果均提示經基因干擾的MHCC97-H細胞遷移能力明顯下降,尤其是TGFβ1干擾的MHCC97-H細胞,表明與OPN相比TGFβ1因子更多地參與了肝癌的轉移行為。有研究認為[11-12],TGFβ1過度表達可導致對免疫細胞包括T、B淋巴細胞過度抑制,使機體的免疫監督功能大大降低, 對外來病原體免疫應答、免疫清除能力下降,對腫瘤細胞的清除作用降低,導致腫瘤的發生和轉移。為進一步探究經基因干擾的MHCC97-H細胞轉移潛能變化的生物學機制,本實驗對肝癌轉移中的關鍵生物學分子整合素αvβ3表達情況進行分析,對病理切片預處理后進行熒光成像觀察,結果顯示經基因干擾的實驗組(OPN和TGFβ1基因干擾組)肺臟中轉移性肝癌病理組織整合素αvβ3的表達能力無明顯變化,這可能與整合素αvβ3表達不僅僅在轉移性肝癌中表達,腫瘤組織中血管內皮也有整合素αvβ3表達有關。整合素αvβ3介導了肝癌轉移行為的變化,周建平等[13]研究結果表明整合素αv表達變化,代表了肝癌的肝癌轉移能力的變化。有研究證實[14],TGFβ1因子與整合素αvβ3受體在腫瘤轉移相關信號通路上具有聯系,即整合素與TGFβ受體介導的兩條信號傳導通路不僅共用某些信號分子,而且共同作用于多種生物效應并相互促進。OPN分子結構中含有RGD多肽序列,主要通過與其受體整合素αvβ3和CD44相互作用,參與腫瘤轉移過程[15]。TGFβ1、OPN與整合素αvβ3之間的關系中,主要OPN介導整合素與細胞外基質(ECM)黏附,成為腫瘤轉移的關鍵步驟,而TGFβ1通過上調整合素關聯蛋白激酶(integrin-linked kinase, IKL)的表達而激活蛋白激酶B和TGFβ1提高黏著斑激酶(focal adhesion kinase,FAK)酪氨酸的磷酸化水平,激活下游的信號分子直接或間接地參與整合素與ECM黏附,促進肝癌侵襲和轉移。也有學者認為,OPN通過介導TGFβ1依賴性骨髓間充質干細胞向纖維細胞轉化機制,而促進腫瘤的增殖和轉移[16]。另有學者也進行了TGFβ與MHCC97-H轉移的關系的研究,結果表明,TGFβ家族中TGFβRⅡ的高表達能抑制MHCC97-H 的增殖和遷移侵襲,認為其機制可能與TGFβRⅡ高表達后激活TGFβ信號轉導通路,改變細胞的生長、運動能力有關[17]。因此,本研究中經OPN、TGFβ1基因干擾的MHCC97-H細胞轉移潛能的下降主要與OPN和TGFβ1表達減少有關,而與轉移性肝癌組織整合素αvβ3表達無關。
通過基因干擾方法抑制肝癌細胞或組織的OPN和TGFβ1表達,無論從細胞學水平和動物模型水平,肝癌的轉移能力均有明顯的下降,尤其是TGFβ1基因干擾組下降更加明顯,轉移相關因子整合素αvβ3表達無明顯變化,本研究中經OPN、TGFβ1基因干擾的MHCC97-H細胞轉移潛能的下降主要與OPN和TGFβ1表達減少有關,而與轉移性肝癌組織整合素αvβ3表達無關。
[1]Li Y, Tang Y, Ye L, et al. Establishment of a hepatocellular carcinoma cell line with unique metastatic characteristics through in vivo selection and screening for metastasis related genes through cDNA microarray . J Cancer Res Clin Oncol, 2003, 129(1): 43-51.
[2]李天然,蔡立杰,趙紹宏,等.OPN轉染BMSCs對高轉移潛能肝癌細胞的影響.胃腸病學與肝病學雜志,2015,24(9):1057-1061.
[3]李天然,杜湘珂,宋斌,等.TGFβ1轉染hMSC對MHCC97-H影響的實驗研究.胃腸病學和肝病學雜志,2013,22(7):615-619.
[4]李天然,盧光明,宋斌,等.骨髓間充質干細胞對高低轉移潛能肝癌細胞影響的實驗研究.胃腸病學與肝病學雜志,2014,23(9):1056-1060.
[5]Kang Y. Imaging TGFβ signaling in mouse models of cancer metastasis. Methods Mol Biol, 2016,1344(1):219-232.
[6]Zhao P, Dai M, Chen W, et al.Cancer trends in china. Jpn J Clin Oncol,2010,40(4):281-285.
[7]倪晶,華海清.索拉非尼聯合中藥治療原發性肝癌的研究進展.東南國防醫藥,2015,17(2):175-178.
[8]Li Y, Tang ZY, Ye SL, et al. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol,2001,7(5):630-636.
[9]Ye QH, Qin LX, ForguesM,et al. Predicting hepatitis B virus-positive metastatic hepatocellular carcinomas using gene expression profiling and supervised machine learing. Nat Med, 2003,9(4):416-423.
[10]Budhu A, Wang XW. The role of cytokines in hepatocellular carcinoma. J Leukocyte Biol, 2006, 80(6): 1197-1213.
[11]Li MO, Wan YY, Sanjabi S, et al. Transforming growth factor-beta regulation of immune responses. Annu Rev Immunol,2006, 24: 99-146.
[12]Prasad P, Tiwari AK, Kumar KM, et al. Association of TGFβ1, TNFα, CCR2 and CCR5 gene polymorphisms in type-2 diabetes and renal insufficiency among Asian Indians. BMC Med Genet, 2007, 8:20.
[13]周建平,周偉平.大肝癌TACE后腫瘤組織VEGF、αv整合素表達及MVD變化.東南國防醫藥,2010,12(3):206-208.
[14]Hayashida T, Jones JC, Lee CK, et al. Loss of beta1-integrin enhances TGF-beta1-induced collagen expression in epithelial cells via increased alphavbeta3-integrin and Rac1 activity. J Biol Chem,2010,285(40):30741-30751.
[15]Zhang R, Pan X, Huang Z, et al. Osteopontin enhances the expression and activity of MMP-2 via the SDF-1/CXCR4 axis in hepatocellular carcinoma cell lines. PLoS One,2011,6(8): e23831.
[16]Weber CE, Kothari AN, Wai PY, et al. Osteopontin mediates an MZF1-TGF-β1-dependent transformation of mesenchymal stem cells into cancer-associated fibroblasts in breast cancer. Oncogene,2015,34(9):4821-4833.
[17]于琨,蔣小峰,鄧武堅,等.TGFβRⅡ基因對肝癌細胞MHCC97H 體外增殖和侵襲能力的影響.實用醫學雜志,2015,31(5):719-722.
(本文編輯:張仲書;英文編輯:王建東)
Effect ofsilence of associated metastasis gene on hepatocellular carcinoma metastasis
HUANG Chu-heng1, LI Tian-ran2, HUANG Xiao-bin1,CAILi-jie1,LUGuang-ming3,LIYan-jun3.
1.DepartmentofRadiology,95HospitalofPLA,Putian,Fujian351100,China; 2.DepartmentofRadiology,theFirstAffiliatedHospitalofPLAGeneralHospital,Beijing, 100048,China; 3.DepartmentRadiology,NanjingGeneralHospitalofPLA,Nanjing,Jiangsu210002,China
ObjectiveTo observe the change of metastasis ability of hepatocellular carcinoma by inhibiting OPN, TGFβ1 gene expression of the high metastatic potential of hepatocellular carcinoma cells (MHCC97-H). MethodsOPN and TGFβ1 gene silencing were made in the MHCC97-H cells and qPCR was used to test the expression of MHCC97-H cells. MHCC97-H cells migration experiment used transwells assay. Lung metastasis animal model making method: MHCC97-H cells were injected into the tail vein of nude mice three times every two days, and 0.2 mL cells suspension contained 5 × 106cells, and the lung tissue was observed after 2 weeks. Lung tissue samples: DAPI nuclear stainined for 10 min, glycerol PBS mounted, and observed under fluorescent microscope. Nude mice animal model of integrin αvβ3 expression was detected by immunofluorescence. ResultsOPN and TGFβ-1 expression of MHCC97-H by genes silencing significantly decreased (P<0.05). Compared with the control group, the cells migration of MHCC97-H OPN and TGFβ-1 genes silencing groups significantly decreased (P<0.01). Animal model experiments showed that there were less tumor cells in the lung tissue of the OPN and the TGFβ1 gene silence group compared with the control group. The results of quantitative analysis showed that the IOD value of the blank control group and the negative control group was greater than the two experimental groups, and the difference was statistically significant (P<0.05). Compared with the control group, the IOD of integrin alpha v beta 3 expression in two genes silencing groups wasn’t significantly different. ConclusionFrom the level of cytology and animal model results, there was significant decrease in the metastatic ability of MHCC97-H cell by genes silencing, especially in the TGFβ1 gene si-lencing group. The expression ability of related metastasis factor integrinαvβ3 had no change, and it suggests that integrin αvβ3 mediates the role of OPN and TGFβ1 in HCC metastasis.
HCC, metastasis; OPN; TGFβ1; integrin
國家自然科學基金資助項目(81271607); 南京軍區醫藥衛生重點資助項目(11Z035);國家博士后基金(2015M572810)
1. 351100福建莆田,解放軍95醫院放射科;2. 100048北京,解放軍總醫院第一附屬醫院放射科; 3. 210002江蘇南京,南京總醫院醫學影像科
李天然, E-mail: lizhaoruixin@sina.com
R735.7
A
10.3969/j.issn.1672-271X.2016.03.001
2016-02-20;
2016-04-16)
引用格式:黃楚恒,李天然,黃曉斌,等.轉移相關基因干擾對肝癌轉移潛能的影響.東南國防醫藥,2016,18(3):225-229,236.

