酒曲中高產蛋白酶和α-淀粉酶霉菌菌株的篩選與分子鑒定
王鵬昊,關統偉,鄧奧宇,田 蕾,董 丹,趙小林(.西華大學微生物研究所,四川成都6009;.四川農業大學資源環境學院,四川成都60;.成都蜀之源酒業有限公司,四川成都65)
?
酒曲中高產蛋白酶和α-淀粉酶霉菌菌株的篩選與分子鑒定
王鵬昊1,關統偉1,鄧奧宇1,田蕾2,董丹1,趙小林3
(1.西華大學微生物研究所,四川成都610039;2.四川農業大學資源環境學院,四川成都611130;3.成都蜀之源酒業有限公司,四川成都611335)
摘要:白酒酒曲中的蛋白酶和α-淀粉酶在酒類的糖化發酵過程中起到了重要作用,能夠有效地水解原料,加快發酵速率。對從酒曲中獲得的30株霉菌進行蛋白酶和α-淀粉酶產生菌的篩選,結果表明,產蛋白酶的菌株有15株,占全部測試菌株的50%;產α-淀粉酶的菌株有9株,占全部測試菌株的30%。其中菌株Y27具有最好的蛋白酶活(酶活性為324.72 U/mL)和α-淀粉酶酶活(225.76 U/g干曲)。因此,Y27菌株具有很好的釀酒開發潛力。系統發育分析表明,菌株Y27與Aspergillus oryzae同源性最高,其序列相似性為99.8%。此研究為米曲霉應用于釀酒工業提供了思路。
關鍵詞:酒曲;霉菌;蛋白酶;α-淀粉酶;米曲霉
優先數字出版時間:2016-04-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160425.1628.023.html。
酒曲是微生物的培養物,是白酒生產中的糖化劑、發酵劑、產香劑,有“酒之骨”之稱[1]。釀酒的糖化過程,是酒曲中蛋白酶、α-淀粉酶、纖維素酶和果膠酶的協同作用的結果[2]。其中酒曲中的蛋白酶和α-淀粉酶在釀酒過程中更是起到至關重要的作用。蛋白酶是分解蛋白質肽鍵一類水解酶的總稱。它能有效水解原料中的蛋白質,破壞原料顆粒間質細胞壁的結構,使原料中可利用的碳源增加;同時由于蛋白質的水解作用,提高了發酵料中氨基態氮的含量,促進酵母生長繁殖,加快發酵速率。α-淀粉酶能迅速水解α-1,4葡萄糖苷鍵,將龐大的淀粉分子斷裂成較小分子,使淀粉漿黏度急速降低,生成糊精及少量麥芽糖和低聚糖進入下一步的發酵過程中。所以在白酒生產過程中不能忽視蛋白酶與α-淀粉酶的作用,從酒曲中選育出高產蛋白酶和α-淀粉酶的功能優質霉菌應用于釀酒工業,將極大改善酒曲性能,提高酒的質量和產率,縮短生產周期,降低生產成本,還可將功能菌應用于相關領域,造福人類社會[3-7]。因此,本研究是通過實驗對酒曲中的真菌菌株進行分離、篩選與鑒定,希望從中得到產酶活力高的優良菌株,為白酒生產提供新的材料。
1材料與方法
1.1材料與試劑
1.1.1菌株
從四川瀘州、宜賓、邛崍、大邑等地酒廠的酒曲中分離純化了30株霉菌,分別編號為Y1—Y30,用于蛋白酶和α-淀粉酶的篩選。
Aspergillus oryzae蘇- 16、Aspergillus oryzae IFO 30113菌株由成都蜀之源酒業有限公司提供。
1.1.2主要培養基[8]
查氏培養基:蔗糖30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO41 g,瓊脂15 g,蒸餾水1000mL,pH6.0~6.5。
酪蛋白培養基:酪蛋白15 g,Na2HPO42 g,NaCl 5 g,瓊脂15 g。
發酵培養基:麥麩∶水=1∶1(質量比),自然pH值。
淀粉瓊脂培養基:蛋白10 g,NaCl 5 g,牛肉膏5 g,可溶性淀粉2 g,瓊脂15 g,蒸餾水1000mL,pH4.0。
固態產酶培養基:麩皮8 g,豆餅粉2 g,MgCl20.1%,水10mL。
1.1.3主要試劑與試劑盒
0.4mol/L三氯乙酸:稱取三氯乙酸65.4 g,用水溶解定容至1000mL。
0.5mol/L NaOH溶液:按GB601配制。
1mol/L HCl:取90mL濃鹽酸溶解于去離子水中,定容至1000mL。
0.1mol/L HCl:取9mL濃鹽酸溶解于去離子水中,定容至1000mL。
磷酸緩沖液:稱取磷酸氫二鈉(Na2HPO4·12H2O)6.02 g和磷酸二氫鈉(NaH2PO4·12H2O)0.5 g,加水溶解并定容至1000mL。
10 g/L酪素溶液:稱取酪素1.000 g,精確至0.001 g。用少量0.5mol/L氫氧化鈉溶液濕潤后,加入緩沖溶液約80mL。邊加熱邊攪拌,直到完全溶解。冷卻后,轉入100mL容量瓶中。用適宜的pH值緩沖溶液稀釋至刻度。此溶液在冰箱內貯存,有效期為3d。
100μg/mL L-酪氨酸標準溶液:稱取L-酪氨酸0.1000 g。用60 mL1mol/L鹽酸定容。吸取1 mg/mL酪氨酸標準溶液10.00mL,用0.1mol/L鹽酸定容到100mL。此溶液在冰箱內貯存或立即使用。
1.2實驗方法
1.2.1產蛋白酶菌株的篩選
初篩:采用酪蛋白平板水解透明圈法,將分離純化后的菌株點種于酪蛋白培養基平板,于恒溫箱內培養48h,挑取產生水解透明圈的菌落,測定L值(L值=透明圈直徑/菌落直徑)后,4℃保存備用。
復篩:經初篩得到產生透明圈的菌株,吸取1mL孢子懸液(108個/mL)接種于發酵培養基中,攪拌均勻,自然pH值,于30℃的培養箱中培養72h后測定蛋白酶活力。
酶活力測定:取待測酶液。40℃恒溫水浴2min,加入酪素2mL(搖勻),40℃恒溫水浴10min,然后加入三氯乙酸4mL(搖勻),離心取上清液,測OD275nm值。同時作空白對照。對酶活力的規定:溫度在40℃時,1mL酶液1min水解酪蛋白產生1 μg酪氨酸量,將此定義為1個蛋白酶活力單位。
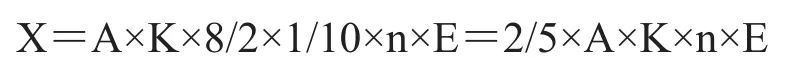
式中:X——樣品的酶活力(U/mL);
A——試樣溶液的平均吸光度;
K——吸光常數;
8——反應試劑的總體積(mL);
2——吸取酶液2.00mL;
1/10——反應時間10min,以1min計;
n——稀釋倍數;
E——中性蛋白酶系數為0.50。
1.2.2 α-淀粉酶產生菌株的篩選
初篩:把菌株接種到已滅菌的淀粉瓊脂培養基上,30℃靜置培養2~3d后,轉接入裝有25mL該培養基的液體三角瓶中,以30℃、150r/min搖床培養24h。取1mL培養液用無菌水梯度稀釋,各取0.15mL菌懸液分別涂布于平板分離培養基,30℃培養3d,在平板上噴灑碘液,將有透明圈的單菌落挑出,進一步劃線分離后,挑至斜面保藏培養基上,30℃培養3d,于4℃下保存。
復篩:取1環初篩菌種接入種子培養基,于30℃、150r/min搖床培養24h。取1mL接入固態產酶培養基,于30℃恒溫培養72h后測定α-淀粉酶酶活,并于4℃下保存活性最佳的菌種。
酶活的測定方法:取底物5mL在40℃水浴預熱10min,加入0.5mL酶液,準確保溫5min,取0.5mL混合液加入5mL0.1mol/L的H2SO4終止反應,從中取0.5mL加入5mL稀碘液顯色,在660nm處測定吸光值。以0.5mL緩沖液代替0.5mL的酶液為對照,以蒸餾水作為比色的空白。
酶活力(U/g)=(R0-R)×1000×10/[R0×T×V×(1-β)]
式中:R0、R代表對照和反應液的光密度;m為底物中含淀粉的質量;T為反應時間;V為酶液的體積;β為含水率。
1.2.3菌株產酶酶活穩定性研究
α-淀粉酶和蛋白酶的耐酸性研究:配制不同pH值的可溶性淀粉溶液,40℃下分別測定酶活性考察酶的耐酸性。所用的緩沖體系:磷酸氫二鈉-檸檬酸緩沖液(pH2.2~8.0)、甘氨酸-氫氧化鈉緩沖液(pH9.0~10.0)。
α-淀粉酶和蛋白酶的耐高溫性研究:酶在不同溫度下的失活速率不同,隨溫度的升高,失活速率加快。本實驗在適宜的pH值條件下分別在不同溫度下(30~60℃)測定酶活性,考察酶的耐高溫性。
1.2.4菌株的分子鑒定
(1)霉菌DNA的提取與聚合酶鏈反應(PCR)擴增采用真菌試劑盒提取菌株DNA基因組,按照試劑盒說明書操作。真菌試劑盒購自上海生物工程公司。
根據真菌18S rDNA保守區設計引物,上游引物PA:(5'- GTAGTCATATGCTTGTCTC- 3')和下游引物PB:(5'-TCCGCAGGTTCACCTACGGA-3'),由上海生物工程公司合成。
PCR擴增的反應體系(15μL):樣品DNA 0.6μL、上游引物0.6μL、下游引物0.6μL、2×Master Mix Taq酶7.5μL,無菌重蒸水補足至15μL。采用真菌常規的PCR反應程序進行。
(2)系統發育分析[9]
送上海生物工程公司進行序列測定,然后用BLAST程序將所測的序列與NCBI GenBank數據庫進行同源性分析;選擇相應參比菌株序列,采用MEGA 6.0軟件及Tamura K等的方法構建系統發育樹[10]。
1.2.5菌株與Aspergillus oryzae蘇-16、Aspergillus oryzae IFO 30113菌株性能比較
米曲的制備:取優質大米淘米2min,浸泡15h,使其含水量在28%~32%。蒸米45min,蒸熟后保持含水量在44%左右。將蒸熟的米滅菌30min,放入無菌室冷卻至31℃,然后按照千分之二的質量比接入菌株孢子懸浮液。將接種后的米曲放入培養箱中進行培養,當曲溫升至42℃時,調節培養箱溫度,使其維持在42℃左右。培養48h后取出烘干備用。該米曲的水分的測定采用烘干法;糖化力的測定采用DNS比色法,即糖化力以1 g絕干曲在pH4.6的條件下,50℃作用1h能糖化可溶解性淀粉的毫克數表示。液化力的測定采用碘反應法,即液化力以1 g絕干曲在pH4.6的條件下,35℃作用1h能液化可溶解性淀粉的克數表示。酸性蛋白酶測定采用福林法,酸性蛋白酶酶活即在40℃條件下每分鐘水解干酪素產生1 μg酪氨酸定義為一個蛋白酶活力單位。
2結果與分析
2.1產蛋白酶菌株的篩選結果
2.1.1初篩
從30株霉菌中初篩得到產生酪蛋白水解圈菌株共15株,占全部測試菌株的50%。初步測定其L值(見表1),數據顯示,其中菌株Y27的L值最大,為3.01。
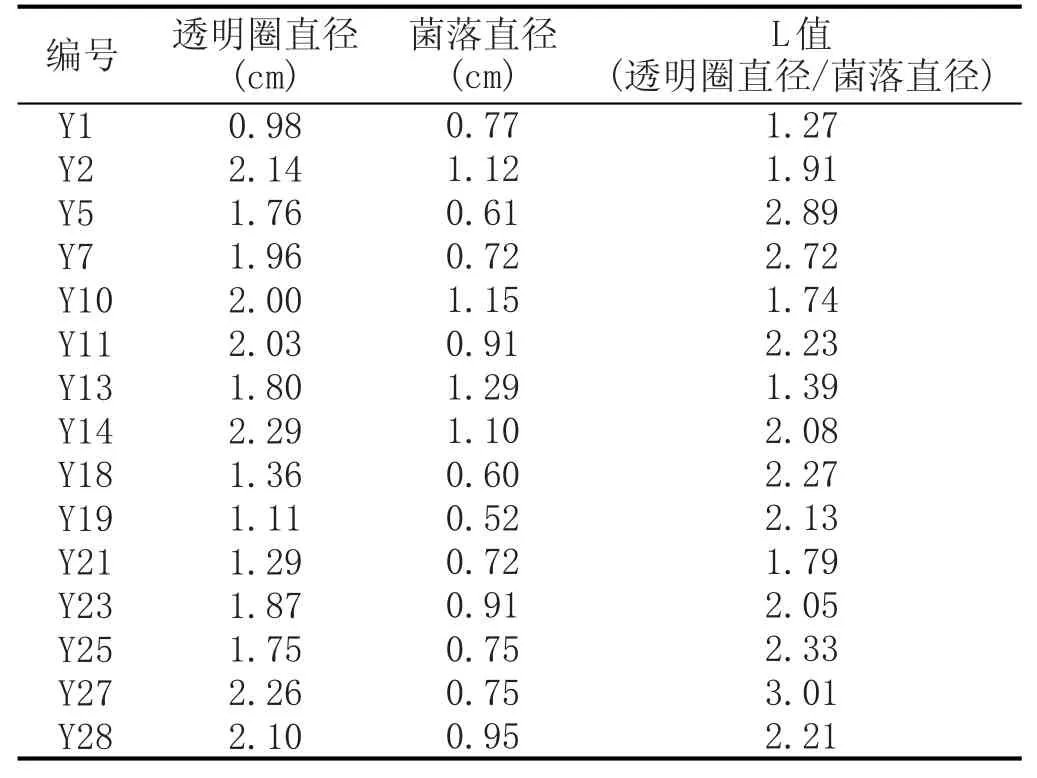
表1產蛋白酶菌株初篩
2.1.2復篩及酶活測定
將挑選出L值較大的5株菌,發酵培養后測定其蛋白酶活性(見表2),5株菌中,L值和酶活都較大的菌株是Y27,分離至濃香型白酒酒曲,其L值為3.01,蛋白酶活是324.72 U/mL。
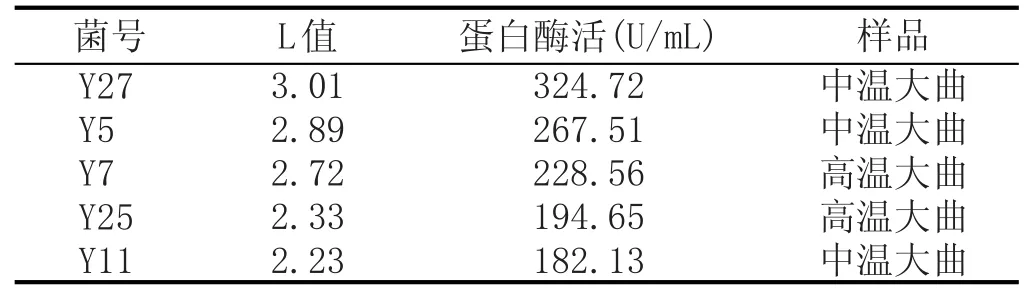
表2菌株的復篩
2.2α-淀粉酶產生菌株的篩選
經產淀粉酶實驗發現,共有9株菌產α-淀粉酶,占測試菌株的30%。進一步復篩發現,Y8、Y20和Y27產α-淀粉酶活力較好,其中Y27菌株產酶較高,酶活達到225.76 U/g,其中酶活較低的是Y30菌株,酶活為67.9 U/g,結果見表3。
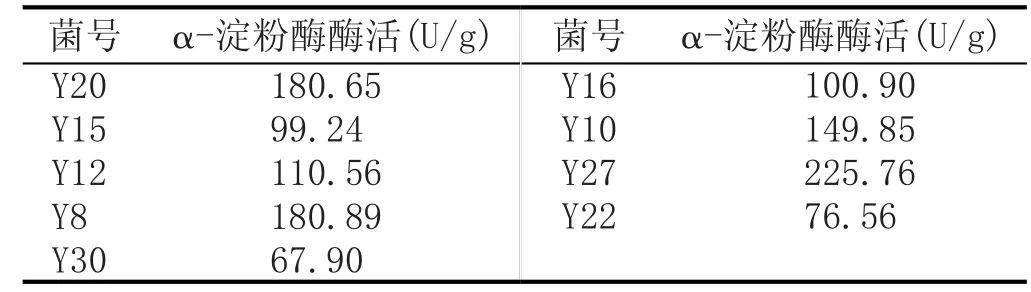
表3 α-淀粉酶活性測定結果
綜合比較供試菌株的產酶能力,則蛋白酶和α-淀粉酶活性最高的是菌株Y27。為了確認該菌株是否適合用于酒曲的制備和是否適合酒精發酵,Y27菌株的耐酸性、耐高溫性研究被進一步實施。
2.3Y27菌株產酶酶活穩定性研究
調節培養基pH值為2.0~9.0,考察蛋白酶和α-淀粉酶的相對活性,結果見圖1。
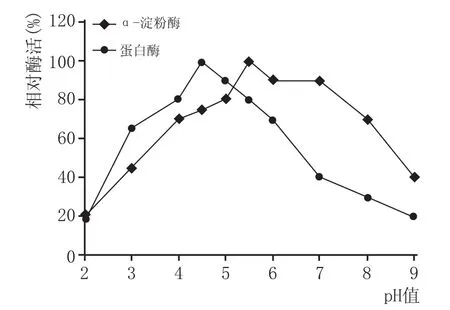
圖1酶的耐酸性
圖1表明,α-淀粉酶在pH值為4.0~8.0時可以保持較高的酶活力,其中最高酶活力在pH值為5.5,當pH值為4.0時,該酶仍然具有最高活性的70%;當pH值為3.0時,α-淀粉酶仍然具有最高活性的45%;說明α-淀粉酶具有一定的耐酸性。對于蛋白酶而言,在pH值為3.0~6.0時保持較好的酶活力,其中pH值調至4.5時,活性達到最大;而當pH值超過7.0時,蛋白酶相對活性迅速下降至40%左右。表明蛋白酶在酸性條件下酶活穩定,能夠發揮良好的酶解作用。
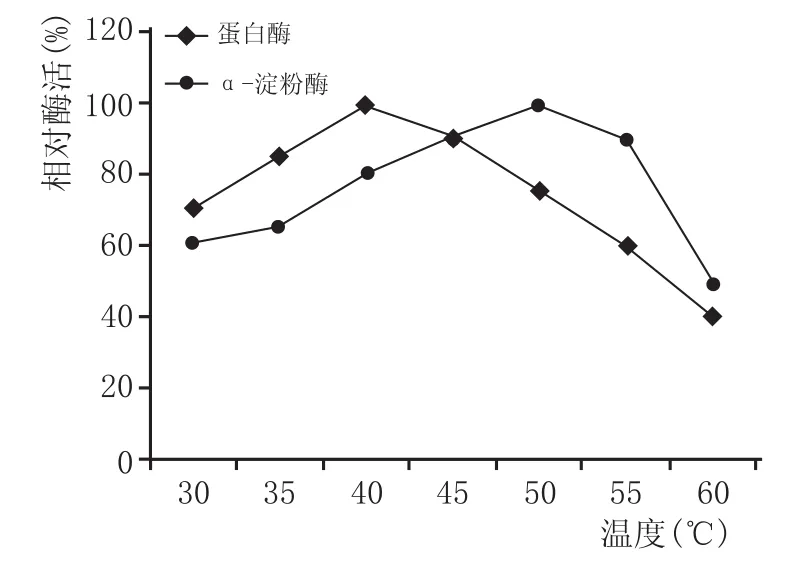
圖2酶的耐高溫性
在調節培養基pH值至最佳的基礎上考察酶的耐高溫性,結果(圖2)表明,當溫度控制在30~50℃時,蛋白酶可以保持較高的酶活性,其中在40℃時蛋白酶活性最高;當溫度升高至50℃時,蛋白酶活性仍為最高值的72%左右,當溫度升高至55℃時,蛋白酶活性才降為最高值的60%左右。對于淀粉酶而言,當溫度達到50℃時,α-淀粉酶活性最高;在30℃時仍可以維持60%的酶活力,當溫度升高至60℃時,α-淀粉酶活性才下降明顯。從圖2可以知道,菌株Y27產出的這2種酶對溫度和酸度都有一定的耐受性,表現出較好的適應能力,適合白酒的釀造生產。
2.4Y27菌株的鑒定
經過序列的Blast比對顯示,菌株Y27屬于曲霉屬的一個種。利用MEGA6.0軟件構建系統發育樹(圖3),其與Aspergillus oryzae RIB40序列相似性最高,達到了99.8%,結合形態特征,我們確定Y27菌株為米曲霉Aspergillus oryzae RIB40。
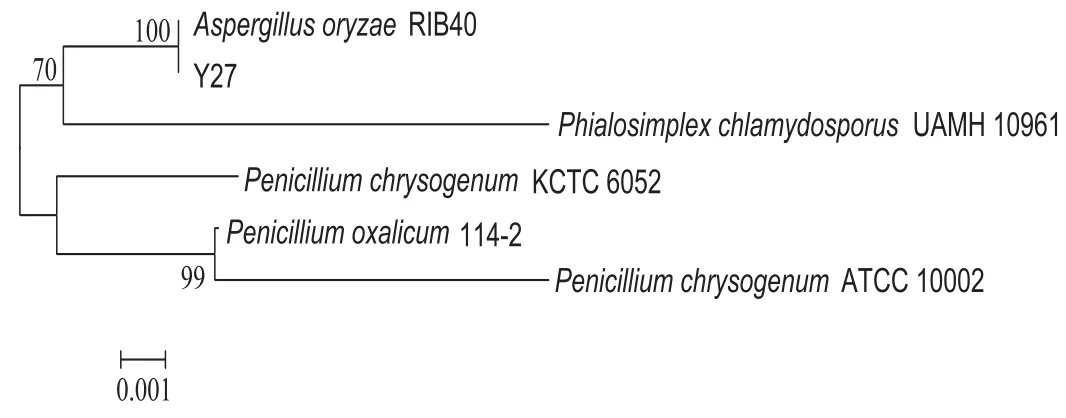
圖3系統發育樹
2.5不同菌株酶系狀況比較分析
Aspergillus oryzae蘇-16是從自然培養麥曲中篩選出的優良菌株,用該菌種制成的麥曲來釀造黃酒,有原有黃酒的風味特色,因而黃酒行業普遍使用。Aspergillus oryzae IFO 30113菌株是日本清酒釀造中的常用菌種,將Y27菌株與二者性能比較,可以對Y27菌株的應用作進一步分析判斷。
采用不同菌株接種的米曲,其比較結果見表4。
由表4可知,接種Y27菌株孢子懸浮液的米曲其糖化力為1267 mg/g·h,其液化力為2.41 g/g·h,均比Aspergillus oryzae蘇-16、Aspergillus oryzae IFO 30113菌株略高,說明Y27菌株對淀粉的利用能力比Aspergillus oryza 蘇-16、Aspergillus oryzae IFO 30113菌株更強,適合白酒的釀造生產;其酸性蛋白酶活力(210 U/g)也比Aspergillus oryzae蘇-16(185 U/g)、Aspergillus oryzae IFO 30113(194 U/g)較高,因此具有很好的開發應用前景。
3 結論
蛋白酶和α-淀粉酶在酒類的糖化發酵過程中起著重要作用,為此對從白酒酒曲中獲得的30株霉菌進行篩選,獲得1株高產蛋白酶和淀粉酶且酶活性能穩定的菌株Y27。通過18S rDNA系統發育分析顯示,Y27與米曲霉(Aspergillus oryzae)在進化關系上同源性最高,達到了

表4不同菌株酶系狀況比較分析
99.8%。據統計,至今為止,還沒有關于米曲霉釀酒的相關報道,但菌株Y27具備的酶活高且在酸性和高溫條件下的穩定為工業化生產新型白酒提供了獨特的發酵菌種資源。這些優質的菌株有望提高酒的質量和產率,縮短生產周期,降低生產成本。因此,Y27也是一株具有巨大開發潛力的工業菌株,其應用前景廣闊。本研究為米曲霉在釀酒行業的應用提供了借鑒,為米曲霉在白酒制曲生產中的應用奠定了理論基礎。
參考文獻:
[1]傅金泉.中國酒曲技術的發展與展望[J].釀酒,2002,29(2):7-9.
[2]徐穎宣,徐爾尼,馮乃憲,等.微生物混菌發酵應用研究進展[J].中國釀造,2008(9):1-4.
[3]范光先,王和玉,崔同弼,等.茅臺酒生產過程中的微生物研究進展[J].釀酒科技,2006(10):75-77.
[4]吳衍庸.白酒工業微生物資源的發掘與應用[J].釀酒科技,2006(11):111-113.
[5]蒲嵐,李璐,謝善慈,等.濃香型白酒窖池中糟醅微生物的變化趨勢研究[J].釀酒科技,2011(1):17-19.
[6]孫劍秋,劉雯雯,臧威,等.醬香型白酒酒醅中霉菌群落組成與功能酶活性[J].中國食品學報,2013(8):239-247.
[7]張建敏,黃永光,周文美,等.傳統白酒固態發酵過程中放線菌的研究進展[J].釀酒科技,2013(10):73-79.
[8]無錫輕工業大學.微生物學[M].北京:中國輕工業出版社,2002.
[9]李德林,張宿義,毛振宇,等.PCR-DGG對濃香型白酒糟醅微生物群落結構解析[J].釀酒科技,2014(3):25-31.
[10]Tamura K,Stecher G,Peterson D,et al.MEGA6: molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30:2725-2729.
Screening and Molecular Identification of Fungal Strains with High-Yield of Protease and α-Amylase
WANG Penghao1,GUAN Tongwei1,DENGAoyu1,TIAN Lei2,DONG Dan1and ZHAO Xiaolin3
(1.Research Institute of Microbiology,Xihua University,Chengdu,Sichuan 610039;2.College of Resources and Environment,Sichuan Agricultural University,Chengdu,Sichuan 611130;3.Shuzhiyuan Distillery Co.Ltd.,Chengdu,Sichuan 611335,China)
Abstract:Protease and α-amylase in liquor starter play important roles in the process of saccharification and fermentation.They could effectively hydrolyze raw materials and accelerate fermenting rate.In this study,30 mold strains isolated from starter underwent protease-producing &α-amylase-producing screening.The results suggested that,there were 15 protease-producing strains,50%of total strains;and there were 9 α-amylase-producing strains,30%of the tested strains.Among them,strain Y27 had the best protease activity(up to 324.72 U/mL)and α-amylase activity(up to 225.76 U/g dry yeast).Therefore,strain Y27 had good development potentials.Phylogenetic analysis showed that strain Y27 and Aspergillus oryzae had the highest homology with their sequence similarity as 99.8%.This study provided new thoughts for the application of Aspergillus oryzae in liquor-making industry.
Key words:starter;mold;protease;α-amylase;Aspergillus oryzae
中圖分類號:TS261.1;Q93-3;TS262.3
文獻標識碼:A
文章編號:1001-9286(2016)06-0061-04
DOI:10.13746/j.njkj.2015405
基金項目:教育部春暉計劃項目(No.Z2012022);西華大學重點科研基金項目(No.Z1220530);食品生物技術四川省高校重點實驗室項目(No.Szjj2013-045)和四川省教育廳基金項目(No.13205688)。
收稿日期:2015-10-16修回日期:2016-01-18
通訊作者:關統偉,男,副教授,博士,碩士生導師,研究方向為微生物系統學與食品發酵工程。

