胰腺癌MiaPaCa-2細胞與樹突細胞融合誘導腫瘤抗原特異性細胞毒T淋巴細胞能力的體外研究
楊金光 陳江 李宏宇 郭曉鐘
?
·論著·
胰腺癌MiaPaCa-2細胞與樹突細胞融合誘導腫瘤抗原特異性細胞毒T淋巴細胞能力的體外研究
楊金光陳江李宏宇郭曉鐘
067000河北承德,承德市第三醫院藥劑科(楊金光);中國人民解放軍沈陽軍區總醫院消化科(楊金光、陳江、李宏宇、郭曉鐘)
【摘要】目的建立胰腺癌MiaPaCa-2細胞與樹突細胞(DC)融合的細胞,觀察其體外誘導胰腺癌腫瘤抗原特異性細胞毒T淋巴細胞(CTL)的能力。方法自胰腺癌患者外周血單核細胞中分離和培養DC,利用50% PEG-10% DMSO融合劑將MiaPaCa-2細胞融合到DC,以不加融合劑僅將DC與MiaPaCa-2共培養組及單純DC組作為對照。采用FITC-CD86及PE-MUC1進行雙標記,上流式細胞儀檢測細胞融合率;MTT法檢測各組DC存活率。按照DC與T淋巴細胞1∶10、1∶20、1∶40、1∶80的比例混合培養細胞,評價各組DC體外刺激自體T淋巴細胞的增殖能力;ELISA法檢測各組DC體外激發的CTL的IL-2、IL-10、Granzyme B、IFN-γ分泌量。結果DC與MiaPaCa-2融合細胞組的融合率為(42.30±7.30)%,明顯高于共培養組的(7.21±1.06)%。DC組、共培養組、融合細胞組DC的存活率分別為95.0%以上、85.0%、62.8%,融合細胞組DC存活率顯著低于DC組及共培養組,差異有統計學意義(P值均<0.05)。DC∶T淋巴細胞為1∶10時,DC組、共培養組、融合細胞組DC刺激自體T細胞增殖指數分別為219±42、3 584±317、8 201±424,1∶20時分別為110±14、2 179±104、6 152±104,融合細胞組顯著高于DC組及共培養組,差異均有統計學意義(P值均<0.05);為1∶40、1∶80 時3組細胞的T細胞增殖指數差異無統計學意義(P值均>0.05)。DC∶T淋巴細胞為1∶10時,DC組、共培養組、融合細胞組DC激發的CTL的IL-2分泌量分別為(27.30±5.21)、(897.44±93.05)、(2243.80±381.46)ng/L;IL-10分泌量分別為(19.55±2.05)、(424.60±108.25)、(706.53±161.29)ng/L;Granzyme B分泌量為(16.23±1.23)、(451.07±120.50)、(1327.77±205.15)ng/L;IFN-γ分泌量為(30.11±4.32)、(982.00±124.68)、(2421.04±488.50)ng/L。融合細胞組激發的CTL的細胞因子分泌量顯著高于DC組及共培養組,差異均有統計學意義(P值均<0.05)。結論DC與MiaPaCa-2融合的細胞具備體外誘導胰腺癌腫瘤抗原特異性CTL的能力。
【關鍵詞】胰腺腫瘤;樹突細胞;細胞融合;T淋巴細胞,細胞毒性
Fund program:National Natural Science Foundation of China(81071982)
胰腺癌是一種常見的消化道惡性腫瘤,多數病例在發現時已屬晚期,手術治療及放、化療作用有限,患者預后極差,臨床迫切需要探索新的有效治療手段[1-2]。樹突細胞(dendritic cell, DC)腫瘤疫苗可主動免疫抗腫瘤,已成為腫瘤免疫治療的研究熱點之一[3]。本研究將人胰腺癌MiaPaCa-2細胞與DC相融合,觀察其體外誘導腫瘤抗原特異性細胞毒性T淋巴細胞(cytotoxic T lymphocytes,CTL)的能力,為今后DC-胰腺癌腫瘤細胞融合疫苗的構建開發奠定前期實驗基礎。
材料與方法
一、材料及試劑
篩選2013年4月至2015年3月期間沈陽軍區總醫院消化科收治的6例HLA-A2+晚期胰腺癌患者,其中男性3例,女性3例,年齡39~70歲,平均55歲。所有患者均經組織病理學檢查(剖腹探查活檢5例,細針穿刺活檢1例)證實為胰腺癌。入選前未經放、化療及免疫治療。所有患者均簽署知情同意書,并經醫院倫理委員會批準,批準號為201200165。
RPMI 1640、小牛血清購自Hyclone公司,rhGM-CSF、rhIL-4、TNF-α購自PeproTec公司,鼠抗人CD40、HLA-DR、CD83和CD86單抗購自Santa-Cruz公司,兔抗人MUC1多抗購自DPC-Biermann公司,Trizol、 MTT、50% PEG-10% DMSO、Ficoll淋巴細胞分離液購自Sigma公司,3H標記甲基胸腺嘧啶由中科院原子能所提供,IL-2、IL-10、Granzyme B、IFN-γ細胞因子檢測試劑盒購自BD公司。
二、DC分離、培養和鑒定
參照文獻[4]方法,通過Ficoll密度梯度離心法分離來自胰腺癌患者100 ml外周血中的單核細胞,培養1 h后,取出未貼壁的細胞另行培養備用,貼壁細胞繼續培養20 h,更換新鮮培養液后加入rhGM-CSF(800 IU/ml)和rhIL-4(500 IU/ml),37℃、5% CO2培養箱中繼續培養5 d,加入TNF-α (10 ng/ml)培養至7 d,收集成熟DC。使用倒置顯微鏡和電鏡連續觀察體外培養5~10 d DC的形態學變化。用流式細胞儀分析DC的特征性標志CD40、CD83、CD86以及MHC類分子HLA-DR等的表達水平。
三、胰腺癌MiaPaCa-2細胞系與DC融合
因人胰腺癌細胞株MiaPaCa-2(沈陽軍區總醫院消化科實驗室保存)連續傳代培養20代后仍穩定表達MUC1蛋白[5],故選擇MiaPaCa-2細胞進行融合。MiaPaCa-2細胞接種于含10%小牛血清的RPMI 1640培養液,置37℃、5% CO2的培養箱中培養。取對數生長期細胞,用25 μg/ml絲裂霉素處理30 min去增殖后,與培養5 d的DC以3∶1混合,離心盡量吸盡上清,置37℃水浴,滴加預熱的50% PEG-10% DM融合劑0.8 ml,作用2 min后加入1 ml血清終止反應。設不加融合劑的MiaPaCa-2與DC共培養組及單純DC組作為對照。細胞分別培養24、48、72、96 h,嚴格按說明書操作。收集各組培養細胞,采用FITC-CD86及PE-MUC1進行雙標記,按說明書操作。上流式細胞儀檢測細胞融合率,融合率(%)=(融合組雙標率-共培養組雙標率)×100%。同時使用MTT法檢測各組DC的存活率。
四、MiaPaCa-2與DC融合細胞體外刺激自體T淋巴細胞增殖
分別收集DC組、共培養組、融合細胞組的DC,調節細胞濃度為1×105/ml作為刺激細胞,取上述患者自體外周血單核細胞培養1 h的懸浮T淋巴細胞,調節細胞濃度為1×106/ml作為反應細胞,按照刺激與效應細胞1∶10、1∶20、1∶40、1∶80比例加入到96孔板中,終體積200 μl,以RPMI-1640培養液替代效應細胞作為對照組,每組設4個復孔,置37℃、5% CO2培養箱中培養5 d,在收獲細胞前18 h加入3H-TdR,每孔1μCi。使用液閃爍儀檢測各孔每分鐘脈沖數(CPM)。
五、MiaPaCa-2與DC融合細胞體外激發抗原特異性CTL釋放細胞因子
分別以3組中的DC為刺激細胞,以患者自體T淋巴細胞為效應細胞,兩種細胞按1∶10比例混合反應14 d,應用ELISA法檢測細胞培養上清中IL-2、IL-10、Granzyme B和IFN-γ含量,按試劑盒說明書操作。細胞培養上清用試劑盒中樣本稀釋液稀釋50倍,每個樣本設2個復孔,取平均值。
六、統計學處理
結果
一、DC的分離、培養和鑒定
經體外分離、培養,DC數量達初始數量的10~15倍。鏡下見胞體向四周伸出大量樹枝狀或裙褶狀不規則突起,部分突起末端呈球狀膨大(圖1)。未成熟DC的表面標志物CD40、HLA-DR、CD83、CD86陽性細胞數分別為總細胞數的9.12%、11.05%、29.84%、11.50%;成熟DC分別為35.20%、49.07%、74.02%、86.73%,成熟DC表面標志物的表達均顯著高于未成熟DC,差異有統計學意義(t值分別為6.50、2.94、2.09、4.51,P值均<0.05)。
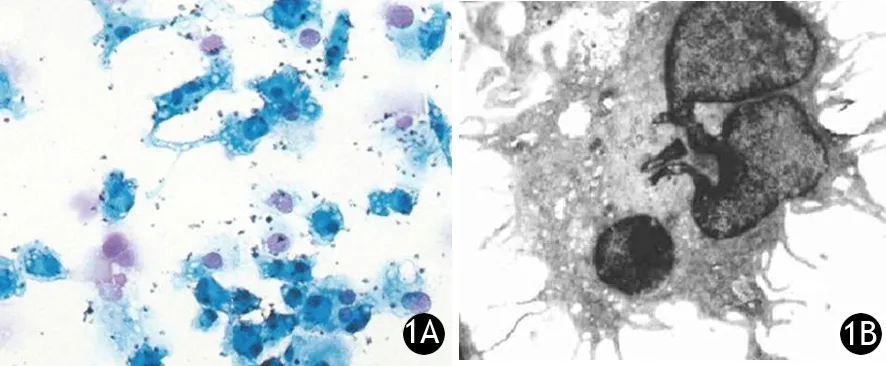
圖1 胰腺癌患者外周血培養5 d(1A)及7 d(1B)的DC形態改變(1A.吉姆薩染色 ×200;1B.透射電鏡 4 μm)
二、DC與MiaPaCa-2融合細胞的鑒定及融合率
經50%PEG-10% DMSO融合劑誘導融合后,部分DC與MiaPaCa-2細胞先發生細胞膜融合,形成雙核的巨大細胞,而后細胞核逐漸發生融合,形成DC與MiaPaCa-2的融合細胞(DC-MiaPaCa-2)。
MiaPaCa-2為MUC1陽性細胞,不表達CD86抗原;而DC為CD86陽性細胞,不表達或低表達MUC1抗原。經FITC-CD86及PE-MUC1雙標記,融合細胞組CD86及MUC1雙陽性的DC為(42.30±7.30)%,共培養組為(7.21±1.06)%,DC-MiaPaCa-2融合率為(35.09±6.24)%(圖2)。
三、DC組、共培養組、融合細胞組的DC存活率
DC組中DC的存活率在95.0%以上;共培養組中DC存活率穩定在85.0%左右;融合細胞組中DC存活率呈時間依賴性顯著下降,最低至62.8%(圖3)。融合細胞組DC存活率顯著低于共培養組,差異有統計學意義(t=8.78,P<0.05)。
四、DC組、共培養組、融合細胞組DC體外刺激自體T淋巴細胞的增殖
DC∶T淋巴細胞為1∶10時,DC組、共培養組、融合細胞組DC刺激自體T細胞增殖指數分別為219±42、3 584±317、8 201±424;為1∶20時,3組的T細胞增殖指數分別為110±14、2 179±104、6 152±104。融合細胞組的T細胞增殖指數顯著高于共培養組,差異均有統計學意義(t值分別為12.55、10.39,P值均<0.05)。而DC∶T淋巴細胞為1∶40、1∶80 時,3組細胞的T細胞增殖指數差異無統計學意義(P值均>0.05)。
五、DC組、共培養組、融合細胞組DC體外激發抗原特異性CTL的細胞因子分泌量
DC∶T淋巴細胞為1∶10時,DC組、共培養組、融合細胞組DC激發的CTL的IL-2分泌量分別為(27.30±5.21)、(897.44±93.05)、(2243.80±381.46)ng/L;IL-10分泌量分別為(19.55±2.05)、(424.60±108.25)、(706.53±161.29)ng/L;Granzyme B分泌量為(16.23±1.23)、(451.07±120.50)、(1327.77±205.15)ng/L;IFN-γ分泌量為(30.11±4.32)、(982.00±124.68)、(2421.04±488.50)ng/L。融合細胞組DC激發的CTL的細胞因子分泌量顯著高于共培養組,差異均有統計學意義(t值分別為15.20、8.78、10.67、20.31,P值均<0.05)。
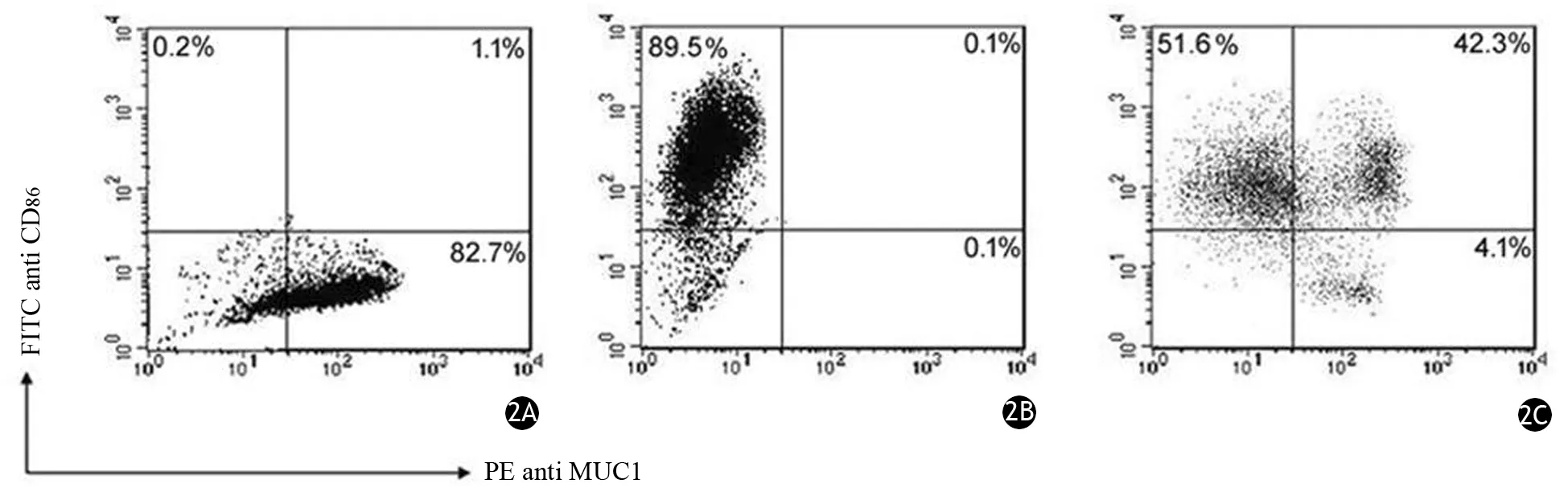
圖2 MiaPaCa-2細胞(2A)、DC(2B)、DC-MiaPaCa-2(2C)的CD86、MUC1表達
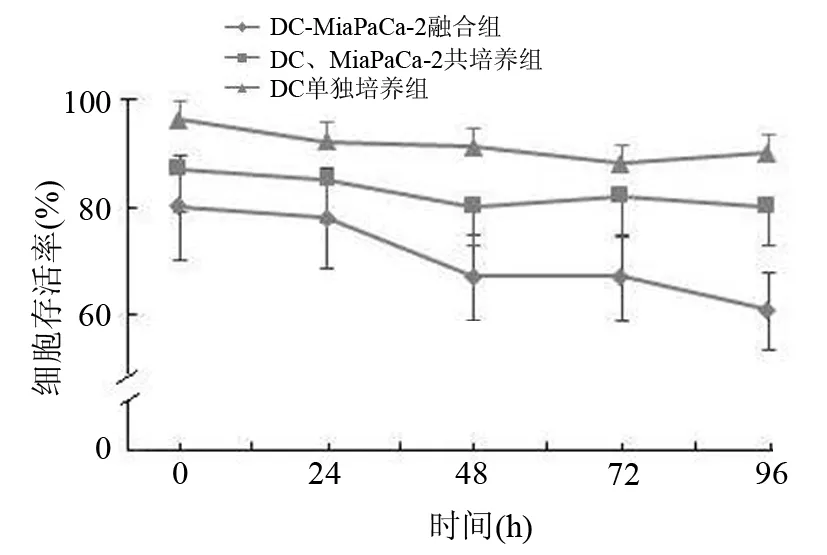
圖3 DC組、共培養組、融合細胞組DC存活率
討論
DC腫瘤疫苗的實質是以特異性T細胞為基礎的細胞免疫,有關胰腺癌DC疫苗構建在于選取適合的腫瘤相關抗原和采用適當的抗原負載方法。
盡管已有大量研究報道惡性細胞高表達的腫瘤相關抗原,但其中少有易受T細胞影響的靶點[6]。MUC1是一種高糖基化I型糖蛋白,其蛋白分子較易被免疫細胞所呈遞和識別[7]。同時,MUC1的表達具有高度的腫瘤特異性,在胰腺癌細胞中的陽性表達率達90%以上,是胰腺癌免疫治療的一個重要靶點[8]。
DC-腫瘤細胞融合疫苗與其他形式的腫瘤抗原負載DC相比具有明顯的優勢:(1)DC-腫瘤融合細胞能表達整個腫瘤細胞抗原決定簇,因而能誘導產生多克隆的CTL反應;(2)DC-腫瘤融合細胞既表達腫瘤抗原,又表達包括MHC、共刺激信號分子在內的DC表面抗原,使細胞介導的抗腫瘤免疫應答大大增強[9];(3)DC-腫瘤融合疫苗能夠將已知和未知的腫瘤相關抗原加工后呈遞給T淋巴細胞,發揮最佳的抗腫瘤免疫作用;(4)DC-腫瘤細胞融合后其抗原呈遞作用持久[10],可誘導出更強的免疫應答反應。
本研究采用胰腺癌患者外周血單核細胞來源的DC作為載體,利用50%PEG-10% DMSO 誘導DC融合技術[3]將MiaPaCa-2細胞融合到DC,融合效率達到40%以上,遠高于單純DC組、MiaPaCa-2細胞與DC共培養組,顯示此方法是有效的。但DC與胰腺癌MiaPaCa-2細胞融合后細胞存活率較DC組、共培養組顯著下降,這與融合劑對DC的毒性蓄積和細胞膜的破壞作用有關。
DC與MiaPaCa-2細胞融合后對自體T細胞的增殖刺激能力顯著高于DC組、共培養組,體外激發抗原特異性CTL的IL-2、IL-10、Granzyme B和IFN-γ等細胞因子分泌量也較DC組、共培養組顯著增加,提示隨著負載抗原效率的增加,DC可增強對腫瘤細胞特異性的殺傷效應,與Van Tendeloo等[11]的研究結果類似,為今后胰腺癌腫瘤細胞與DC融合疫苗的構建開發奠定了部分前期實驗基礎。
參考文獻
[1]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63:11-30.DOI:10.3322/caac.21166.
[2]楊尹默.胰腺癌外科治療的熱點與難點[J].中華消化外科雜志,2015,14(8):612-614.DOI:10.3760/cma.j.issn.1673-9752.2015.08.004.
[3]Matsumoto S, Saito H, Tsujitani S, et al. Allogeneic gastric cancer cell-dendritic cell hyrids induce tumor antigen (carcinoembryonic antigen) specific CD8+ T cells[J]. Cancer Immunol Immunother, 2006, 55(2):131-139.DOI:10.1007/s00262-005-0684-3.
[4]Zeis M, Siegel S, Wagner A, et al. Generation of cytotoxic responses in mice and human individuals against hematological malignancies using survivin-RNA-transfected dendritic cells[J]. J. Immunol, 2003, 170(11): 5391-5397. DOI:10.4049/jimmunol.170.5391.
[5]Chen J, Li HY, Wang D, et al. Human dendritic cells transfected with amplified MUC1 mRNA stimulate cytotoxic T lymphocyte responses against pancreatic cancer in vitro[J]. J Gastroenterol Hepatol, 2011, 26(10):1509-1518.DOI:10.1111/j.1440-1746.2011.06778.x.
[6]Zitvogel L, Regmanlt A, Lcizer A, et al. Eradication of watablished murine tumors using a novel cell free vaccine: dendritic cell derived exosomes[J]. Nat Med, 2005, 4(5):594-600.
[7]von Mensdorff-Pouilly S, Snijdewint FG, Verstraeten AA, et al. Human MUC1 mucin: a multifaceted glycoprotein[J]. Int J Biol Markers, 2000, 15(4): 343-356.
[8]Yonezawa S, Higashi M, Yamada N, et al. Significance of mucin expression in pancreatobiliary neoplasms[J]. J Hepatobiliary Pancreat Sci, 2010, 17(2):108-124.
[9]Trefzer U, Weingart G, Chen Y, et al. Hybrid cell vaccination for cancer immune therapy: first clinical trial with metastatic melanoma[J]. Int J Cancer, 2008, 85(5):618-626.DOI:10.1007/s00534-009-0174-7.
[10]Koido S, Hara E, Torii A, et al. Induction of antigen-specific CD4-and CD8-mediated T-cell responses by fusions of autologous dendritic cells and metastatic colorectal cancer cells[J]. Int J Cancer, 2005, 117(4):587-595. DOI: 10.1002/ijc.21184.
[11]Van Tendeloo VF, Ponsaerts P, Lardon F, et al. Highly efficient gene delivery by mRNA electroporation in human hematopoietic cells: superiority to lipofection and passive pulsing of mRNA and to electroporation of plasmid cDNA for tumor antigen loading of dendritic cells[J]. Blood, 2001, 98(1): 49-56. DOI:10.1182/blood.v98.1.49.
(本文編輯:屠振興)
In vitro study on the induction of antigen-specific cytotoxic T lymphocytes by fusion of dendritic cells with pancreatic cancer MiaPaCa-2 cells
YangJinguang,ChenJiang,LiHongyu,GuoXiaozhong.
DepartmentofPharmacy,ThirdHospitalofChengdeCity,Chengde067000,China
【Abstract】Objective To investigate the ability of inducing antigen-specific cytotoxic T lymphocytes (CTL) stimulated by dendritic cell (DC) fused with MiaPaCa-2 cells in vitro. MethodsDC were isolated and cultured from peripheral blood mononuclear cells (PBMCs). 50% PEG and 10% DMSO were used to fuse MiaPaCa-2 cells and DC, and DC co-cultured with MiaPaCa-2 cells and DC alone served as control. The fusion efficiency was assessed by flow cytometry (FCM) and DC-MiaPaCa-2 hybrids were identified as PE-MUC1/FITC-CD86double positive cells. The survival rate of DC was determined by MTT method. The lymphocyte proliferation stimulated by DC in vitro was evaluated by mixed cell culture with DC in different ratios of 1∶10, 1∶20 and 1∶80. IL-2, IL-10, granzyme B and IFN-γ released by antigen-specific CTLs were measured by ELISA assay. ResultsThe fusion rate in DC fused with MiaPaCa-2 cells (fused cells) was (42.30±7.30)%, which was higher than (7.21±1.06)% in DC co-cultured with MiaPaCa-2 cells(co-cultured cells). The cell viability of DC, co-cultured cells and fused cells was >95.0%, 85.0% and 62.8%, and fused cells had greatly lower cell viability than DC and co-cultured cells (P<0.05). When DC and T cells were co-cultured at the ratio of 1∶10, T cell proliferation index in DC, co-cultured and fused cells was 219±42, 3 584±317, 8 201±424, respectively. At the ratio of 1∶20, T cell proliferation index was 110±14, 2 179±104, 6 152±104. T cell proliferation index was higher in fused cells than that in DC and co-cultured cells (both P<0.05) at the ratio of 1∶10 and 1∶20, while the difference was not statistically significant at the ratio of 1∶40 and 1∶80 (P>0.05). At the co-culture ratio of 1∶10, IL-2 secreted by CTL in DC, co-cultured and fused cells was(27.30±5.21 ),(897.44±93.05),(2 243.80±381.46)ng/L; IL-10 was (19.55±2.05),(424.60±108.25),(706.53±161.29)ng/L; Granzyme B was(16.23±1.23),(451.07±120.50),(1327.77±205.15)ng/L; IFN-γ was (30.11±4.32 )、(982.00±124.68)、(2421.04±488.50)ng/L. Cytokines from the antigen-specific CTL induced by DC fused with MiaPaCa-2 cells were significantly higher than those by DC and DC co-cultured with MiaPaCa-2 cells ( all P<0.05). ConclusionsThe fusion of DC and pancreatic cancer MiaPaCa-2 cells could stimulate tumor antigen-specific CTL in vitro.
【Key words】Pancreatic neoplasms;Dendritic cells;Cell fusion;T-lymphocytes, cytotoxic
DOI:10.3760/cma.j.issn.1674-1935.2016.03.003
通信作者:陳江,Email:matrix44@163.com
基金項目:國家自然科學基金(81071982)
Corresponding author:Chen Jiang, Email: matrix44@163.com
(收稿日期:2015-10-15)

