Par-4特異誘導腫瘤凋亡及其機制的研究新進展
吳隨一,胡波,王梁華Δ
(1.第二軍醫大學 海醫系,上海 200433;2.第二軍醫大學 海洋生物醫藥研究中心,上海 200433)
Par-4特異誘導腫瘤凋亡及其機制的研究新進展
吳隨一1,胡波2,王梁華2Δ
(1.第二軍醫大學 海醫系,上海 200433;2.第二軍醫大學 海洋生物醫藥研究中心,上海 200433)
前列腺凋亡反應基因-4(prostate apoptosis response gene-4,par-4)基因是最早在前列腺癌細胞中發現,這個基因在正常細胞和腫瘤細胞中均可表達,其編碼產物前列腺凋亡蛋白-(prostate apoptosis response protein,Par-4)可通過內源性和外源性途徑選擇性的誘導腫瘤細胞凋亡,而對正常細胞沒有影響。Par-4發揮作用可包括內源性Par-4裂解和磷酸化、內源性Par-4轉運Fas/FasL并激活Fas/FasL促凋亡通路、及外源性的Par-4和細胞膜上的GPR78結合誘導細胞凋亡等過程。特別是Par-4的外源性途徑在腫瘤的靶向治療中有很重要的應用價值。本文就Par-4誘導凋亡機制及外源性Par-4在腫瘤治療方面的最新研究進展進行綜述。
前列腺凋亡反應蛋白-4;腫瘤;外源性途徑;凋亡
癌癥是世界范圍內導致死亡的主要原因之一,也是當今人類亟待解決的健康問題。根據WHO在2016年2月4日全球癌癥日上的數據顯示,全球每年新增癌癥患者約1400萬人,每年因癌癥及其相關疾病死亡的約有800萬人[1]。現行的癌癥治療仍以手術、放療和化療為主。由于切除范圍的限制或是癌細胞對放療或是化療的敏感性差異,腫瘤很難被徹底清除。目前通過研究調節細胞特異蛋白的表達,進而抵抗或消滅腫瘤的方法越來越受到重視[2]。因此,能選擇性殺傷腫瘤細胞的治療方式被人們越來越寄予厚望。
在癌癥靶向治療中,發現了很多促凋亡基因,前列腺凋亡反應基因-4(prostate apoptosis response-4 gene,par-4)就是其中一個[3],其編碼的前列腺凋亡反應蛋白-4(prostate apoptosis response protein-4,Par-4)能夠誘導前列腺癌細胞凋亡而對正常前列腺細胞無影響。Par-4不僅能在細胞內介導腫瘤細胞的凋亡,同時還能分泌出細胞,在細胞外誘導包括前列腺癌細胞在內的多種腫瘤細胞凋亡[4]。這預示著Par-4作為一種潛在的腫瘤治療藥物具有良好前景。
1 Par-4的結構
在par-4保守序列中,包括以下幾個結構:(1)2個在N-端的核定位序列(nuclear localization sequence,NLS)分別是位于20-25aa處的NLS1及位于137-153aa處的NLS2。NLS2是Par-4進入細胞核在核內定位以及發揮凋亡誘導凋亡作用的關鍵結構域,它對Par-4功能的發揮至關重要。(2)在其C-末端(292 -332aa)有一個亮氨酸拉鏈區(leucine zipper domain,LZ),該區可以和許多Par-4伴侶分子如WT1、ζ蛋白激酶C和p62等相結合。(3)C-末端的核輸出序列。同時,在Par-4的分子中,還有2個關鍵的磷酸化位點T163和S241,需分別經PKA和Akt磷酸化后才能入核誘導凋亡。這些結構在Par-4的胞內定位,二聚體形成和發揮誘導凋亡的功能中發揮重要作用[5]。
Par-4的137-195aa的59個氨基酸區域,包括了NLS2結構域以及T163位的磷酸化位點,構成了Par-4足以誘導凋亡的最小域,即選擇性腫瘤細胞凋亡誘導域[6](the selective for apoptosis induction cancer cells domain,SAC)(見圖1)。人類和大鼠以及小鼠的SAC是100%同源的[6]。SAC結構域可以通過大鼠肉瘤(rat sarcoma,Ras)或是蛋白激酶C(protein kinase C,PKC)抑制核轉錄因子-κB (nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)的活性,協助凋亡相關因子/凋亡相關因子因子(factor associated suicide/factor associated suicide ligand,Fas/FasL)在細胞膜上定位,同時激活Fas通路以及通過與B淋巴細胞瘤-2(B-cell lymphoma-2, Bcl-2)啟動子上的 Wilms 腫瘤蛋白1(Wilms tumor protein 1,WT1)結合位點結合下調Bcl-2表達。這個結構域和完整的Par-4有著相同的誘導腫瘤細胞凋亡的功能,Par-4發揮抑制腫瘤生長的作用就是通過這個結構域實現的[7]。
2 Par-4的細胞定位
通過綠色熒光蛋白標記Par-4的實驗,發現Par-4在誘導細胞凋亡與其細胞內定位之間存在著密切的聯系[8]。在大多數腫瘤細胞中,Par-4被轉移至細胞核而引起細胞凋亡。相對的,在正常細胞中,Par-4定位于細胞質中,如果不發生繼發的引起凋亡損傷,則不能引起細胞凋亡。類似的,如雄激素依賴的前列腺癌和激素依賴的乳腺癌細胞系等激素依賴的腫瘤細胞中,Par-4主要定位于細胞質,則它就不能引起細胞凋亡。但是,在這2種細胞衍生的激素非依賴細胞中[持續表達Ras的乳腺癌細胞系MCF-7細胞(human breast cancer cell line,MCF-7cells)Ras細胞系和持續表達IL-6的LNCaP-IL6前列腺淋巴結癌細胞系LNCaP細胞(lymph node carcinoma of prostate cell line,LNCaP cells)細胞系],Par-4可以轉移至細胞核而誘導凋亡。Par-4進入細胞核后再發揮誘導腫瘤細胞凋亡的特點說明NLS2比NLS1更為重要,因為前者是決定Par-4的核內定位的。同時,Par-4可以被細胞自發的分泌至細胞外,并在細胞外選擇性誘導腫瘤細胞凋亡。這個重要特性使得Par-4成為治療腫瘤的一個潛在靶點[7]。
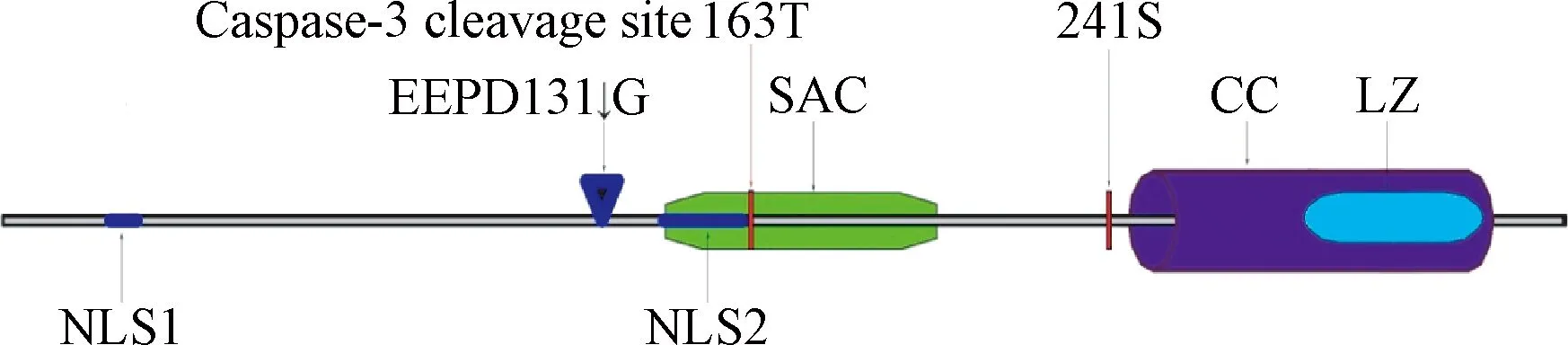
圖1 Par-4蛋白質結構和關鍵位點示意圖NLS1:核內定位序列1;cleavage site at EEPD131↓G:Caspase-3裂解位點;NLS2:核內定位序列2;T163:PKA磷酸化位點;SAC:選擇性腫瘤細胞凋亡誘導域;S241:AKT磷酸化位點;LZ:亮氨酸拉鏈結構域;CC:C-末端輸出序列Fig.1 Schematic diagram of protein structure and the specific amino acid sites of Par-4NLS1:Nuclear localization sequence 1;cleavage site at EEPD131↓G:cleavage site of Caspase-3;NLS2:Nuclear localization sequence 2;T163:Phosphorylation site of PKA;SAC:The elective for apoptosis induction cancer cells domain;S241:Phosphorylation site of AKT;LZ:Leucine zipper domain;CC:coiled-coil motif
3 Par-4誘導腫瘤細胞凋亡的機制
3.1 內源性Par-4經裂解和磷酸化后進入細胞核誘導凋亡 在正常細胞中Par-4主要分布在細胞質中,而在前列腺癌細胞中Par-4在細胞質和細胞核內均有分布,這說明Par-4的功能和它在細胞內的分布密切相關[9]。內源性Par-4選擇性誘導腫瘤細胞凋亡而對正常細胞沒有殺傷作用,這是因為Par-4亮氨酸拉鏈結構域上的S241位點能夠被細胞中的Akt磷酸化[10],磷酸化的亮氨酸拉鏈結構域能夠和細胞中的14-3-3蛋白結合形成復合物,進而停留在細胞質內[6],不能誘導正常細胞凋亡。醉茄素A(withaferin A)通過磷酸化AKT的Ser473位點抑制AKT活性后,能夠促進Par-4入核誘導凋亡。抑制AKT的活性也促進了依賴于叉頭框蛋白O-3a(Forkhead box O-3a,FOXO3a)的細胞凋亡,FOXO3a能結合在Par-4的啟動子上調控Par-4的翻譯[11]。在腫瘤細胞中Caspase-3表達水平升高,Caspase-3能夠將Par-4裂解為19kd和25kd的2個片段,C端的25kd片段(包含SAC片段)進入細胞核中誘導凋亡[12]。研究發現抗癌晶體蛋白-2Aa1(parasporin-2Aa1)作用于細胞后,能夠發揮和Caspase-3相同的裂解Par-4的作用[13]。
有研究將Par-4的SAC結構域在正常的細胞中過表達,盡管SAC沒有亮氨酸拉鏈結構域,不會和14-3-3蛋白結合,應該更容易進入細胞核誘導凋亡,但實驗中正常細胞并沒有凋亡。研究分析Par-4的SAC結構域上的有一個發揮作用的關鍵位點T163,T163被細胞中的PKA磷酸化之后才會發揮誘導細胞凋亡的作用。腫瘤細胞中PKA的表達顯著高于正常細胞,能夠充分將SAC結構域的T163位點磷酸化,而在正常細胞中,PKA的表達含量較低,不足以將胞質中SAC結構域上的T163充分磷酸化,SAC也就不能發揮誘導凋亡的作用[4]。
3.2 Par-4入核后通過下調Bcl-2,抑制NF-κB和抑制TOPO1促進細胞凋亡 在淋巴細胞中Par-4能夠通過轉錄和轉錄后修飾抑制Bcl-2蛋白家族中抗凋亡蛋白的表達。Bcl-2表達量下調[14]會引起線粒體膜電位的下降,淋巴細胞進而凋亡。Par-4和轉錄因子WT1相互作用后,WT1通過結合在Bcl-2基因啟動子上抑制Bcl-2的轉錄[15];Par-4也可上調miR-24a,進而抑制Bcl-2 的mRNA的翻譯[16]。研究發現Par-4濃度增高導致的Bcl-2表達下調能夠促進三疊氮醉茄素A(3-azido withaferin A)誘導的前列腺癌自噬,同時Par-4上升會抑制自噬效應蛋白(Beclin 1,BECN1)從而中斷Bcl-2和BECN1的相互作用[17]。所以在腫瘤細胞中Bcl-2與Par-4的表達呈負相關,Par-4也可和抗癌藥物三疊氮醉茄素A發揮協同作用。Par-4影響NF-κB[11],蛋白激酶(protein kinase C,PKC)和蛋白激酶C(protein kinase B,Akt)。這3種蛋白介導的通路相互聯系:PKC和Akt能促進NF-κB的激活,PKC也增強Akt的活性。Par-4結合到PKC上造成PKC構象改變,抑制了PKC的活性。Par-4能抑制NF-κB的復制和轉錄。同時,Par-4也可以通過結合到PKC的鋅指結構域,導致PKC的空間構象改變,生物活性下降,活化IκB激酶的能力下降。IκB激酶活性下降后,IκB磷酸化受到抑制,NF-κB活化過程受阻[13]。此外,Par-4通過抑制Akt的活性來抑制NF-κB的活性。Par-4入核后還可以通過抑制TOPO1(拓撲異構酶1)的活性,使得基因DNA不能解旋,從而抑制NF-κB的激活和促進細胞凋亡[15]。
3.3 內源性Par-4將Fas/FasL轉運到細胞膜上并激活Fas/FasL促凋亡通路 內源性Par-4能促進Fas/FasL轉移到細胞膜上,激活Fas/FasL通路,誘導細胞凋亡。Fas受體,也稱為APO1(CD95),屬于I型跨膜蛋白的TNF-κB受體家族中成員。它的c-端有一個大約80aa區域,稱為死亡結構域[19](death domain)。Fas受體與Fas配體結合后形成三聚體并且招募Fas死亡結構域相關蛋白(fas-associating protein with death domain,FADD),FADD可以吸引pro-Caspase-8,通過其死亡效應結構域(Death Effector Domain)形成死亡誘導信號復合體(death inducing signaling complex,DISC),從而特異切割pro-Caspase 8成活性的Caspase-8,啟動凋亡[13]。只有內源性Par-4將FADD激活,形成DISC后,才能夠使外源性Par-4的GPR78/FADD/Caspase8/Caspase3信號途徑發揮作用,進而誘導腫瘤細胞凋亡[14]。
3.4 內質網應激后Par-4分泌到細胞外同時將GPR78轉運至細胞膜上 當細胞外界條件惡劣時,例如低營養水平,缺氧等可干擾內質網的正常功能,并引起未成熟蛋白在內質網中聚集,產生內質網應激。內質網應激后,Par-4通過經典途徑被分泌到胞外。3-芳基喹啉能夠誘導Par-4從正常細胞的中間絲蛋白和波形蛋白上釋放并促進Par-4通過旁分泌的方式和靶癌細胞結合[20]。6H也可以作為Par-4的促分泌素促進Par-4的分泌[21]。研究發現用波形蛋白處理正常細胞后,Par-4局限在細胞內而不向胞外分泌[20]。繼體外實驗發現前列腺癌細胞可分泌Par-4到細胞外之后,在Par-4轉基因小鼠的體內實驗中也發現了血清中存在Par-4,并且血清里的Par-4也可以特異性誘導腫瘤細胞凋亡[4]。作為熱休克蛋白70家族成員之一,內質網分子伴侶GPR78能夠與未折疊和錯誤折疊的蛋白結合,通過蛋白修飾糾正這些錯誤折疊蛋白的結構,從而減少未折疊和錯誤折疊蛋白[22]。Par-4在GPR78的表達或分泌中不發揮作用,但是能夠影響GPR78在細胞內的定位。過表達Par-4后細胞膜上的GPR78含量增加,相似的,抑制Par-4的表達導致細胞膜上Par-4的含量下降。Par-4參與了GPR78的重新定位,但是未參與其他ER分子伴侶蛋白的定位。當腫瘤細胞表面的GPR78含量上升時,對Par-4的敏感性也隨之升高。內質網應激初期,GPR78的表達量迅速增加以適應細胞的應激水平[23]。內質網穩態對于正常細胞的生存至關重要,腫瘤細胞中內質網的穩態被打破,細胞出于自我機制會自行凋亡,避免正常機體細胞受到損害[24]。
3.5 外源性Par-4和細胞表面的GPR78結合后誘導腫瘤細胞凋亡 內質網應激后,腫瘤細胞表面的GPR78含量上升。外源性Par-4和細胞表面的GPR78結合,研究人員用含有全長的GPR78載體,或是含有N端結構域突變的GPR78載體轉染前列腺癌細胞,并將內源性Par-4敲除,再用外源性的Par-4處理以上細胞,發現用GPR78的N端結構域突變的載體處理的細胞不凋亡。提示:Par-4的SAC結構域和GPR78的N端特異性結合,進一步激活FADD,進而激活Caspase-8凋亡通路,最終導致細胞凋亡[5]。但是研究也發現,如果干擾掉腫瘤細胞的內源性的Par-4,使腫瘤細胞只保留細胞膜表面較高密度的GPR78,再用外源性的Par-4處理腫瘤細胞,腫瘤細胞并不發生凋亡[5]。這是因為內源性Par-4促進Fas/FasL從胞質內轉移到細胞膜上,使Fas/FasL通路被激活后,外源性Par-4誘導的凋亡通路才能發揮作用。此外,Capsase-3水平升高后能夠將更多的Par-4裂解為SAC,使得SAC能夠進入細胞核誘導凋亡。Par-4也可以活化Caspase-3,2者形成一個正反饋調節,進一步促進了腫瘤細胞凋亡[12]。
4 討論與展望
在腫瘤細胞中,內質網應激刺激Par-4參與GRP78的膜轉移以及Par-4自身的分泌,而Par-4和GRP78在胞膜上的相互作用又可以進一步激活內質網應激,這就形成一個包括GRP78,內源性和外源性Par-4一起參與的應激環路。Par-4在多種不同的腫瘤細胞中都表現出誘導凋亡的作用,見表1。同時Par-4上升也能增加抗癌藥物的作用。高濃度Par-4能夠促進三疊氮醉茄素A誘導的前列腺癌自噬[17],減輕了卵巢癌的發展并且增加了對紫杉醇治療的敏感性[9]。Par-4是醉茄素A抑制雌激素抵抗的前列腺癌的一個重要的下游靶標。關于Par-4的分泌及其在胞外誘導腫瘤細胞凋亡的作用的研究,見圖2。

表1 Par-4在不同腫瘤組織中誘導凋亡及其機制
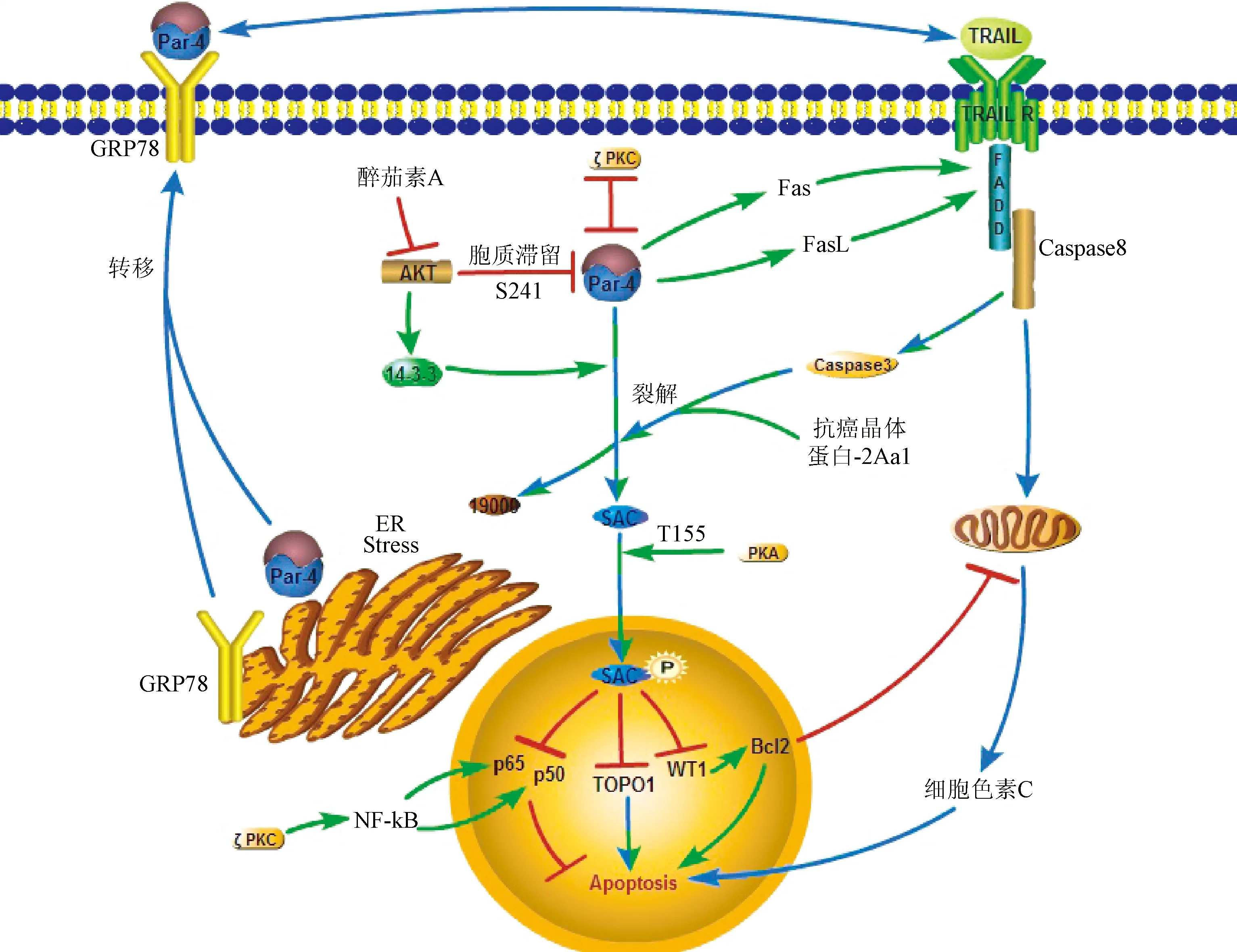
圖2 腫瘤細胞中Par-4促進凋亡的通路:胞內途徑;:胞外途徑;:胞內外共同途徑;:抑制作用;:相互抑制作用Fig.2 Signaling pathway of Par-4 inducing apoptosis in cancer cells:Intracellular promoting effect;:Extracellular promoting effect;:Intracellular and extracellular promoting effect;:Inhibitoryeffect;:Mutual inhibitory effect
關于Par-4和GRP78的研究,展現了它們在腫瘤治療方面的良好前景。在煙草中表達par-4的SAC蛋白后,植物源性的SAC蛋白作用于前列腺癌等腫瘤細胞后均能抑制腫瘤細胞的生長;最新的研究已經實現將SAC蛋白的含量在煙草植物的總可溶性蛋白中占到0.15%[7],Par-4大規模生產后將會在腫瘤治療中發揮重要作用。腫瘤細胞分泌的Par-4和用藥物刺激后正常細胞分泌的Par-4是否有結構上的差異性?植物源性的Par-4在體內是如何運輸的?是否能夠構建合適的運載體提高Par-4在體內的穩定性?這些都是需要進一步研究的問題,這些問題的解答將有助于更好地發揮Par-4的抗腫瘤作用。
[1] WHO.Cancer[OL].February 2016; Available from: http://www.who.int/mediacentre/factsheets/fs297/en/.
[2] Bjorkholm M, Ohm L, Eloranta S, et al.Success story of targeted therapy in chronic myeloid leukemia: a population-based study of patients diagnosed in Sweden from 1973 to 2008[J].J Clin Oncol, 2011, 29(18):2514-2520.
[3] Sells SF, Wood DP Jr, Joshi-Barve SS, et al.Commonality of the gene programs induced by effectors of apoptosis in androgen-dependent and -independent prostate cells[J].Cell Growth Differ, 1994,5(4):457-466.
[4] Burikhanov R, Zhao Y, Goswami A, et al.The tumor suppressor Par-4 activates an extrinsic pathway for apoptosis[J].Cell, 2009,138(2):377-388.
[5] Hebbar N, Shrestha-Bhattarai T,Rangnekar VM, Cancer-selective apoptosis by tumor suppressor par-4[J].Adv Exp Med Biol, 2014(818):155-166.
[6] Gan X, Wu Q, Deng W, et al.Effect of Par-4 on the apoptosis of islet beta cell[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2015,40(1):6-11.
[7] Sarkar S,Jain S, Rai V, et al.Plant-derived SAC domain of PAR-4 (Prostate Apoptosis Response 4) exhibits growth inhibitory effects in prostate cancer cells[J].Front Plant Sci, 2015(6):822.
[8] Liu Y, Gilbert MR, Kyprianou N, et al.The tumor suppressor prostate apoptosis response-4 (Par-4) is regulated by mutant IDH1 and kills glioma stem cells[J].Acta Neuropathol, 2014,128(5):723-732.
[9] Meynier S, Kramer M, Ribaux P, et al.Role of PAR-4 in ovarian cancer[J].Oncotarget, 2015,6(26):22641-22652.
[10] Wu Z, Wang G, Zhang K.Pro-apoptosis and selective anticancer activities of prostate apoptosis response protein 4: research progress and prospects[J].Nan Fang Yi Ke Da Xue Xue Bao, 2014,34(1):128-132.
[11] Das TP, Suman S, Alatassi H, et al.Inhibition of AKT promotes FOXO3a-dependent apoptosis in prostate cancer[J].Cell Death Dis, 2016(7):e2111.
[12] Thayyullathil F, Pallichankandy S, Rahman A, et al.Caspase-3 mediated release of SAC domain containing fragment from Par-4 is necessary for the sphingosine-induced apoptosis in Jurkat cells[J].J Mol Signal, 2013, 8(1):2.
[13] Brasseur K, Auger P, Asselin E, et al.Parasporin-2 from a New Bacillus thuringiensis 4R2 Strain Induces Caspases Activation and Apoptosis in Human Cancer Cells[J].PLoS One, 2015,10(8):e0135106.
[14] Jagtap JC, Dawood P, Shah RD, et al.Expression and regulation of prostate apoptosis response-4 (Par-4) in human glioma stem cells in drug-induced apoptosis[J].PLoS One, 2014,9(2):e88505.
[15] Amin H, Nayak D, Ur Rasool R, et al.Par-4 dependent modulation of cellular beta-catenin by medicinal plant natural product derivative 3-azido Withaferin A[J].Mol Carcinog, 2015.doi: 10.1002/mc.22328.
[16] Nguyen KA, Hamzeh-Cognasse H, Laradi S, et al.Specific activation, signalling and secretion profiles of human platelets following PAR-1 and PAR-4 stimulation[J].Platelets, 2015,26(8):795-798.
[17] Rah B, ur Rasool R, Nayak D, et al.PAWR-mediated suppression of BCL2 promotes switching of 3-azido withaferin A (3-AWA)-induced autophagy to apoptosis in prostate cancer cells[J].Autophagy, 2015,11(2):314-331.
[18] Chen X, Sahasrabuddhe AA, Szankasi P, et al.Fbxo45-mediated degradation of the tumor-suppressor Par-4 regulates cancer cell survival[J].Cell Death Differ, 2014,21(10):1535-1545.
[19] Merhi B, Bayliss G, Gohh RY, Role for urinary biomarkers in diagnosis of acute rejection in the transplanted kidney[J].World J Transplant, 2015,5(4):251-260.
[20] Sviripa VM, Burikhanov R, Obiero JM, et al.Par-4 secretion: stoichiometry of 3-arylquinoline binding to vimentin[J].Organic & Biomolecular Chemistry, 2016,14(1):74-84.
[21] Frasinyuk MS,Bondarenko SP,Sviripa VM,et al.Development of -Chromeno[3,4-]pyrido[3',2':4,5]thieno[2,3-e]pyridazin-6-ones as Par-4 Secretagogues[J].Tetrahedron Lett,2015, 56(23):3382-3384.
[22] Ge Y, Li G, Liu B, et al.The Protective Effect of Lacidipine on Myocardial Remodeling Is Mediated by the Suppression in Expression of GPR78 and CHOP in Rats[J].Evid Based Complement Alternat Med, 2015(2015):945076.
[23] Yee SB, Choi HJ, Chung SW, et al, Growth inhibition of luteolin on HepG2 cells is induced via p53 and Fas/Fas-ligand besides the TGF-beta pathway[J].Int J Oncol, 2015,47(2):747-754.
[24] Chen W, Zou P, Zhao Z, et al.Selective killing of gastric cancer cells by a small molecule via targeting TrxR1 and ROS-mediated ER stress activation[J].Oncotarget, 2016.doi: 10.18632/oncotarget.7565.
[25] Moscat J, Diaz-Meco MT, Wooten MW.Of the atypical PKCs, Par-4 and p62: recent understandings of the biology and pathology of a PB1-dominated complex[J].Cell Death Differ, 2009,16(11):1426-1437.
[26] Lee TJ, Jang JH, Noh HJ, et al.Overexpression of Par-4 sensitizes TRAIL-induced apoptosis via inactivation of NF-kappaB and Akt signaling pathways in renal cancer cells[J].J Cell Biochem, 2010,109(5):885-895.
[27] Wang G, Dinkins M, He Q, et al.Astrocytes secrete exosomes enriched with proapoptotic ceramide and prostate apoptosis response 4 (PAR-4): potential mechanism of apoptosis induction in Alzheimer disease (AD)[J].J Biol Chem, 2012,287(25):21384-21395.
[28] Hart LS and El-Deiry WS.Cell death: a new Par-4 the TRAIL[J].Cell, 2009,138(2):220-222.
[29] Tan J, You Y, Xu T, et al.Par-4 downregulation confers cisplatin resistance in pancreatic cancer cells via PI3K/Akt pathway-dependent EMT[J].Toxicol Lett, 2014,224(1):7-15.
[30] Visavadiya NP, Li Y, Wang S.High glucose upregulates upstream stimulatory factor 2 in human renal proximal tubular cells through angiotensin II-dependent activation of CREB[J].Nephron Exp Nephrol, 2011,117(3):e62-70.
[31] Jagtap JC, Parveen D, Shah RD, et al.Secretory prostate apoptosis response (Par)-4 sensitizes multicellular spheroids (MCS) of glioblastoma multiforme cells to tamoxifen-induced cell death[J].FEBS Open Bio, 2015(5):8-19.
[32] Libich DS, Schwalbe M, Kate S, et al.Intrinsic disorder and coiled-coil formation in prostate apoptosis response factor 4[J].FEBS J, 2009,276(14):3710-3728.
[33] Lu C, Li JY, Ge Z, et al.Par-4/THAP1 complex and Notch3 competitively regulated pre-mRNA splicing of CCAR1 and affected inversely the survival of T-cell acute lymphoblastic leukemia cells[J].Oncogene, 2013,32(50):5602-5613.
[34] Alvarez JV,Pan TC, Ruth J, et al. Par-4 downregulation promotes breast cancer recurrence by preventing multinucleation following targeted therapy[J].Cancer Cell, 2013,24(1):30-44.
[35] Saegusa M, Hashimura M, Kuwata T, et al.Transcriptional regulation of pro-apoptotic Par-4 by NF-kappaB/p65 and its function in controlling cell kinetics during early events in endometrial tumourigenesis[J].J Pathol, 2010,221(1):26-36.
[36] Sviripa VM, Burikhanov R, Obiero JM, et al.Par-4 secretion: stoichiometry of 3-arylquinoline binding to vimentin[J].Org Biomol Chem, 2015,14(1):74-84.
(編校:王冬梅)
New research progresses on the prostate apoptosis response protein-4 for apoptosis induction cancer and its mechanism
WU Sui-yi1, HU Bo2, WANG Liang-hua2Δ
(1.Faculty of Naval Medicine, The Second Military Medical University, Shanghai 200433, China; 2.Marine Biomedical Research Center, The Second Military Medical University, Shanghai 200433, China)
Prostate apoptosis response gene-4(par-4)was first identified from the prostate tissue.This gene can express in both normal and cancer cells.The translation product ofpar-4 is prostate apoptosis response protein-4(Par-4),which is unique in its ability to selectively induce apoptosis in cancer cells while leaving the normal cells unaffected through intracellular and extracellular pathway.Par-4 is cleaved and phosphorylated by caspase3 and PKA; Par-4 transportsFas/FasL tocell membrane and activation of pro-apoptotic pathway;intracellular Par-4 transports GPR78 to cell membrane; extracellular Par-4 binds to GRP78 and activates it.There is a significant potential role in anti-tumors therapy of extracellular Par-4.The latest research progress on the mechanism of apoptosis induced by Par-4 and the treatment of exogenous Par-4 in tumor was discussed in this article.
prostate apoptosis response protein-4;tumor;extracellular pathway; apoptosis
第二軍醫大學大學生創新能力培養基金(ZD2014031)
吳隨一,男,本科在讀,研究方向:生物化學與分子生物學,E-mail:wusuiyi@foxmail.com;王梁華,通信作者,男,博士,副教授,研究方向:生物化學與分子生物學,E-mail:lhwang@smmu.edu.cn。
R91
A
10.3969/j.issn.1005-1678.2016.04.07

