miR-21對瘢痕疙瘩成纖維細胞膠原分泌及細胞增殖的影響
周仁鵬 王琛 王丹茹
·論著·
miR-21對瘢痕疙瘩成纖維細胞膠原分泌及細胞增殖的影響
周仁鵬王琛王丹茹
【摘要】目的探討miR-21(microRNA-21)在瘢痕疙瘩中的表達及其生物學作用,為瘢痕疙瘩的防治提供新的思路。方法收集臨床患者正常皮膚及瘢痕疙瘩標本,部分進行組織學檢測;部分進行體外細胞培養,Real-time PCR檢測體外培養的正常皮膚來源和瘢痕疙瘩來源的成纖維細胞中,miR-21、Smad7(miR-21靶基因)、Col 1 A1、Col 3 A1(纖維化相關基因)的表達;應用miRNA-21的模擬物和抑制劑,以Western-Blot和Real-time PCR分別檢測Col 1 A1、Col 3 A1 及Smad7的蛋白和核酸水平表達變化,結晶紫實驗檢測細胞增殖能力的變化。結果瘢痕疙瘩標本組織學檢測,其膠原的含量明顯高于正常皮膚;瘢痕疙瘩成纖維細胞中miR-21、Col 1 A1、Col 3 A1表達高于正常皮膚組織,Smad7表達低于正常皮膚組織;正常皮膚來源成纖維細胞轉染miR-21模擬物后,Smad7表達降低,纖維化相關基因的表達、細胞增殖能力增加;瘢痕疙瘩組織來源成纖維細胞轉染miR-21抑制劑后,Smad7表達增加,纖維化相關基因的表達、細胞增殖能力降低。結論瘢痕疙瘩中miR-21表達升高,促進了細胞外基質中纖維化相關膠原基因的表達,促進成纖維細胞的體外增殖能力,可能是導致瘢痕疙瘩形成的重要原因。
【關鍵詞】小分子核糖核酸瘢痕疙瘩細胞外基質細胞增殖纖維化
瘢痕疙瘩是繼發于真皮損傷后,以成纖維細胞異常增殖,細胞外基質大量沉積為特征的疾病[1-3]。瘢痕疙瘩的形成機制尚不清楚,一般認為遺傳、免疫、張
MicroRNA(微小RNA,miR)是內源性的單鏈非編碼RNA,含21~23個堿基,主要通過靶基因轉錄RNA的3’UTR(非翻譯區)互補結合,使mRNA降解或翻譯抑制,最終抑制靶基因的表達[7]。目前已有多個miR被發現與組織的纖維化有關。其中與TGF-β通路相關的miR中,miR-21在纖維化的心肌、腎、肺組織中表達顯著增加,抑制靶基因Smad7轉錄后的翻譯過程,從而促進纖維化的發生[8-11]。與瘢痕疙瘩一樣,有纖維化特征的增生性瘢痕中,高表達的miR-21可促進增生性瘢痕來源的成纖維細胞的增殖[12]。
因此,本實驗旨在探討瘢痕疙瘩來源成纖維細胞與正常皮膚成纖維細胞的miR-21是否存在差異性表達,并進一步探討miR-21對瘢痕疙瘩成纖維細胞的生物學影響。
1 材料和方法
1.1標本收集
實驗標本 (8例瘢痕疙瘩組織和8例正常皮膚組織)來源于2014年2月到2014年12月我科收治的瘢痕疙瘩患者,均獲患者知情同意。
1.2主要材料與儀器
0.2%Ⅰ型膠原酶 (Worthington,美國);DMEM培養液、胎牛血清(Gibco,美國);磷酸鹽緩沖液、0.25%胰蛋白酶 (上海思吉生物制品有限公司);miR-21 mimics、miR-21 inhibitor設計合成(上海吉瑪制藥技術有限公司);人Col1A1、Col3A1、Smad7、β-actin基因引物設計合成(上海生工公司);鼠抗人抗體:Col1A1、Col3A1、β-actin(Santa Cruz,美國);鼠抗人抗體:Smad7(Abcam,美國);結晶紫染色液(上海碧云天生物技術公司);熒光定量PCR儀 (BIO-rad IQ5多色實時PCR儀,美國BIO-rad公司)。
1.3實驗方法
1.3.1組織學研究
新鮮手術切除的瘢痕疙瘩和正常皮膚標本用無菌濕紗布包裹,在無菌條件下切取部分組織進行組織冰凍切片,部分組織進行成纖維細胞分離培養。組織樣本4%多聚甲醛固定,30%蔗糖溶液中過夜脫水,OCT包埋,以5 μm層厚進行冰凍切片。切片分別進行HE和Masson染色,鏡下觀察。
1.3.2成纖維細胞的分離和培養
用于成纖維細胞分離的組織,以PBS沖洗3遍,剪碎,0.2%Ⅰ型膠原酶溶液37℃振蕩(120 r/min)下消化3 h。以等體積的含10%FBS的DMEM培養液終止消化,200目篩網過濾,將濾液收集到離心管離心,棄上清,用培養液重懸細胞,按4×104 cells/cm2的密度接種于100 mm培養皿中,37℃、5%CO2條件下常規培養。取第2、3代細胞用于后續實驗。
1.4Real-time PCR檢測成纖維細胞的纖維化指標與miR-21及Smad7的表達
為確認分離培養的成纖維細胞仍有原組織中的生物學特性,將體外培養的融合至80%左右的第2代成纖維細胞消化后離心,用qPCR檢測成纖維細胞中col1A1和col3A1的表達水平。引物序列:βactin(F:5'-GGACTTCGAGCAAGAGATGG-3';R:5'-AGCACTGTGTTGGCGTACAG-3');COL1α1(F:5'-CGAAGACATCCCACCAATCAC-3';R:5'-GATCGCACAACACCTTGCC-3');COL3A1(F:5'-CCTGGTCCTTGCTGTGGTGGTGT-3';R:5'-GCAGTTTCTAGC GGGGTTTTTACG-3');Smad7(F:5'-TGCTGTGCAAAGTGTTCAGGTG-3';R:5'-CCATC GGGTAT CTGGAGTAAGGA-3')。
其他RNA用GoScript反轉錄酶試劑盒采用莖環法進行反轉錄,以U6為內參檢測miR-21的表達,引物序列:miR-21(RT primer:5'-GTCGTATCCA GTGCAGGGTCCGAGGTATTTCGCACTGGATACGACTCAACA;F:5'-TGCGGTAGCTTATCAGACTGATG);U6(RT primer:5'-GTGCAGGGTCCGAGGT;F:5'-CTCGCTTCGGCAGCACA;Universal reverse primer:5'-GTGCAGGGTCCGAGGT)。
1.5miR-21 mimics(模擬物)與inhibitor(抑制物)的轉染
轉染前24 h,在6孔板中以每孔1×105個的密度接種正常皮膚及瘢痕疙瘩組織來源的成纖維細胞,加入2 mL培養液,繼續培養。分別配置混合液A(200 μL的DMEM加2 μL的Lipo2000轉染試劑,充分混勻靜置5 min),混合液B1(200 μL的DMEM加1 μL的miR-21 mimic,充分混勻靜置5 min),混合液B2(200 μL的DMEM加1 μL的miR-21 mimic control,即NC,模擬物陰性對照,充分混勻靜置5 min),混合液C1(200 μL的DMEM加1.25 μL 的miR-21 inhibitor,充分混勻靜置5 min),混合液C2(200 μL的DMEM加1 μL的miR-21 inhibitor control,即NC,抑制劑陰性對照,充分混勻靜置5 min)。分別將混合液A與B1、B2、C1、C2混合,分別記為AB1、AB2、AC1和AC2,靜置20 min。吸出6孔板中培養液,加入1 600 μL DMEM,然后在正常皮膚的成纖維細胞組中分別加入AB1、AB2混合液,在瘢痕疙瘩成纖維細胞組中分別加入AC1、AC2混合液。培養箱中培養5 h后換成全培養液,48 h后提取細胞RNA行Real-time PCR檢測,72 h后提取細胞蛋白進行Western-blot檢測。
1.6Western-blot檢測
上述不同組培養細胞用RIPA裂解液充分裂解離心取上清,蛋白定量,以10%的SDS-PAGE膠進行電泳蛋白分離,濕轉到PVDF膜后,用5%脫脂奶粉/TBST室溫封閉1 h,一抗4℃孵育過夜,TBST洗3次(每次10 min),二抗室溫孵育1×,TBST洗3次(每次10 min),用ECL發光試劑進行顯色。分別檢測Col1A1、Col3A1和Smad7的蛋白表達水平。
1.7細胞增殖檢測
將第2、3代成纖維細胞分組接種入12孔板中,每組3個復孔,結晶紫溶液行細胞數目檢測。細胞用PBS清洗后,在不同時間點用0.1%結晶紫溶液固定30 min,用PBS清洗干燥后掃描,再加10%乙酸,于搖床上洗脫,所得溶液檢測590 nm處吸光度值。
1.8統計學分析
2 結果
2.1瘢痕疙瘩組織學觀測
HE與Masson染色顯示,與正常皮膚相比,瘢痕疙瘩組織中真皮乳頭減少,真皮網狀層中膠原增粗增厚,排列紊亂并異常沉積(圖1)。
2.2成纖維細胞的纖維化標記物、miR-21及Smad7表達檢測
與正常皮膚成纖維細胞相比,瘢痕疙瘩成纖維細胞中Col1A1、Col3A1和miR-21的表達顯著增加,Smad7表達降低(圖2)。
2.3miR-21模擬物和抑制物轉染對成纖維細胞表達的影響
三次重復實驗結果均顯示,正常皮膚成纖維細胞應用miR-21模擬物后,相比對照組,miR-21靶基因Smad7的核酸及蛋白水平表達降低,Col1A1、Col3A1核酸及蛋白水平表達增加;瘢痕疙瘩成纖維細胞應用miR-21抑制劑后,相比對照組,miR-21靶基因 Smad7的核酸及蛋白水平增加,col1A1、col3A1核酸及蛋白水平表達降低(圖3-4)。
2.4miR-21模擬物和抑制物轉染對成纖維細胞增殖能力的影響
在不同時間點結晶紫染色法測定細胞增殖能力結果顯示,正常皮膚成纖維細胞應用miR-21模擬物后,與對照組相比,在48及72 h,成纖維細胞數量明顯多于對照組;瘢痕疙瘩成纖維細胞應用miR-21抑制劑后,與對照組相比,在24、48及72 h成纖維細胞數量明顯少于對照組(圖5)。
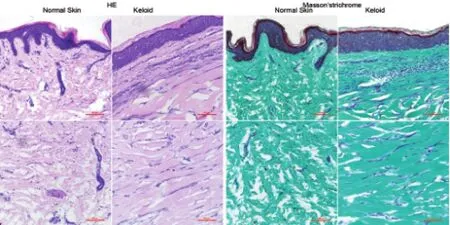
圖1 正常皮膚和瘢痕疙瘩組織的組織學觀察Fig.1 Histological observation of normal skin tissue and keloids by HE staining and Masson trichrome staining
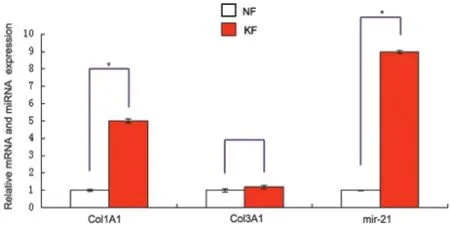
圖2 Real-time PCR檢測正常皮膚(NF)及瘢痕疙瘩(CF)成纖維細胞中Col1A1、Col3A1以及miR-21的表達(*:P<0.01)Fig.2 The relative expression of Col1A1,Col3A1and miR-21 in normal(NF)and keloid fibroblasts(KF)detected by Realtime PCR.(*:P<0.01)
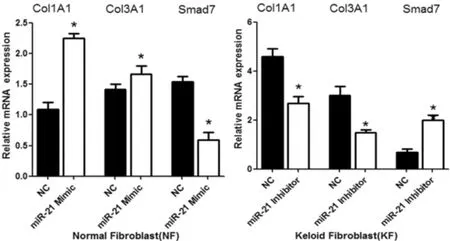
圖3 成纖維細胞分別轉染miR-21模擬物和抑制劑后,Realtime PCR檢測Col1A1、Col3A1以及Smad7的表達Fig.3 The expression of Col1A1,Col3A1 and Smad7 detected by Real-time PCR in fibroblasts transfected with miR-21 mimics and inhibitor respectively NC:Negative control
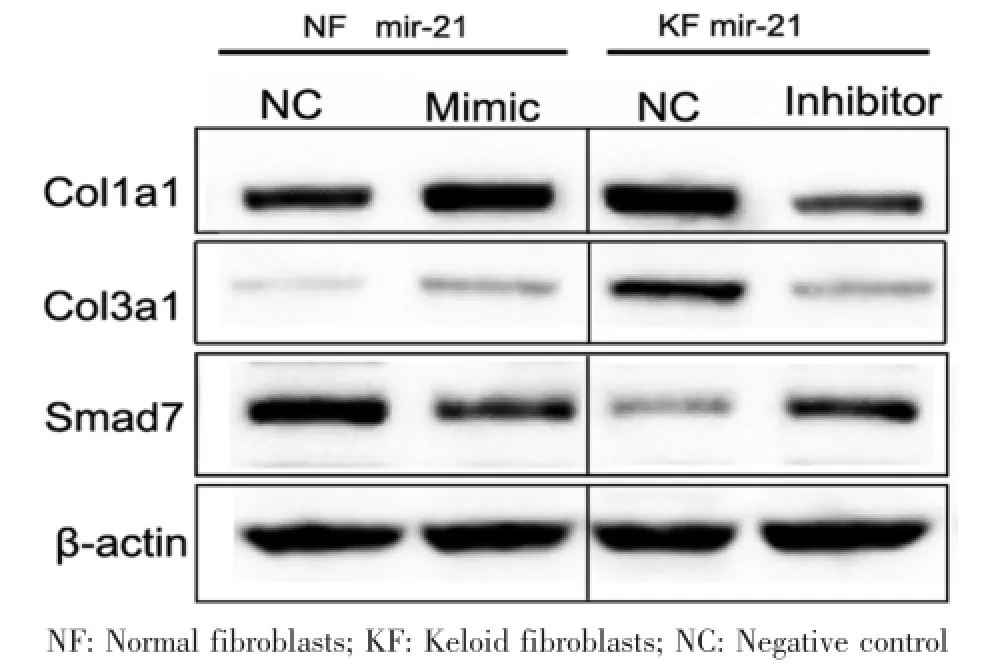
圖4 成纖維細胞分別轉染miR-21的模擬物和抑制劑后,Western-blot檢測Col1A1、Col3A1以及Smad7的表達Fig.4 The expression of Col1A1,Col3A1 and Smad7 detected by Western-blot in fibroblasts transfected with miR-21 mimics and inhibitor respectively
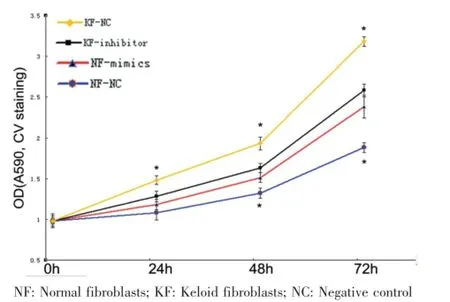
圖5 成纖維細胞分別轉染miR-21模擬物和抑制劑后的增殖能力變化(P<0.01)Fig.5 The change of cell proliferation in fibroblasts transfected with miR-21 mimics and inhibitor respectively(P<0.01)
3 討論
瘢痕疙瘩是創口異常愈合過程中膠原合成和降解的失衡,引起以Ⅰ型膠原增粗增厚,排列紊亂為主要病理特點的疾病[13]。本研究中,我們首先確認了標本組織學上的病理學表型,然后檢測組織分離的細胞中Col1A1和Col3A1的表達,進一步確認分離的成纖維細胞具有組織中的生物學特性。
miR與多種病理疾病相關,且其中miR-196,miR-21等都有參與纖維化疾病的過程[14-15]。研究表明,在TGF-β1誘導的CAF轉化過程中,miR-21/ Smad7途徑發揮著關鍵性的調控作用[16]。熒光素酶報告系統確認,miR-21能直接調控smad7的mRNA 的3'-UTR,證實了smad7為miR-21的直接靶基因。既往研究表明,miR-21能通過TGF-β通路促進增生性瘢痕形成,促進細胞外基質合成[16]。miR芯片篩選結果顯示,miR-21在瘢痕疙瘩中同樣表達上調,本實驗通過莖環法反轉錄和qPCR定量實驗,證實了瘢痕疙瘩來源的成纖維細胞中miR-21表達顯著高于對照組。
為研究miR-21是否通過Smad7調控瘢痕疙瘩成纖維細胞的細胞外基質分泌。本實驗分別在瘢痕疙瘩來源的成纖維細胞和正常皮膚來源的成纖維細胞中加入miR-21的抑制物和模擬物,發現miR-21模擬物能降低靶基因Smad7的表達,導致下游Col1A1及Col3A1的表達增加;而miR-21抑制物則起相反的作用。說明miR-21能直接降低Smad7的蛋白表達水平,從而增加細胞外基質的分泌。
為研究miR-21對成纖維細胞的增殖能力的影響,我們分別在正常皮膚及瘢痕疙瘩組織來源的成纖維細胞中加入miR-21的模擬物和抑制物,發現miR-21模擬物組的細胞數量明顯高于對照組,而抑制物組則相反。說明miR-21能促進成纖維細胞的增殖能力。
本實驗發現miR-21能通過調節Smad7的表達促進瘢痕疙瘩來源的成纖維細胞的纖維化,不過Smad7是 TGF-β通路中的一個環節,miR-21與TGF-β1的關系仍有待進一步研究。此外,miR-21在體內對成纖維細胞的生物學作用也有待更為深入地探索。
綜上所述,本實驗證實瘢痕疙瘩成纖維細胞中miR-21表達上調,一方面通過靶基因Smad7的表達下調,從而增加成纖維細胞的細胞外基質分泌;另一方面,可促進成纖維細胞的增殖能力,說明miR-21在瘢痕疙瘩的形成過程中發揮了重要的作用。
參考文獻
[1]Vincent AS,PhanTT,Mukhopadhyay A,et al.Human skin keloid fibroblasts display bioenergetics of cancer cells[J].J Invest Dermatol,2008,128(3):702-709.
[2]Russell SB,Russell JD,Trupin KM,et al.Epigenetically altered wound healing in keloid fibroblasts[J].J Invest Dermatol,2010, 130(10):2489-2496.
[3]Smith JC,Boone BE,Opalenik SR,et al.Gene profiling of keloid fibroblasts shows altered expression in multiple fibrosis-associated pathways[J].J Invest Dermatol,2008,128(5):1298-1310.
[4]Peltonen J,Hsiao L,Jaakkola S,et al.Activation of collagen gene expression in keloids:co-localization of typeⅠandⅥcollagenandtransforminggrowthfactor-β1mRNA[J].J Invest Dermatol,1991,97(2):240-248.
[5]Verrecchia F,Chu ML,Mauviel A.Identification of novel TGF-beta/Smad gene targets in dermal fibroblasts using a combined cDNA microarray/promoter transactivation approach[J].J Biol
Chem,2001,276(20):17058-17062.
[6]Neptune ER,Frischmeyer PA,Arking DE,et al.Dysregulation of TGF-βactivationcontributestopathogenesisinMarfan syndrome[J].Nat Genet,2003,33(3):407-411.
[7]Brown BD,Naldini L.Exploiting and antagonizing microRNA regulation for therapeutic and experimental applications[J].Nat Rev Genet,2009,10(8):578-585.
[8]Yi R,Pasolli HA,Landthaler M,et al.DGCR8-dependent microRNA biogenesis is essential for skin development[J].Proc Natl Acad Sci U S A,2009,106(2):498-502.
[9]Sand M,Gambichler T,Sand D,et al.MicroRNAs and the skin: tiny players in the body's largest organ[J].J Dermatol Sci,2009, 53(3):169-175.
[10]Schneider MR.MicroRNAs as novel players in skin development, homeostasis and disease[J].Br J Dermatol,2012,166(1):22-28.
[11]Zhu H,Li Y,Qu S,et al.MicroRNA expression abnormalities in limited cutaneous scleroderma and diffuse cutaneous scleroderma [J].J Clin Immunol,2012,32(3):514-522.
[12]Zhu HY,Li C,Bai WD,et al.MicroRNA-21 regulates hTERT via PTEN in hypertrophic scar fibroblasts[J].PLoS One,2014,9 (5):e97114.
[13]Chong Y,Park TH,Seo Sw,et al.Histomorphometric analysis of collagen architecture of auricular keloids in an Asian population [J].Dermatol Surg,2015,41(3):415-422
[14]Thum T,Gross C,Fiedler J,et al.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[15]Liu G,Friggeri A,Yang Y,et al.miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis[J].J Exp Med,2010,207(8):1589-1597.
[16]Li Q,Zhang D,Wang Y,et al.miR-21/Smad 7 signaling determines TGF-β1-induced CAF formation[J].Sci Rep,2013,3:2038.
·論著·
【中圖分類號】R619+.6
【文獻標識碼】A
【文章編號】1673-0364(2016)03-0167-05
doi:10.3969/j.issn.1673-0364.2016.03.006
基金項目:上海市科委項目(12140904100)。
作者單位:200011上海市上海交通大學醫學院附屬第九人民醫院整復外科。
通訊作者:王丹茹(E-mail:wangdanru1776@163.com)。力等因素在瘢痕疙瘩發生發展中起著重要作用,有報道認為TGF-β信號通路與瘢痕疙瘩形成有密切聯系。TGF-β有三個亞型:TGF-β1,TGF-β2與TGF-β3。其中,TGF-β1主要參與Ⅰ型膠原的沉積和細胞的增殖,目前已知若干編碼細胞外基質蛋白導致纖維化的基因被TGFβ-SMAD信號通路調節[4-6]。
收稿日期:(2016年5月4日;修回日期:2016年5月20日)
The Effect of miR-21 on Collagen Synthesis and Cell Proliferation of Fibroblasts in Keloid
ZHOU Renpeng,WANG Chen,WANG Danru.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:WANG Danru(E-mail:wangdanru1776@163.com).
【Abstract】ObjectiveTo investigate the expression and function of miR-21(microRNA-21)in the formation of the keloid,and provide a new direction for the prevention and treatment of the scar.MethodsNormal skin tissue and keloid were harvested for histological detection and cell culture in vitro.Real-time PCR was used to detect the expression of mir21, Smad7,Col 1 A1 and Col 3 A1 in normal and keloid fibroblasts.The expression of Smad7,Col 1 A1 and Col 3 A1 with miR-21 mimics and anti-miR-21 oligonucleotides were also detected by Western-Blot and Real-time PCR.The cell proliferation was also detected by crystal violet assay.ResultsThe content of collagen was significantly higher in keloid tissue than that of normal skin.The expression of miR-21,Col 1 A1 and Col 3 A1 were higher in keloid fibroblasts than that of normal fibroblasts,while the expression of Smad7 was lower.After transfection,the expression of Smad7 was decreased,the expression of scar related genes and cell proliferation were increased in normal fibroblasts.And the contrast results were observed in keloid fibroblasts after transfection.ConclusionThe high expression of miR-21 can increase the expression of scar related genes and promote the proliferation of fibroblasts in vitro,which may be an important cause of the formation of the scar.
【Key words】microRNA;Keloid;Extracellular matrix;Cell proliferation;Fibrosis

