急性痛風性關節炎患者血清IL-1β、IL-6、IL-18及TNF-α水平的研究
劉淑娟丁煥發* 徐曉辰王尚云蘭立強韋涌濤( 青島市第八人民醫院內分泌科,山東 青島 6600; 青島市第八人民醫院檢驗科,山東 青島 6600)
?
急性痛風性關節炎患者血清IL-1β、IL-6、IL-18及TNF-α水平的研究
劉淑娟1丁煥發1* 徐曉辰1王尚云2蘭立強1韋涌濤2
(1 青島市第八人民醫院內分泌科,山東 青島 266100;2 青島市第八人民醫院檢驗科,山東 青島 266100)
【摘要】目的 探討急性痛風性關節炎(acute gouty arthritis,AGA)患者血清白細胞介素(interleukin,IL)-1β、IL-6、IL-18及腫瘤壞死因子(tumor necrosis factor,TNF)-α水平的變化及意義。方法 用ELISA法測定100例AGA患者(觀察組,T)和100名健康查體者(對照組,C)血清IL-1β、IL-6、IL-18及TNF-α水平。觀察組與對照組比較采用獨立樣本t檢驗,一般生理指標及血生化指標用獨立樣本t檢驗,計數資料采用χ2檢驗。計量資料用(?±s)表示。采用IBM SPSS 19.0軟件包對所有數據進行統計學分析。結果 觀察組與對照組相比,IL-1β、IL-6、IL-18及TNF-α水平均顯著升高,差異有統計學意義(P<0.01)。結論 IL-1β、IL-6、IL-18及TNF-α水平在AGA發病時升高,提示它們參與了炎性反應過程,在炎癥機制中發揮了重要作用。
【關鍵詞】白細胞介素-1β;白細胞介素-6;白細胞介素-18;腫瘤壞死因子-α;痛風性關節炎
隨著社會的發展,痛風的患病率逐年上升,急性痛風性關節炎(AGA)患病率隨年齡的增長有逐漸增高的趨勢,且常伴有多種代謝病、慢性病,發病高峰年齡為40歲左右,臨床上以男性患者多見,女性約占5%[1],且多為絕經期后婦女。近年來研究發現單核/巨噬細胞系統在急性痛風性關節炎啟動、進展及緩解中均發揮了關鍵作用,其中IL-1β是單鈉尿酸鹽(monosodium urate,MSU)晶體誘導炎癥的關鍵因子,NLRP3炎性體通過促進IL-1β的生成在AGA發作中發揮不可替代的作用[2]。同時IL-6、IL-18及TNF-α等多種促炎性細胞因子參與了AGA的發病過程。當AGA發生時上述炎性因子水平升高。本研究即對此進行研究、探討,以期發現IL-1β、IL-6、IL-18及TNF-α在AGA表達水平的變化及意義,指導AGA的早期防治及優化治療方案。
1 對象與方法
1.1 研究對象。觀察組(T):隨機選取符合以下診斷標準和剔除標準的患者100例(男95例,女5例),年齡(47.25±10.99)歲,全部來自本院2014年8月至2016年2月的門診患者。①急性痛風性關節炎診斷標準:應用美國風濕病協會(ACR)1997年制定的診斷標準。②入選和剔除標準:a.符合ACR診斷標準的急性原發性痛風性關節炎。d.排除心血管、腎臟、血液疾病、腫瘤疾病引起的繼發性痛風。c.排除合并感染性疾病患者。d.排除自身免疫性疾病及全身系統疾病患者。e.年齡18~75歲。f.一般情況良好。g.未服用降尿酸藥物治療者。對照組(C):隨機選取青島本地居民健康查體者100例(男95例,女5例),年齡(46.15±11.80)歲,排除高尿酸血癥患者。高尿酸血癥的診斷標準:是指正常嘌呤飲食狀態下,非同日兩次空腹血清尿酸水平(37 ℃)男性>420 μmol/L,絕經前女性>360 μmol/L,絕經后女性的診斷標準同男性。
1.2 觀測指標。①測定兩組的一般生理指標:年齡(Age)、身高(BH)、體質量(BW)、收縮壓/舒張壓(SBP/DBP)、腰圍(WC)、臀圍(HC)。計算腰臀比(WHR)及體質量指數(BMI)。BMI=體質量(kg)/身高(m)2。②測定兩組的空腹血清丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、尿酸(UA)、空腹血糖(FPG)、三酰甘油(TG)、總膽固醇(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)、C-反應蛋白(CRP)、肌酐(Cr)、尿素氮(BUN)。測定兩組全血白細胞總數(WBC)、中性粒細胞數(NEUT)、中性粒細胞百分比(NEUT%)。③測定兩組空腹血清IL-1β、IL-6、IL-18及TNF-α水平。
1.3 主要檢測方法:所有入選者由專人進行一般生理指標測量并記錄。實驗中血清ALT、AST、UA、FPG、TG、TC、LDL-C、HDL-C、CRP、Cr、BUN的檢測用全自動生化分析儀,IL-1β、IL-6、IL-18及TNF-α的檢測采用ELISA試劑盒。血分析采用SYSMEX XT-2000i全自動血液分析儀檢測。
1.4 統計學處理:觀察組與對照組IL-1β、IL-6、IL-18及TNF-α水平、一般生理指標、血生化指標、全血分析白細胞數等用獨立樣本t檢驗,計數資料采用χ2檢驗。計量資料用(±s)表示。采用IBM SPSS 19.0軟件包對所有數據進行統計學分析,以P<0.05為有統計學差異。
2 結 果
2.1 一般臨床資料及實驗室檢查指標比較:觀察組與對照組比較,兩組性別、Age、AST差異均無統計學意義(P>0.05);與對照組相比,觀察組BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C、C-RP、WBC、NEUT、NEUT%均明顯升高,差異有統計學意義(P<0.05~0.01),見表1。
表1 兩組一般資料及實驗室檢查指標水平(±s)
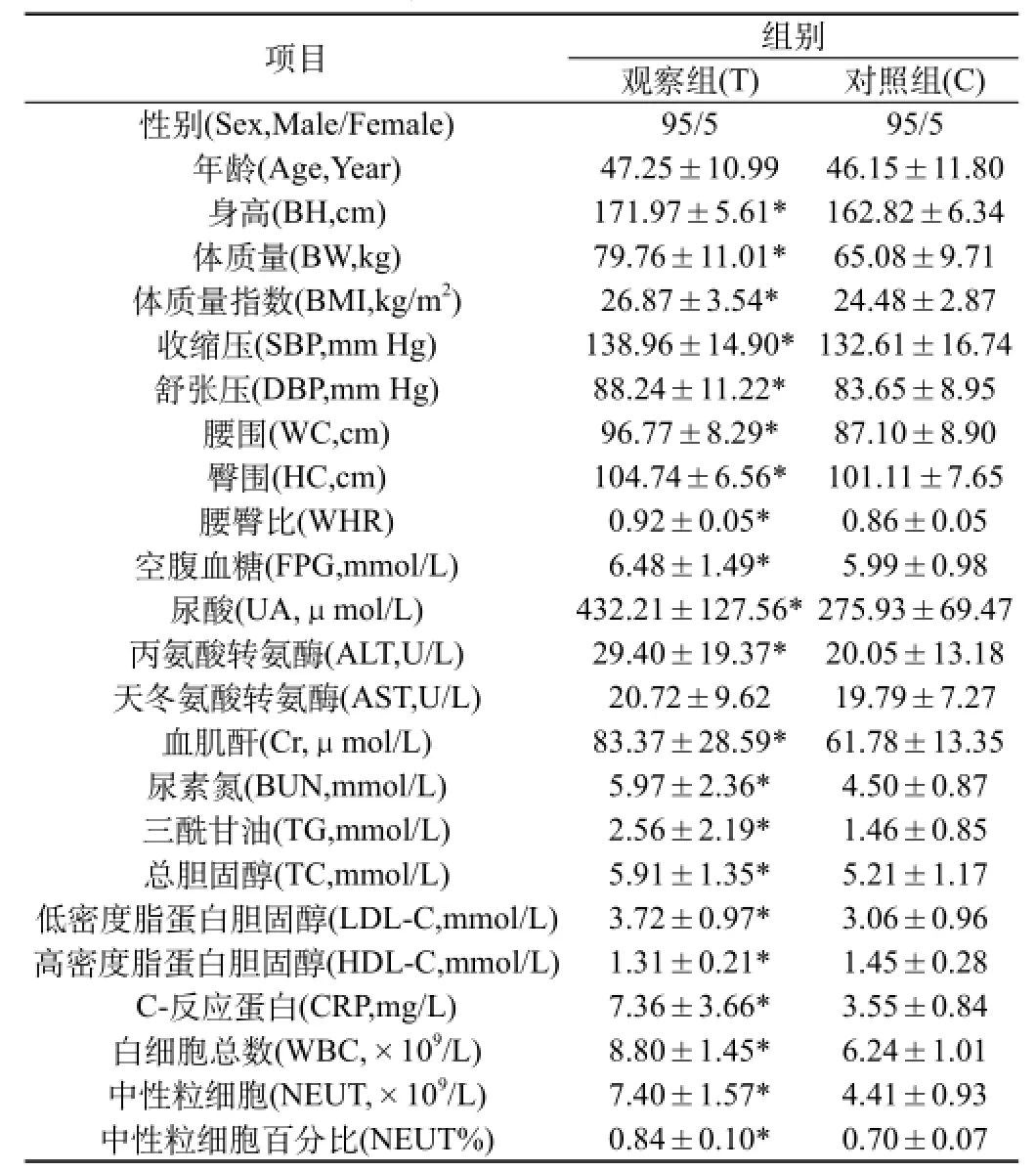
表1 兩組一般資料及實驗室檢查指標水平(±s)
注:*觀察組與對照組相比(T vs C)P<0.01,#觀察組與對照組相比(T vs C)P<0.05
項目 組別觀察組(T) 對照組(C)性別(Sex,Male/Female) 95/5 95/5年齡(Age,Year) 47.25±10.99 46.15±11.80身高(BH,cm) 171.97±5.61* 162.82±6.34體質量(BW,kg) 79.76±11.01* 65.08±9.71體質量指數(BMI,kg/m2) 26.87±3.54* 24.48±2.87收縮壓(SBP,mm Hg) 138.96±14.90*132.61±16.74舒張壓(DBP,mm Hg) 88.24±11.22* 83.65±8.95腰圍(WC,cm) 96.77±8.29* 87.10±8.90臀圍(HC,cm) 104.74±6.56* 101.11±7.65腰臀比(WHR) 0.92±0.05* 0.86±0.05空腹血糖(FPG,mmol/L) 6.48±1.49* 5.99±0.98尿酸(UA,μmol/L) 432.21±127.56*275.93±69.47丙氨酸轉氨酶(ALT,U/L) 29.40±19.37* 20.05±13.18天冬氨酸轉氨酶(AST,U/L) 20.72±9.62 19.79±7.27血肌酐(Cr,μmol/L) 83.37±28.59* 61.78±13.35尿素氮(BUN,mmol/L) 5.97±2.36* 4.50±0.87三酰甘油(TG,mmol/L) 2.56±2.19* 1.46±0.85總膽固醇(TC,mmol/L) 5.91±1.35* 5.21±1.17低密度脂蛋白膽固醇(LDL-C,mmol/L) 3.72±0.97* 3.06±0.96高密度脂蛋白膽固醇(HDL-C,mmol/L) 1.31±0.21* 1.45±0.28 C-反應蛋白(CRP,mg/L) 7.36±3.66* 3.55±0.84白細胞總數(WBC,×109/L) 8.80±1.45* 6.24±1.01中性粒細胞(NEUT,×109/L) 7.40±1.57* 4.41±0.93中性粒細胞百分比(NEUT%) 0.84±0.10* 0.70±0.07
2.2 兩組血清炎性因子表達水平比較:觀察組與對照組相比,IL-1β、IL-6、IL-18及TNF-α水平均顯著升高,差異有統計學意義(P <0.01)。見表2。
表2 兩組血清炎性因子水平(±s)

表2 兩組血清炎性因子水平(±s)
注:*觀察組與對照組相比(T vs C)P<0.01,#觀察組與對照組相比(T vs C)P<0.05
炎性因子 觀察組(T) 對照組(C)IL-1β(pg/mL) 62.41±13.68* 15.56±4.02 IL-6(pg/mL) 48.87±19.25* 10.21±3.62 IL-18(pg/mL) 198.48±21.40* 55.09±16.36 TNF-α(ng/mL) 532.77±217.95* 216.57±43.76
3 討 論
痛風(gout)是因嘌呤代謝障礙和(或)尿酸排泄減少、血UA持續升高而導致MSU晶體析出并沉積于組織或器官引起的一組臨床癥候群,屬于代謝性風濕病[3]。報道顯示,國內痛風的患病率目前在1%~3%,2009年山東沿海地區當地居民痛風患病率為1.96%,2007年~2008年美國痛風患病率上升至3.9%[4]。AGA可發生于任何年齡,發病高峰年齡為40歲左右,且常伴有糖尿病、肥胖、心腦血管病、腎臟病等,患病率隨年齡的增長有逐漸增高的趨勢。本研究中,與對照組相比,觀察組BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C均明顯升高(P<0.01)亦支持上述觀點。AGA臨床上以男性患者多見,女性約占5%[1],且多為絕經期后婦女。AGA發作時疼痛劇烈,患者異常痛苦,嚴重影響日常工作和生活。近年來研究發現單核/巨噬細胞系統在AGA啟動、進展及緩解中均發揮了關鍵作用,發作涉及IL-1β、IL-6、IL-18、TNF-α等多種炎性因子,其中IL-1β是MSU晶體誘導炎癥的關鍵因子,IL-6、IL-18、TNF-α亦發揮了重要作用。
AGA的前炎性介質來源于常駐的滑膜細胞和遷移的單核巨噬細胞,而NEUT的侵入和活化是最重要的環節。發病時關節滑液和滑膜中出現的大量NEUT甚至可與急性化膿性關節炎時相當[5]。本研究中,發病時的WBC、NEUT、NEUT%及CRP均顯著高于對照組,提示AGA發病時WBC及NEUT在炎癥初期就參與了反應。
IL-1β已被確定為MSU晶體誘導炎癥的關鍵因子,IL-1β對細胞和組織有多種作用。IL-1β是IL-1可溶型。IL-1主要由單核巨噬細胞所產生,也能由中性粒細胞合成,分為膜結合型(IL-α)和可溶型(IL-β)兩種。IL-1多存在于血液和組織中。其生物學活性包括活化巨噬細胞、粒細胞并增強其活性;刺激單核/巨噬細胞等合成IL-1、IL-6、IL-8及TNF-α;致炎性反應等。IL-1β在滑膜、滑液、軟骨等關節組織中均有它的活性形式被發現,并被認為是最經典的炎癥調節劑,是炎癥調節的始動因素。AGA時,MSU及UA激活NLRP3炎性體,上調IL-β表達,促進AGA患者炎性反應發生、進展[6-7]。本研究結果中發現,觀察組血清IL-1β水平在AGA發病時較對照組明顯升高,差異有統計學意義(P<0.01),提示IL-β在AGA炎癥發生、進展時發揮及其重要的作用。
IL-6是AGA的重要炎性因子,發病時關節液中IL-6水平明顯升高。本研究中,觀察組血清IL-6水平與對照組相比顯著升高,差異有統計學意義,表明IL-6在AGA炎癥過程中發揮重要作用。與國內研究顯示AGA致炎性因子IL-6表達顯著升高相一致[8]。IL-6主要由Th2細胞產生,單核/巨噬細胞、成纖維細胞、內皮細胞、肥大細胞等亦可產生。IL-1可刺激單核/巨噬細胞等合成IL-6。IL-6有多種生物活性,參與多種疾病的炎性反應[9],可抑制炎性反應的許多方面,如減少中性粒細胞,單核/巨噬細胞在脂多糖誘導下的IL-1、TNF的合成;增加IL-1Ra合成;促進IL-1β及TNF受體釋放;減少IL-8等炎癥趨化因子的表達。在痛風性關節炎患者滑液中發現IL-6水平升高。有報道稱,當痛風性關節炎等病情活動或關節破壞嚴重時,血清與關節液中IL-6水平升高。有人將IL-6作為判斷痛風性關節炎等疾病活動性和嚴重程度的指標[10]。
IL-18也是AGA炎性反應過程中的重要炎性因子,其可能主要來源于痛風性關節炎患者的軟骨和滑膜細胞及內皮細胞[5]。IL-18發揮生物學效應的活性成分,由單核/巨噬細胞、樹突狀細胞和Kupffer細胞,以及一些成骨細胞和角質形成細胞分泌,是在NLRP3炎性體介導caspase-1的活化,水解激活IL-18的前體釋放出來。作為AGA一個重要的調節因子,IL-18通過促進NEUT的聚集,促進炎性反應,具有促進T細胞增殖的作用,增強TH1細胞和NK細胞的細胞毒活性,是一種多效能炎性細胞因子[11]。IL-18最終作用是產生干擾素-γ,從而加速炎性反應,成熟IL-18對IFN-γ的產生過程和對促溶細胞性NK細胞的活性有重要影響。本研究中,觀察組血清IL-18水平與對照組相比顯著升高,差異有統計學意義(P<0.01),提示IL-18參與了AGA炎性反應,在AGA啟動、進展時發揮了重要作用。
TNF-α是一種具有內毒素樣抗腫瘤炎性細胞因子,可作用于T細胞、B細胞、NK細胞發揮多種生物學活性。TNF-α主要由巨噬細胞、單核細胞產生,中性粒細胞、內皮細胞、星狀細胞、平滑肌細胞、殺傷細胞也可產生TNF-α。有研究表明[12],TNF-α在風濕性關節炎的血清和滑膜中大量增加,并刺激下丘腦體溫調節中樞及巨噬細胞釋放IL-1、IL-6。TNF-α主要作用是刺激機體產生炎性反應,減低基質中蛋白多糖、膠原物質的合成,誘導基質金屬蛋白酶高表達,增加血管內皮細胞的通透性,刺激產生如IL-1、IL-6、IL-8等炎性細胞因子。研究顯示,在炎癥的早中期階段,痛風患者關節液中IL-1β、IL-6和TNF-α等炎性因子水平和白細胞水平明顯升高。本研究中,觀察組血清TNF-α水平與對照組相比顯著升高,差異有統計學意義(P <0.01),表明在AGA炎癥啟動階段TNF-α水平升高,與國內有些研究結果相一致[8,13]。TNF-α可加速急性滑膜炎關節滑液內的NEUT凋亡過程,凋亡的NEUT可被巨噬細胞所吞噬[5]。關于TNF-α對NEUT凋亡影響的研究結論尚不一致。
總之,本研究結果表明,IL-1β、IL-6、IL-18及TNF-α水平在AGA患者發病時異常,提示它們在AGA發病中參與了炎性反應過程,在炎癥機制中可能發揮了重要作用。結果亦提示,IL-1β、IL-6、IL-18及TNF-α在炎癥過程中存在共同作用,相互影響,各炎性因子之間的相互關系需要在今后的研究中進一步探討。
參考文獻
[1] Wallace K,Riedel A,Joseph-Ridge N,et al.In creasing prevalence of gout and hyperuricemia over 10 years among older adults in a managed care population[J].J Rheumatol,2004,31(18):1582-1587.
[2] Sidiropoulos PI,Goulielmos G,Voloudakis GK,et a1.Inflammasomes and rheumatic diseases: evolving concepts[J].Ann Rheum Dis,2008,67(10):1382-1389.
[3] Riehette P,Bardin T.Gout[J].Lancet,2010,375(9711):318-328.
[4] Zhu Y,Pandya BJ,Choi HK.Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008[J].Arthritis Rheum,201l,63(10):3136.
[5] 伍滬生.痛風與晶體性關節病[M].北京:人民衛生出版社,2014:62.
[6] Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 in flammasome[J].Nature,2006,440 (7081):237-239.
[7] Gotseh F,Romero R,Chaiworapongsa T,et al.Evidence of the involvement of caspase-1 underphysiologic and pathologic cellula stress during human pregnancy: a link between the inflammasome and parturition[J].J Maternal-Fetal Neonat Med,2008,21(9):605-616.
[8] 黨萬太,周京國,謝文光,等.NLRP3炎性體在痛風性關節炎患者炎性反應中的機制研究[J].中國免疫學雜志,2014,30(3):373-377.
[9] 祝威,汪欣,杜寶東,等.殺菌—通透性增強蛋白對分泌性中耳炎大鼠中耳黏膜TNF-α和IL-6表達的影響[J].吉林大學學報,2004,30 (1):41-43.
[10] Punzi I,Calo L,Plobani M.Clinical sig-nificance of cytokine determination in synovial fluid[J].Crit Rev Clin Lab Sci,2002,39 (1):63-88.
[11] Sugimoto T,Ishikawa Y,Yoshimoto T,et a1.Interleukin l8 acts on memory T helper cells type l to induce airway in flammation and hyper-responsiveness in a naive host mouse[J].J Exp Med,2004,l99(4):535-545.
[12] Yabe Y,Hagiwara Y,Suda H,et al.Joint immobmmatory conditions in rat knee joints[J].Connect Tissue Res,2010,44(8):1039-1046.
[13] 黨萬太,王婧,謝文光,等.sCD14在痛風性關節炎患者炎性反應中的變化及其意義[J].西安交通大學學報(醫學版),2015,36(4): 514-518.
中圖分類號:R589.7
文獻標識碼:B
文章編號:1671-8194(2016)16-0003-03
基金項目:青島市衛生科技發展計劃項目,項目編號:2014-WJZD103
*通訊作者:E-mail: huanfadings@163.com
Research of Serum Level of IL-1β, IL-6, IL-18 and TNF-α of Patients with Acute Gouty Arthritis
LIU Shu-juan1, DING Huan-fa1*, XU Xiao-chen1, WANG Shang-yun2, LAN Li-qiang1, WEI Yong-tao2
(1 Department of Endocrinology, Qingdao Eighth People's Hospital, Qingdao 266100, China; 2 Department of Laboratory, Qingdao Eighth People's Hospital, Qingdao 266100, China)
[Abstract]Objective To investigate the change of serum level of interleukin (IL)-1β, IL-6, IL-18 and tumor necrosis factor (TNF)-α in the subjects with acute gouty arthritis (AGA) and their significance. Methods Based on standards of American College of Rheumatology (ACR) in 1997, 100 AGA patients were selected as AGA group (T) and 100 healthy subjects as control group (C). IL-1β, IL-6, IL-18 and TNF-α were measured using Enzyme-linked immunosorbent assay (ELISA) in the two groups. The statistical data were analyzed by IBM SPSS 19.0 software. Independent-samples t test was used in two groups. Result The expression of IL-1β, IL-6, IL-18 and TNF-α increased significantly when compared to C (P<0.01). Conclusion Increased expression of IL-1β, IL-6, IL-18 and TNF-α level are involved in the inflammatory response and play important roles in the pathogenesis of the process of AGA.
[Key words]Interleukin-1β; Interleukin-6; Interleukin-18; Tumor necrosis factor-α; Arthritis gouty

