比較3種不同儲存條件對純鈦SLA表面生物學性能的影響*
崔玲
比較3種不同儲存條件對純鈦SLA表面生物學性能的影響*
崔玲①
【摘要】目的:比較3種不同儲存條件對純鈦SLA表面生物學性能的影響。方法:采用噴砂加酸蝕的方法在商用二級純鈦鈦片上制備SLA表面,并將其置于3種不同環境中儲存不同的時間,分組如下:Ⅰ組鈦片為常溫常壓保存;Ⅱ組鈦片為真空保存;Ⅲ組鈦片NaCl溶液中保存。分別對不同組別鈦片的理化性質、生物活性進行比較。結果:三組之中,Ⅲ組中的純鈦SLA表面表面自由能、蛋白質吸附率、MG63成骨細胞的黏附、增殖、ALP活性及表面礦化效果均為最佳,Ⅰ組中的純鈦SLA表面最容易受到C元素的污染,理化性能及生物活性均明顯下降。結論:不同儲存條件對純鈦SLA表面的理化性質、生物活性具有明顯的影響。將處理后的鈦片置于NaCl溶液中有利于降低C污染,并促進鈦片表面的蛋白質吸附、細胞黏附、增殖與分化。
【關鍵詞】儲存條件; 純鈦SLA表面; 表面理化性能; 生物活性;
First-author’s address:The Eighth People’s Hospital of Guangzhou,Guangzhou 510440,China
隨著人們對口腔健康重視程度的不斷提高,人工種植牙在口腔修復中的應用也越來越廣泛。純鈦因其良好的穩定性、生物相容性、機械性能成為目前臨床最常使用的種植體材料[1]。但其經生物活化后會隨保存時間的延長出現老化現象,選擇合適的保存方法延緩甚至組織老化的發生直接影響到種植牙修復的成功率[2]。本文通過分析不同保存方法下純鈦表面理化性能與生物活性的變化情況,探討最佳保存方法,具體報告如下。
1 資料與方法
1.1 一般資料 選取將商用二級純鈦片作為實驗材料,并將其切割成15 mm×15 cm×1.5 mm的鈦片。經SiC防水砂紙打磨拋光后,采用Al2O3顆粒進行噴砂,H2SO4/HCl混合酸進行酸蝕處理,獲得純鈦SLA表面。經超聲清洗、干燥、紫外線消毒等一系列方法處理后,按照預定設計儲存于3種不同的條件下:Ⅰ組鈦片為常溫常壓密封保存;Ⅱ組鈦片為真空保存;Ⅲ組鈦片保存在NaCl溶液中。
1.2 方法
1.2.1 不同儲存條件下鈦片的理化性質變化情況 將三組鈦片在不同保存方式下保存3、14、28 d后,每組隨機抽取3片進行鈦片表明理化性能分析。在超高真空的環境下,通過掃描電鏡與X線光電子能譜儀分別對各組鈦片的表面形貌、表面元素構成進行觀察并分析。然后,通過表面粗糙度測量儀分析不同保存方式和保存時間下鈦片的表面粗糙度,以利于鈦片表面拓撲結構的分析。再對不同組別鈦片在2 μL ddH2O中的表面接觸面積進行測定。
1.2.2 不同儲存條件下鈦片的生物活性變化情況
1.2.2.1 蛋白質吸附情況 選擇牛血清白蛋白作為模型蛋白,并將300 μL濃度為1 mg/mL的蛋白質溶液轉移到不同組別鈦片表面,在37 ℃條件下孵育1 h,棄去未吸附的蛋白液后,將其與微喹啉二甲酸繼續混合并在相同條件下孵育0.5 h。在562 nm的波長下測定OD值、繪制標準曲線,并據此計算蛋白質吸附量。
1.2.2.2 MG63成骨細胞的黏附與增殖情況 MG63成骨細胞株經培養、傳代、接種并沖洗、消化、離心、重懸等處理后,通過對MG63成骨細胞懸液進行細胞計數,按照操作要求調整細胞濃度,然后接種于不同組別鈦片表面,于37 ℃、5%二氧化碳濃度的細胞培養箱中進行培養、換液,至實驗時點后經漂洗、多聚甲醛處理、常溫固定、緩沖液再次漂洗、通透細胞、熒光劑染色、漂洗、干燥等一系列處理后,在專業的顯微鏡成像系統中隨機選取10個視野進行圖像采集,計算并統計鈦片上吸附細胞的數目。同時,選擇MTS試劑盒對MG63成骨細胞在不同組別鈦片上的增殖情況進行檢測。
1.2.2.3 不同鈦片表面的堿性磷酸酶活性 通過堿性磷酸酶(ALP)試劑盒對不同組別鈦片上的MG63成骨細胞ALP活性進行測定,檢測使用酶標儀,檢測波長為405 nm,讀取吸光度繪制標準曲線,并通過ALP活性分析成骨細胞在不同鈦片上的早期分化活性[3]。
1.2.2.4 不同鈦片表面MG63成骨細胞的礦化情況測定 細胞培養的第14天,在不同鈦片表面的培養細胞層上實施茜素紅染色,并行陽性礦化結節檢測,檢測波長為620 nm,通過礦化能力的測定分析成骨細胞在不同鈦片上的晚期分化活性[4]。
蛋白質吸附實驗及細胞實驗均采用儲存了28 d的鈦片。
1.3 統計學處理 本次實驗數據采用SPSS 12.0統計學軟件進行數據分析,計量資料以(±s)表示,比較采用t檢驗,對存在交互效應的組別可以通過單因素方差分析及Levene’s test檢驗進行分析,以P<0.05為差異有統計學意義。
2 結果
2.1 不同組別鈦片表面理化性質檢測結果
2.1.1 不同組別鈦片表面元素構成比較 經掃描電鏡觀察,不同組別鈦片在保存不同時間后,其鈦片表面的形貌基本相似,均為多孔狀結構,且分布均勻、結構規則。但在表面元素構成上,Ⅰ組的C元素隨保存時間延長不斷構成比例不斷升高,而O元素、Ti元素、N元素不斷降低,與Ⅱ、Ⅲ組比較有統計學差異(P<0.05),見表1。
表1 不同組別鈦片表面元素構成比較(±s) %
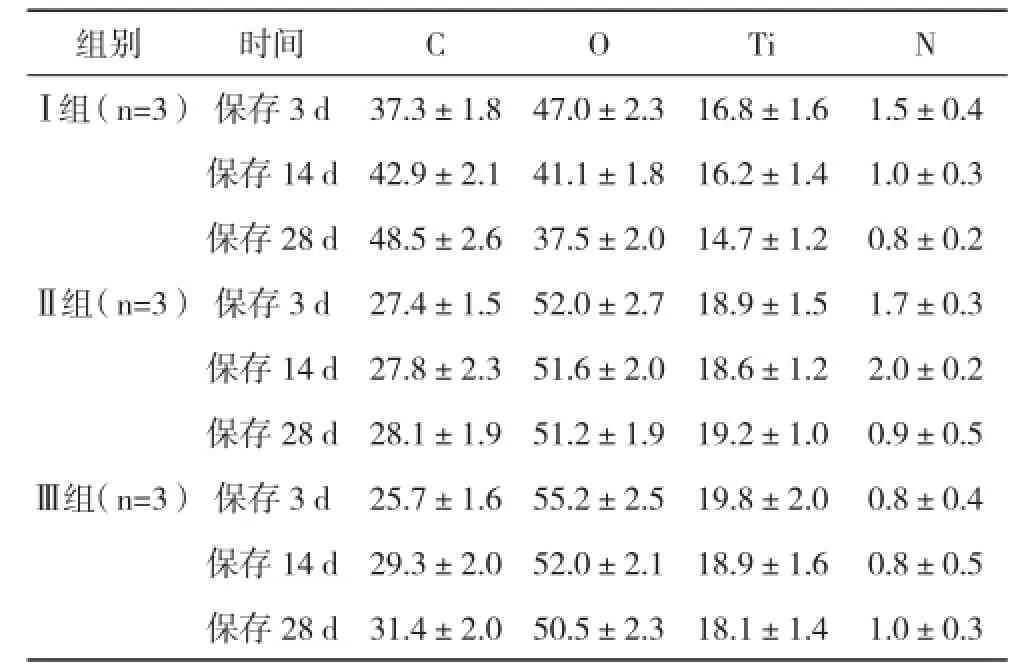
表1 不同組別鈦片表面元素構成比較(±s) %
組別 時間 C O Ti NⅠ組(n=3)保存3 d 37.3±1.8 47.0±2.3 16.8±1.6 1.5±0.4保存14 d 42.9±2.1 41.1±1.8 16.2±1.4 1.0±0.3保存28 d 48.5±2.6 37.5±2.0 14.7±1.2 0.8±0.2Ⅱ組(n=3)保存3 d 27.4±1.5 52.0±2.7 18.9±1.5 1.7±0.3保存14 d 27.8±2.3 51.6±2.0 18.6±1.2 2.0±0.2保存28 d 28.1±1.9 51.2±1.9 19.2±1.0 0.9±0.5Ⅲ組(n=3)保存3 d 25.7±1.6 55.2±2.5 19.8±2.0 0.8±0.4保存14 d 29.3±2.0 52.0±2.1 18.9±1.6 0.8±0.5保存28 d 31.4±2.0 50.5±2.3 18.1±1.4 1.0±0.3
2.1.2 不同組別鈦片表面ddH2O接觸面積比較 不同組別鈦片的粗糙程度參數a、St、Sdr比較無明顯差異,處于同一水平。而其親水性比較存在明顯的變化,Ⅰ組的純鈦SLA表面,則均勻的隨儲存時間的延長,鈦片與ddH2O表面接觸面積不斷下降,而Ⅲ組下降程度最低,Ⅰ組與Ⅱ、Ⅲ組ddH2O表面接觸面積比較差異均有統計學意義(P<0.05),見表2。
表2 不同組別鈦片表面ddH20接觸面積比較(±s) %
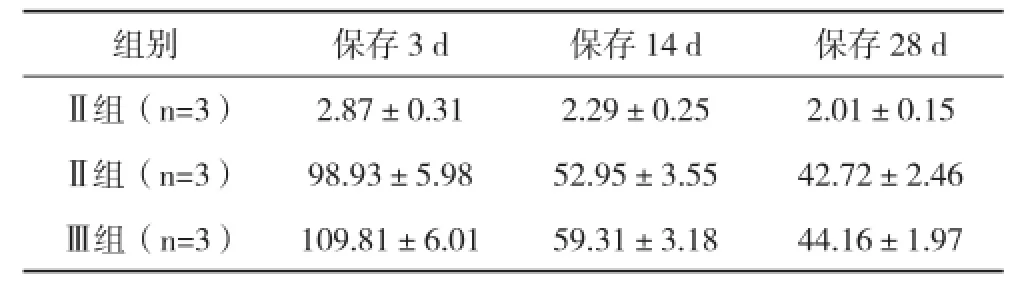
表2 不同組別鈦片表面ddH20接觸面積比較(±s) %
組別 保存3 d 保存14 d 保存28 dⅡ組(n=3) 2.87±0.31 2.29±0.25 2.01±0.15Ⅱ組(n=3) 98.93±5.98 52.95±3.55 42.72±2.46Ⅲ組(n=3) 109.81±6.01 59.31±3.18 44.16±1.97
2.2 不同組別鈦片表面的生物活性檢測結果
2.2.1 不同組別鈦片表面蛋白吸附率比較 Ⅰ組鈦片隨著保存時間延長出現顯著下降,而Ⅱ、Ⅲ組波動相對較小,均比Ⅰ組高,差異均有統計學意義(P<0.05),見表3。
2.2.2 不同組別鈦片表面MG63成骨細胞黏附數目比較 隨著細胞培養時間的延長,鈦片表面MG63成骨細胞黏附數目均不斷增長,但Ⅰ組鈦片的黏附數目最低,在不同培養時間下的比較均顯著低于其他組別,Ⅲ組鈦片的黏附數目最高,顯著高于Ⅰ、Ⅱ組鈦片,比較差異有統計學意義(P<0.05),見表4。
表3 不同組別鈦片表面蛋白質吸附率比較(±s) %

表3 不同組別鈦片表面蛋白質吸附率比較(±s) %
組別 保存3 d 保存14 d 保存28 dⅠ組(n=3) 10.16±0.43 6.21±0.23 4.87±0.15Ⅱ組(n=3) 10.03±0.57 8.93±0.51 8.81±0.34Ⅲ組(n=3) 9.97±0.56 9.23±0.45 9.01±0.41
表4 不同組別鈦片表面MG63成骨細胞黏附數目比較(±s) ×103
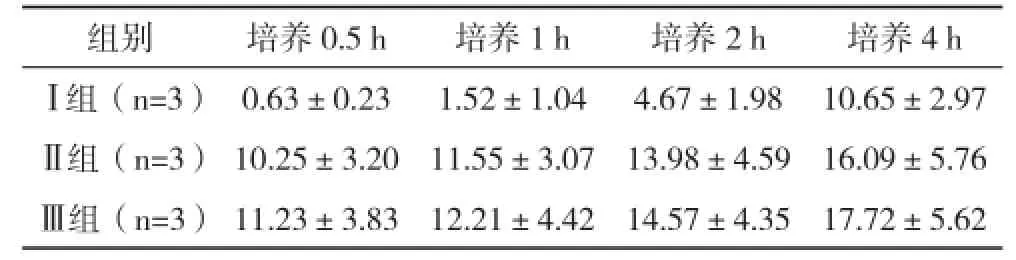
表4 不同組別鈦片表面MG63成骨細胞黏附數目比較(±s) ×103
組別 培養0.5 h 培養1 h 培養2 h 培養4 hⅠ組(n=3) 0.63±0.23 1.52±1.04 4.67±1.98 10.65±2.97Ⅱ組(n=3) 10.25±3.20 11.55±3.07 13.98±4.59 16.09±5.76Ⅲ組(n=3) 11.23±3.83 12.21±4.42 14.57±4.35 17.72±5.62
2.2.3 不同組別鈦片表面MG63成骨細胞增殖后吸光度比較 在細胞培養的第1、3天均有Ⅲ組>Ⅱ組>Ⅰ組的情況,Ⅱ與Ⅲ組無統計學差異,但均比Ⅰ組高,差異均有統計學意義(P<0.05),見表5。
表5 不同組別鈦片表面MG63成骨細胞增殖后吸光度比較(±s)×102
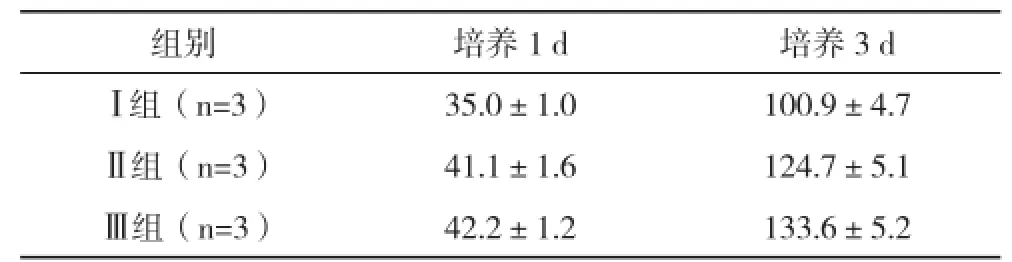
表5 不同組別鈦片表面MG63成骨細胞增殖后吸光度比較(±s)×102
組別 培養1 d 培養3 dⅠ組(n=3) 35.0±1.0 100.9±4.7Ⅱ組(n=3) 41.1±1.6 124.7±5.1Ⅲ組(n=3) 42.2±1.2 133.6±5.2
2.2.4 不同組別鈦片表面MG63成骨細胞ALP吸光度比較 培養7 d,Ⅰ、Ⅱ、Ⅲ組鈦片表面MG63成骨細胞ALP吸光度值分別為(25.0±0.6)、(25.1±0.8)、(24.8±0.7)×102,三組大致相近,比較差異無統計學意義(P>0.05)。
2.2.5 不同組別鈦片表面礦化溶解后的吸光度比較 培養14 d,Ⅰ、Ⅱ、Ⅲ組鈦片表面礦化溶解后的吸光度值分別為(3.5±0.3)、(3.7±0.3)、(4.1±0.5)×102,Ⅲ組>Ⅱ組>Ⅰ組,比較差異有統計學意義(P<0.05)。
3 討論
人工種植體在口腔修復治療中應用廣泛,但種植成功率受多種因素的影響,一方面,種植體植入后需要較長的愈合時間(6~12周),此間容易受多種風險因素的干擾,另一方面,受限于材料的生物相容性,種植體和骨結合率總體上較低(50%~65%),在實際應用中受到較大的限制[5]。如何使種植體更快更好與骨結合是研究的重點和難點[6-7]。
種植牙的植入與骨結合的過程實際上是生物組織與生物活性材料化學鍵的結合過程,而作為影響骨結合速度、強度的主要因素,種植體表面的生物活性高低、理化性能好壞至關重要,純鈦表面的理化性能與生物活性之間也息息相關。緊密相連[8-9]。鈦金屬是一種生物惰性材料,從本身的性質來說,其與骨組織之間存在較大的差異,一旦純鈦表面形成鈍態氧化膜之后,則其與骨組織的化學鍵性結合更加困難[10-13]。因而,臨床應用中通常采用表面活化的方法來實現種植體與生物組織直接鍵性結合的目的。無論是何種純鈦表面生物活化處理方法,均存在時效性。往往通過一段時間的保存后,純鈦表面經處理后得到的高表面能及高生物活性效應會逐漸消失,生物活性也會隨著保存時間的延長出現明顯降低的情況,也即鈦表面生物活性的老化[14-16]。
通過蛋白質吸附實驗、成骨細胞在材料表面的黏附、增殖、分化、礦化情況的分析,則可以對材料的生物活性進行反映。本文對比較了3種不同儲存條件對純鈦SLA表面生物學性能的影響,結果發現,常溫常壓下密封保存的鈦片保存過程中容易受到C污染,導致其C元素構成比例增加,導致其表面親水性下降,影響其蛋白吸附能力和細胞黏附、增殖及分化的能力。而將鈦片真空保存及液體保存可以降低C元素污染,并能保持超級親水性,有利于鈦片的蛋白吸附及細胞的黏附、增殖及分化。其中,NaCl液體保存的效果最佳。盧海賓等[17]的研究比較了經酸蝕處理的鈦片分別保存于常溫常壓條件、ddH2O、NaCl和CaCl2溶液四種條件下的表面C元素含量、靜態水接觸角、MG63成骨細胞在接種不同時間后的黏附數目、細胞增殖能力,結果大致與本文相似。由此可見,這種趨勢在不同的純鈦表面類型具有一致性。
不同儲存條件對純鈦SLA表面的理化理化性質、生物活性具有明顯的影響。將處理后的鈦片置于NaCl溶液中有利于降低C污染,并促進鈦片表面的蛋白質吸附、細胞黏附、增殖與分化。
參考文獻
[1]盧海賓.不同保存方法對純鈦表面理化性能以及生物活性的影響[D].廣州:南方醫科大學,2013.
[2]張燕,王星,齊魯,等.分根術聯合純鈦樁核冠保存治療下頜磨牙殘冠殘根的臨床觀察[J].新疆醫學,2015,45(1):64-66.
[3] Gomathisankar P,Yamamoto D,Katsumata H,et al.Photocatalytic hydrogen production with aid of simultaneous metal deposition using titanium dioxide from aqueous glucose solution[J].International Journal of Hydrogen Energy,2013,38(14):5517-5524.
[4]丁婧文.紫外線處理微弧氧化純鈦種植體早期成骨作用的組織學探討[D].廣州:南方醫科大學,2013.
[5] Rajesh P,Muraleedharan C V,Komath M,et al.Pulsed laser deposition of hydroxyapatite on titanium substrate with titania interlayer[J].Journal of Materials Science,Materials in Medicine,2011,22(3):497-505.
[6]童興野,芶立.射頻等離子體對純鈦表面的氨基化改性[J].真空科學與技術學報,2014,34(6):640-644.
[7]賈曉瑞,辛海濤,張強,等.超細晶純鈦種植體表面微弧氧化處理的實驗研究[J].牙體牙髓牙周病學雜志,2015,12 (3):158-161,172.
[8]霍芳軍,謝利,童興野,等.陽極氧化制備的鈦表面不同微觀形貌膜層耐腐蝕性研究[J].華西口腔醫學雜志,2015,33 (6):646-650.
[9] Zhang W N,Lu J L,Zhu J W,et al.Studies on the preparation and thermal stability of SiO2aerogels doped with fibrous bructite and TiO2opacifier[J].Asian Journal of Chemistry:An International Quarterly Research Journal of Chemistry,2013,25(2):877-879.
[10]沈彬,劉向輝,孫衛革,等.純鈦表面不同處理方法對成纖維細胞生長影響的研究[J].安徽醫科大學學報,2015,14 (6):775-778.
[11]賈曉瑞.超細晶純鈦材料表面微弧氧化處理及其生物安全性研究[D].西安:第四軍醫大學,2015.
[12]商亞微,張偉,何晶,等.純鈦表面涂層(Ca+Zn)/P比值與成骨細胞生物活性的關系[J].上海口腔醫學,2015,24 (1):46-51.
[13] Carreno-Morelli E,Bidaux J E, Rodriguez-Arbaizar M,et al.Production of titanium grade 4 components by powder injection moulding of titanium hydride[J].Powder Metallurgy,2014,57 (2):89-92.
[14]邵文儉,曹歡,繆羽,等.二氧化鋯全瓷冠與純鈦PFM全冠修復前牙的臨床對比研究[J].包頭醫學院學報,2015,31 (11):80-81.
[15]陳赟.純鈦種植體表面摻鍶納米二氧化鈦層的制備和生物學評價[D].杭州:浙江大學,2015.
[16] Patnaik A K,Poondla N,Menzemer C C,et al. Understanding the mechanical response of built-up welded beams made from commercially pure titanium and a titanium alloy[J].Materials Science & Engineering A,2014,590(2):390-400.
[17]盧海賓,萬蕾,張雪洋,等.純鈦表面在不同儲存條件下理化性能及生物活性的變化[J].臨床醫學工程,2016,23(6):9-13.
(WSTJJ20140114441781198501014116)
①廣州市第八人民醫院 廣東 廣州 510440
doi:10.3969/j.issn.1674-4985.2016.20.003
收稿日期:(2016-06-02) (本文編輯:蔡元元)
*基金項目:廣東省醫學科學項目
Comparison of the Influence of Three Different Storage Conditions on the Biological Properties of Titanium SLA Surface
CUI Ling.//Medical Innovation of China,2016,13(20):009-012
【Abstract】Objective:To compare the effect of three different storage conditions on the biological properties of pure titanium SLA surface.Method:SLA surface were produced with commercial pure titanium disk by treated with the method of sand blasting and acid-etch,and store in three different environments of different time,group Ⅰ:atmospheric pressure preservation;group Ⅱ:vacuum preservation;group Ⅲ:NaCl solution.Physical and chemical properties, biological activity were compared.Result:Among the three groups,the pure titanium SLA surface in group Ⅲ showed the best effect in the surface free energy,protein adsorption rate,MG63 osteoblast adhesion, proliferation and ALP activity and mineralization.Physical and chemical properties and biological activity of surface group Ⅰ decreased obviously because of C element pollution.Conclusion:The difference of storage conditions have significant impacts on physical and chemical properties,biological activity of pure titanium SLA surface.Storing titanium plate in NaCl solution is helpful to reduce the pollution of the C,and increase protein adsorption,cell adhesion, proliferation and differentiation on the pure titanium SLA surface.
【Key words】Storage conditions; Pure titanium surface of SLA; Surface physical and chemical properties; Biological activity

