嗅鞘細胞聯合神經干細胞對大鼠急性脊髓損傷及腦源性神經營養因子表達的影響*
陳大偉劉燕青張朝
嗅鞘細胞聯合神經干細胞對大鼠急性脊髓損傷及腦源性神經營養因子表達的影響*
陳大偉①劉燕青①張朝①
【摘要】目的:探討嗅鞘細胞(OECs)聯合神經干細胞(NSCs)對大鼠急性脊髓損傷及腦源性神經營養因子(Brain Derived Neurotrophic Factor,BDNF)表達的影響。方法:取新生3 d SD大鼠的海馬和嗅球制備神經干細胞和嗅鞘細胞,對80只SD大鼠做急性脊髓損傷造模,隨機分為對照組(假手術組)、NSCs移植組、OECs移植組、NSCs+OECs聯合移植組(記為實驗A、B、C組),細胞移植。于術前,術后1、3、7、14、21 d行BBB評分、斜板實驗和運動誘發電位(MEP N1波)潛伏期檢測,在各組隨機抽一只SD大鼠做免疫組化,觀察比較受損脊髓中BDNF的表達情況。結果:(1)BBB評分變化:除第1天外,各實驗組恢復程度均明顯大于對照組(P<0.05),第7天開始各實驗組間兩兩比較差異均有統計學意義(P<0.05)。(2)斜板試驗角度變化:第1周開始,四組中任意兩組比較差異均有統計學意義(P<0.05)。(3)MEP(N1波)潛伏期變化:自第3天,四組中任意兩組比較差異均有統計學意義(P<0.05)。(4)BDNF染色陽性細胞數變化:細胞移植后,各組大鼠受損脊髓中BDNF開始升高,第3天到高峰后減少。術后第3天開始,四組中任意兩組比較均有統計學意義(P<0.05)。結論:采用細胞移植治療大鼠急性脊髓損傷,OECs與NSCs聯合移植治療效果最佳;單細胞移植時,OECs比NSCs移植治療效果更強。聯合移植組中BDNF表達最高。
【關鍵詞】嗅鞘細胞; 神經干細胞; 急性脊髓損傷; 腦源性神經營養因子
First-author’s address:The First Affiliated Hospital of Baotou Medical College,Baotou 014010,China
脊髓損傷(Spinal Cord Injury,SCI)是臨床上中樞神經系統一種嚴重的創傷性疾病。該病有發病率高,致殘率高,治療費用高等特點,一直被醫學界高度關注。僅北京地區脊髓損傷發病率就從上世紀80年代末6.8/百萬人增至2002年的60/百萬人,十多年間發病率增長近10倍[1]。
急性脊髓損傷動物實驗中新方法和臨床中治療措施是層出不窮,細胞移植是一非常有前途的修復策略。本實驗對大鼠急性損傷脊髓局部注入神經干細胞,嗅鞘細胞,神經干細胞+嗅鞘細胞,通過BBB評分、斜板實驗、運動誘發電位(MEP)及免疫組化檢測BDNF表達情況,來評判各組受損脊髓恢復情況,比較兩種細胞各自、聯合對急性脊髓損傷修復的能力,以期可作為臨床治療的實驗依據。
1 材料與方法
1.1 實驗材料 SD大鼠88只,成年SD大鼠85只(80只實驗,5只備用);另3只(出生3 d)SD大鼠為神經干細胞和嗅鞘細胞取材。隨機分組(每組20只):對照組(假手術組)、NSCs移植組、OECs移植組、NSCs+OECs聯合移植組(分別記為實驗A、B、C組)。
1.2 試劑與儀器 兔抗鼠巢蛋白(Nestin)單抗、兔抗鼠P75單抗、異硫氰酸熒光素(FITC)標記羊抗兔二抗、兔抗大鼠BDNF多克隆抗體、免疫組化SABC試劑盒、生物素標記羊抗兔IgG二抗等試劑、IX71型倒置熒光顯微鏡、Thermo3110型5%CO2培養箱、TGL-16B型普通臺式離心機等。
1.3 實驗方法
1.3.1 新生SD大鼠海馬和嗅球的取材 將(出生3 d)SD大鼠消毒后,引頸脫位法處死,無菌操作顯露兩大腦半球、嗅球和小腦。完全剝離海馬,分離嗅球保持兩側嗅鞘完整。去除表面毛細血管等軟組織,4 ℃下分別清洗后備用。
1.3.2 細胞培養及鑒定
1.3.2.1 嗅鞘細胞的培養及鑒定 將嗅球入DMEM/ F12培養液,剪碎吹打分離,細胞篩網過濾后離心沉淀,沉淀入DMEM/F12細胞培養液(按比例配入bFGF、EGF和B27),至培養箱(37 ℃、5%CO2)。每3天全換一次培養液,16 d傳代1次。第二代細胞懸液入凹玻片,培養、棄液,PBS漂洗,固定,依步驟進行至滴兔抗鼠P75一抗(1∶200),PBS漂洗3次,滴羊抗兔二抗(1∶400),孵育封片。倒置熒光顯微鏡下觀察。
1.3.2.2 神經干細胞的培養及鑒定 將海馬同法制備,每2~4天換半量培養液,傳代1次約6~8 d。鑒定同樣,兔抗鼠Nestin為一抗(1∶100),羊抗兔二抗(1∶200)。封片觀察。
1.3.3 大鼠急性脊髓損傷Allen’s模型的制備及局部注射細胞移植 將大鼠麻醉見效,俯臥固定,術區備皮消毒,脊正中切口(約3 cm),顯露T10~12棘突及椎板。定位切除T12棘突及椎板上半部分,T11全椎板和棘突,T10棘突及椎板下半部分[2],顯露T11相應脊髓節段的硬脊膜,定為損傷區。自制改良Allen’s撞擊器重物15 g高度6 cm自由落下,瞬間下落能量對T11段脊髓致傷即制為大鼠急性脊髓損傷實驗模型[3],打擊后重物停3 min,硬脊膜靜脈充血增粗,局部紫紅色,鼠尾痙攣擺動,后肢回縮抽動,即打擊有效。造模后即行細胞移植(生理鹽水植入對照組、NSCs植入實驗A組、OECs植入實驗B組、NSCs與OECs混合1∶1植入實驗C組):用1 mL無菌注射器慢注入0.1 mL細胞懸液(數量約為1×105個)。逐層關閉傷口。術后禁食水數小時。1.3.4 功能檢測 在術后1、3、7、14 d和21 d,隨機抽取對照組、實驗組各15只大鼠,進行BBB評分,評分基本內容:雙后肢可活動的關節數量、活動范圍、步態、負重、前后肢協調性及尾部活動情況,共22個分數級別;斜板實驗[4],實驗時將大鼠頭朝前,身體軀干與斜板平行,角度漸大,大鼠在板上停留5 s且不滑落,記錄角度,測3次取平均值。兩檢測法對大鼠后肢運動功能進行雙盲法評分來了解受損脊髓功能恢復情況;再行神經電生理運動誘發電位(motor evoked potentials,MEP)潛伏期檢測,刺激電極穿骨膜置于皮層,記錄電極置于暴露的坐骨神經,參考電極位于大鼠硬腭下。觀察脊髓傳導或外周運動神經功能狀況。
1.3.5 大鼠灌注、取材、固定與免疫組化 每組隨機抽一只大鼠麻醉開胸,用靜脈針頭經左心室入主動脈,待冰鹽水從右心耳流出后灌注4%多聚甲醛。切取T10~12對應脊髓節段(損傷處為中心約1 cm),入10%福爾馬林固定,脫水沉底后石蠟包埋,厚度10 μm連續切片。按SABC試劑盒操作說明進行。按步驟進行,其中按步滴入一抗兔抗鼠BDNF多克隆抗體(1∶200)、生物素化標記的二抗羊抗兔IgG。封片選最優切片15張。10倍光鏡下分別計數4個視野內BDNF染色陽性細胞占總計數細胞比例,即為陽性細胞標記指數,染色陽性標志是細胞漿或細胞膜呈明顯棕黃色。即檢測BDNF在受損脊髓中表達情況。
1.4 統計學處理 實驗結果采用SPSS 17.0軟件處理,計量資料以 (±s)表示,比較采用單因素方差分析(ANOVA),P<0.05為差異有統計學意義。
2 結果
2.1 SD大鼠急性脊髓損傷細胞移植后BBB評分變化 除第1天外,各實驗組恢復程度均明顯大于對照組(P<0.05),第7天開始各實驗組間兩兩比較差異均有統計學意義(P<0.05)。見表1、圖1。
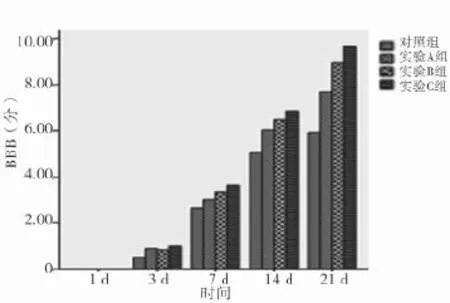
圖1 SD大鼠急性脊髓損傷細胞移植后BBB評分變化
2.2 SD大鼠急性脊髓損傷細胞移植后斜板實驗角度變化 第1周開始,四組中任意兩組比較差異均有統計學意義(P<0.05)。見表2、圖2。
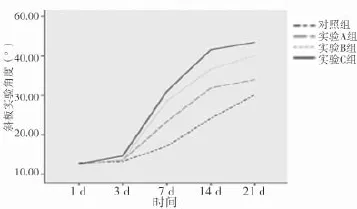
圖2 SD大鼠急性脊髓損傷細胞移植后斜板試驗角度變化
2.3 SD大鼠急性脊髓損傷細胞移植MEP(N1波)潛伏期變化 自第3天,四組中任意兩組比較差異均有統計學意義(P<0.05)。見表3、圖3。
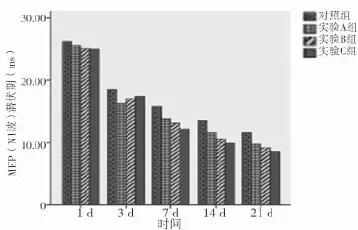
圖3 SD大鼠急性脊髓損傷細胞移植MEP(N1波)潛伏期變化
2.4 SD大鼠急性脊髓損傷細胞移植后BDNF染色表達陽性的細胞數變化 細胞移植后,各組大鼠受損脊髓中BDNF開始升高,第3天到高峰后減少。術后第3天開始,四組中任意兩組比較均有統計學意義(P<0.05)。見表4、圖4。
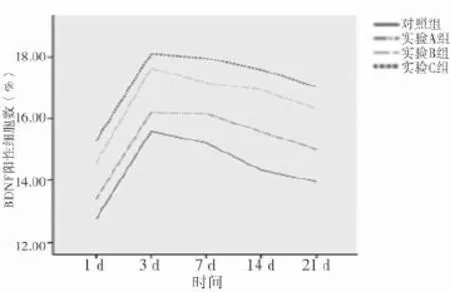
圖4 SD大鼠急性脊髓損傷細胞移植后BDNF染色表達陽性細胞數變化
表1 SD大鼠急性脊髓損傷細胞移植后BBB評分變化(±s) 分
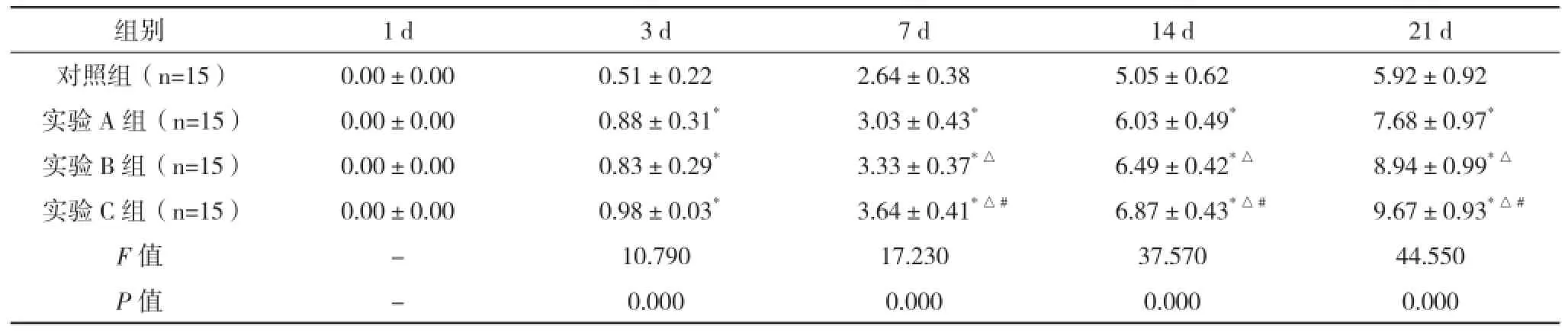
表1 SD大鼠急性脊髓損傷細胞移植后BBB評分變化(±s) 分
*與對照組比較,P<0.05;△與實驗A組比較,P<0.05;#與實驗B組比較,P<0.05
組別 1 d 3 d 7 d 14 d 21 d對照組(n=15) 0.00±0.00 0.51±0.22 2.64±0.38 5.05±0.62 5.92±0.92實驗A組(n=15) 0.00±0.00 0.88±0.31*3.03±0.43*6.03±0.49*7.68±0.97*實驗B組(n=15) 0.00±0.00 0.83±0.29*3.33±0.37*△6.49±0.42*△8.94±0.99*△實驗C組(n=15) 0.00±0.00 0.98±0.03*3.64±0.41*△#6.87±0.43*△#9.67±0.93*△#F值 - 10.790 17.230 37.570 44.550 P值 - 0.000 0.000 0.000 0.000
表2 SD大鼠急性脊髓損傷細胞移植后斜板試驗角度變化(±s)
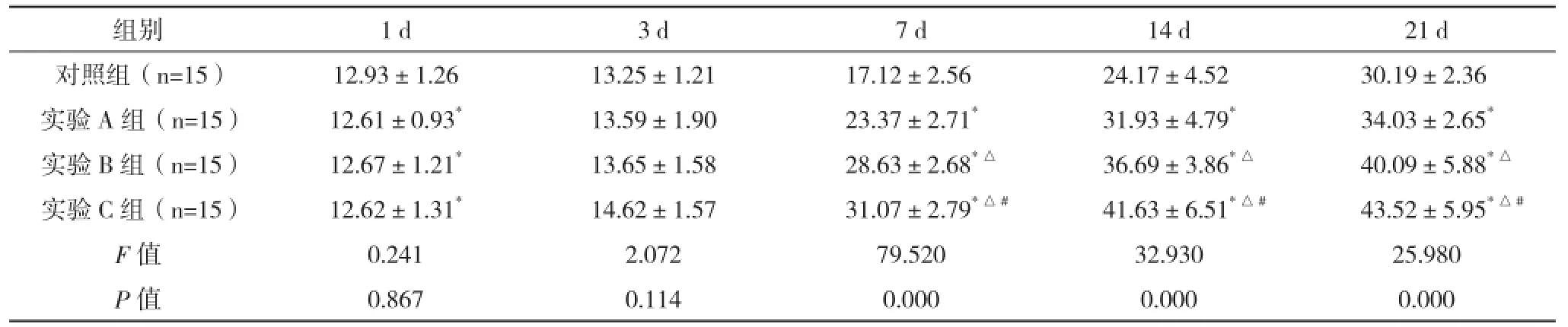
表2 SD大鼠急性脊髓損傷細胞移植后斜板試驗角度變化(±s)
*與對照組比較,P<0.05;△與實驗A組比較,P<0.05;#與實驗B組比較,P<0.05
組別 1 d 3 d 7 d 14 d 21 d對照組(n=15) 12.93±1.26 13.25±1.21 17.12±2.56 24.17±4.52 30.19±2.36實驗A組(n=15) 12.61±0.93*13.59±1.90 23.37±2.71*31.93±4.79*34.03±2.65*實驗B組(n=15) 12.67±1.21*13.65±1.58 28.63±2.68*△36.69±3.86*△40.09±5.88*△實驗C組(n=15) 12.62±1.31*14.62±1.57 31.07±2.79*△#41.63±6.51*△#43.52±5.95*△#F值 0.241 2.072 79.520 32.930 25.980 P值 0.867 0.114 0.000 0.000 0.000
表3 SD大鼠急性脊髓損傷細胞移植MEP(N1波)潛伏期變化(±s) ms
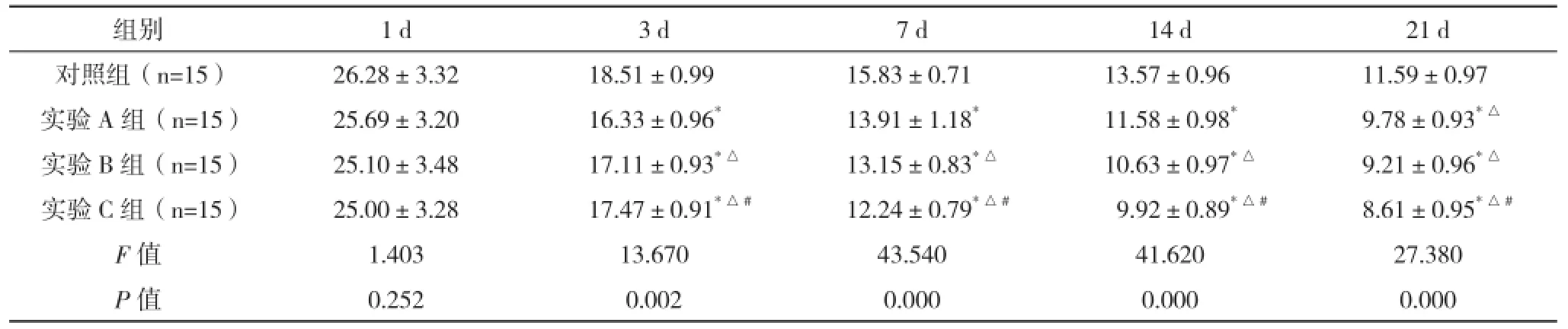
表3 SD大鼠急性脊髓損傷細胞移植MEP(N1波)潛伏期變化(±s) ms
*與對照組比較,P<0.05;△與實驗A組比較,P<0.05;#與實驗B組比較,P<0.05
組別 1 d 3 d 7 d 14 d 21 d對照組(n=15) 26.28±3.32 18.51±0.99 15.83±0.71 13.57±0.96 11.59±0.97實驗A組(n=15) 25.69±3.20 16.33±0.96*13.91±1.18*11.58±0.98*9.78±0.93*△實驗B組(n=15) 25.10±3.48 17.11±0.93*△13.15±0.83*△10.63±0.97*△9.21±0.96*△實驗C組(n=15) 25.00±3.28 17.47±0.91*△#12.24±0.79*△#9.92±0.89*△#8.61±0.95*△#F值 1.403 13.670 43.540 41.620 27.380 P值 0.252 0.002 0.000 0.000 0.000
表4 SD大鼠急性脊髓損傷細胞移植后BDNF染色表達陽性細胞數變化(±s) %
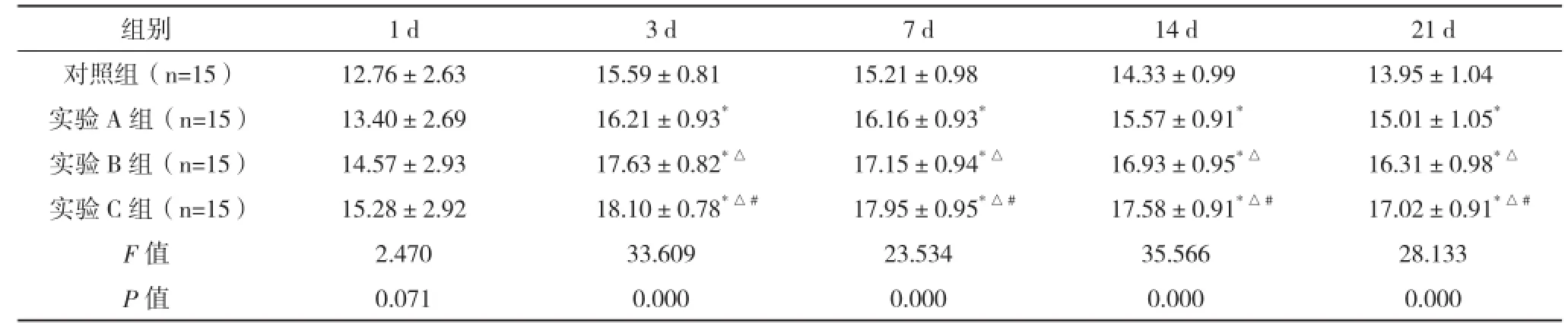
表4 SD大鼠急性脊髓損傷細胞移植后BDNF染色表達陽性細胞數變化(±s) %
*與對照組比較,P<0.05;△與實驗A組比較,P<0.05;#與實驗B組比較,P<0.05注:表中各組例數為切片數
組別 1 d 3 d 7 d 14 d 21 d對照組(n=15) 12.76±2.63 15.59±0.81 15.21±0.98 14.33±0.99 13.95±1.04實驗A組(n=15) 13.40±2.69 16.21±0.93*16.16±0.93*15.57±0.91*15.01±1.05*實驗B組(n=15) 14.57±2.93 17.63±0.82*△17.15±0.94*△16.93±0.95*△16.31±0.98*△實驗C組(n=15) 15.28±2.92 18.10±0.78*△#17.95±0.95*△#17.58±0.91*△#17.02±0.91*△#F值 2.470 33.609 23.534 35.566 28.133 P值 0.071 0.000 0.000 0.000 0.000
3 討論
3.1 造模方法及脊髓損傷治療方法的選擇 實驗中改良Allen’s重物打擊挫傷法,不僅減小重物致傷力量延長擠壓時間,還有穩定、簡便、可重復性等優勢,且實驗中對脊髓階段(T11)制損并未發生硬脊膜破損及腦脊液外滲等現象,與臨床急性脊髓損傷更為相近,更貼切體現治療方法及療效對比。細胞移植在臨床中對ASCI治療國外已有報道,國內學者將嗅鞘細胞移植治療SCI處于臨床試驗,效果頗為滿意[5],有望推廣。NSCs有多向性分化能力,OECs可調節受損脊髓局部微環境。將NSCs和OECs分別、聯合移植到急性受損脊髓中發揮各自特性,觀察比較效果,來體現對受損脊髓功能恢復的強弱。
3.2 各項實驗結果分析
3.2.1 BBB評分和斜板實驗結果分析 BBB評分法側重雙后肢運動的各行為細節,如關節、腳趾、尾部等,斜板實驗注重雙后肢肌力情況,兩評法從不同角度分析對比,各有側重又有彌補,評價更加客觀。
實驗中各組大鼠造模前BBB評分均21分,造模細胞移植后24 h全是0分,隨實驗進行有不同程度恢復,各實驗組比對照組明顯增高(P<0.05),說明細胞移植對急性脊髓損傷有修復作用,且大于脊髓損傷后自身恢復作用。NSCs+OECs組比OECs組、NSCs組的增高差異都有統計學意義(P<0.05),也說明NSCs+OECs聯合移植對急性脊髓損傷后運動功能發揮最大恢復作用。這與損傷早期進行聯合移植會有較好效果的研究假設相符合[6]。
造模前,各組大鼠斜板實驗平均角度(81.50±2.33)°,造模細胞移植后,第1天斜板實驗角度降至(12.71±1.19)°,降低幅度之大與脊髓損傷導致后肢肌力減退呈直接關系,說明急性脊髓損傷造模成功。隨實驗進行各組斜板實驗角度都回復增大,第7天開始實驗組比對照組增大幅度更明顯(P<0.05),NSCs+OECs組比OECs組、NSCs組增大幅度有統計學意義(P<0.05),OECs組次之,NSCs組最弱,再次證實單種或多種細胞移植對損傷脊髓均有不同程度修復且急性脊髓損傷后有一定自身恢復性。
3.2.2 運動誘發電位(MEP)檢測結果分析 采用MEP(N1波)潛伏期為檢測標準,反復刺激取平均值。造模細胞移植后各組大鼠MEP(N1波)潛伏期明顯延長,對照組潛伏期延長幅度比三實驗組都大,第3天開始三實驗組縮短幅度大于對照組縮短幅度(P<0.05),說明細胞移植促進受損脊髓的運動傳導功能,NSCs+OECs組縮短幅度比OECs組、NSCs組都大(P<0.05),OECs組次之,NSCs組最差,與BBB評分和斜板實驗結果趨于一致。表明大鼠急性脊髓損傷后有些許修復作用,細胞移植促進修復效果應是由NSCs、OECs對軸突再生的促進,再髓鞘化及延長,建立新突觸連接有助于傳導束功能恢復。
3.2.3 BDNF染色表達陽性細胞數結果分析 實驗觀察發現,急性脊髓損傷后BDNF表達明顯增大,術后第3天到高峰,后下降,說明大鼠脊髓受損早期會自我保護性的提高BDNF分泌,那么BDNF很可能參與損傷早期有限的恢復過程。三實驗組BDNF表達量比對照組的增多部分,在第3、7、14、21天比較差異均有統計意義(P<0.05)。無論BDNF上升或下降,三實驗組與對照組的變化趨勢相一致基礎上且表達要高,說明細胞移植對BDNF表達有明顯促進。OECs+NSCs組與OECs組、NSCs組相比增大很明顯(P<0.05),說明OECs+NSCs組產生BDNF最多,除OECs+NSCs分泌BDNF外脊髓損傷后自身也分泌,OECs組比NSCs組所表達BDNF要多(P<0.05),實驗組中NSCs組表達BDNF最弱,OECs組較強,OECs+NSCs組最強。
OECs、NSCs移植可提高BDNF表達,且BDNF參與ASCI修復過程,作用機制可能降低繼發性損傷的炎癥反應,與神經生長抑制因子進行對抗及競爭,在ASCI中對受損神經元起改善和修復的生物效應及抗損傷性的保護作用,促進軸突塑造,引導干細胞分裂方向,減少自由基代謝及堆積[7-8],以調控到滿足神經元再生所需微環境,促進脊髓損傷后功能恢復。
3.3 NSCs與OECs移植修復ASCI 目前細胞聯合移植治療ASCI倍受關注,但目前NSCs和OECs移植后各自所發揮作用機制的諸多方面并未徹底明確,結合細胞特性、以往經驗和實驗結果做出推測:急性脊髓損傷勢必引起神經細胞衰亡、神經元殘缺和壞死、纖維受損及髓鞘脫離。NSCs分化成新的神經元發揮作用;也可生成膠質細胞(如星形、少突膠質細胞等),發揮支持、滋養、協助神經信號傳遞。NSCs增殖分化狀態受局部微環境和多種細胞因子所影響[9-11],即NSCs對損傷脊髓發揮作用過程受干預性很強,這可能是本實驗OECs組比NSCs組效果顯著的原因。OECs是一種具備神經再生功能的細胞發揮作用同時分泌BDNF、NTF等神經營養因子,調節局部微環境更適宜神經細胞生長、分化及修復;還能分泌有利于神經纖維延伸的各種蛋白[12],和在細胞膜上表達出多細胞黏合和軸突生長相關支持因子[13-14],以建立新髓鞘,向受損邊延伸,建立新突觸連接。實驗中OECs組大鼠雙后肢運動功能和MEP(N1波)潛伏期部分恢復正是機制的體現。目前對NSCs和OECs移植后各自所發揮作用機制的諸多方面并未徹底明確,兩者各自濃度和配比比例等諸多因素都需深入探索研究。在單細胞移植的基礎上,醫學界對聯合移植治療的研究日益升溫,使之早日在脊髓損傷的綜合多種方法這一鏈條中發揮自身最大能力。
參考文獻
[1]李建軍,周紅俊,洪毅,等,2002年北京市脊髓損傷發病率調查[J].中國康復理論與實踐,2004,10(7):412-413.
[2]盧旻鵬,權正學,劉渤,等.小鼠脊髓損傷標準化重物打擊模型的制備及評價[J].中國修復重建外科雜志,2008,22 (8):933-938.
[3] Fujimoto T,Nakamura T,Ikeda T,et al.Potent protective effects of melatonin on experimental spinal cord injury[J].Spine,2000,25(7):769-775.
[4] Albert T,Ravaud J F.Tetrafigap group.Rehabilitation of spinal cord injury in France: a nationwide multicentre study of incidence and regional disparitics[J].Spinal Cord,2005,43(6):357-365.
[5]黃紅云,王洪美,陳琳,等.嗅鞘細胞移植治療晚期脊髓損傷臨床試驗初步報告[J].立體定向和功能性神經外科雜志,2004,17(6):348-350.
[6] Ao Q,Wang A J,Chen G Q,et al.Combined transplantation of neural stem cells and olfactory ensheathing cells for the repair of spinal cord injuries[J].Med Hypotheses,2007,69(6):1234-1237.
[7]張任飛,肖詩柔.神經營養素家族類細胞因子對神經干細胞分化影響的研究現狀[J].中國科技信息,2011,21(2):176-178.
[8]林雙竹,楊璐璐,陳穩根,等.神經干細胞與腦源性神經生長因子[J].中國醫藥指南,2011,11(15):78-80.
[9] Rogister B, Ben-Hur T, Dubois-Dalcq M. From neural stem cells to myelinating oligodendrocytes[J].Mol Cell Neurosci,1999,14 (4-5):287-300.
[10] Lennington J B,Yang Z,Conover J C.Neural stem cells and the regulation of adult neurogenesis[J].Reprod Biol Endocrinol,2003,1(25):99.
[11] Kwon Y K.Effect of neurotrophic factors on neuronal stem cell death[J].J Biochem Mol Biol,2002,35(1):87-93.
[12] Santos-Silva A,Cavalcante L A.Expression of the non-compact myelin protein 2’,3’-cyclic nucleotide 3’-phosphodiesterase (CNPase) in olfactory bulb ensheathing glia from explant cultures[J].Neurosci Res,2001,40(2):189-193.
[13] Dityatev A,Schachner M.Extracellular matrix molecules and synaptic plasticity[J].Nat Rev Neurosci,2003,4(6):456-468.
[14] Schwob J E.Neural regeneration and the peripheral olfactory system[J].Anat Rec,2002,269(1):33-49.
①包頭醫學院第一附屬醫院 內蒙古 包頭 014010
doi:10.3969/j.issn.1674-4985.2016.20.006
收稿日期:(2015-04-21) (本文編輯:蔡元元)
*基金項目:內蒙古自治區高等學校科學技術研究項目(自然科學研究)中的一般項目(NJ10186)
通信作者:張朝
Impact of Olfactory Ensheathing Cells Combined Neural Stem Cells in Rats Subjected to Acute Spinal Cord Injury and Brain Derived Neurotrophic Factor Expression
CHEN Da-wei,LIU Yan-qing,ZHANG Chao.//Medical Innovation of China,2016,13(20):022-027
【Abstract】Objective:To explore effect of olfactory ensheathing cells combined with neural stem cells on acute spinal cord injury in rats and brain derived neurotrophic factor(BDNF) expression.Method:The newborn (born 3 days) SD rats hippocampus and olfactory bulb were taken for preparation of neural stem cells and olfactory ensheathing cells.80 SD rats were made model of acute spinalcord injury,the rats were randomly divided into the control group(sham group),NSCs,OECs,NSCs+OECs transplantation group(were the experimental A,B,C group successively),then the cell transplantation.In the preoperative and postoperative 1 day,3,7,14,21 days,adopt BBB score,inclined plane experiments and tested motor evoked potential(MEP N1 wave)preclinical,Last,one rat were selected in each group randomly.Immunohistochemical staining were used to observe and comparison BDNF in the damaged spinal cord tissue localized expression in each group.Result:(1)The change of BBB score:except for the first day,any of experimental group the degree of recovery was significantly higher than the control group(P<0.05).From the beginning of the seventh day,the comparison between arbitrary two experimental group was statistically significant difference(P<0.05).(2)The changes of the inclined plate test:from the seventh day,the differences between arbitrary the group were statistically significant(P<0.05).(3)The change of MEP (N1 wave) latency:from the third day,the differences between arbitrary the group were statistically significant(P<0.05).(4)BDNF staining of cells expressing positive change:after cell transplantation,BDNF in the injured spinal cord of Each group rats began to increase.Until third days to reach the peak,after decrease.From the third day,the differences between arbitrary the group were statistically significant(P<0.05).Conclusion:When the cell transplantation is used to treat acute spinal cord injury in rats,research show:OECs+NSCs transplantation group achieve the best results.When a single cell specie transplant alone,OECs transplantation has better treatment effect than NSCs transplantation.BDNF expresses highest in the OECs+NSCs transplantation group.
【Key words】Olfactory ensheathing cells; Neural stem cells; Acute spinal cord injury; Brain derived neurotrophic factor

