產生物表面活性劑的地衣芽孢桿菌種子培養條件研究
尤 賀, 唐文竹, 孫玉梅
大連工業大學 生物工程學院,遼寧 大連 116034
?
產生物表面活性劑的地衣芽孢桿菌種子培養條件研究
尤賀,唐文竹,孫玉梅*
大連工業大學 生物工程學院,遼寧 大連 116034
摘要:本文對產生物表面活性劑的油藏地衣芽孢桿菌種子培養條件進行優化。通過測定種子培養液中菌體濃度和發酵液的菌濃及表面張力,研究溫度、通氣量、接種齡、接種量對種子生長和發酵產生物表面活性劑的影響。確定了種子適宜培養條件為裝液量100 mL/250 mL,12層紗布封口,于50 ℃、180 r/min搖床培養14 h。以10%接種量接種發酵,發酵24 h的發酵液表面張力降至最低,為22.6 mN/m。在該條件下培養種子,可縮短種子培養時間,實現提前接種發酵并高產生物表面活性劑。
關鍵詞:地衣芽孢桿菌; 生物表面活性劑; 種子培養; 表面張力
生物表面活性劑是由微生物發酵或酶催化合成的具有高表面活性的兩親性次級代謝產物[1],具有很高的生物降解性、起泡性和選擇性,在極端環境條件下仍能保持活性,且毒性和刺激性較低。因此,在環境治理、石油、食品、農藥、紡織等領域得以廣泛應用,在一些領域已經完全替代化學合成表面活性劑。但其應用和推廣受到產量低、生產成本高等問題的限制[1,2]。
為了提高生物表面活性劑產量,目前國內外研究大多對發酵條件進行優化,對種子培養條件研究較少。微生物發酵生產的種子培養目的在于較短的時間內獲得大量健壯和代謝活性強的種子,為發酵合成產物奠定基礎[3]。種子培養條件對獲得優良種子至關重要,不僅影響種子生物量還影響其代謝產物合成能力。產鼠李糖脂的銅綠假單胞菌的種子培養優化條件為,在pH 6~8、30 ℃培養,以5%接種量接種此條件培養的種子,可使發酵鼠李糖脂產量提升至13.024 g/L[4]。對BacillussubtilisSPB1的種子培養條件、接種齡、接種量進行優化,優化后可使生物表面活性劑產量提高至3.3 g/L[5]。本文對產生物表面活性劑的地衣芽孢桿菌種子培養條件進行優化,并對發酵的接種齡和接種量進行研究,以期獲得健壯種子,為微生物發酵生產提供條件。
1材料與方法
1.1菌株
菌株分離自遼河油田的原油,經16s rDNA 鑒定為BacilluslicheniformisDGG-1-3-F,菌種用20%甘油保存于-80 ℃冰箱。
1.2培養基
斜面培養基(g/L):牛肉膏 5,蛋白胨 10,NaCl 5,瓊脂 20,pH 7.0。
種子培養基(g/L):牛肉膏 5,蛋白胨 10,NaCl 5,pH 7.0。
發酵培養基(g/L):可溶性淀粉10,KH2PO43.4,Na2HPO41.5,NaNO34.0,MgSO4·7H2O 0.2,酵母浸粉0.2,pH 7.0。
1.3實驗方法
1.3.1菌種活化與培養
取在-80 ℃保存的地衣芽孢桿菌,接一環于斜面種子培養基上,于30 ℃培養24 h,于4 ℃保存備用。取斜面菌種,接種于新的斜面種子培養基上,于30 ℃培養24 h,使其活化。取兩環活化的菌種,接種于種子培養基中,于設定的溫度和轉速搖床培養一定時間,得種子液。在種子培養過程定期取樣測定菌體密度。
1.3.2發酵條件
將種子液以10%接種量接種至發酵培養基中,在裝液量20 mL/50 mL,14層紗布封口的三角瓶中于30 ℃、160 r/min的搖床發酵96 h。在發酵過程中定期取樣測定菌體濃度和表面張力。
1.3.3溫度和通氣量對種子生長和發酵產生物表面活性劑的影響
取20環活化的菌種,用20 mL生理鹽水制成均勻菌液,吸取2 mL菌液至裝液量100 mL/250 mL,14層紗布封口的三角瓶中,將三角瓶分別置于30 ℃、40 ℃、50 ℃搖床中培養,搖床轉速160 r/min,定期取樣測定菌體濃度。分別取各培養溫度下的對數生長期末期的種子,以10%接種量接種至發酵培養基中,定期取樣測定發酵液菌體濃度及表面張力。通過種子生長、發酵液菌體濃度及表面張力確定適宜種子培養溫度。在適宜溫度基礎上,按前述實驗方法,將三角瓶分別置于140 r/min、160 r/min和180 r/min搖床中培養,其它條件不變,通過種子生長、發酵液菌體濃度及表面張力確定適宜種子培養搖床轉速。在適宜溫度、轉速的基礎上,按前述實驗方法,將種子培養所用三角瓶分別用12、14和16層紗布封口,其它條件不變,通過種子生長、發酵液菌體濃度及表面張力確定適宜種子培養封口紗布層數。
1.3.4接種齡和接種量對發酵產生物表面活性劑的影響
在適宜條件下培養種子,分別培養至對數生長期、對數生長期末期、穩定期后分別以10%接種量接種至發酵培養基中。發酵條件同上。通過發酵液菌體濃度及表面張力,確定適宜接種齡。
將適宜條件下培養的種子培養至適宜接種齡,分別以5%、10%和15%接種量接種至發酵培養基中,通過發酵液菌體濃度及表面張力,確定適宜接種量。
1.3.5菌體濃度測定
采用濁度法[6],于600 nm測定。
1.3.6表面張力測定
將發酵液于10 000 r/min離心20 min,得發酵上清液。在室溫下,采用吊環法[7]測定發酵上清液的表面張力。
所有的培養和測定均為三個平行試驗,實驗結果為三個平行實驗的平均值。
2結果與討論
2.1溫度對種子生長和發酵產生物表面活性劑的影響
由圖1a可知,于50 ℃、40 ℃和30 ℃培養的種子分別在16 h、22 h和28 h達到對數生長期末期。取培養至該時期的種子接種發酵,結果見圖1b,隨種子培養溫度的升高,發酵過程中菌體生長速度和發酵液表面張力下降速度加快,接種50 ℃培養的種子發酵的菌體生長最快,表面張力降低最多,發酵24 h降至最低值24 mN/m,接種30 ℃培養的種子發酵的菌體生長最慢,表面張力降低最少,發酵48 h降至最低值28.25 mN/m。說明,溫度不僅影響種子生長,還影響其發酵過程中菌體生長和生物表面活性劑合成[8]。因此,取50 ℃為適宜種子培養溫度。
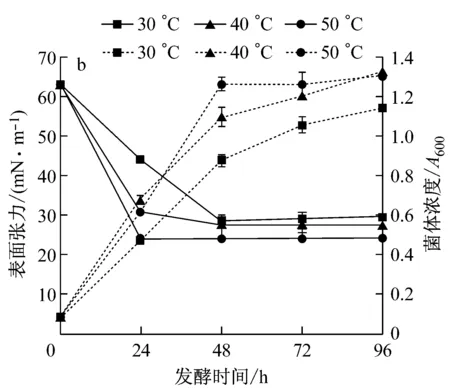
a:種子生長;b:發酵過程中菌濃及表面張力
2.2通氣量對種子生長和發酵產生物表面活性劑的影響
在三角瓶培養階段,搖床轉速和三角瓶封口的紗布層數均會影響三角瓶液體培養的通氣量[9]。
由圖2a可知,于180 r/min、160 r/min和140 r/min培養的種子分別在14 h、16 h和20 h達到對數生長期末期。取培養至該時期的種子接種發酵,結果見圖2b,隨種子培養搖床轉速的升高,發酵過程中菌體生長速度加快,接種180 r/min培養的種子發酵的菌體生長最快,表面張力降低最多,發酵48 h降至最低值23.75 mN/m,接種140 r/min和160 r/min培養的種子發酵的表面張力相近,發酵72 h降至最低值26 mN/m和26.25 mN/m。因此,取180 r/min為適宜種子培養搖床轉速。
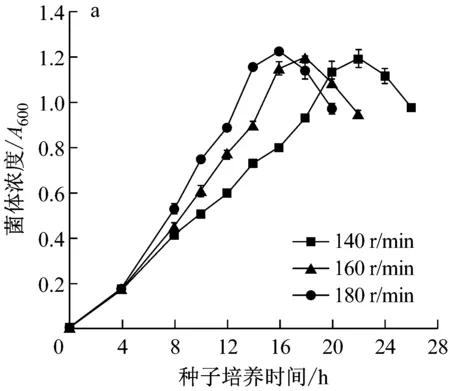
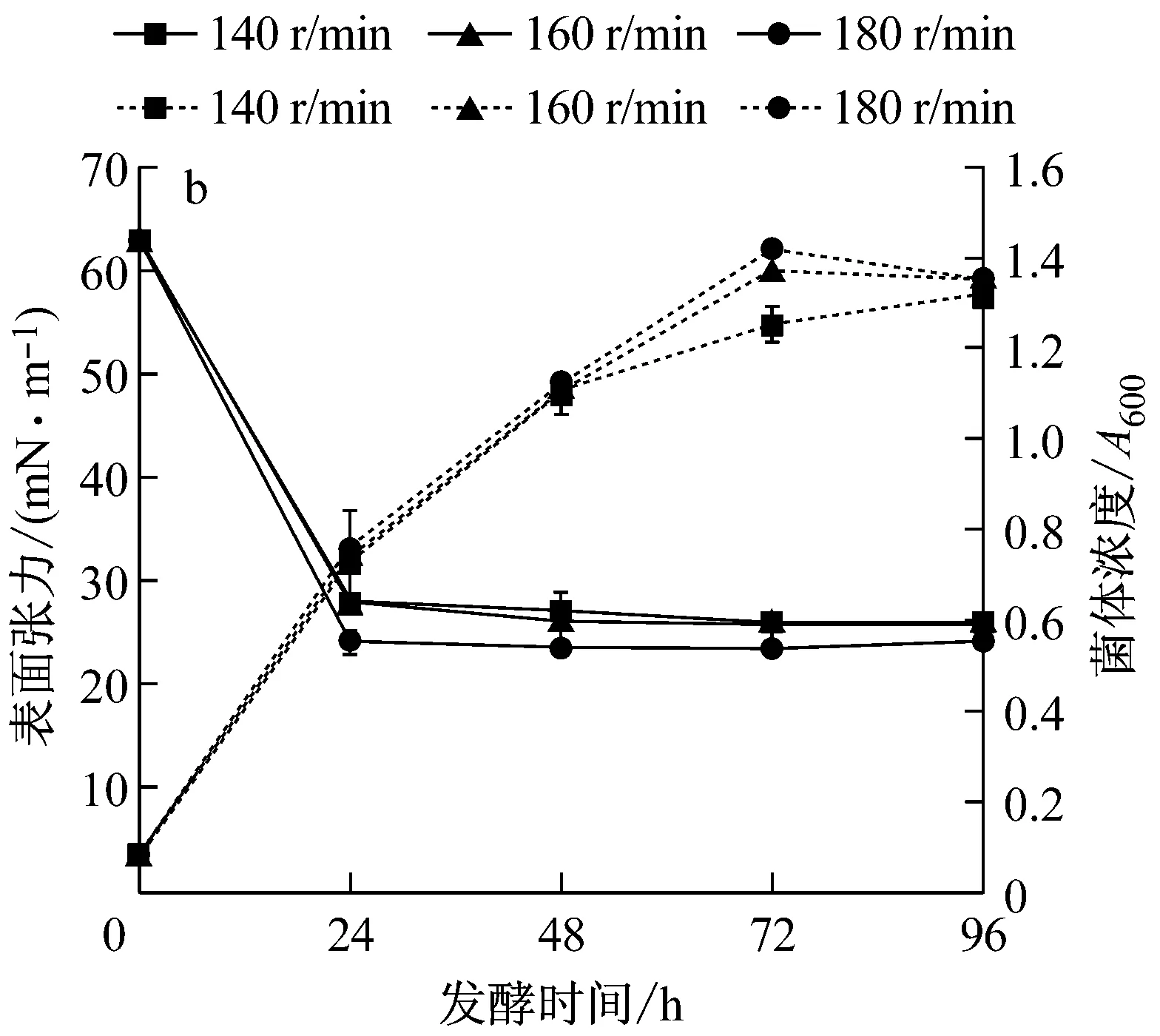
a:種子生長;b:發酵過程中菌濃及表面張力
由圖3a可知,于16、14和12層紗布封口的三角瓶中培養的種子都在14 h達到對數生長期末期,說明封口三角瓶的紗布層數對種子生長快慢影響不大。取培養至該時期的種子接種發酵,結果見圖3b,隨封口三角瓶的紗布層數的增加,發酵過程中菌體生長速度和發酵液表面張力下降速度減慢,接種12層紗布封口的三角瓶所培養的種子發酵的菌體生長最快,表面張力降低最多,發酵24 h降至最低值22.75 mN/m。接種16層紗布封口的三角瓶所培養的種子發酵的菌體生長最慢,表面張力降低最少,發酵24 h降至最低值26.65 mN/m。因此,取12層為適宜種子培養封口紗布層數。由以上結果可知,通氣量不僅影響種子生長,還影響其發酵過程中菌體生長和生物表面活性劑合成,且通氣量多利于生物表面活性劑的合成[9]。在本實驗范圍內,搖床轉速比紗布層數對種子生長的影響要大,但二者對發酵的影響差異不大。
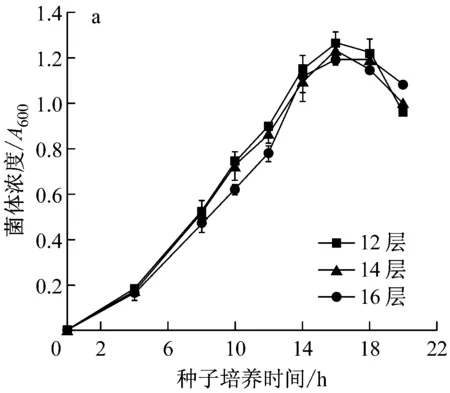
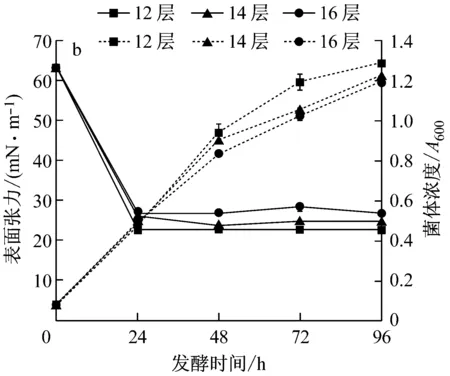
a:種子生長;b:發酵過程中菌濃及表面張力
2.3接種齡對發酵產生物表面活性劑的影響
由圖4可知,接種培養14 h的種子發酵的菌體生長最快,表面張力降低最多,發酵24 h降至最低值22.7 mN/m。一般接種的種子培養時間以對數生長期末期即培養液中菌濃接近高峰時所需的時間較為適宜。 培養時間較短的種子接種后往往會出現前期生長緩慢,整個發酵周期延長,產物開始形成時間推遲。培養時間較長的種子雖然菌量較多但接種后會導致生產能力的下降,菌體過早衰退[3]。因此,取14 h為適宜接種齡,這與彭新榜等人研究結果相同[10]。

圖4 接種齡對發酵生產的影響
2.4接種量對發酵產生物表面活性劑的影響
由圖5可知,接種量為10%時,發酵的菌體生長最快,表面張力降低最多,發酵24 h降至最低值22.6 mN/m。其次是接種量15%。接種量為5%時,發酵初期菌濃低,發酵液表面張力下降慢,第72 h時菌濃接近其它兩個接種量,表面張力降至最低的值也與其接近,說明接種量小只會推遲達到最大菌體量和表面張力降至最低值的時間。因此,取10%為適宜接種量,這與解舒涵等人研究結果相同[11]。
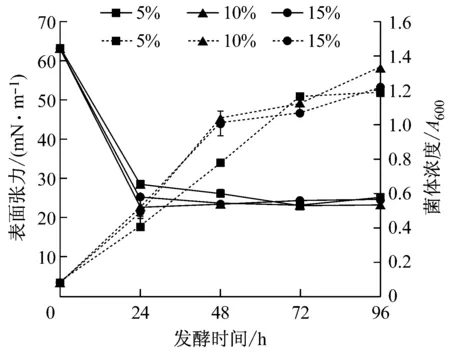
圖5 接種量對發酵生產的影響
3結論
本試驗對地衣芽孢桿菌種子培養條件進行優化,確定了種子適宜培養條件為裝液量100 mL/250 mL,12層紗布封口,于50 ℃、180 r/min搖床培養14 h。以10%接種量接種發酵,發酵24 h的發酵液表面張力降至最低,為22.6 mN/m。試驗發現,種子培養溫度對種子生長和發酵產生物表面活性劑的影響較大。本研究為縮短種子培養和發酵時間,提高BacilluslicheniformisDGG-1-3-F產生物表面活性劑產量奠定了一定的基礎。
參考文獻
[1]Mukherjee S, Das P, Sen R. Towards commercial production of microbial surfactants[J]. Trends Biotechnol , 2006, 24(11): 509-515.
[2]馮會粉, 杜巧娟, 欒靜等. 煙堿降解菌以烷烴為碳源產生物表面活性劑的研究[J]. 工業微生物, 2015, 45(3): 48-52.
[3]石天虹, 劉雪蘭, 劉輝等. 微生物發酵的影響因素及其控制[J]. 家禽科學, 2005, 4(2): 45-48.
[4]張祥勝, 許德軍. 產鼠李糖脂菌株種子培養條件和C、N源的優化[J]. 生物加工過程, 2013, 5: 38-43.
[5]Mnif I, Ellouze-Chaabouni S, Ghribi D. Optimization of inocula conditions for enhanced biosurfactant production byBacillussubtilisSPB1, in submerged culture, using Box-Behnken design[J]. Probiotics Antimicrob Proteins, 2013, 5(2): 92-98.
[6]Sheppard JD, Mulligan CN. The production of surfactin byBacillussubtilisgrown on peat hydrolysate[J]. Applied Microbiologyand Biotechnology, 1987, 27(2): 110-116.
[7]Margaritis A, Zajic JE, Gerson DF,etal. Production and surface-active properties of microbial surfactants[J]. Biotechnology and Bioengineering, 1979, 21(7): 1151-1162.
[8]陳宏軍, 楊曉志, 劉丹. 微生物發酵法生產大豆肽工藝條件的研究[J]. 飼料研究, 2008, 4: 21-23.
[9]付瑞敏, 楊雪, 谷亞楠等. 石油烴降解菌CQ6產生物表面活性劑發酵條件的優化[J]. 湖北農業科學, 2015, 11: 2710-2714.
[10]彭新榜, 馬歌麗, 衛軍等. 微生物生產生物表面活性劑發酵條件的研究[J]. 食品科技, 2004, 10: 8-12.
[11]解舒涵, 何連芳, 張玉蒼. 產生物表面活性劑芽孢桿菌培養條件的優化[J]. 生物技術通報, 2012, 4:127-134.
doi:10.3969 /j.issn.1001-6678.2016.03.006
作者簡介:尤賀(1992~),男,碩士研究生。 E-mail:716863212@qq.com。
*通訊作者:孫玉梅(1962~),女,教授。
Cultivation conditions of inocula for Bacillus licheniformis producing biosurfactant
YOU He, TANG Wen-zhu, SUN Yu-mei
College of Biology Engineering,Dalian Polytechnic University,Dalian 116034,China
AbstractBacillus licheniformis isolated from crude oil was used to produce biosurfactant. The cultivation condition of inocula was optimized in this research. By measuring the cell density in inoculum culture broth, the cell density and surface tension in fermenting broth, the effects of temperature, ventilation and time of inoculum cultivation and inoculation rate on cell growth and the surfactant production in fermentation were investigated. The results indicated that the inocula should be cultivated at 50 ℃, 180 r/min for 14 h in 100 mL/250 mL shaking flasks sealed with 12-layer gauze. And when the fermentation was conducted for 24 h with 10% of inoculation rate, the surface tension of cell-free fermenting broth lowered to the minimum 22.6 mN/m. Inocula cultivation under the optimal conditions could shorten the cultivation time of inocula and result in earlier biosurfactant production and higher yield in the fermentation.
Key wordsBacillus licheniformis; biosurfactant; inocula cultivation; surface tension
項目名稱:大連市科技局 (編號:2013B11NC078)。

