miR-181a及其靶基因Atg5在胃癌中的表達及臨床意義
周 藝,聶玉強,林 泳,杜艷蕾
廣州醫科大學附屬廣州市第一人民醫院消化內科,廣東 廣州 510180
miR-181a及其靶基因Atg5在胃癌中的表達及臨床意義
周 藝,聶玉強,林 泳,杜艷蕾
廣州醫科大學附屬廣州市第一人民醫院消化內科,廣東 廣州 510180
目的 研究miR-181a及其靶基因Atg5在人胃癌細胞株和胃癌組織中的表達及其與臨床病理參數的關系。方法 體外培養人胃癌細胞株(MGC-803、SGC-7901、BGC-823)和正常胃黏膜細胞株(GSE-1),收集30例胃癌血清和手術切除的癌組織及癌旁正常組織,并以30名正常人血清標本為對照,應用實時熒光定量PCR(qRT-PCR)技術檢測血清、細胞株、組織中miR-181a及細胞株、組織中Atg5 mRNA的表達情況。結果 胃癌細胞株、組織、血液中miR-181a的表達較正常細胞、癌旁正常組織及正常人血清明顯升高(P<0.05);Atg5 mRNA相對表達量在胃癌細胞株和胃癌組織中均分別低于正常胃黏膜細胞株和癌旁正常組織(P<0.05)。在胃癌組織和癌旁正常組織中,miR-181a與Atg5 mRNA表達呈負相關。結論 miR-181a在胃癌細胞株、胃癌組織和血清中顯著高表達,提示其有望成為潛在的胃癌標志物。Atg5在胃癌中低表達并與miR-181a表達呈負相關,提示其可能是miR-181a在胃癌中的潛在作用靶基因。
胃癌;miR-181a;Atg5;RT-PCR
在世界范圍內,胃癌正嚴重威脅著人們的健康[1]。microRNA(miRNA)參與了腫瘤的發生、增殖、侵襲、轉移、復發等多種惡性生物學行為的調控[2]。miRNA通過其“種子區”與靶基因的3’非翻譯區(3’UTR)的完整配對,使mRNA降解或者抑止mRNA的翻譯,從而轉錄后調控靶基因表達[3]。我們課題組前期通過基因芯片和qRT-PCR證實miR-181a作為癌基因在胃癌的進展中起重要作用[4-5]。自噬是細胞一個有高度保護作用的代謝途徑,能降解異常的蛋白質和受損的細胞器,是保護細胞癌變的一個機制[6]。
自噬也是惡性腫瘤形成及惡性腫瘤發展的一個關鍵步驟,一些自噬相關蛋白(如:Bif-1、Beclin1、Atg4C、Atg5、UVRAG)具有腫瘤抑制活性[7-8]。Tekirdag等[9]研究發現Atg5是miR-181a的靶基因,miR-181a的過表達會減少Atg5蛋白和mRNA的表達水平,miR-181a是一種新的自噬調控通路。因此,本研究探討miR-181a、Atg5的表達水平在胃癌發生、發展中的臨床意義,為胃癌的診治等提供新的參考依據。
1 材料與方法
1.1 細胞、血液組織標本來源 GES-1、BGC-823、MGC-803均由南方醫科大學消化科惠贈,SGC-7901購自南京凱基生物。配對胃癌組織血液標本30例,其中高分化腺癌1例,中分化腺癌16例,低分化腺癌13例;18例有局部淋巴結轉移。25例為外科手術切除病灶獲得,5例胃鏡活檢所得,所有標本均經病理學確診,全部病例收取標本前均未行放療、化療。對照組外周血為在廣州市第一人民醫院住院的非腫瘤患者(經胃、腸鏡、影像學、實驗室檢查排除腫瘤),以急性胃腸炎、功能性胃腸病等疾病為主,并排除合并有胃腸道息肉、胃潰瘍、炎癥性腸病等共30例。標本取出立即放液氮速凍后存放在-80 ℃冰箱。血液用抗凝管采集1~2 h,3 000 r/min離心置于-80 ℃冰箱,用于提取總RNA 或microRNA。
1.2 引物設計與合成 miR-181a及內參U6由Qiagen公司設計合成,Atg5自UCSC 數據庫(http://genome.ucsc.edu/) 查找基因序列,用Primer-Express 2.0軟件進行引物設計。
1.3 實驗方法
1.3.1 總RNA和miRNA提取:用TRIZOL提取細胞和組織中的總RNA,血液中miRNA按QIGEN血清中提取miRNA試劑盒的操作說明,檢測OD260/280值,判斷純度;RNA樣品在1%瓊脂糖凝膠電泳觀察總RNA中的5s rRNA、18s rRNA和28s rRNA條帶,3條條帶完整即證明總RNA抽提比較完整。
1.3.2 miR-181a的檢測:應用實時熒光定量PCR(qRT-PCR)技術檢測miR-181a的表達:按照QIGEN逆轉錄試劑盒的操作說明合成cDNA,qRT-PCR使用的是MJ Research熒光定量PCR儀和Opticon Monitor 2軟件操作系統,PCR反應試劑購自QIGEN,U6和miR-181a的PCR反應條件:預變性:95 ℃,15 min,PCR反應:94 ℃,15 s;55 ℃,30 s;70 ℃,30 s。對55 ℃到95 ℃升溫過程進行全程熒光信號收集,繪制溶解曲線。以U6作為內參,用2-△△Ct比較目的基因在癌組織、癌旁組織及正常胃黏膜組織中的表達差異。
1.3.3 Atg5 mRNA的檢測:應用RT-PCR技術檢測組織中Atg5的表達,總mRNA提取,mRNA濃度、純度及完整性測定方法與上述相同:按照TAKARA逆轉錄試劑盒操作說明合成cDNA,PCR反應條件為: 預變性95 ℃,30 s,1個循環; PCR反應:95 ℃,5 s;60 ℃,20 s;40個循環,融解曲線分析 95 ℃,60 s;65 ℃,60 s;從65 ℃開始每1 s加熱0.1 ℃直至95 ℃。用U6作為內參進行分析。

2 結果
2.1 miR-181a的表達量 胃癌細胞株中miR-181a的表達量均高于正常胃黏膜細胞中miR-181a的表達量(P<0.05),而MGC-803、 SGC-7901、BGC-823 三種癌細胞柱間miR-181a的表達量比較差異無統計學意義(P>0.05)。miR-181a在正常組織和胃癌組織中的mRNA的表達量分別為1.0021和3.1205,而在血液中mRNA 的表達量正常組為 0.4536,胃癌組為1.2702,兩組比較差異有統計學意義(P<0.05,見圖1)。
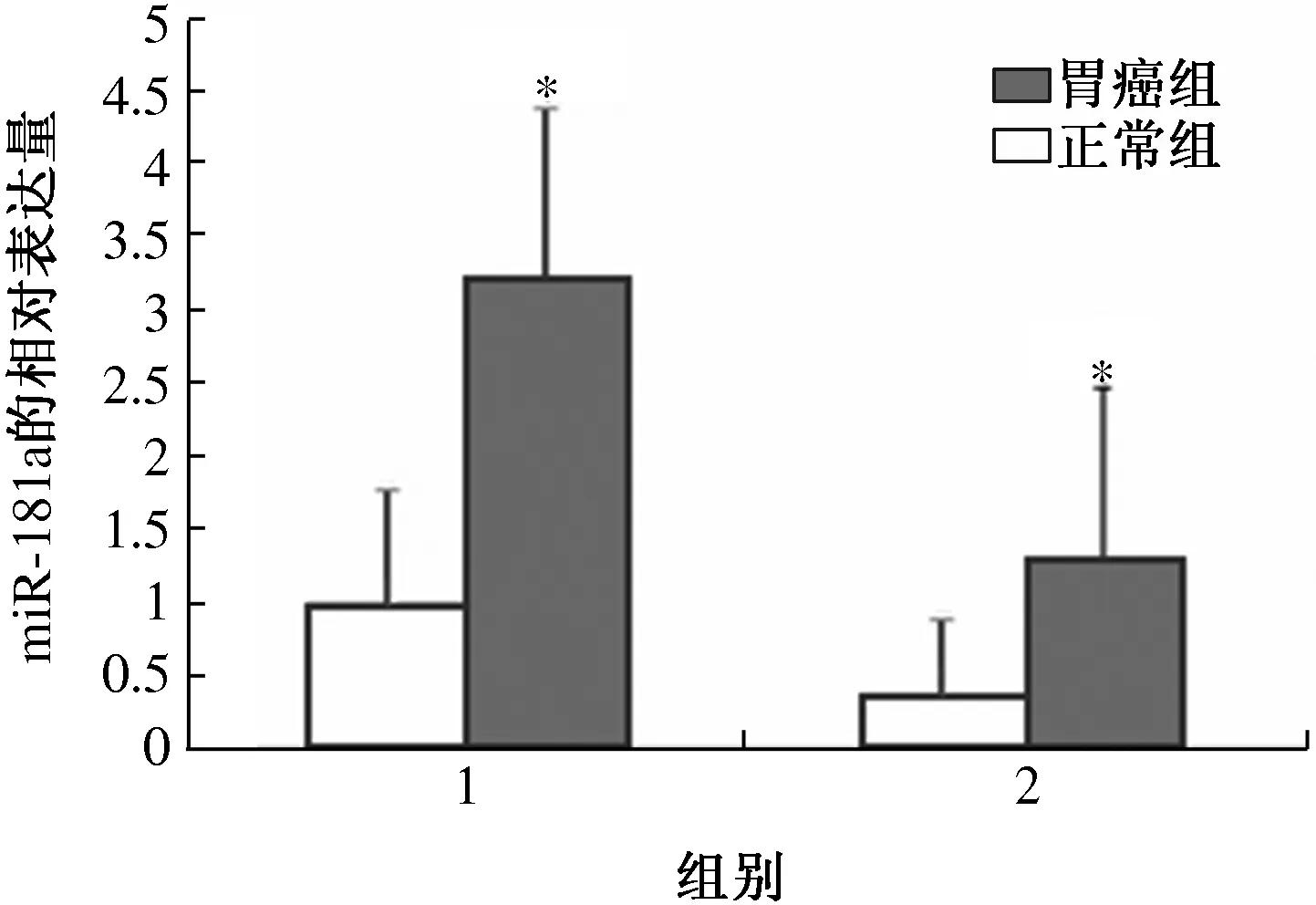
注:1組為組織中miR-181a含量水平;2組為血液中miR-181a含量水平,與正常組比較,*P<0.05。
圖1 胃癌組與正常組miR-181a的表達量比較
Fig 1 Comparison of miR-181a expression between gastric cancer group and control group
2.2 Atg5 mRNA相對表達量 胃癌細胞株中Atg5 mRNA相對表達量低于正常胃黏膜細胞株(P<0.05),MGC-803、 SGC-7901、BGC-823 三種癌細胞株間Atg5 的表達量比較差異無統計學意義(P>0.05),Atg5 在正常組和胃癌組組織中表達量分別為0.6896和0.2429,兩組比較差異有統計學意義(P<0.05)。
2.3 Atg5表達與miR-181a表達的關系 在正常細胞株和胃癌細胞株中Atg5與miR-181a呈負相關(r=-0.999,P<0.05)。在30例胃癌組織中28例Atg5的表達降低,26例的miR-181a高表達,顯示在胃癌組織中Atg5與miR-181a的表達呈負相關(r=-0.459,P<0.05,見圖2)。

圖2 胃癌組織中Atg5與miR-181a的相關性分析
Fig 2 Correlation analysis of Atg5 and miR-181a expression in gastric cancer
3 討論
miRNA是一種內源性的19~25個核苷酸組成的小分子RNA,廣泛存在于真核生物中,經由核糖核酸酶Drosha和Dice切割。miR-181家族的成員有4個:miR-181a、miR-181b、miR-181c和miR181d,研究發現多個mRNAs受這4個成員的調控,而miR-181a是其中重要的一員,能通過與Bcl-2等基因的靶向調節,調控腫瘤的發生、發展。在口腔癌、神經膠質瘤、胃癌等腫瘤的形成和發展中起重要作用。Yang 等[10 ]發現miR-181可調控細胞的運動,在口腔癌中呈高表達與淋巴結轉移、血管侵襲及不良預后密切相關。Guo 等[11]通過 qRT-PCR 等方法發現miR-181家族4個成員在人胃癌細胞系中與正常胃黏膜細胞相比表達均上調。
Huang等[12]發現某些miRNA調控的mRNA參與自噬過程,包括miR-181a和miR-374a。實驗發現miR-181a抑制劑能增加Atg5蛋白表達,Tekirdag等[13]發現在饑餓和雷帕霉素兩種常見的自噬應激條件下都有miR-181a的過表達。miR-181a作為一個新的分子調控自噬通路,在細胞自噬調控中具有關鍵作用。miR-181a的過表達會減少Atg5蛋白和mRNA的表達水平,由于在Atg5基因的3’UTR區域中發現了MRE作為miR-181a的應答區域,且這段序列的突變會影響到miRNA的作用,因此在細胞自噬過程中,Atg5是作為miR-181a的限速靶基因和重要因素。根據本研究結果miR-181a高表達,推測miR-181a升高引起自噬活性抑制導致自噬基因Atg5表達下調有關,即隨著淋巴轉移的增加,miR-181a 蛋白的表達水平也隨之升高;隨著細胞分化程度降低,Atg5的 mRNA表達水平也隨之下降。提示胃癌的發生、發展與miR-181a和Atg5 密切相關。因此,結合前面的研究結果,我們認為:在胃癌中miR-181a的高表達引起Atg5的表達降低,從而影響胃癌的發生、發展。胃癌患者血清中miR-181a表達量明顯上調,可作為腫瘤標志物進一步深入研究。
[1]NCCN gastric cancer clinical practice guidelines (Chinese version) expert group. NCCN clinical practice guidelines for gastric cancer (China Version) [C]. 2011,MS-1. NCCN胃癌臨床實踐指南(中國版)專家組. NCCN胃癌臨床實踐指南(中國版)[C]. 2011,MS-1.
[2]Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?[J]. Hepatology, 2013, 57(2): 840-847.
[3]Brodersen P, Voinnet O. Revisiting the principles of microRNA target recognition and mode of action [J]. Nat Rev Mol Cell Biol, 2009, 10(2): 141-148.
[4]Ye M, Nie YQ, Chen X, et al. Differential expression of microRNA in gastric carcinoma tissue [J]. Chin J Biomed Eng, 2011, 17 (5): 403-406. 葉敏, 聶玉強, 陳熙, 等. 胃癌組織中microRNA的差異表達[J].中華生物醫學工程雜志, 2011, 17(5): 403-406.
[5]Zhang X, Nie Y, Du Y, et al. MicroRNA-181a promotes gastric cancer by negatively regulating tumor suppressor KLF6 [J]. Tumour Biol, 2012, 33(5): 1589-1597.
[6]Pattingre S, Espert L, Biard-Piechaczyk M, et al. Regulation of macroautophagy by mTOR and Beclin 1 complexes [J]. Biochimie, 2008, 90(2): 313-323.
[7]Jin S, White E. Role of autophagy in cancer: management of metabolic stress [J]. Autophagy, 2007, 3(1): 28-31.
[8]Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion [J]. Nature, 2008, 451(7182): 1069-1075.
[9]Tekirdag KA, Korkmaz G, Ozturk DG, et al. MIR181A regulates starvation- and rapamycininduced autophagy through targeting of Atg5 [J]. Autophagy 2013, 9(3): 374-385.
[10]Yang CC, Hung PS, Wang PW, et al. miR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma [J]. J Oral Pathol Med, 2011, 40(5): 397-404.
[11]Guo JX, Tao QS, Lou PR, et al. miR-181b as a potential molecular target for anticancer therapy of gastric neoplasms [J]. Asian Pac J Cancer Prev, 2012, 13(5): 2263-2267.
[12]Huang Y, Guerrero-Preston R, Ratovitski EA, et al. Phospho-ΔNp63α-dependent regulation of autophagic signaling through transcription and micro-RNA modulation [J]. 2012, 11(6): 1247-1259.
[13]Tekirdag KA, Korkmaz G, Ozturk DG, et al. MIR181A regulates starvation-and rapamycin-induced autophagy through targeting of Atg5 [J]. Autophagy, 2013, 9(3): 374-385.
(責任編輯:李 健)
Expression and clinical significance of miR-181a and its target gene Atg5 in gastric cancer
ZHOU Yi, NIE Yuqiang, LIN Yong, DU Yanlei
Department of Gastroenterology, Guangzhou First People’s Hospital, Guangzhou Medical University, Guangzhou 510180, China
Objective To study expressions of miR-181a and its target gene Atg5 in human gastric cancer tissue and cell lines and to investigate whether these two genes expression changes were related with the clinicopathological parameters. Methods The miRNA levels of both miR-181a and Atg5 were detected by qRT-PCR in the gastric cancer cell line (MGC-803, SGC-7901 and BGC-823) and normal gastric mucosa cell lines (GSE) in vitro, in the gastric adenocarcinoma tissue and the adjacent to non-carcinoma tissue specimens from 30 gastric cancer patients. qRt-PCR was used to detect miR-181a expression in the serum of 30 gastric cancer patients and 30 healthy people. Results The expression of miR-181a in gastric cancer cells, serum and the gastric cancer tissue was increased significantly compared with the cells and the serum of healthy controls groups, and also the adjacent to non-carcinoma specimens (P<0.05). Atg5 mRNA expression in gastric cancer cells and the gastric cancer tissue was significantly lower than that in normal gastric mucosa cell lines and normal tissue adjacent to carcinoma (P<0.05). miR-181a mRNA expression had a negative correlation with Atg5 mRNA expression in gastric cancer tissue and normal tissue adjacent to carcinoma. Conclusion In gastric cancer cell lines, cancer tissue and serum of gastric cancer patients, miR-181a expression is significantly elevated, suggesting that it may be the potential markers for gastric carcinoma. Atg5 has low expression in gastric cancer and has a negative correlation with miR-181a, suggesting it may be the potential target gene of miR-181a in gastric cancer.
Gastric cancer; MiR-181a; Atg5; RT-PCR
10.3969/j.issn.1006-5709.2016.03.010
國家自然科學基金(813802078)
周藝,碩士研究生,研究方向:消化道腫瘤。E-mail:158005515@qq.com
聶玉強,主任醫師,博士,E-mail:158005515@qq.com
R735.2
A
1006-5709(2016)03-0276-03
2015-05-12

