山杏初代培養影響因素研究
劉曉光,徐巖巖,劉 璐,楊曉歌
(1.河北民族師范學院 化學系,河北 承德 067000;2.北京工業大學 生命科學與生物工程學院,北京 朝陽 100124)
山杏初代培養影響因素研究
劉曉光1,徐巖巖1,劉 璐1,楊曉歌2
(1.河北民族師范學院 化學系,河北 承德 067000;2.北京工業大學 生命科學與生物工程學院,北京 朝陽 100124)
以山杏幼嫩莖尖為外植體,研究在75%的酒精及75%酒精和升汞不同處理時間下,莖尖的污染率和成活率,以及不同植物生長調節劑配比下的誘導率和生長情況。結果表明,使用75%酒精(20 s)+0.1% HgC12(3 min)處理山杏外植體成活率最高;6-B A可有效促進外植體的萌發,1.2mg·L-1時萌發率最高。6-B A 1.2mg·L-1與不同濃度的生長素IBA和NAA組合,可促進外植體的萌發生長,萌發率最高為94.16%。山杏莖尖外植體初代培養最適宜的培養基為MS+6-B A1.2mg·L-1+I B A1.0mg·L-1。
山杏;滅菌時間;植物生長調節劑;初代培養
文獻著錄格式:劉曉光,徐巖巖,劉璐,等.山杏初代培養影響因素研究[J].浙江農業科學,2016,57(1):84-86.
山杏(Prunus sibiric)為薔薇科杏屬灌木或小喬木,主要分布在黑龍江、內蒙古、河北等地區,是造林綠化的先鋒樹種,具有優良的水土保持和防風固沙功能,同時山杏具有很高的經濟價值和藥用價值。目前山杏栽培中的難題是優良品種的利用,利用組織培養快速繁殖可獲得大量與母株性狀一致的無性系組培苗。本研究以山杏幼嫩莖尖為外植體,用酒精和升汞滅菌處理,探索出最適合的滅菌時間,篩選出適合山杏外植體滅菌的流程;探究6-BA濃度及與IBA和NAA濃度組合對初代培養的影響,篩選出適宜的培養基,為山杏工廠化育苗提供參考。
1 材料與方法
1.1 材料
以山杏的幼嫩莖尖作為外植體,2014年7月采自承德市馮營子鎮野生山杏林。
1.2 方法
1.2.1 材料預處理
將采集后的幼嫩莖尖,剪去多余帶有木質部的枝條,剩下的莖段具有嫩葉且長度為2~3 cm,先用清水沖洗2~3次,再用流水沖洗30 min,然后將其放置在超凈臺上備用。
1.2.2 滅菌方式
酒精滅菌方法。選取沖洗好的外植體分別用以下5種方法進行滅菌:質量分數75%酒精浸泡5 s;質量分數75%酒精浸泡10 s;質量分數75%酒精浸泡15 s;質量分數75%酒精浸泡20 s;質量分數75%酒精浸泡30s。滅菌后,分別用無菌水沖洗3次,然后將幼嫩莖尖的葉和多余的莖段切取,接種到MS培養基上。每個處理接種30株,重復3次。接種8 d后統計污染率、死亡率、存活率、生長情況。
升汞滅菌方法。選取山杏幼嫩莖尖作為外植體,在流水下沖洗30 min,用最適酒精滅菌時間進行處理后,無菌水沖洗3次,再用0.1%升汞進行滅菌處理。滅菌時間處理分別為:0.1% HgC12浸泡 1 min、0.1%HgC12浸泡 3min、0.1%HgC12浸泡5 min、0.1%HgC12浸泡7 min;隨后無菌水沖洗5次,將幼嫩莖尖接種在MS培養基中。每處理接種30株山杏外植體,重復3次。20 d后統計污染率、死亡率、存活率、側芽萌發率、生長情況。
1.2.3 培養基
6-BA基本培養基。采用M S培養基+蔗糖30 g· L-1+瓊脂g·L-1。采用不同濃度6-B A進行處理,濃度梯度設為0,0.4,0.8,1.2mg·L-1,接種20 d后統計萌芽率、芽萌發天數、生長情況。
6-BA分別與IBA和NAA組合處理。在對6-B A濃度的考察基礎上,將上一步所得到的最適宜的6-B A濃度分別與IBA和NAA組合處理,IBA和NAA濃度均設3個梯度:0,0.5,1.0mg·L-1。
1.2.4 培養條件
培養溫度24~26℃,光照強度設為2 500~3 000 1 x,光暗周期14/8 h,空氣相對濕度60%~70%,培養基的pH值5.8。
1.2.5 數據分析
在培養基中出現各種顏色的菌斑或外植體附近有黏液狀和發酵泡沫狀物質或培養基出現渾濁和云霧狀痕跡,這些都視為污染植株。
生長情況的評價標準分3個等級:第一等級為山杏外植體葉色濃綠,長勢健壯,有新芽萌發(+++);第二等級為組培苗葉色發黃,生長緩慢(++);第三等級為嫩葉或莖尖被褐化,莖段是綠色(+)。
外植體出現白化現象,不再生長,整株組培苗全部嚴重褐化,無生命跡象視為死亡。
用Exce1和SPSS進行數據處理和分析。
2 結果與分析
2.1 酒精滅菌時間對山杏外植體成活率的影響
由表1得知,75%酒精對山杏外植體進行滅菌處理,處理5~15 s,山杏外植體成活率逐漸下降,最低成活率僅50%。滅菌處理20 s時成活率達到最高,為 93.3%。滅菌處理30 s,成活率下降,為86.7%。其原因是隨著時間的延長,酒精滅菌會加大山杏莖尖細胞水分流失,導致山杏莖尖表面細胞脫水,進而降低莖尖組織生物活性,導致成活率降低[1]。滅菌 15 s山杏外植體的死亡率最高,其次是5,10 s的滅菌處理,死亡率最低的滅菌處理是20,30 s。因為短時間的滅菌處理不能殺死菌體,導致成活率下降。滅菌處理5~15 s,山杏莖尖生長健壯,嫩芽萌發,葉色濃綠。20,30 s的滅菌處理因為酒精長時間的處理,破壞了莖尖組織細胞內的生物活性,表現出葉色發黃,生長緩慢的狀態,但不會導致外植體死亡。綜合考慮成活率、污染率、死亡率和生長情況,用75%酒精滅菌處理20 s時效果最好。
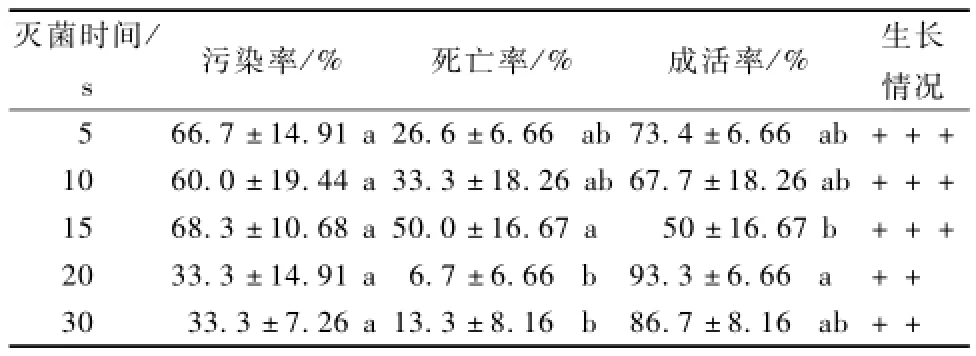
表1 酒精滅菌時間對外植體成活率的影響
2.2 升汞滅菌時間對山杏外植體成活率的影響
用75%酒精滅菌20 s后,再用0.1%升汞處理。由表2可知,滅菌處理1,3 min萌芽效果高,達26.7%;滅菌處理5,7 min萌芽率較低。滅菌處理 1 min污染率最高,達40%;處理 3,5,7 min時,外植體污染率效果不顯著,污染率最低為0%。隨處理時間的延長,污染率逐漸下降。山杏外植體的成活率最高的是滅菌3 min,成活率達93.3%;其次為1,5和7 min。觀察中發現,用0.1%升汞滅菌處理,山杏莖尖生長狀況因升汞的影響,絕大多數莖尖褐化,經過一段時間后,處理1,3 min的莖尖,生長狀況發生轉變,褐化部分長出新的嫩芽,葉色也轉綠,但生長仍緩慢。綜合考慮萌芽率、污染率、成活率、死亡率和生長情況,用0.1%升汞對山杏外植體滅菌,最佳滅菌時間為3 min。

表2 升汞滅菌時間對山杏外植體成活率的影響
2.3 6-B A濃度對山杏外植體生長的影響
在山杏初代培養基上添加不同濃度的細胞分裂素6-B A。由表3可知,6-B A濃度為0時,其萌芽率比0.4mg·L-1時的萌芽率高,但前者的萌芽天數為8 d,后者萌芽天數為4 d。空白培養基上外植體的萌發率為49.91%,芽生長緩慢,長勢一般;使用6-B A處理,隨著濃度的升高,腋芽的萌發率依次升高,分別為39.65%,59.73%,74.92%,其中濃度為1.2mg·L-1時萌發率最高,長勢最好。綜上,山杏初代培養用6-B A處理,最適宜的培養基為MS+1.2mg·L-16-B A。
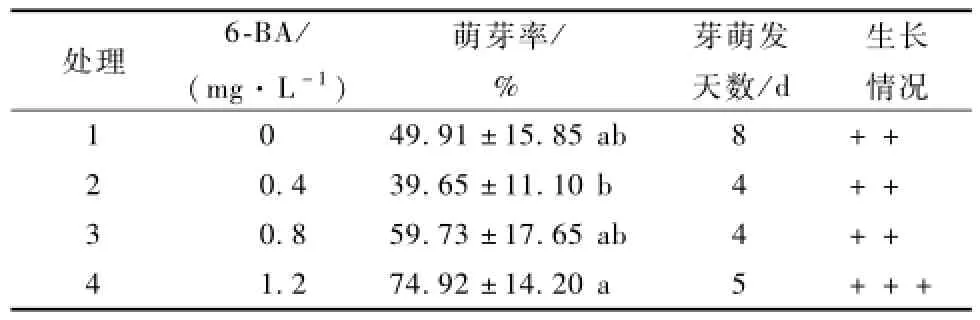
表3 6-B A濃度對山杏外植體生長的影響
2.4 6-B A與生長素共同作用對山杏初代培養的影響
在山杏初代培養基上添加1.2mg·L-16-B A與不同的生長素。
由表4可知,接種3~4 d時外植體開始萌發,N A A處理比 I B A處理的外植體萌發早。20 d后,用6-B A與I B A共同處理的外植體萌發率為86.24%,94.16%;用6-B A與N A A共同處理的外植體萌發率為83.43%和83.8%,各處理間差異不顯著。4組處理中外植體均長勢良好,30 d時腋芽伸長生長明顯且部分出現增殖的現象。綜上,山杏初代培養最適宜的培養基為MS+6-B A1.2mg· L-1+I B A1.0mg·L-1。
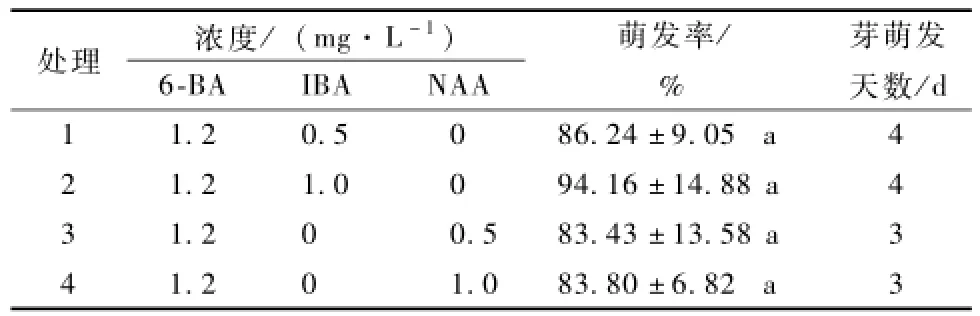
表4 6-B A與生長素共同作用對山杏初代培養的影響
3 小結與討論
本研究以山杏幼嫩莖尖為植株材料,研究了不同滅菌時間對山杏外植體成活率的影響。結果表明,用75%的酒精(20 s)+0.1%HgC12(3 min)成活率最高。對山杏外植體進行初代培養時,最適宜的培養基為M S+6-B A1.2mg·L-1+I B A1.0mg·L-1,試驗結果各項指標均優于鄭可等[2]的研究。
外植體是進行組培時從植物體上切取下來的組織或器官[3],通常采用75%酒精和0.1%升汞交叉對外植體進行滅菌[4-5]。本試驗得到的結果與齊高強等[6]和郭暉[7]的研究有所不同,用升汞滅菌的時間縮短1倍,但成活率仍能夠達到93%以上。山杏莖尖培養芽的分化多以MS培養基為基本培養基[5]。本試驗得到的最佳植物生長調節劑濃度較其他學者[7-9]研究略高。有研究表明,夏季氣溫較高,各類菌的活躍程度較高,污染率也高[10]。但山杏的新梢萌發快,只定于3-5月份采樣處理,時間短且任務重。雖本次試驗的采樣時間在7月份,但試驗結果表明,經處理后的山杏莖尖的成活率、萌發率較高,生長狀況良好。因此,為山杏外植體的培養延長了采樣時間,更能夠應用于實際生產。
[1]苗玉青,李冠,吳松林,等.薄皮核桃組織培養與快速繁殖[J].新疆農業科學,2010,47(3):503-507.
[2]鄭可,董勝君,田明芳,等.山杏組培繁殖技術[J].北方園藝,2013(3):115-118.
[3]李靜,王云德.西伯利亞百合鱗片組織培養與快速繁殖[J].生物學通報,2012,47(4):56-58.
[4]李建民,文清成,呂守城,等.大巖桐的組培快繁及其產業化技術研究[J].北方園藝,2011(4):153-154.
[5]朱廣廉.植物組織培養中的外植體滅菌[J].植物生理學通訊,1996,32(6):444-449.
[6]齊高強,趙忠,張存旭,等.大扁杏組培基本培養基與培養條件的優化研究[J].西北農林科技大學學報,2006,34(3):115-118.
[7]郭暉.大扁杏離體組織莖芽分化誘導試驗[J].平原大學學報,2007,8(4):122-125.
[8]田毅,王艷,趙宇瑛.凱特杏愈傷組織的誘導[J].現代農業科技,2006(9):10-13.
[9]杜雪玲,余如剛,宋運賢,等.“巴斗杏”組培快繁體系建立與耐鹽植株篩選[J].亞熱帶植物科學,2011,40(2):34-38.
[10]馬琳,何麗娜,姜巖,等.鋸葉班克木外植體的選擇及消毒方法的研究[J].中南林業科技大學學報,2011,31(12):134-137.
(責任編輯:張瑞麟)
S665.1
A
0528-9017(2016)01-0084-03
10.16178/j.issn.0528-9017.20160132
2015-11-04
承德市財政局項目(CZ2014004)
劉曉光(1980-),女,河北石家莊人,博士,講師,從事野生植物資源開發與利用方面的研究,E-mai1:zaosy126@126.com。

