熊果酸抑制胃癌細胞COX-2表達的信號轉導研究
朱 悅,周逸嬋,朱國琴,李劍萍,焦 政,李曉林,邵 耘,孫為豪
(1.南京醫科大學第一附屬醫院老年消化科,江蘇 南京 210029;2.鹽城市第一人民醫院腫瘤科,江蘇 鹽城 224005)
?
熊果酸抑制胃癌細胞COX-2表達的信號轉導研究
朱悅1,周逸嬋1,朱國琴1,李劍萍2,焦政1,李曉林1,邵耘1,孫為豪1
(1.南京醫科大學第一附屬醫院老年消化科,江蘇 南京210029;2.鹽城市第一人民醫院腫瘤科,江蘇 鹽城224005)
目的進一步明確熊果酸(ursolic acid,UA)抑制胃癌細胞環氧化酶-2(cycloxygenase-2,COX-2)表達的信號轉導通路。方法人胃腺癌細胞株SGC-7901和MKN-45常規培養于RPMI-1640培養液中,細胞長至亞單層后分別加抗氧化劑N-乙酰-L半胱氨酸(NAC)、單磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase, AMPK)激活劑5-氨基咪唑-4-甲酰胺核苷酸(AICAR)、AMPK抑制劑compound C和信號轉導與轉錄活化因子3(signal transducer and activator of transcription 3, STAT3)抑制劑WP1066預處理后再加UA連續培養24 h,Western blot檢測AMPK、STAT3磷酸化水平和COX-2蛋白表達。結果抗氧化劑NAC和AMPK抑制劑compound C有效地阻斷了UA抑制STAT3磷酸化和COX-2表達的作用,AMPK激活劑AICAR抑制STAT3磷酸化和COX-2表達,AICAR和UA聯合作用大于單用,STAT3抑制劑WP1066對UA誘導的AMPK磷酸化無明顯影響,WP1066單獨或聯合UA均可抑制STAT3磷酸化和COX-2表達且聯合作用大于單用。結論UA通過ROS/AMPK/STAT3信號轉導通路抑制胃癌細胞COX-2表達。
熊果酸;胃癌;活性氧;單磷酸腺苷激活的蛋白激酶;信號轉導與轉錄活化因子3;環氧化酶-2
胃癌是影響我國人民生命健康最嚴重的惡性腫瘤之一,是癌癥死亡的主要原因。根治性手術是目前治療胃癌的最有效方法,但手術不能完全避免局部復發和遠處轉移的可能,防止腫瘤復發和轉移的輔助治療越來越受到國內外學者的重視。熊果酸(ursolic acid, UA)是廣泛存在于白花蛇舌草、女貞子、烏梅和夏枯草等天然植物中的一種五環三萜類化合物,具有抑制腫瘤細胞增殖、誘導細胞凋亡、抗血管生成、抗促癌、抗突變和調節氧化應激等作用,近年來已成為腫瘤化學預防研究的熱點[1-3]。臨床前研究顯示,UA在轉基因腫瘤動物模型和人癌裸鼠移植模型中的抑瘤作用明顯[3-4],具有良好的臨床應用前景。我們的前期研究發現,UA促進胃癌細胞內活性氧(reactive oxygen species, ROS)生成,誘導單磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase, AMPK)磷酸化,抑制信號轉導與轉錄活化因子3(signal transducer and activator of transcription 3, STAT3)磷酸化和環氧化酶-2(cycloxygenase-2,COX-2)表達[5-6]。UA通過下調COX-2表達而抑制胃癌細胞增殖、誘導凋亡[6-7]。然而,UA抑制胃癌細胞COX-2表達的信號轉導通路尚不清楚。本研究選擇2株不同分化程度但COX-2高表達的SGC-7901和MKN-45胃癌細胞株作為研究對象,觀察ROS/AMPK/STAT3信號轉導通路在UA影響SGC-7901和MKN-45胃癌細胞株COX-2表達中的作用,進一步探討UA抑制胃癌細胞COX-2表達的具體機制。
1 材料與方法
1.1藥物和試劑UA、AMPK激活劑5-氨基咪唑-4-甲酰胺核苷酸(AICAR)、二甲基亞砜(DMSO)、碘化丙啶(PI)、苯甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF) 和抑肽酶為美國Sigma-Aldrich公司產品;AMPK抑制劑compound C和STAT3抑制劑WP1066為德國Merck公司產品;RPMI 1640培養液和胎牛血清為美國Gibco BRL公司產品;蛋白質定量BCA試劑盒為美國Pierce公司產品;抗氧化劑N-乙酰-L半胱氨酸(NAC)為江蘇碧云天生物技術公司產品;兔抗人AMPK和磷酸化AMPK(p-AMPK)、乙酰輔酶A羧化酶(ACC)和磷酸化ACC(p-ACC)、STAT3和 磷酸化STAT3(p-STAT3)、COX-2和β-actin單克隆抗體為美國Cell Signaling Technology公司產品;辣根過氧化物酶標記的山羊抗兔IgG抗體為美國Bioworld Technology公司產品。PVDF膜為美國Millipore公司產品;ECL發光試劑盒為英國Amersham公司產品;其它試劑為國產分析純級。
1.2細胞和培養人胃腺癌中分化細胞株SGC-7901購自中國科學院上海生科院細胞資源中心,人胃腺癌低分化細胞株MKN-45購自南京凱基生物科技發展有限公司。SGC-7901和MKN-45細胞常規傳代培養于含10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1鏈霉素的RPMI 1640培養液中,37℃、5% CO2及飽和濕度的二氧化碳培養箱中培養生長。隔天換液,3 d傳代1次。
1.3藥物配制UA、AICAR、compound C和WP1066先以DMSO溶解,NAC用超純水溶解,而后均以RPMI 1640培養液稀釋至所需濃度,DMSO在培養液中的濃度不超過0.1%,0.22 μm的微孔濾膜過濾除菌后4℃保存備用。
1.4實驗分組將傳代后處于對數生長期的細胞分為對照(control)組、UA(30 μmol·L-1)組、抗氧化劑(NAC, 5 mmol·L-1)組、NAC+UA組、AMPK激活劑(AICAR, 0.5 mmol·L-1)組、AICAR+UA組、AMPK抑制劑(compound C, 2.5 μmol·L-1)組、compound C+UA組、STAT3抑制劑(WP1066, 5 μmol·L-1)組、WP1066+UA組。NAC+UA組NAC預處理30 min后UA再干預培養24 h;AICAR+UA組AICAR預處理2 h后UA再干預培養24 h;compound C+UA組compound C預處理1 h后UA再干預培養24 h;WP1066+UA組WP1066預處理1 h后UA再干預培養24 h。
1.5細胞蛋白提取和Western blot檢測各組干預培養后的細胞用預冷的PBS洗滌3次,以100 μL細胞裂解液(PBS內含:Nonidet P-40 1%,脫氧膽酸鈉5 g·L-1,SDS 1 g·L-1,PMSF 0.1 g·L-1和抑肽酶10 mg·L-1)4℃處理60 min。細胞裂解物經11 000×g4℃離心10 min后取上清,BCA試劑盒測定其蛋白濃度。常規進行SDS-PAGE電泳后轉印至PVDF膜,室溫封閉2 h,分別加入一抗(APMK抗體、p-AMPK抗體、ACC抗體、p-ACC抗體、STAT3抗體、p-STAT3抗體、COX-2抗體和β-actin抗體),4℃孵育過夜,辣根過氧化物酶標記的山羊抗兔IgG抗體為第二抗體,4℃孵育2 h,ECL發光,使用ImageJ(National Institute of Health, Bethesda, MD)圖像分析軟件對蛋白電泳帶的灰度進行半定量分析。
2 結果
2.1UA和抗氧化劑NAC對胃癌細胞AMPK、STAT3磷酸化和COX-2表達的影響Western blot檢查結果顯示,抗氧化劑NAC有效抑制UA誘導的AMPK磷酸化,ACC是AMPK的下游直接效應靶蛋白,p-ACC被認為是觀察AMPK被激活的最佳指標[8](Fig 1),UA抑制STAT3磷酸化和COX-2表達的作用被NAC所逆轉(Fig 2)。
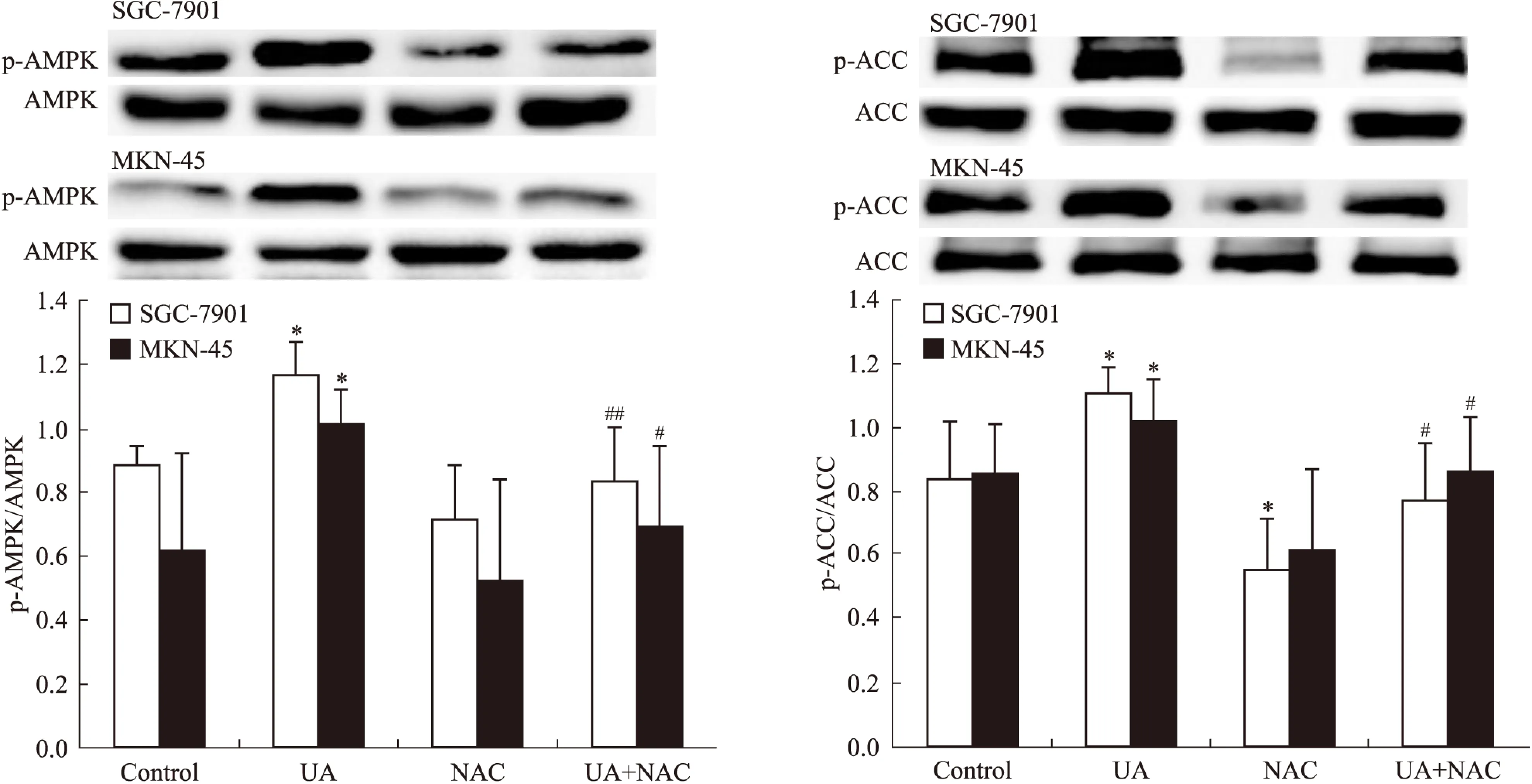
Fig 1 Effects of NAC on ursolic acid(UA)-induced AMPK and ACC phosphorylation in gastric cancer cells
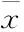
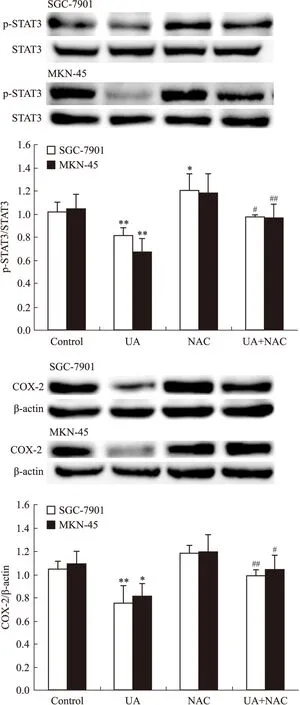
Fig 2 Effects of NAC on UA-inhibited STAT3 phosphorylation and COX-2 expression in gastric cancer cells

2.2UA和AMPK激活劑AICAR對胃癌細胞AMPK、STAT3磷酸化和COX-2表達的影響Western blot檢查結果顯示,AMPK激活劑AICAR單用或聯合UA均可誘導SGC-7901和MKN-45細胞AMPK磷酸化(Fig 3),抑制STAT3磷酸化和COX-2表達,聯合作用大于單藥作用(Fig 4)。
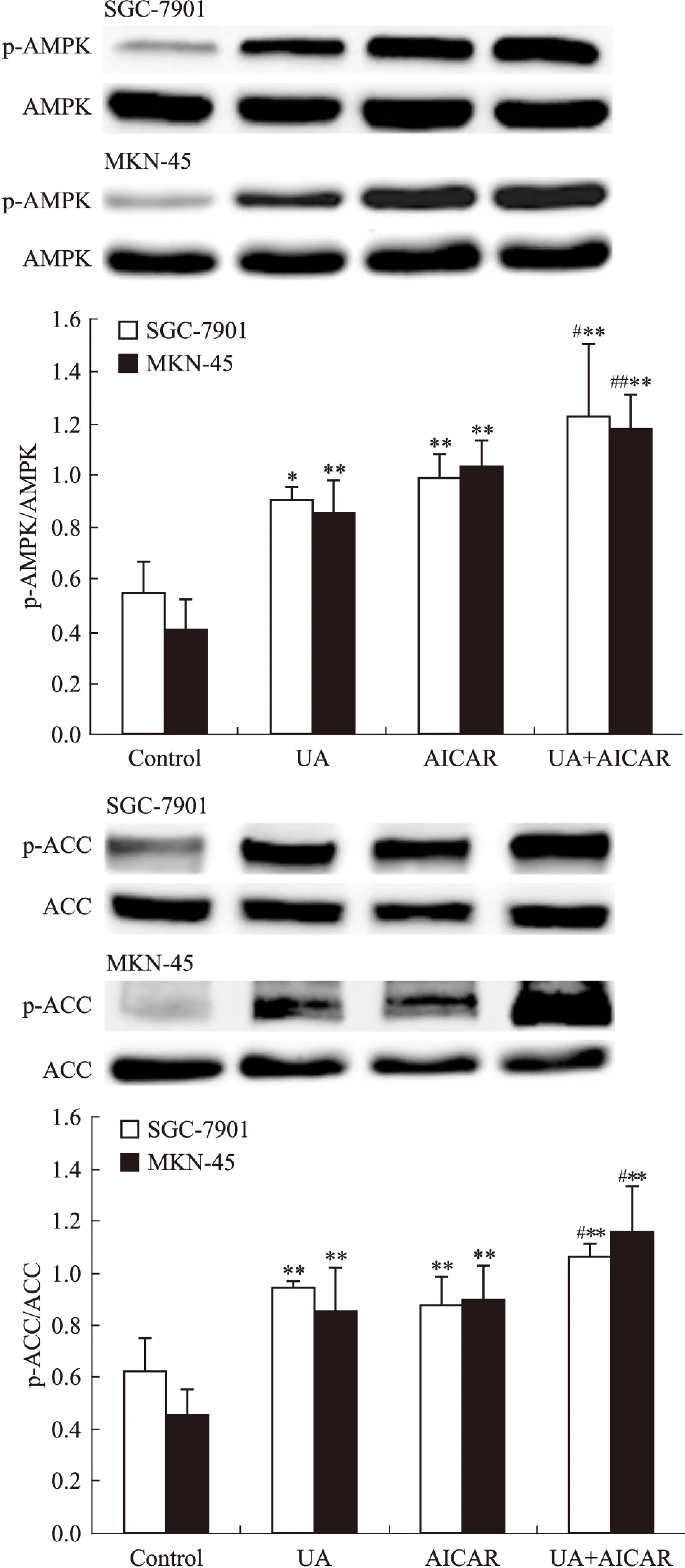
Fig 3 Effects of AMPK activator AICAR(5-amino-4-imidazolecarboxamide riboside-1-b-D-ribofuranoside) on UA-induced AMPK and ACC phosphorylation in gastric cancer cells
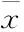
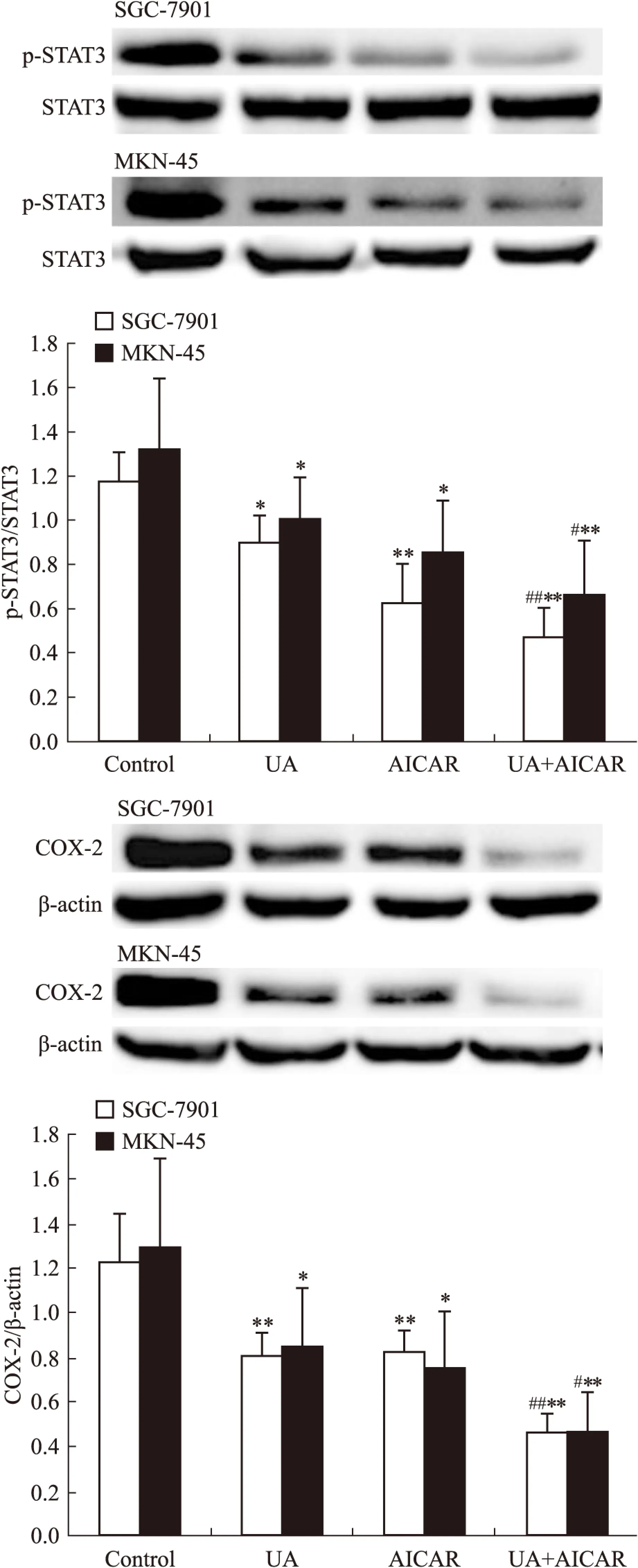
Fig 4 Effects of AMPK activator AICAR on UA-inhibited STAT3 phosphorylation and COX-2 expression in gastric cancer cells

2.3UA和AMPK抑制劑compound C對胃癌細胞AMPK、STAT3磷酸化和COX-2表達的影響AMPK抑制劑compound C有效抑制UA誘導的AMPK磷酸化(Fig 5),UA抑制STAT3磷酸化和COX-2表達的作用被compound C所逆轉(Fig 6)。

Fig 5 Effects of AMPK inhibitor compound C on UA-induced AMPK and ACC phosphorylation in gastric cancer cells
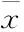
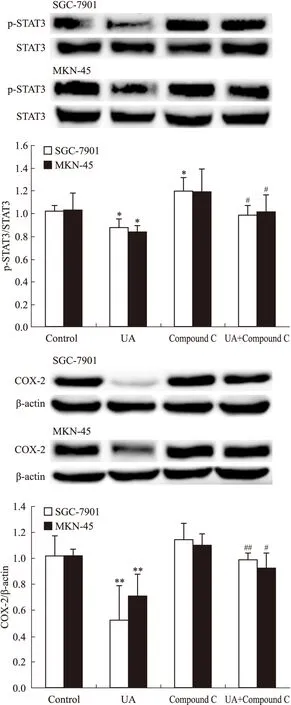
Fig 6 Effects of AMPK inhibitor Compound C on UA-inhibited STAT3 phosphorylation and COX-2 expression in gastric cancer cells

2.4UA和STAT3抑制劑WP1066對胃癌細胞AMPK、STAT3磷酸化和COX-2表達的影響STAT3抑制劑WP1066對UA誘導的AMPK磷酸化無明顯影響(Fig 7),WP1066單用或聯合UA均可抑制SGC-7901和MKN-45細胞STAT3磷酸化和COX-2表達,且聯合作用大于單藥作用(Fig 8)。
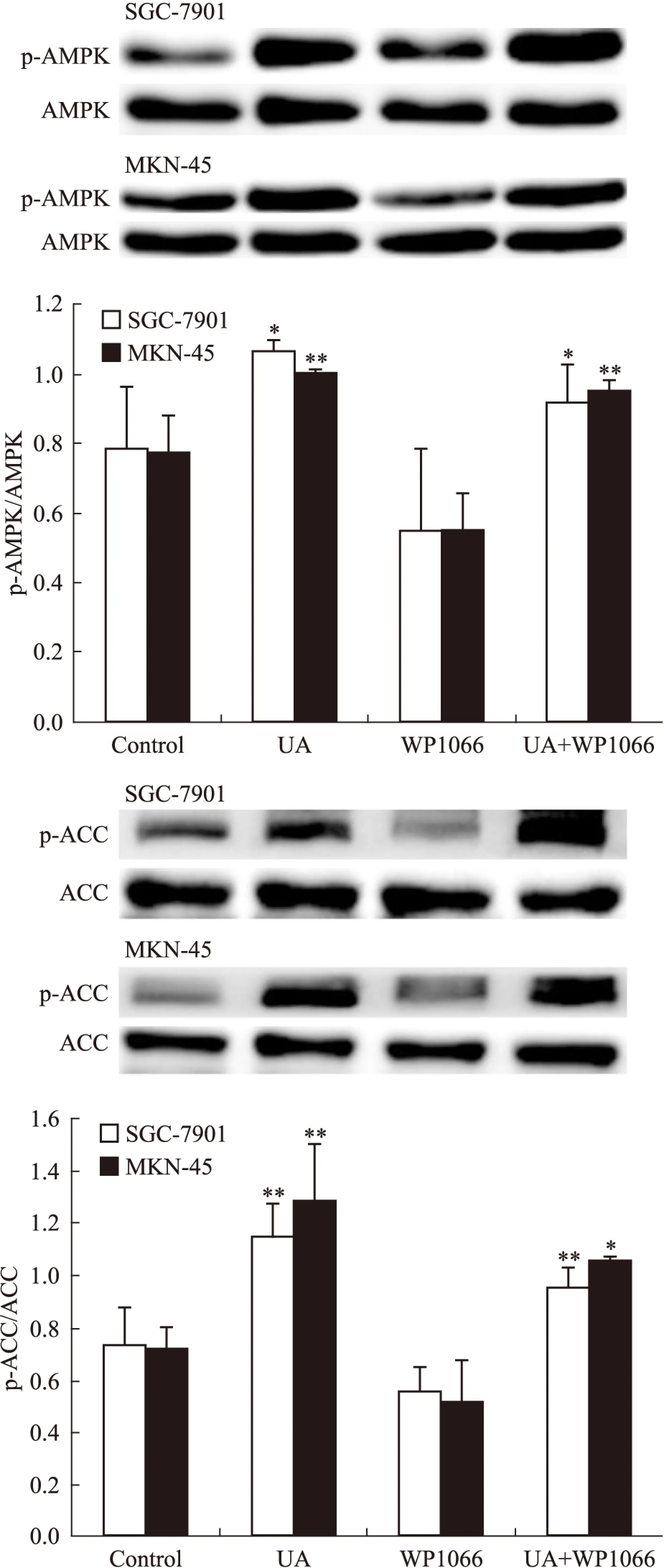
Fig 7 Effects of STAT3 inhibitor WP1066 on UA-induced AMPK and ACC phosphorylation in gastric cancer cells
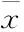
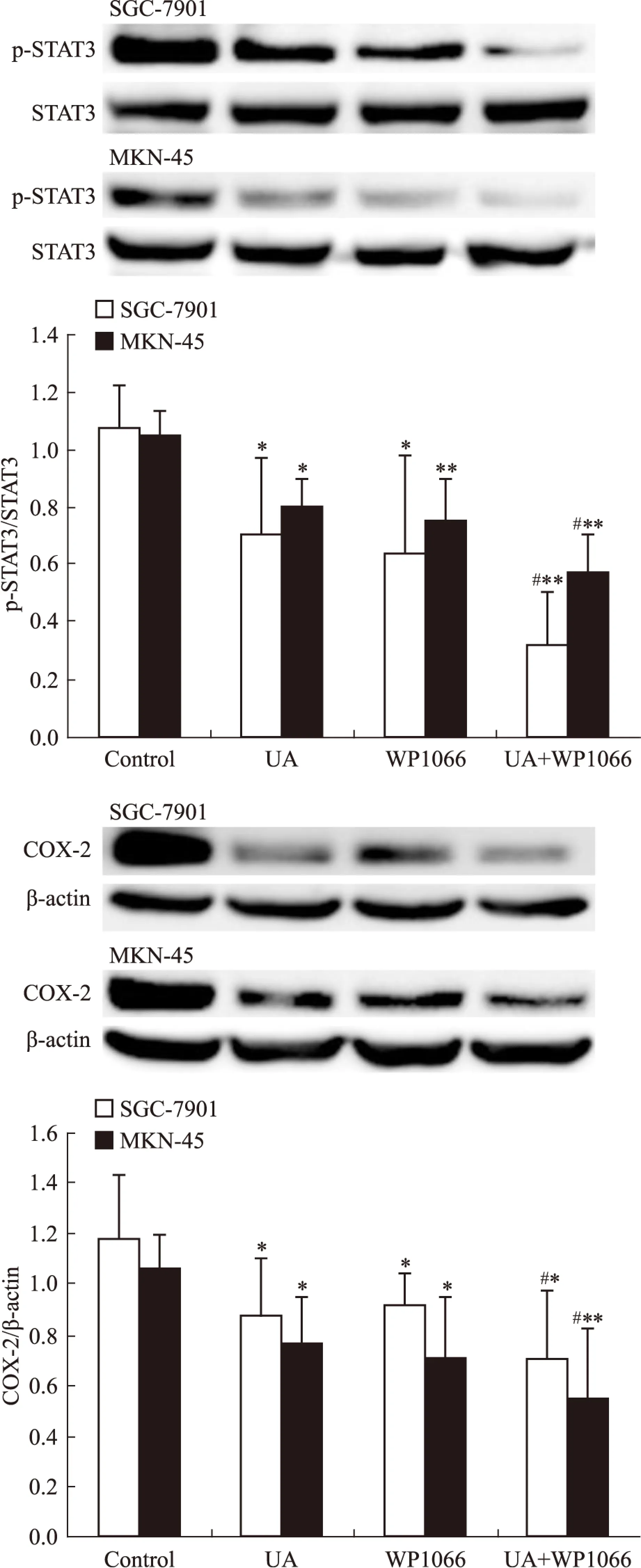
Fig 8 Effects of STAT3 inhibitor WP1066 on UA-inhibited STAT3 phosphorylation and COX-2 expression in gastric cancer cells

3 討論
ROS是氧在機體代謝過程中產生的中間產物及其衍生物,參與細胞增殖、分化、轉化和凋亡以及細胞內重要信號途徑的轉導[9],近年來研究表明,抗腫瘤藥物誘導細胞凋亡與其引起腫瘤細胞內ROS水平增加密切相關[10-12]。AMPK是細胞能量代謝的主要調節器[13],激活AMPK可誘導胃癌和胰腺癌等腫瘤細胞發生凋亡[14-15],UA和白藜蘆醇(resveratrol)的抗腫瘤作用與ROS依賴的AMPK活化有關[5,16-17]。
AMPK除參與細胞內的能量代謝調節外還調控一些基因的轉錄和表達[18],本研究結果顯示,UA誘導AMPK磷酸化,抑制STAT3磷酸化和COX-2表達;抗氧化劑NAC能逆轉UA對STAT3磷酸化和COX-2表達的抑制作用,提示ROS是UA抑制STAT3活性和COX-2表達的重要介質[5]。AMPK激活劑AICAR是AMP類似物,明顯抑制STAT3磷酸化和COX-2表達,UA與AICAR聯合使用對STAT3磷酸化和COX-2表達的抑制作用和單用UA組相比差異有顯著性,提示UA聯合AICAR后AMPK得到進一步的激活。而AMPK抑制劑compound C則逆轉UA對STAT3磷酸化和COX-2表達的抑制作用,進一步證明UA通過AMPK信號通路抑制胃癌細胞STAT3活化和COX-2表達。
我們前期研究發現,JAK2/STAT3和PI3K/Akt信號途徑能誘導胃癌細胞COX-2的表達[19],而UA能阻斷STAT3通路抑制多發性骨髓瘤細胞增殖[20]。STAT3在各種類型的人胃癌細胞株和胃癌組織中都有較高的活性,JAK/STAT信號轉導途徑可能在胃癌的發生、發展中起重要的作用[21]。因此,我們推測UA通過ROS/AMPK/STAT3通路下調COX-2表達。當然,由于細胞內信號轉導機制十分復雜,UA抑制胃癌細胞COX-2表達尚不排除有其它通路的存在,也不排除不同通路之間存在關聯(如cross-talk等),要全面了解其機制需大量而深入的研究。
[1]Kalani K, Yadav D K, Khan F, et al. Pharmacophore, QSAR, and ADME based semisynthesis andinvitroevaluation of ursolic acid analogs for anticancer activity[J].JMolModel, 2012, 18(7):3389-413.
[2]Zhao C, Yin S, Dong Y, et al. Autophagy-dependent EIF2AK3 activation compromises ursolic acid-induced apoptosis through upregulation of MCL1 in MCF-7 human breast cancer cells[J].Autophagy, 2013, 9(2):196-207.
[3]Shanmugam M K, Manu K A, Ong T H, et al. Inhibition of CXCR4/CXCL12 signaling axis by ursolic acid leads to suppression of metastasis in transgenic adenocarcinoma of mouse prostate model[J].IntJCancer, 2011, 129(7):1552-63.
[4]Prasad S, Yadav V R, Sung B, et al. Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways: chemosensitization with capecitabine[J].ClinCancerRes, 2012, 18(18):4942-53.
[5]龐姍姍,朱悅,周逸嬋,等. 熊果酸通過ROS/AMPK/STAT3信號通路抑制胃癌細胞COX-2表達[J]. 江蘇醫藥,2015, 41(12):1368-70.
[5]Pang S S, Zhu Y, Zhou Y C, et al. Ursolic acid inhibiting COX-2 expression in gastric cancer cell through ROS/AMPK/STAT3 signal pathway[J].JiangsuMedJ, 2015, 41(12):1368-70.
[6]唐丹,李劍萍,鄭錫鳳,等. 熊果酸通過STAT3通路調控胃癌細胞增殖和凋亡[J]. 中國藥理學通報,2012, 28(2):179-84.
[6]Tang D, Li J P, Zheng X F, et al. Regulation of ursolic acid on proliferation and apoptosis of gastric cancer cells via STAT3 signaling pathway[J].ChinPharmacolBull, 2012, 28(2):179-84.
[7]Zhang H, Li X, Ding J, et al. Delivery of ursolic acid(UA) in polymeric nanoparticles effectively promotes the apoptosis of gastric cancer cells through enhanced inhibition of cyclooxygenase 2(COX-2)[J].IntJPharm, 2013, 441(1-2):261-8.
[8]Shaw R J. Glucose metabolism and cancer[J].CurrOpinCellBiol,2006,18(6):598-608.
[9]Ray P D, Huang B W, Tsuji Y. Reactive oxygen species(ROS) homeostasis and redox regulation in cellular signaling[J].CellSignal, 2012, 24(5):981-90.
[10]Yi B,Liu D,He M,et al. Role of the ROS/AMPK signaling pathway in tetramethylpyrazine-induced apoptosis in gastric cancer cells[J].OncolLett,2013, 6(2):583-9.
[11]Li X, Zheng D, Lu X, et al. Enhanced cytotoxicity and activation of ROS-dependent c-Jun Np-terminal kinase and caspase-3 by low doses of tetrandrine-loaded nanoparticles in Lovo cells-A possible Trojan strategy against cancer[J].EurJPharmBiopharm, 2010, 75(3):334-40.
[12]Li X, Lu X, Xu H, et al. Paclitaxel/tetrandrine coloaded nanoparticles effectively promote the apoptosis of gastric cancer cells based on "oxidation therapy"[J].MolPharm, 2012, 9(2):222-9.
[13]Hardie D G. AMPK: positive and negative regulation, and its role in whole-body energy homeostasis[J].CurrOpinCellBiol, 2015, 33:1-7.
[14]Saitoh M, Nagai K, Nakagawa K, et al. Adenosine induces apoptosis in the human gastric cancer cells via an intrinsic pathway relevant to activation of AMP-activated protein kinase[J].BiochemPharmacol, 2004, 67(10):2005-11.
[15]Wang B, Wang X B, Chen L Y, et al. Belinostat-induced apoptosis and growth inhibition in pancreatic cancer cells involve activation of TAK1-AMPK signaling axis[J].BiochemBiophysResCommun, 2013, 437(1):1-6.
[16]Zheng Q Y, Jin F S, Yao C, et al. Ursolic acid-induced AMP-activated protein kinase(AMPK) activation contributes to growth inhibition and apoptosis in human bladder cancer T24 cells[J].BiochemBiophysResCommun, 2012, 419(4):741-7.
[17]Yuan Y, Xue X, Guo R B, et al. Resveratrol enhances the antitumor effects of temozolomide in glioblastoma via ROS-dependent AMPK-TSC-mTOR signaling pathway[J].CNSNeurosciTher, 2012, 18(7):536-46.
[18]McGee S L, Hargreaves M. AMPK and transcriptional regulation[J].FrontBiosci,2008, 13:3022-33.
[19]Xu W, Chen G S, Shao Y, et al. Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J].CancerLett, 2013, 332(1):11-8.
[20]Pathak A K, Bhutani M, Nair A S, et al. Ursolic acid inhibits STAT3 activation pathway leading to suppression of proliferation and chemosensitization of human multiple myeloma cells[J].MolCancerRes, 2007, 5(9):943-55.
[21]Huang W, Yu L F, Zhong J, et al. Stat3 is involved in angiotensin II-induced expression of MMP2 in gastric cancer cells[J].DigDisSci, 2009, 54(10):2056-62.
Signal transduction pathway of ursolic acid inhibiting COX-2 expression in gastric cancer cells
ZHU Yue1, ZHOU Yi-chan1, ZHU Guo-qin1, LI Jian-ping2,JIAO Zheng1, LI Xiao-lin1, SHAO Yun1, SUN Wei-hao1
(1.DeptofGeriatricGastroenterology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China;2.DeptofOncology,theFirstPeople′sHospitalofYanchengCity,YanchengJiangsu224005,China)
AimOur previous study has found that ursolic acid(UA) increased intracellular reactive oxygen species(ROS) production and adenosine monophosphate-activated protein kinase(AMPK) phosphorylation, inhibited signal transducer and activator of transcription 3(STAT3) phosphorylation and cyclooxygenase-2(COX-2) expression in gastric cancer cells. However, the molecular mechanism by which UA inhibits COX-2 expression in gastric cancer cells has not been fully clarified. In this study we aimed to further clarify the signal transduction pathways involved in the UA-mediated inhibition of COX-2 expression in gastric cancer cells.MethodsHuman gastric cancer cell lines SGC-7901 and MKN-45 were routinely cultured in RPMI-1640 medium supplemented with 10% heat-inactivated fetal calf serum. Sub-confluent cell cultures were pre-treated with antioxidant N-acetylcysteine(NAC), AMPK activator 5-amino-4-imida- zolecarboxamide-riboside(AICAR), AMPK inhibitor compound C, or STAT3 inhibitor WP1066 and then treated with or without UA for 24 h. The expression of AMPK and phosphorylated AMPK(p-AMPK), STAT3 and phosphorylated STAT3(p-STAT3), as well as COX-2 was detected by Western blot analysis.ResultsAntioxidant NAC and AMPK inhibitor compound C blocked UA-induced inhibition of STAT3 phosphorylation and down-regulation of COX-2 expression in gastric cancer cells. Both AMPK activator AICAR and UA inhibited STAT3 phosphorylation and COX-2 expression; the combination of two drugs resulted in further reduction. STAT3 inhibitor WP1066 did not affect UA-induced AMPK phosphorylation, whereas it inhibited STAT3 phosphorylation and COX-2 expression. The inhibitory effects on the STAT3 phosphorylation and COX-2 expression were significantly enhanced when SGC-7901 and MKN-45 cells were treated simultaneously with WP1066 plus UA.ConclusionUA inhibits COX-2 expression in gastric cancer cells, which may be mediated through ROS/AMPK/STAT3 signal transduction pathway.
ursolic acid; gastric cancer; reactive oxygen species; adenosine monophosphate-activated protein kinase; signal transducer and activator of transcription 3; cyclooxygenase-2
2016-01-07,
2016-03-17
國家自然科學基金面上項目(No 81372659)
朱悅(1990-),女,碩士生,研究方向:胃癌防治,E-mail: 421892415@qq.com;孫為豪(1963-),男,教授,博士生導師,研究方向:胃腸道腫瘤的分子生物學,通訊作者,E-mail:swh@njmu.edu.cn
10.3969/j.issn.1001-1978.2016.07.009
A
1001-1978(2016)07-0925-08
R284.1;R345.4;R345.57;R735.202.2;R977.3;R977.6
網絡出版時間:2016-6-20 11:49網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.018.html