骨髓間充質干細胞在潰瘍性結腸炎小鼠模型結腸的定位
李榮富 高廣周 孫 濤 王志紅
?
·基礎研究·
骨髓間充質干細胞在潰瘍性結腸炎小鼠模型結腸的定位
李榮富高廣周孫濤王志紅
230032合肥市第二人民醫院消化內科(李榮富,王志紅);100048北京,海軍總醫院消化內科(高廣周,孫濤)
潰瘍性結腸炎(UC)是一種病因和發病機制尚不清楚的慢性腸道炎性疾病,近年來UC的患病率呈明顯升高趨勢,有報道約為11.6/10萬[1],目前缺乏有效的治療方法。1996年Tyndall等[2]用異體造血干細胞移植治療白血病合并UC患者時,發現其對白血病起治療作用的同時,也明顯改善了UC的癥狀,這為UC的治療方法研究提供了新的思路。目前干細胞移植用于UC的治療是國內外相關領域研究的熱點之一。本研究旨在探討骨髓間充質干細胞(BMSC)在小鼠遠端結腸的定位情況,為干細胞移植治療UC的實驗研究提供理論基礎。
1材料與方法
1.1實驗動物
健康BALB/c小鼠,雌性(8周齡)30只,雄性(3周齡)4只,購自軍事醫學科學院實驗動物中心,許可證號:SCXK-(軍)2007-004,飼養于海軍總醫院實驗動物中心SPF級動物實驗室。
1.2主要試劑及儀器
DMEM/F12培養基(Thermo);PE標記小鼠抗人CD44、CD34、CD45、CD90抗體(Biolegend);葡聚糖硫酸鈉(MP Biomedicals);兔抗SRY蛋白單抗(Sigma);細胞培養箱(Thermo Forma);倒置熒光顯微鏡(Nikon)。
1.3BMSC的分離培養及鑒定
脫臼處死雄性小鼠,無菌條件下分離脛骨及股骨,暴露骨髓腔,用培養液沖洗骨髓腔,收集后過濾離心,1000 r/min離心5 min,棄上清液后用培養液重懸細胞,37 ℃,5% CO2飽和濕度下培養。72 h首次換液,細胞繁殖長滿瓶底90%時,按1∶2比例傳代。細胞培養過程中逐日觀察細胞貼壁特性及形態。并利用流式細胞儀檢測P3代細胞CD34、CD44、CD45、CD90的表達情況。
1.4實驗動物分組及UC模型的建立
30只雌性BALB/c小鼠隨機分為2組,移植組[5%葡聚糖硫酸鈉(DSS)+干細胞移植]20只,空白組10只。根據Kihara等[3]方法建立急性DSS小鼠UC模型,將DSS溶于蒸餾水,配成5%DSS溶液,讓移植組小鼠自由飲用7 d,建立UC模型。
1.5小鼠疾病活動指數評分
造模期間每日觀察造模小鼠的體質量變化、大便性狀及便血情況,按表1[4]進行評分,得出每只小鼠的疾病活動指數(DAI)評分(表1)。

表1 DAI評分標準
注:正常成形大便;松散不黏附于肛門的糊狀、半成形大便;稀便可黏附于肛門的稀水樣便
1.6 BMSC移植及取材
造模后,移植組小鼠經鼠尾靜脈回輸P3代雄性小鼠BMSC,細胞數目和液體量為每只1×106/0.4 mL;空白組小鼠各經鼠尾靜脈回輸生理鹽水0.4 mL。移植組及空白組于移植后0 d(BMSC移植前)、3 d、7 d、14 d、21 d分別處死4只及2只。小鼠麻醉后仰臥位固定,暴露腹腔組織,距肛門1 cm處取結腸組織2 cm,以10%福爾馬林溶液固定,常規石蠟包埋,連續4 μm切片,共切3張,用于組織切片蘇木精-伊紅(HE)染色、性別決定區Y(SRY)蛋白免疫組織化學染色。
2結果
2.1BMSC培養結果
原代細胞培養12 h,可見細胞貼壁現象,72 h首次換液后,可見瓶底貼壁細胞散在生長,分布不均,部分呈集落狀或單個細胞存在,胞體呈長梭形,兩端有長突起,折光性差,核不清楚(見圖1A)。原代培養 7 d,懸浮細胞已清除,貼壁細胞形態一致,培養瓶底部細胞達90%融合,呈漩渦狀或輻射狀排列,細胞形態狹長,核呈橢圓形,進行第1次傳代培養(見圖1B)。隨著傳代次數增加,細胞不斷增殖分化形成均一的梭形細胞,梭形細胞呈放射狀向周邊生長,即呈典型的極性漩渦狀(見圖1C)。

圖1 BMSC培養結果(×100) A 原代3 d B 原代7 d C P3代
2.2 BMSC表面抗原鑒定結果
經流式細胞術檢測,經培養至第3代細胞的藻紅蛋白(P-phycoerythrin,PE)標記CD34(Date.07)陽性率為0.61%、PE標記CD45(Date.04)陽性率為0.28%、PE標記CD44(Date.03)陽性率為99.42%、PE標記CD90(Date.02)陽性率為98.69%、空白對照組陽性率為0.45%(Date.01)(見圖2)。
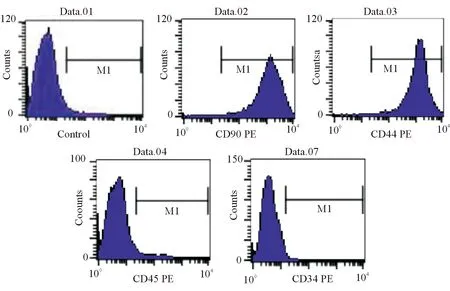
圖2 CD34、CD44、CD45、CD90抗體流式細胞術檢測結果
2.3造模期間小鼠DAI評分
空白組小鼠DAI評分在實驗過程中為0;移植組小鼠飲用5%DSS后的第1天和第2天,DAI評分也均為0,第3、4、5、6、7 天的DAI評分依次為(1.06±0.96)、(2.48±1.23)、(4.32±1.43)、(7.26±1.62)、(8.92±1.01),見圖3。
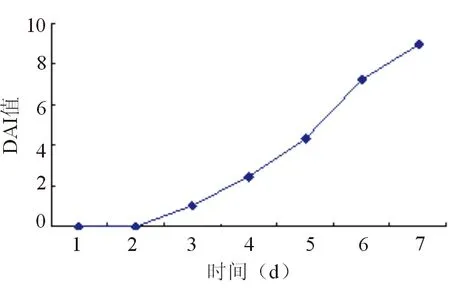
圖3 移植組小鼠DAI評分
2.4結腸組織HE染色結果
移植組飲用DSS 7 d后,結腸黏膜多處糜爛、潰瘍、出血,黏膜上皮不完整,部分上皮細胞壞死脫落,黏膜層及黏膜下層廣泛充血、水腫,炎性反應主要累及黏膜及黏膜下層,浸潤的炎性細胞以中性粒細胞為主;空白組結腸黏膜上皮完整、連續,腺體排列規則、結構清楚,黏膜層及黏膜下層無異常(見圖4)。
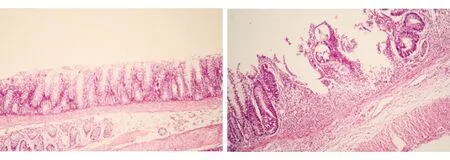
圖4兩組的結腸組織HE染色結果A空白組(×100)B移植組(BMSC移植前,×400)
2.5SRY蛋白免疫組織化學檢測結果
結果顯示,移植組的結腸組織在移植后3、7、14、21 d均可檢測到SRY蛋白陽性細胞,部分陽性細胞呈簇排列(見圖5)。
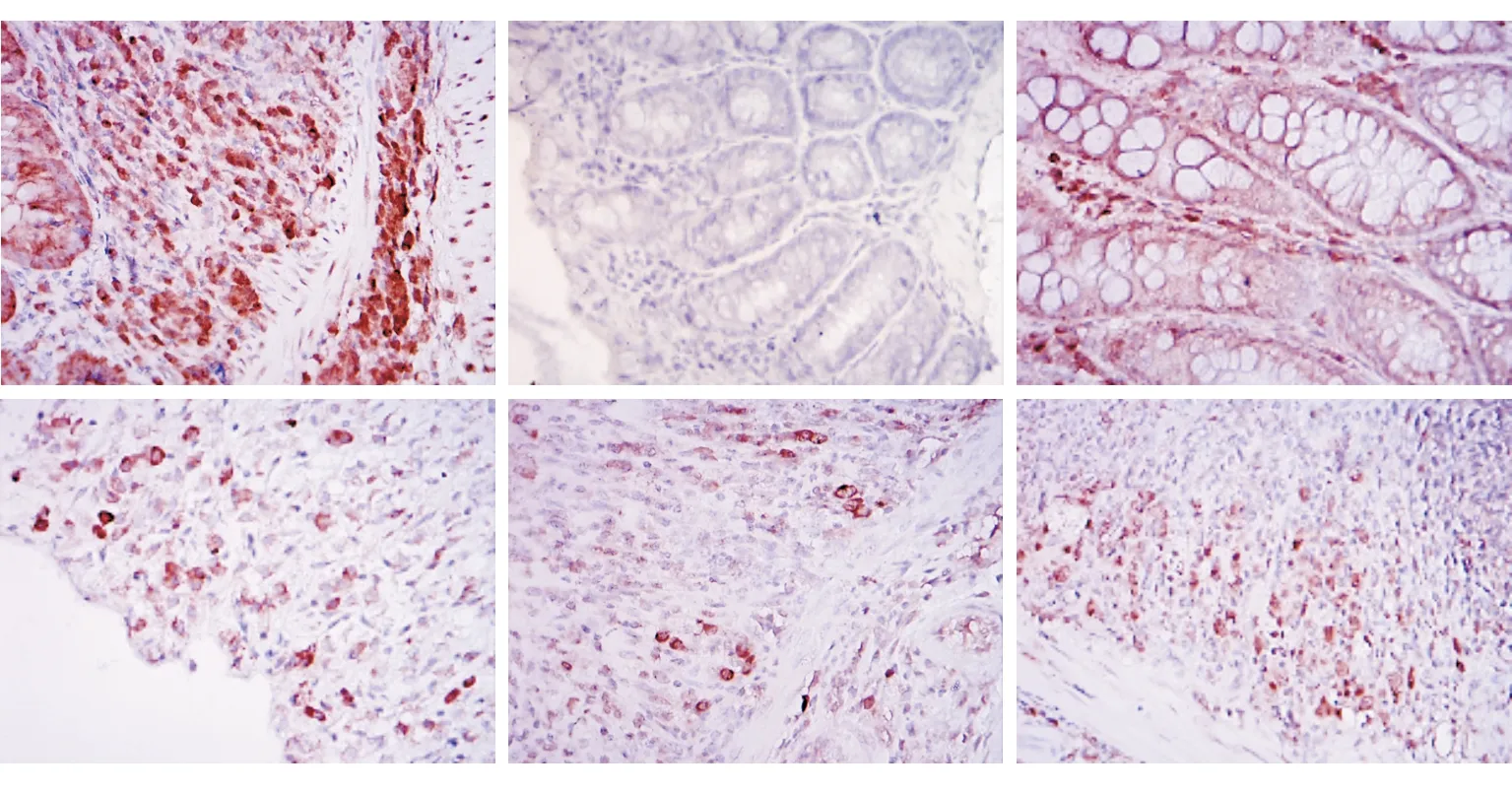
圖5移植組的結腸組織中SRY蛋白陽性細胞檢測結果(×100)A陽性對照BBMSC移植前C移植后3 dD移植后7 dE移植后14 dF移植后21 d
3討論
3.1BMSC的分離及培養
BMSC是一種具有多向分化潛能的細胞,在特定的條件下能誘導分化形成多種非造血組織細胞(如成骨細胞、軟骨細胞、肌細胞等)。目前對于BMSC的分離與培養,存在著流式細胞分選法、密度梯度離心法、免疫磁珠法及全骨髓貼壁篩選法等多種方式。全骨髓貼壁篩選法是最早也是較簡單的提取分離方法,有研究表明擴增1代及2代后,BMSC的純度分別達到95%和98%[5]。本實驗采用的是全骨髓貼壁篩選法,獲取的BMSC在培養12 h后即可貼壁,在培養7 d后培養瓶底即有90%融合,表明原代細胞生長旺盛,增殖能力強,可在體內快速大量增殖;傳至P3代后BMSC形態單一均勻,呈典型的極性漩渦狀生長,說明經全骨髓培養法所獲取的BMSC純度較高。
3.2BMSC的鑒定
BMSC沒有理想的特異性表面標志物,它既有間質細胞的表面抗原,又有內皮細胞、上皮細胞及肌肉細胞的表面抗原,包括表達CD29、CD44、CD71、CD90、CD105、CD120 a、CD124、CD166等表面抗原[6],不表達的是造血細胞表面標志物,包括CD14、CD34及白細胞共同抗原CD45等。目前實驗中應用的BMSC的表面分子,只是相對接近于BMSC,比如首先排除造血前體細胞標志物抗原CD34,白細胞標志物抗原CD45,以及單核細胞、巨噬細胞表面抗原CD14 等;再檢測BMSC表達陽性的細胞表面標志物,如CD13、CD29、CD44、CD90、CD105。由于沒有特異性的表型,其鑒定尚無統一標準,這給準確鑒定BMSC帶來一定的困難。本實驗利用流式細胞術檢測細胞表面CD45、CD34、CD44、CD90抗原的表達率,發現CD44和CD90表達率>98%,而CD45和CD34表達率<1%,符合BMSC表面抗原表達特征。
3.3UC模型的建立
從20世紀60年代至今,為研究UC,學者們制作了多種動物模型,如化學物質誘導模型、免疫致敏模型、細胞移植模型和基因敲除模型等[7]。其中化學物質誘導模型的準備方法較為簡單、經濟,且在許多方面與人類UC有相似之處。1985年日本學者首次應用DSS制備UC模型,此后大量研究表明DSS誘導的UC模型在臨床表現、腸道病理和發病機制等方面均與人類UC相似[8]。本實驗采用的是DSS誘導的UC模型,DAI評分隨著飲用DSS時間的延長而升高,與UC急性期主要臨床表現完全相符。飲用DSS 7 d后,遠端結腸組織HE染色結果顯示黏膜多處糜爛、潰瘍、出血,黏膜層及黏膜下層充血水腫,炎性細胞浸潤,與Okayasu等[9]的研究結果一致。結合制模小鼠臨床病理表現,表明本研究成功復制了BALB/c小鼠急性UC模型。
3.4BMSC的示蹤
有研究表明,BMSC具有向損傷組織趨化及低免疫原性的特性,可在造血組織以外的多種組織如肺、骨、軟骨、皮膚等處定位和分布,移植后無免疫排斥反應[10-11]。為了追蹤移植細胞,必須對細胞進行標記,目前細胞的標記方法主要有熒光染料標記法、抗原標記法、轉基因標記法、Y 染色體標記法、磁性標記法等。Y 染色體標記法是將雄性供體動物細胞移植到雌性動物體內后,對Y染色體進行檢測,此法不受時間和細胞表型變化的影響,也不受組織類型的限制[12-13],其穩定性及特異性均較高,且可在受體體內終生存在,被認為是檢測移植細胞的金標準。本實驗采用的是Y染色體標記法,Y染色體為雄性個體所獨有,所有被分析的哺乳動物的Y染色體上都能找到原始性別決定基因Sry。本研究通過免疫組織化學檢測Y染色體上的Sry基因所表達的SRY蛋白,結果顯示移植組的結腸組織在BMSC移植后3、7、14、21 d均可檢測到SRY蛋白陽性細胞,表明移植細胞在炎性反應等因素的作用下向受損腸道遷移,并可在受損腸道定位成活,這為應用BMSC移植治療UC提供了可能。然而,對于移植后定位于受損腸道的干細胞是否有功能、是否發揮了對腸道的修復作用以及通過何種途徑發揮作用,尚需進一步研究。
參考文獻
1 Inflammaotry bowel disease cocperation group, Chinese society of gastroenterology. Chinese consensus on diagnosis and treatment standard of inflammatory bowel disease[J]. Chin J Gastroenterol, 2007, 12: 488-495.
2 Tyndall A, Gratwohl A. Blood and marrow stem cell transplants in autoimmune disease. A consensus report written on behalf of the European League Against Rheumatism (EULAR) and the European Group for Blood and Marrow Transplantation (EBMT)[J]. Br J Rhematol, 1997, 36: 390-392.
3 Kihara N, de la Fuente SG, Fujino K, et al.Vanilloid receptor-1 containing primary sensory neurones mediate dextran sulphate sodium induced colitis in rats[J]. Gut, 2003, 52: 713-719.
4 Murano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J]. Clin Exp Immunol, 2000, 120: 51-58.
5 Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284: 143-147.
6 Meirelles Lda S, Nardi NB. Murine marrow-derived mesenchymal stem cell: isolation, in vitro expansion, and characterization[J]. Br J Haematol, 2003, 123: 702-711.
7 Hagar HH, El-Medany A, El-Eter E, et al. Ameliorative effect of pyrrolidinedithiocar-bamate on acetic acid-induced colitis in rats[J]. Eur J Pharmacol, 2007, 554: 69-77.
8 Kullmann F, Messmann H, Alt M, et al. Clinical and histopathological features of dextran sulfate sodium induced acute and chronic colitis associated with dysplasia in rats[J]. Int J Colorectal Dis, 2001, 16: 238-246.
9 Okayasu I, Hatakeyama S, Yamada M, et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J]. Gastroenterology, 1990, 98: 694-702.
10 Horwitz EM, Prockop DJ, Fitzpatrick LA, et al. Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta[J]. Nat Med, 1999, 5: 309-313.
11 Azizi SA, Stokes D, Augelli BJ, et al. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats-similarities to astrocyte grafts[J]. Proc Natl Acad Sci U S A, 1998, 95: 3908-3913.
12 Doi K, Nibu K, Ishida H, et al. Adenovirus-mediated gene transfer in olfactory epithelium and olfactory bulb: a long-term study[J]. Ann Otol Rhinol Laryngol, 2005, 114: 629-633.
13 Grove JE, Lutzko C, Priller J, et al. Marrow-derived cells as vehicles for delivery of gene therapy to pulmonary epithelium[J]. Am J Respir Cell Mol Biol, 2002, 27: 645-651.
(本文編輯:林磊)
DOI:10.3969/j.issn.1673-534X.2016.03.014
(收稿日期:2015-12-30)

