Cripto—1介導的上皮間質轉化在卵巢漿液性腺癌形成中的作用
步曉琳
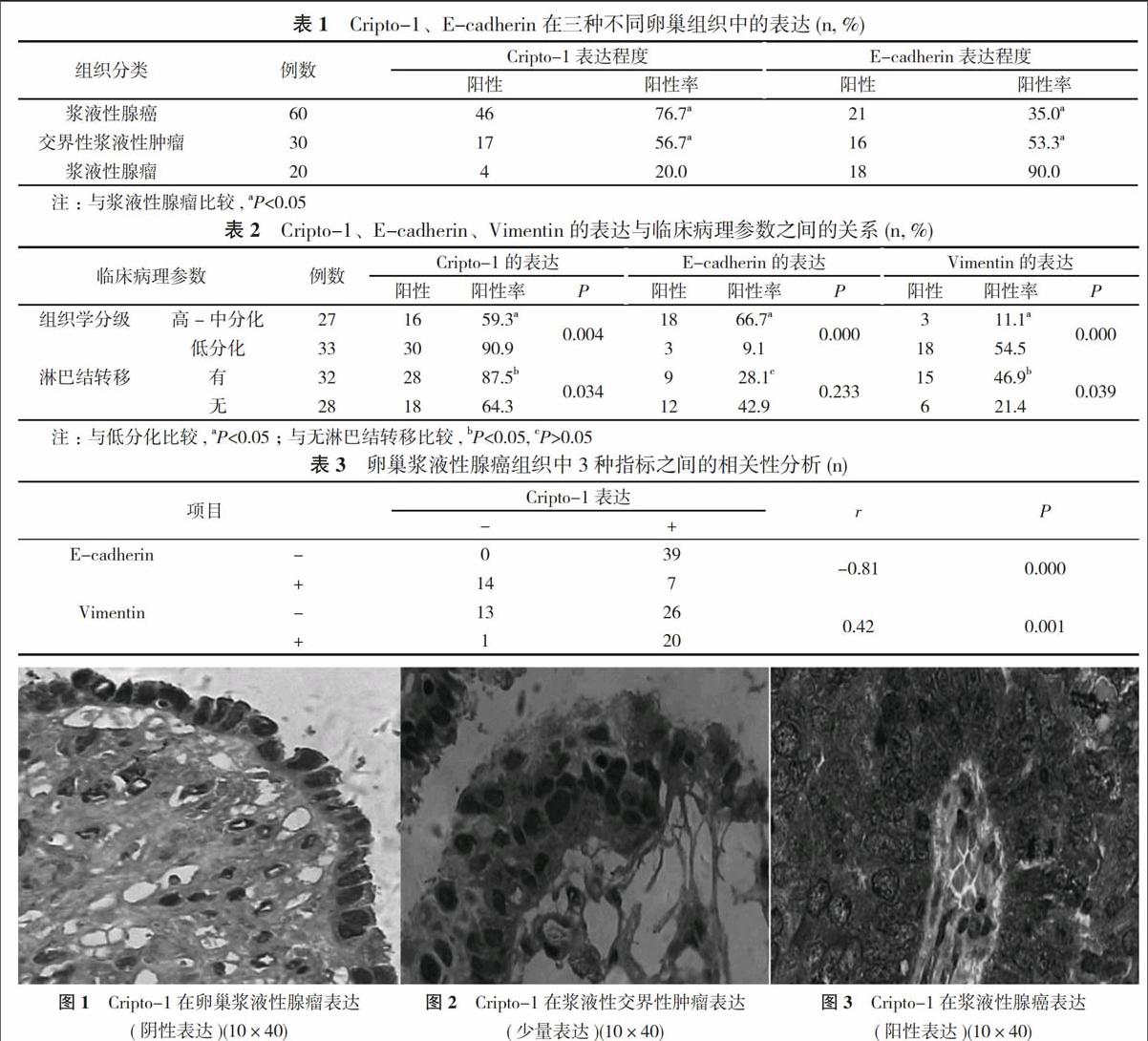
【摘要】 目的 檢測Cripto-1、E-鈣粘蛋白(E-cadherin)、波形蛋白(Vimentin)在卵巢腫瘤中的表達, 探討卵巢漿液性腺癌的發生發展機制, 以及Cripto-1介導的上皮間質轉化(EMT)在其中的作用。方法 采用免疫組化SP法檢測Cripto-1、E-cadherin、Vimentin在60例卵巢漿液性腺癌、30例卵巢交界性漿液性腫瘤、20例卵巢漿液性腺瘤中的表達, 并探討其表達程度的相關性及與臨床病理參數之間的關系。結果 Cripto-1在卵巢漿液性腺瘤中的表達20.0%低于漿液性腺癌76.7%和交界性漿液性腫瘤56.7%, 差異具有統計學意義(P<0.05), E-cadherin在卵巢漿液性腺瘤中的表達90.0%高于漿液性腺癌35.0%和交界性漿液性腫瘤53.3%, 差異具有統計學意義(P<0.05)。Cripto-1、Vimentin在卵巢漿液性腺癌中的表達與組織學分級、淋巴結轉移有關(P<0.05);E-cadherin的表達與組織學分級有關(P<0.05), 與淋巴結轉移無關(P>0.05)。在卵巢漿液性腺癌中Cripto-1與E-cadherin的表達呈負相關(r=-0.81, P<0.05), Cripto-1與Vimentin的表達呈正相關(r=0.42, P<0.05)。結論 在卵巢漿液性腺癌中Cripto-1、Vimentin表達上調, E-cadherin表達下調, 提示Cripto-1介導的EMT可能在卵巢漿液性腺癌侵襲轉移過程中起作用。
【關鍵詞】 Cripto-1;E-鈣粘蛋白;波形蛋白;卵巢漿液性腺癌;上皮間質轉化
DOI:10.14163/j.cnki.11-5547/r.2016.22.001
Effect by Cripto-1 mediated epithelial-mesenchymal transition in formation of ovarian serous adenocarcinoma BU Xiao-lin. Department of Pathology, Xinglin Branch of First Affiliated Hospital of Xiamen University, Xiamen 361000, China
【Abstract】 Objective To detect expression of Cripto-1, E-cadherin and Vimentin in ovarian tumor, and to investigate development mechanism of ovarian serous adenocarcinoma and effect by Cripto-1 mediated epithelial-mesenchymal transition (EMT). Methods Immunohistochemical SP test was applied to detect expression of Cripto-1, E-cadherin and Vimentin in 60 cases with ovarian serous adenocarcinoma, 30 cases with ovarian borderline serous tumor and 20 cases with ovarian serous adenoma. Investigation was made on relationship between expression degree and clinical pathological parameters. Results Expression of Cripto-1 was lower in ovarian serous adenoma as 20.0% than 76.7% in ovarian serous adenocarcinoma and 56.7% in ovarian borderline serous tumor, their difference had statistical significance (P<0.05). Expression of E-cadherin was higher in ovarian serous adenoma as 90.0% than 35.0% in ovarian serous adenocarcinoma and 53.3% in ovarian borderline serous tumor, their difference had statistical significance (P<0.05). Expression of Cripto-1 and Vimentin showed their relationship with histological grade and lymphatic metastasis in ovarian serous adenocarcinoma (P<0.05); while expression of E-cadherin was related with histological grade (P<0.05) and not related with lymphatic metastasis (P>0.05). Cripto-1 and E-cadherin showed negatively correlated expression in ovarian serous adenocarcinoma (r=-0.81, P<0.05), and expression of Cripto-1 and Vimentin showed their positive correlation (r=0.42, P<0.05). Conclusion Up-regulated expression of Cripto-1 and Vimentin and down-regulated expression of E-cadherin in ovarian serous adenocarcinoma suggest the effect by Cripto-1 mediated EMT in invasion and metastasis of ovarian serous adenocarcinoma.
【Key words】 Cripto-1; E-cadherin; Vimentin; Ovarian serous adenocarcinoma; Epithelial-mesenchymal transition
卵巢癌是女性生殖器官常見的惡性腫瘤之一, 是卵巢惡性腫瘤最常見的組織類型, 因為其組織學類型復雜, 早期病情隱匿, 大部分患者發現到確診時腫瘤細胞已經播散和轉移, 錯過了最佳治療時間, 治療效果不佳, 生存期短, 是女性生殖系統中病死率最高的腫瘤。卵巢癌的侵襲轉移方式主要有兩種:①直接在腹腔內播散和血管淋巴管轉移;②研究發現, EMT是癌細胞發生侵襲轉移的重要機制之一[1]。在EMT的發生過程中, 腫瘤細胞不僅形態學上發生改變, 其表達的標志物也會隨之發生變化。最近一項研究表明, Cripto-1可以促進EGFR基因突變的非小細胞肺癌患者的EMT[2]。本研究旨在探討Cripto-1介導的EMT在卵巢漿液性腺癌發生發展過程中的作用, 現報告如下。
1 材料與方法
1. 1 標本來源 選取2010~2015年廈門大學附屬第一醫院病理確診卵巢漿液性腺癌患者60例。年齡24~73歲, 中位年齡58歲, 平均年齡56.3歲。術前未經輔助治療。選取同期病理確診的卵巢漿液性腺瘤患者20例及交界性漿液性腫瘤患者30例作為對照。所有標本均經10%福爾馬林固定, 常規脫水、石蠟包埋, 將蠟塊制備3 μm厚度連續切片。
1. 2 結果判定 采用免疫組化SP法, 按試劑盒說明書操作, Cripto-1主要定位于細胞質, 出現棕黃色顆粒狀染色為陽性;E-cadherin蛋白主要定位于細胞膜, 細胞膜呈棕黃色顆粒為陽性;Vimentin蛋白定位于胞漿, 胞質中呈棕黃色顆粒為陽性表達。
1. 3 統計學方法 采用SPSS17.0統計學軟件處理數據。計數資料以率(%)表示, 采用χ2驗;相關性采用Spearman相關分析。P<0.05表示差異具有統計學意義。
2 結果
Cripto-1在卵巢漿液性腺瘤中的表達低于漿液性腺癌和交界性漿液性腫瘤, 差異具有統計學意義(P<0.05), E-cadherin在卵巢漿液性腺瘤中的表達高于漿液性腺癌和交界性漿液性腫瘤, 差異具有統計學意義(P<0.05)。見表1。Cripto-1、Vimentin在卵巢漿液性腺癌中的表達與組織學分級、淋巴結轉移有關(P<0.05);E-cadherin的表達與組織學分級有關(P<0.05), 與淋巴結轉移無關(P>0.05)。見表2。在卵巢漿液性腺癌中Cripto-1與E-cadherin的表達呈負相關(r=-0.81, P<0.05), Cripto-1與Vimentin的表達呈正相關(r=0.42, P<0.05)。見表3。Cripto-1分別在卵巢漿液性腺瘤、漿液性交界性腫瘤、漿液性腺癌中的免疫組化染色見圖1, 圖2, 圖3。
3 討論
腫瘤細胞發生侵襲轉移是卵巢癌死亡的主要原因, 其機制尚未十分明確, 一直以來是研究者關注的熱點。腫瘤細胞由良性向惡性轉變時, 為適應與周圍基質的接觸, 其形態學和分子機制也隨之發生了變化, 上皮細胞經去分化轉變為間葉細胞, 同時細胞的粘附力降低, 運動遷移能力增強, 即EMT, 既往有研究報道, EMT與獲得干細胞樣特性有關[3]。Luo等[4]發現, 卵巢癌EMT的發生與干細胞的形成密切相關, 而干細胞對傳統治療手段不敏感[5, 6]。積極的探索卵巢漿液性腺癌的發病機制, 從初始階段抑制腫瘤細胞的發生發展, 對卵巢癌患者的防治尤為重要。
E-cadherin是跨膜糖蛋白, 主要位于上皮細胞, 能抑制基質金屬蛋白酶的產生, 通過介導上皮細胞間的粘附, 促進同型細胞間連接的緊密性, 維持細胞形態、運動及粘附能力。發生EMT時, 正常上皮細胞表面的E-cadherin表達下調, 而代表間質細胞表達的標記蛋白表達升高, 導致癌細胞之間粘附能力下降, 加快細胞的侵襲轉移[7, 8]。本研究中, 在漿液性腺瘤中E-cadherin的表達程度較高, 其表達程度與漿液性腺癌患者的組織學分級有關(P<0.05), 腫瘤從良性向交界性再向惡性轉變過程中, 其表達程度越來越低, 并且表達程度與漿液性腺癌患者的分化有關, 在高-中分化組織中的表達高于低分化, 說明從良性到癌這個轉變過程中其細胞間的粘附能力越來越差。Vimentin是間質表達的標記物, 但在一些低分化惡性腫瘤的上皮組織中也有表達。本研究中Vimentin的表達水平與卵巢漿液性腺癌患者的組織學分級和淋巴結轉移有關(P<0.05), 分化越差的組織中其表達程度越高, 說明在一些腫瘤發生過程中, 其細胞形態和生長方式也發生變化, 上皮細胞向纖維細胞樣形態轉變, 更易移動, 進而引起EMT的發生。
Cripto-1基因為表皮生長因子家族的成員。在人幾種不同類型的腫瘤中過表達, 但其生物學行為在惡性腫瘤中的機制不明。本研究發現, 漿液性腺瘤患者Cripto-1的表達水平較低, 其表達程度與漿液性腺癌患者的組織學分級和淋巴結轉移有關(P<0.05)。提示其陽性的正常組織細胞存在有惡變的潛在風險, 高表達可能促進腫瘤生長。進一步行Spearman相關分析結果顯示, 在癌組織中Cripto-1的表達程度較高, 而E-cadherin的表達程度較低, 二者之間呈負相關(r=-0.81, P<0.05), 而與Vimentin的表達程度呈正相關(r=0.42, P<0.05), 由此可見, 隨著病變惡性程度的增高, Cripto-1的陽性表達增高, E-cadherin表達下調, Vimentin表達于上皮中。本次研究發現, 當Cripto-1表達較高時, E-cadherin的表達受到抑制, 而其表達程度降低說明細胞間粘附能力下調, 進而促進上皮間質轉化的發生, 腫瘤細胞即播散種植于腹盆腔, 發生侵襲轉移。其機制可能是, Cripto-1 通過激活Ras-Raf-MEK- ERK和PI3K-Akt信號通路刺激腫瘤細胞的增殖與存活。但EMT的發生是多因子共同作用的結果, 是腫瘤發生發展過程中的重要樞紐, 對其發生的分子機制還有待進一步研究, 早期阻斷EMT的轉變可以提高患者的遠期生存率, 并且為治療提供寶貴的機會。
綜上所述, 在卵巢漿液性腺癌中Cripto-1、Vimentin表達上調, E-cadherin表達下調, 提示Cripto-1介導的EMT可能在卵巢漿液性腺癌侵襲轉移過程中起作用。
參考文獻
[1] Schaefer D, Somarelli JA, Hanna G, et al. Cellular migration and invasion uncoupled: increased migration is not an inexorable consequence of epithelial-to-mesenchymal transition. Mol Cell Biol, 2014, 34(18):3486-3499.
[2] Park KS, Raffeld M, Moon YW, et al. CRIPTO1 expression in EGFR-mutant NSCLC elicits intrinsic EGFR-inhibitor resistance. J Clin Invest, 2014, 124(7):3003-3015.
[3] Mani SA, Guo W, Liao MG, et al. The epithelial-mesenchynml transion generates cells with properties of stem cells.Cell, 2008, 133(4):704-715.
[4] Luo X, Dong Z, Chen Y, et al. Enrichment ofovarian cancer stem-like cells is associated with epithelial to mesenchymal transition through an miRNA-activated AKT pathway.Cell Prolif, 2013, 46(4):436-446.
[5] Blagosklonny MV. Cancer stem cell and cancer stemloids: from biology totherapy. Cancer Biol Ther, 2007, 6(11):1684-1690.
[6] Ishii H, Iwatsuki M, Ieta K, et al. Cancer stem cells and chemoradiation resistance. Cancer Science, 2008, 99(10):1871-1877.
[7] Ksiazkiewicz M, Markiewicz A, Zaczek AJ. Epithelial-mesenchy-mal transition:a hallmark in metastasis formation linking circulating tumor eels and cancer stem cells. Pathobiology, 2012, 79(4):195-208.
[8] Guo F, Parker Kerrigan BC, Yang D, et al. Post-transcriptional regulatory network of epithelial-to-mesenchymal and mesenchymal- to-epithelial transitions. J Hematol Oncol, 2014, 7(1):7-19.
[收稿日期:2016-03-25]

