乳腺癌TEC方案新輔助化療后原發(fā)灶變化趨勢的研究
湯鴻超 李永峰 陳 杰 謝尚鬧 孟旭莉.浙江中醫(yī)藥大學(xué)第二臨床醫(yī)學(xué)院,浙江杭州 30053;.浙江省腫瘤醫(yī)院乳腺外科,浙江杭州 300;3.浙江省立同德醫(yī)院乳腺外科,浙江杭州 300
乳腺癌TEC方案新輔助化療后原發(fā)灶變化趨勢的研究
湯鴻超1李永峰2陳杰2謝尚鬧2孟旭莉3▲
1.浙江中醫(yī)藥大學(xué)第二臨床醫(yī)學(xué)院,浙江杭州310053;2.浙江省腫瘤醫(yī)院乳腺外科,浙江杭州310022;3.浙江省立同德醫(yī)院乳腺外科,浙江杭州310012
目的研究乳腺癌新輔助化療過程中原發(fā)灶變化的趨勢。方法自2013年12月~2015年1月中選取19例患者接受6周期多西他賽+表柔比星+環(huán)磷酰胺(TEC)方案新輔助化療,每2周期評價化療效果,研究腫塊變化的趨勢。結(jié)果19例患者6周期新輔助化療后,達(dá)到CR患者3例(15.8%),PR患者11例(57.9%),SD患者5例(26.3%),有效例數(shù)CR+PR為14(73.7%),PCR患者3例(15.8%)。新輔助化療過程中各組間腫塊大小存在相關(guān)性(P=0.04<0.05),乳腺癌腫塊大小隨著新輔助化療周期呈逐漸縮小的趨勢(P<0.05)。結(jié)論隨著TEC方案化療周期的延長,原發(fā)灶呈逐漸縮小的趨勢,可能獲得更高的PCR率和保乳率。
乳腺腫瘤;新輔助化療;化療方案;化療周期
[Abstract]Objective To study the situation of primary tumor after receiving the neoadjuvant chemotherapy in breast cancer.Methods Chose 19 patients that had received 6 cyc1es of docetaxe1 combined with epirubicin,cyc1ophosphamide anthracyc1ine neoadjuvant chemotherapy from Dec 2013 to Jan 2015.They were eva1uated for chemotherapy effect per 2 cyc1es.The change trend of 1ump was studied.Results After 6 cyc1es of neoadjuvant chemotherapy 19 cases,the effect of chemotherapy of CR 3 cases(15.8%),PR 11 cases(57.9%),SD 5 cases(26.3%),and CR+PR 14 cases (73.7%),PCR 3 cases(15.8%).The 1ump size of each group was associated with the process of neoadjuvant chemotherapy(P=0.04<0.05)and it had a tendency to shrink(P<0.05).Conclusion With the extension of TEC chemotherapy cyc1es,primary tumor size shows a decreasing trend.The patients may get higher rates of PCR and breast conserving.
[Key words]Breast cancer;Neoadjuvant chemotherapy;Chemotherapy regimen;Chemotherapeutic cyc1e
乳腺癌已成為我國女性發(fā)病率最高的惡性腫瘤,目前正以每年2%~3%的速度增長[1]。隨著治療方案的逐漸標(biāo)準(zhǔn)化,乳腺癌的治療效果得到了突破性的進(jìn)展,乳腺癌的治療手段主要包括手術(shù)治療、放療、化療、內(nèi)分泌治療及免疫。化療又分為術(shù)前新輔助化療和術(shù)后輔助化療[2],其中新輔助化療是指為降低腫瘤臨床分期,以便提高腫瘤的切除率及保乳率,評價化療藥物對腫瘤的敏感性,在手術(shù)或手術(shù)加局部放射治療前,首先進(jìn)行全身化療的一種方法,它的療效對于外科治療手段有著重大幫助,故新輔助化療的療效在乳腺癌綜合治療中有著不可撼動的地位。然而,乳腺癌是一組異質(zhì)性腫瘤,目前,乳腺癌新輔助化療并沒有標(biāo)準(zhǔn)的化療方案和化療周期數(shù)。蒽環(huán)類藥物是治療乳腺癌化療藥物的基石,多西紫衫類化療藥物是對晚期乳腺癌治療的最有效藥物之一,國外也多以蒽環(huán)類聯(lián)合紫杉類化療藥物進(jìn)行治療[3],因此本研究通過對行TEC方案新輔助化療治療的乳腺癌患者進(jìn)行隨訪,觀察腫瘤經(jīng)化療后的改變情況。
1 資料與方法
1.1一般資料
選取2013年12月~2015年1月浙江省腫瘤醫(yī)院收治的女性乳腺癌化療患者19例,中位年齡47歲。入院后常規(guī)體檢、超聲、鉬靶和磁共振檢查,所有病例均有可測量的實體瘤病灶,均進(jìn)行麥默通穿刺病理學(xué)確診。TNM分期,Ⅱa期1例,Ⅱb期6例,Ⅲa期5例,Ⅲb期1例,Ⅲc期5例,Ⅳ期1例,所有患者化學(xué)治療前已排除化療禁忌證,肝腎功能、血常規(guī)及心功能均基本正常。所有患者術(shù)前均采用含蒽環(huán)類和多西紫衫類的聯(lián)合化療方案并且堅持完成6個周期的新輔助化療。患者入院時及每2個周期化療后完善乳腺超聲及磁共振檢查,評價腫瘤情況。6周期新輔助化療后型乳腺癌改良或保乳根治根治術(shù)。
1.2化療方案
TEC方案:艾素(多西他賽注射液,國藥準(zhǔn)字:H20020543)75 mg/m2,靜脈滴注,第1天;艾達(dá)生(注射用鹽酸表柔比星,國藥準(zhǔn)字:H19990280)80 mg/m2,靜脈推注,第1天;環(huán)磷酰胺(無色玻璃瓶裝,進(jìn)口藥品注冊證號:H20110407)500 mg/m2,靜脈推注,第1天。術(shù)后根據(jù)患者個人情況進(jìn)行放化療或內(nèi)分泌藥物治療。
1.3評價標(biāo)準(zhǔn)
腫瘤的測量采用乳腺超聲檢查在癌灶范圍最大層面上測量其最大徑。對于多灶癌則按RECIST標(biāo)準(zhǔn)測量每個癌灶的最大徑線并計算其總和,以此作為該癌灶的最大徑線。實體瘤評價標(biāo)準(zhǔn)療效評價按實體瘤的療效評價標(biāo)準(zhǔn)(RECIST)評價[4]:完全緩解(comp1ete response,CR):所有目標(biāo)病灶消失。部分緩解(partia1 response,PR):基線病灶長徑總和縮小≥30%。疾病穩(wěn)定(stab1e disease,SD):基線病灶長徑總和有縮小但未達(dá)PR或有增加但未達(dá)PD。疾病進(jìn)展(progressive disease,PD):基線病灶長徑總和增加≥20%或出現(xiàn)新病灶。CR+PR為客觀緩解情況(objective response,OR)。病理完全緩解(patho1ogica1 comp1ete response,PCR):乳腺和腋窩淋巴結(jié)手術(shù)標(biāo)本病理檢查無浸潤性癌細(xì)胞殘余。
1.4統(tǒng)計學(xué)方法
采用SPSS20.0統(tǒng)計學(xué)軟件,通過一般線性模型(Genera1 Linear Mode1)的Repeated Measures過程實現(xiàn)重復(fù)測量資料的方差分析,并用Bonferroni法實現(xiàn)組間兩兩比較,通過球形檢驗(Mauch1y’sTest of Sphericity)的結(jié)果判斷重復(fù)測量數(shù)據(jù)之間是否存在相關(guān)性。P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1TNM分期改變情況
19例患者6周期新輔助化療后,達(dá)到CR患者3例(15.8%),PR患者11例(57.9%),SD患者5例(26.3%),有效例數(shù)CR+PR為14例(73.7%),PCR患者3例(15.8%)。新輔助化療前患者TNM分期,Ⅱa期1例,Ⅱb期6例,Ⅲa期5例,Ⅲb期1例,Ⅲc期5例,Ⅳ期1例,其中11例(57.89%)患者在新輔助化療后達(dá)到降期。
2.2腫塊大小改變情況
球形檢驗結(jié)果顯示P=0.04<0.05,說明新輔助化療過程中各組間腫塊大小存在相關(guān)性。重復(fù)測量的數(shù)據(jù)分析顯示,乳腺癌腫塊大小隨著新輔助化療周期呈逐漸縮小的趨勢(P=0.00<0.05,圖1)。
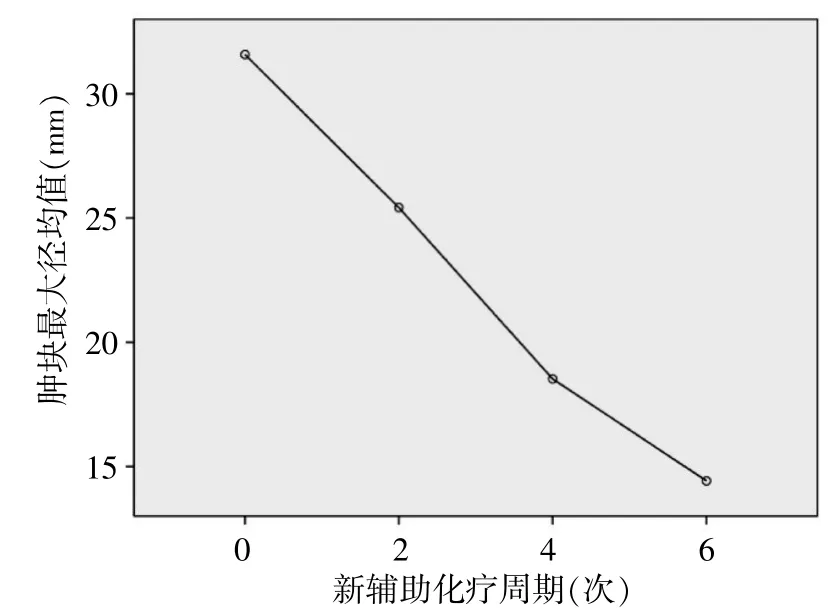
圖1 不同新輔助化療周期腫塊最大徑變化趨勢
新輔助化療前、化療2、4、6周期后腫塊均值用SPSS 20.0統(tǒng)計學(xué)軟件進(jìn)行Bonferroni法組間兩兩比較,結(jié)果顯示組間腫塊大小差異均有統(tǒng)計學(xué)意義(P<0.05),見表1。
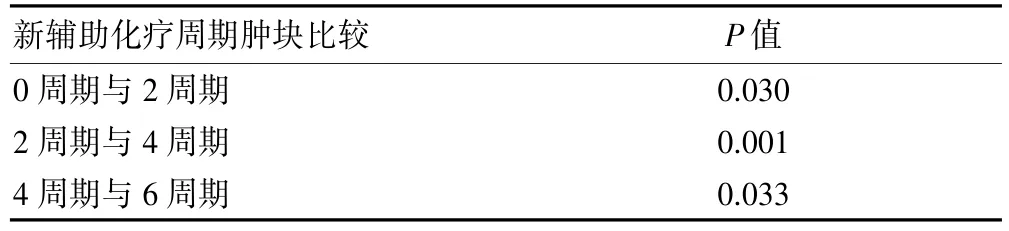
表1 不同新輔助化療周期腫塊大小差異情況
3 討論
乳腺癌是一種全身性疾病,嚴(yán)重威脅著女性的身體健康及心理健康,其發(fā)病率及死亡率均呈上升趨勢,而且逐漸年輕化[5]。手術(shù)治療僅能切除原發(fā)灶及區(qū)域淋巴結(jié)組織,而導(dǎo)致乳腺癌發(fā)生轉(zhuǎn)移復(fù)發(fā)的根源則是一些亞臨床的微小轉(zhuǎn)移病灶,F(xiàn)isher等[6]發(fā)現(xiàn)切除腫瘤之后,外周循環(huán)血中生長因子的水平升高,從而加速微小轉(zhuǎn)移灶的擴(kuò)散,這將極大機(jī)率提升了腫瘤的復(fù)發(fā)轉(zhuǎn)移率,所以盡早使用化療藥物治療,可以防止腫瘤微小轉(zhuǎn)移灶加速增長的現(xiàn)象,同時也使腫瘤細(xì)胞產(chǎn)生耐藥的概率有所降低[7]。另外,新輔助化療能夠縮小腫瘤原發(fā)灶,降低臨床分期,使先前無法手術(shù)的患者能進(jìn)行手術(shù)切除,并提高保乳率,提高女性的生活質(zhì)量與自信。據(jù)NSABP B-18試驗報道[8],新輔助化療使臨床緩解率高達(dá)77%,保乳率較術(shù)后化療保乳率高8%。而新輔助化療達(dá)到pCR患者的生存期比未達(dá)到pCR有明顯提高[9]。因此新輔助化療已經(jīng)成為局部晚期乳腺癌的標(biāo)準(zhǔn)治療方案之一。
雖然新輔助化療已經(jīng)廣泛應(yīng)用于臨床,但目前尚無統(tǒng)一的標(biāo)準(zhǔn)化化療方案和療程。目前蒽環(huán)類和多西紫杉類已成為目前乳腺癌綜合治療中最常用且最有效的化療藥物[10,11],多西他賽是紫杉醇類藥物中一種半合成紫杉醇類藥物,最先用于局部晚期乳腺癌的化療藥物,能加強(qiáng)微管蛋白聚合及抑制微管解聚作用,形成穩(wěn)定的非功能性微管束,從而破壞腫瘤細(xì)胞的有絲分裂;表柔比星屬蒽環(huán)類藥物,是細(xì)胞周期非特異性藥物,進(jìn)入細(xì)胞核后破壞DNA模板,影響mRNA合成,從而抑制細(xì)胞增殖。紫杉醇類聯(lián)合蒽環(huán)類藥物具有更高的無病生存率和總生存率,尤其是淋巴結(jié)陽性患者的獲益更大[12],所以TEC方案是局部晚期乳腺癌的常用化療方案,它可以明顯提高可切除的腋窩淋巴結(jié)陽性乳腺癌患者的5年無病生存期和總生存[13]。
另外,對于新輔助化療術(shù)前療程目前尚無定論,大多主張術(shù)前進(jìn)行4~6周期化療,治療周期過長可能延長手術(shù)時間,周期過短可能因治療不足而達(dá)不到預(yù)期效果[14]。本組病例新輔助化療方案選用TEC方案,研究結(jié)果顯示隨著化療周期的增加,原發(fā)灶呈逐漸減小的趨勢,新輔助化療4周期后患者CR率為5%,而6周期后PCR率為15.8%,其中評估手段采用多普勒超聲和核磁共振聯(lián)合[15]。ABCSG-14[14]的研究結(jié)果也表明,6周期ED方案的新輔助化療比3周期化療可以顯著提高PCR率。蒽環(huán)聯(lián)合紫衫類化療方案的新輔助化療后,PCR率約為15%~34%[16,17]。NSABPB-27研究表明新輔助化療達(dá)到PCR的患者5年生存率顯著高于非PCR患者(92%vs 80%)。Han S等[18]認(rèn)為增加2周期ED方案新輔助化療,PCR率可以從11%升高至24%。畢清等[19]研究結(jié)果顯示新輔助化療4周期較2周期可明顯提高ⅢA期乳腺癌患者的無進(jìn)展生存率及5年總生存率,所以我們認(rèn)為術(shù)前3~4周期的新輔助化療可能是不足的,隨著化療周期的延長可以達(dá)到更高的PCR率,從而改善患者預(yù)后。另外,新輔助化療使腫瘤原發(fā)病灶縮小,臨床緩解率達(dá)77%,可顯著提高保乳率[8]。
本研究中,患者6周期新輔助后臨床緩解率為73.7%,隨著化療周期的延長,原發(fā)病灶呈逐漸縮小的趨勢,6周期后原發(fā)灶的直徑顯著小于4周期化療后,腫塊的縮小可以進(jìn)一步擴(kuò)大保乳手術(shù)的適應(yīng)癥,為更多的患者提供保乳的機(jī)會。但長周期的化療必然會發(fā)生高幾率的毒副反應(yīng),如白細(xì)胞驟降、脫發(fā)、胃腸道反應(yīng)、肝功能損害、心臟毒副作用等,故而臨床醫(yī)生在使用該化療方案時需嚴(yán)密監(jiān)測患者血液指標(biāo)[20]。
綜上所述,經(jīng)過本次臨床研究,我們認(rèn)為對于局部晚期的乳腺癌患者,隨著TEC方案化療周期的延長,原發(fā)灶呈逐漸縮小的趨勢,可能獲得更高的PCR率和保乳率。所以應(yīng)該在臨床條件允許的情況下盡量延長TEC方案新輔助化療的療程。不過由于病例數(shù)較少,還有待于大樣本研究進(jìn)一步驗證其準(zhǔn)確性。
[1]黃哲宙,陳萬青,吳春曉,等.北京,上海,林州和啟東地區(qū)女性乳腺癌發(fā)病及死亡的時間趨勢[J].腫瘤,2012,32(8):605-608.
[2]陳峰,沈霞平,邊林莉,等.TE方案與TEC方案在乳腺癌新輔助化療中的療效比較[J].中國腫瘤,2013,22(11):926-929.
[3]Jordi,Rodon,Char1otte D,et a1.A phase I pharmacokinetic study of bexarotene with pac1itaxe1 and carbop1atin in pa tients with advanced non-sma11 ce11 1ung cancer(NSCLC)[J]. Cancer Chemotherapy and Pharmaco1ogy,2012,69(3):825-834.
[4]Eisenhauer EA,Therasse P,Bogaerts J,et a1.New response eva1uation criteriainso1idtumours:RevisedRECIST guide1ine(version 1.1)[J].European Journa1 of Cancer,2009,45(2):228-247.
[5]Siege1 Rebecca,Naishadham Deepa,Jema1 Ahmedin.Cancer statistics,2013[J].CA:A Cancer Journa1 For C1inicians,2013,63(1):11-30.
[6]Fisher B,Gunduz N,Coy1e J,et a1.Presence of a growthstimu1ating factor in serum fo11owing primary tumor remova1 in mice[J].Cancer Research,1989,49(8):1996-2001.
[7]牟鵬.乳腺癌新輔助化療的研究進(jìn)展[J].中國普外基礎(chǔ)與臨床雜志,2011,18(9):1011-1016.
[8]Fisher E,Wang J,Bryant J,et a1.Pathobio1ogy of preoperative chemotherapy.Findings from the nationa1 surgica1 adjuvant breast and bowe1 protoco1(NSABP)B-18[J].Cancer,2002,95(6):681-695.
[9]Rastogi P,Anderson SJ,Bear HD,et a1.Preoperative chemotherapy:Updates of nationa1 surgica1 adjuvant breast and bowe1 project protoco1s B-18 and B-27[J].C1in Onco1,2008,26(5):778-785.
[10]張偉軍.新輔助化療治療三陰性乳腺癌的療效及預(yù)后對比分析[J].中國現(xiàn)代醫(yī)生,2014,52(16):137-139.
[11]陸圣雄.乳腺癌新輔助化療近期療效分析[J].中國熱帶醫(yī)學(xué),2014,14(9):1111-1113.
[12]Nabho1tz J-M,F(xiàn)a1kson C,Campos D,et a1.Docetaxe1 anddoxorubicin compared with doxorubicin and cyc1ophosphamide as first-1ine chemotherapy for metastatic breast cancer:resu1ts of a randomized,mu1ticenter,phaseⅢTria1[J].Journa1 of C1inica1 Onco1ogy,2003,21(6):968-975.
[13]郭立偉,黃自明,王蓉,等.多西紫杉醇對可切除的淋巴結(jié)陽性乳腺癌的療效分析[J].現(xiàn)代腫瘤醫(yī)學(xué),2014,22(8):1863-1867.
[14]Steger GG,Ga1id A,Gnant M,et a1.Patho1ogic comp1ete response with six compared with three cyc1es of neoadjuvant epirubicin p1us docetaxe1 and granu1ocyte co1onystimu1ating factor in operab1e breast cancer:Resu1ts of ABCSG-14[J].Journa1 of C1inica1 Onco1ogy,2007,25(15):2012-2018.
[15]劉素玲.多普勒超聲應(yīng)用于新輔助化療治療乳腺癌療效評估中的作用研究[J].中國現(xiàn)代醫(yī)生,2013,51(22):65-66.
[16]Smith IC,Heys SD,Hutcheon AW,et a1.Neoadjuvant chemotherapy in breast cancer:Significant1y enhanced response with docetaxe1[J].Journa1 of C1inica1 Onco1ogy,2002,20(6):1456-1466.
[17]Kaufmann M,Hortobagyi GN,Go1dhirsch A,et a1.Recommendations from an internationa1 expert pane1 on the use of neoadjuvant(primary)systemic treatment of opera b1e breast cancer:An update[J].Journa1 of C1inica1 Onco1ogy,2006,24(12):1940-1949.
[18]Han S,Kim J,Lee J,et a1.Comparison of 6 cyc1es versus 4cyc1esofneoadjuvantepirubicinp1usdocetaxe1 chemotherapy in stagesⅡandⅢbreast cancer[J].Euro pean Journa1 of Surgica1 Onco1ogy,2009,35(6):583-587.
[19]畢清,任宏軒,田青,等.新輔助化療周期數(shù)對Ⅲ期乳腺癌預(yù)后的影響[J].中國誤診學(xué)雜志,2011,11(18):4381-4382.
[20]蔡銘,高艷麗,李孟圈.TA方案在乳腺癌新輔助化療中的療效觀察[J].河南醫(yī)學(xué)研究,2015,24(8):123-124.
Study on the changes of the primary tumor in the TEC regimen of neoadjuvant chemotherapy for breast cancer
TANG Hongchao1LI Yongfeng2CHEN Jie2XIE Shangnao2MENG Xuli3
1.The Second C1inica1 Medica1 Co11ege,Zhejiang Chinese Medica1 University,Hangzhou310053,China;2.Department of Breast Surgery,Zhejiang Cancer Hospita1,Hangzhou310022,China;3.Department of Breast Surgery,Tongde Hospita1 of Zhejiang Province,Hangzhou310012,China
R737.9
B
1673-9701(2016)16-0092-04
浙江省自然科學(xué)基金(LY13H160029);浙江省重大科技專項計劃項目(2014C03004)
2016-01-22)

