核黃素抑制大鼠缺血性腦損傷
阮名花,鄒贏鋅,欒 潔,儲智勇
(1.江西中醫藥大學,江西 南昌 330004;2.海軍醫學研究所,上海 200433)
?
核黃素抑制大鼠缺血性腦損傷
阮名花1,鄒贏鋅2,欒潔2,儲智勇2
(1.江西中醫藥大學,江西 南昌330004;2.海軍醫學研究所,上海200433)
doi:10.3969/j.issn.1001-1978.2016.08.017
目的探討核黃素對缺血性腦損傷的保護作用及其機制。方法在體實驗,采用SD ♂大鼠,隨機分為對照組、模型組和核黃素組。核黃素組大鼠腹腔注射核黃素1 mg·kg-1,連續7 d后,模型組和核黃素組大鼠用線栓法制作大腦中動脈栓死(middle cerebral artery occlusion,MCAO)模型。術后24 h,用2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)檢測腦梗死面積、稱重法檢測腦水腫狀況、電鏡觀察缺血處腦皮層超微結構變化。離體實驗采用原代培養的大鼠腦皮層神經元制備氧糖剝奪(oxygen and glycose deprivation,OGD)模型。用噻唑藍[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide,MTT]法檢測OGD后神經元活力、電鏡觀察神經元超微結構變化。大鼠經MCAO模型24 h后,對腦組織中的超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的酶活力進行測定。結果核黃素明顯減少MCAO引起的腦梗死面積(P<0.01)、抑制腦水腫(P<0.01)、抑制亞細胞結構損傷;核黃素明顯保護神經元OGD后的細胞活力(P<0.01)和亞細胞結構。核黃素明顯提高銅鋅SOD(Cu-ZnSOD,SOD1)、GSH-Px和CAT的酶活力(P<0.01);而對錳SOD(Mn-SOD,SOD2)的酶活力無影響。結論核黃素對大鼠缺血性腦損傷具有保護作用,其作用機制包括保護缺血時腦組織的抗氧化酶活力。
核黃素;大鼠;缺血性腦損傷;大腦中動脈栓死;氧糖剝奪模型;神經元;抗氧化酶
核黃素是人體必需的維生素之一,人體不能合成,只能從外界獲取。近年來研究發現核黃素與人類癌癥、心腦血管病、糖尿病等多種疾病密切相關。研究顯示,人腦卒中后處于核黃素缺乏的狀態[1]。核黃素激酶功能低下與腦卒中發生密切相關[2]。但文獻中關于核黃素與缺血性腦損傷的關系局限于核黃素參與葉酸[3]、同型半胱氨酸[4]等的代謝,進而間接抑制缺血性腦損傷;我們前期報道了核黃素抑制缺血后神經細胞凋亡,進而抑制缺血性腦損傷[5]。本研究旨在研究核黃素對缺血性腦損傷的保護作用及其抗氧化應激機制。
1 材料
1.1實驗動物清潔級SD大鼠,體質量180~200 g,購買于上海西普爾-必凱實驗動物有限公司,動物許可證號:SCXK(滬)2013-0016。大鼠自由攝食攝水,飼養于溫度為22℃、相對濕度70%、8 ∶00~20 ∶00照明的環境中。
1.2儀器大腦中動脈栓死(middle cerebral artery occlusion,MCAO)模型硅膠栓線(北京沙東生物制藥有限公司),TB-214型電子天平(北京賽多利斯儀器系統有限公司),三氣培養箱(Thermo scientific),酶標儀(Thermo scientific),T6型新世紀紫外-可見分光光度計(北京普析通用儀器有限責任公司),透射電子顯微鏡(日本日立公司),SW-CJ-IBH超凈臺(蘇凈集團安泰公司)。
1.3試劑核黃素(Sigma,貨號R9504);DMEM培養液(Hyclone);2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)(國藥集團化學試劑有限公司);噻唑藍[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide,MTT](國藥集團化學試劑有限公司);特制不含核黃素DMEM培養液(Gibco公司定制);多聚賴氨酸(Sigma公司);L-谷氨酰胺(Gibco公司);B27神經元生長因子(Gibco公司);Neurobasal(Gibco公司);超氧化物歧化酶(Superoxide dismutase,SOD)檢測試劑盒、過氧化氫酶(catalase,CAT)檢測試劑盒、谷胱甘肽過氧化物酶(glutathione peroxide,GSH-Px)試劑盒、蛋白測定試劑盒,均購買于南京建成生物有限公司。
2 方法
2.1分組與給藥在體實驗,選取體質量180~200 g的SD大鼠,隨機分成3組:對照組、模型組、核黃素組。核黃素組大鼠每天腹腔注射核黃素1 mg·kg-11次,連續7 d。離體實驗以原代培養至7~10 d的神經元為研究對象,將神經元隨機分為對照組、模型組、核黃素各劑量組(0.85、3.1、12.6、300.6 nmol·L-1)。核黃素劑量的設計理由如下[5]:① 0.85 nmol·L-1,代表嚴重缺乏核黃素的人體血漿中核黃素濃度;② 3.1 nmol·L-1,代表中度缺乏核黃素的人體血漿中核黃素濃度;③ 12.6 nmol·L-1,代表正常人體血漿中核黃素濃度;④ 300.6 nmol·L-1,代表補充核黃素后的人體血漿中核黃素濃度。
2.2MCAO模型制備大鼠用10%水合氯醛溶液腹腔注射麻醉(3 mL·kg-1體質量)。固定消毒,剃掉喉頸部被毛,沿頸部正中線切口,鈍性分離皮下組織,沿大鼠左側找到胸鎖乳突肌肌腱,找到頸內動脈鞘,分離動脈鞘,可見光滑的頸總動脈,向頭端可見頸外動脈、頸內動脈,結扎頸外動脈近頭端、頸總動脈近心端,在頸總動脈開小口,將栓線從頸總動脈插入頸內動脈直到大腦前動脈處,以造成大腦中動脈處局部缺血,模擬人腦卒中病理狀態。將頸內動脈、頸外動脈和頸總動脈結扎縫合傷口。大鼠醒后再次給藥,24 h后進行神經功能缺失體征評分以判斷手術模型是否成功。
2.3腦組織2,3,5-氯化三苯基四氮唑(TTC)染色SD大鼠24只,分組和給藥同“2.1”,每組8只。MCAO手術24 h后大鼠麻醉、斷頭取腦,保持大腦的完整性。將腦組織進行每片2 mm冠狀切片,共6片。將切片置于預先配制好的濃度為2% TTC染色液中,避光放入37℃恒溫孵育30 min。4%多聚甲醛固定1 h。TTC染色后,正常腦組織呈玫瑰紅色,梗死腦組織未被染色而呈白色。腦切片充分染色后取出排列整齊,拍照保存。TTC與正常組織中的脫氫酶反應而顯現紅色,缺血組織內因脫氫酶活性下降而不產生變化。用Image J 1.4圖像分析系統計算梗死面積及全腦總面積。梗死面積百分比以所占腦片總面積的百分率(%)表示。
2.4腦水腫測定選取SD大鼠27只,分組和給藥同“2.1”,每組9只。MCAO模型制備24 h后取大鼠手術側半腦組織,去除延髓、小腦后稱重。
2.5腦皮層超微結構觀察SD大鼠9只,分組和給藥同“2.1”,每組3只。MCAO手術24 h后取大鼠梗死側腦中動脈附近皮層,以4%多聚甲醛4℃固定過夜;用磷酸緩沖液漂洗3次,每次5~10 min;用1%鋨酸固定1.5 h;再次漂洗3次;分別用30%、50%、70%、85%、95%、100%乙醇脫水封片,每步5~10 min;用丙酮加環氧樹脂包埋;加熱聚合;超薄切片;檸檬酸進行雙重染色;最后用超微電鏡觀察拍照。
2.6原代神經元培養細胞培養板用0.1 g·L-1多聚賴氨酸包被過夜。剖取孕期為16~19 d的胎鼠大腦皮層,仔細剝除腦膜和血管;剝離的皮層組織轉入新鮮預冷的高糖DMEM中漂洗2次;用眼科剪盡量剪碎;將組織塊轉移到含有37℃預熱的10 mL 0.125%胰蛋白酶的錐形瓶中,置于37℃的CO2培養箱消化10~15 min;加入10% FBS終止消化;1 500 r·min-1離心3 min,棄上清;加入接種培養基[DMEM+20% FBS+1%青鏈霉素混合液(100×)],輕輕吹打,200目篩網過濾;調整細胞密度為1×109·L-1種板,記為原代接種d 0;種板后24 h更換神經元生長培養基[Neurobasal+2% B27+25 μmol·L-1L-谷氨酰胺+1%青鏈霉素混合液(100×)];每3 d更換1次新鮮培養基;d 7~10,可以進行實驗處理。
2.7氧糖剝奪(OGD)模型制備神經元細胞用PBS清洗2次;加入高糖Krebs溶解的相應藥物,37℃的5% CO2恒溫孵育箱作用2 h;取出細胞PBS清洗2次;加入無糖Krebs液溶解的相應藥物,放入37℃通以94% N2、5% CO2、1% O2的混合氣體的三氣培養箱,穩定15 min后開始計時,持續作用2 h,模擬神經元缺糖缺氧狀態。模型結束后立即進行相關實驗處理和測定,以免細胞氧復吸。
2.8細胞活力檢測采用MTT比色法。在待測的96孔神經元細胞培養液中加入5 g·L-1的MTT溶液20 μL;混勻后,于37℃恒溫孵育4 h;吸除培養液,每孔加入150 μL的DMSO;震蕩溶解后于490 nm處測定吸光值。以模型組吸光值為1.0計。
2.9離體神經元超微結構觀察神經元細胞用PBS清洗2次;胰酶消化收集細胞;1 500 r·min-1離心3 min,吸棄上清,把細胞團塊轉移至EP管內,以4%多聚甲醛4°C固定過夜;用磷酸緩沖液漂洗3次,每次5~10 min;用1%鋨酸固定1.5 h;再次漂洗3次;分別用30%、50%、70%、85%、95%、100%乙醇脫水封片,每步5~10 min;用丙酮加環氧樹脂包埋;加熱聚合;超薄切片;檸檬酸進行雙重染色;最后用超微電鏡觀察拍照。
2.10抗氧化酶活性測定取MCAO大鼠缺血側腦組織按1 ∶9(g·mL-1)的比例加入生理鹽水在冰浴下勻漿,4℃、2 500 r·min-1離心20 min,取上清。采用南京建成生物有限公司的試劑盒按說明書操作,通過公式計算出待測樣品中的SOD、CAT、GSH-Px的活力。
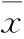
3 結果
3.1核黃素抑制MCAO后大鼠腦梗死由Fig 1可見,大鼠MCAO術后24 h,模型組大鼠腦梗死明顯;而核黃素組大鼠的腦梗死面積相比模型組明顯減小(P<0.01),提示核黃素抑制MCAO引起的大鼠腦梗死。
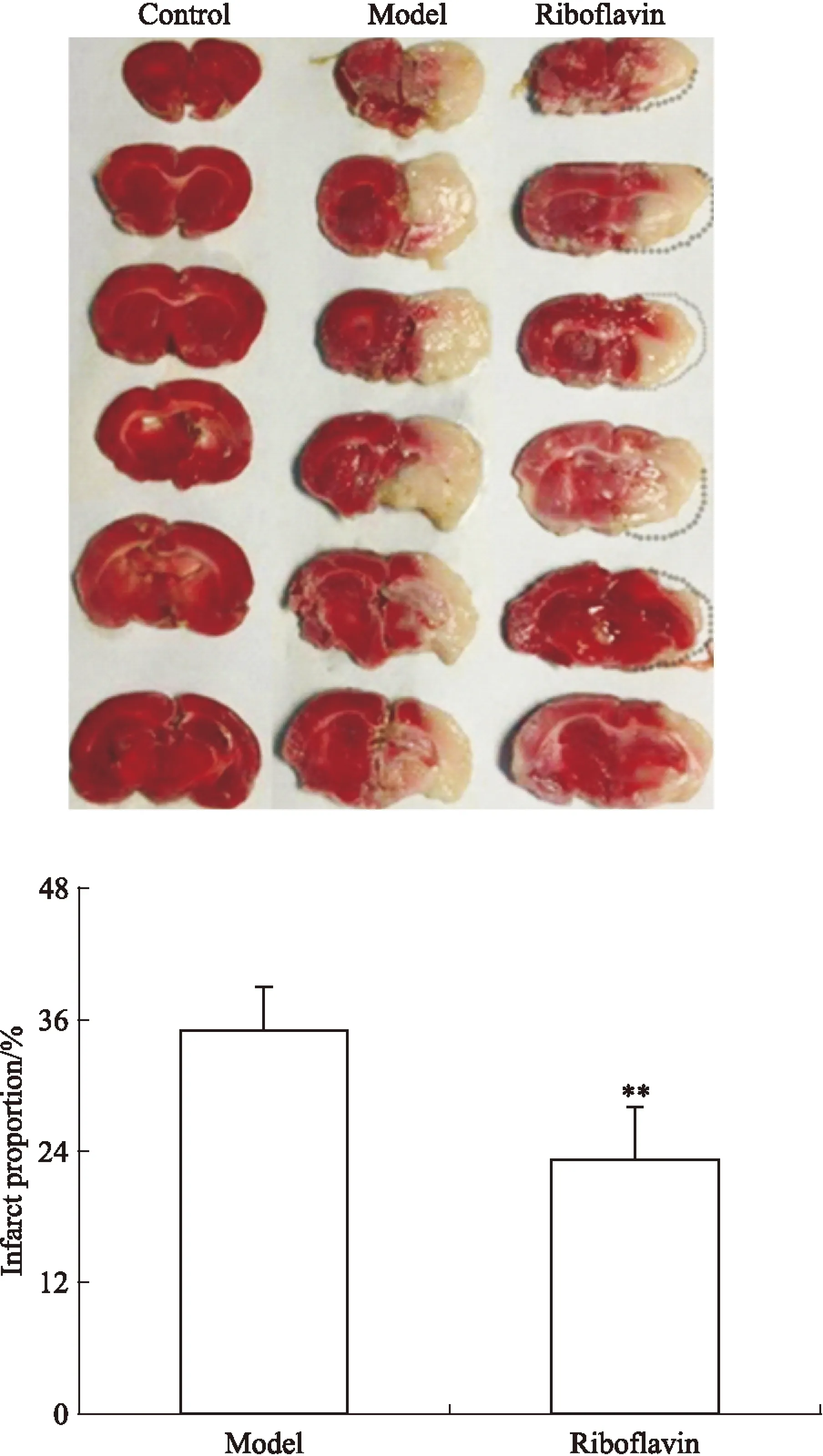
Fig 1 Riboflavin inhibited cerebral infarction in rats induced by MCAO(n=8)
**P<0.01vsmodel
3.2核黃素抑制MCAO后大鼠腦水腫由Fig 2可見,大鼠MCAO術后24 h,與對照組相比,模型組大鼠梗死側腦組織重量明顯升高,提示水腫嚴重(P<0.01);而核黃素組大鼠的梗死側腦組織重量相比模型組明顯降低(P<0.01),提示核黃素明顯抑制MCAO引起的大鼠腦水腫。
3.3核黃素抑制MCAO后大鼠腦皮層超微結構損傷由Fig 3可見,對照組大鼠腦皮層的突觸泡正常,細胞核染色質均勻分布,線粒體輪廓清晰;而模型組則胞質嚴重脫落,核染色質聚集,突觸泡擴大明顯,整個細胞以及細胞核都呈現收縮狀態;核黃素組損傷有明顯改善,細胞器豐富,線粒體輪廓清楚無腫脹,突觸泡正常,核染色質分布均勻,提示核黃素對MCAO引起的大鼠腦皮層亞細胞結構損傷具有明顯的抑制作用。
Fig 2 Riboflavin inhibited brain edema in rats induced by MCAO(n=9)
**P<0.01vscontrol;##P<0.01vsmodel
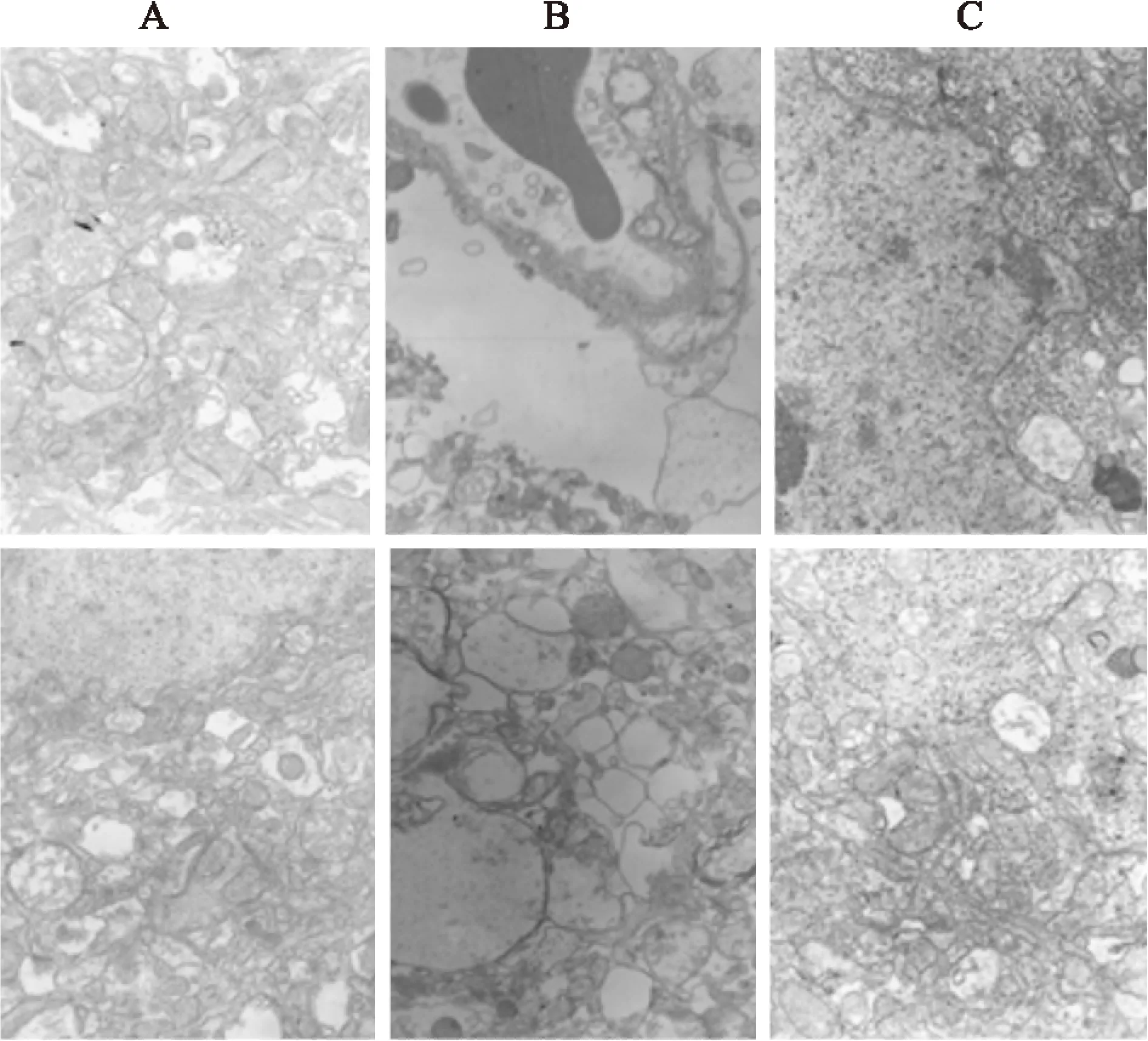
Fig 3 Riboflavin inhibited ultrastructural injury in rats induced by MCAO(10 000×)
A:Control;B:Model;C:Riboflavin
3.4核黃素抑制OGD誘導的神經元細胞活力下降由Fig 4可見,與OGD模型組相比,核黃素組的神經元活力均明顯提高,差異具有統計學意義(P<0.01)。3.1 nmol·L-1核黃素組與0.85 nmol·L-1核黃素組相比,神經元活力提高明顯;3.1、12.6、300.6 nmol·L-1核黃素對神經元活力的保護作用接近最高值,不再有明顯的上升趨勢。
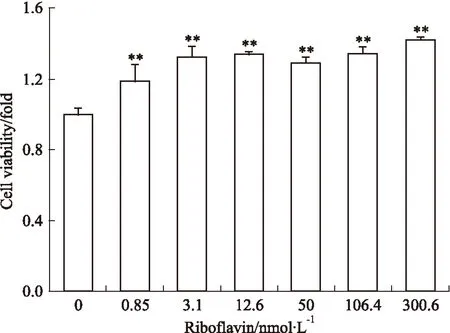
Fig 4 Riboflavin inhibited cell viability decreasing in neurons induced by OGD(n=8)**P<0.01 vs control
3.5核黃素抑制OGD誘導的神經元超微結構損傷由Fig 5可見,對照組神經元核大而圓,核染色質分布均勻,細胞結構豐富;模型組細胞量減少,凋亡趨勢明顯,核染色質邊集化,突觸泡擴張,染色質裂解,胞質內線粒體空泡化,細胞呈皺縮狀;核黃素給藥后細胞狀態比模型組好,核輪廓清楚,染色質分布均勻,胞質中突觸泡輕度擴張。此離體實驗結果再次表明核黃素對缺血性神經元具有保護作用。
3.6核黃素保護MCAO后大鼠腦抗氧化酶活性由Fig 6可見,與對照組相比,模型組大鼠腦組織中SOD、銅鋅SOD(Cu-ZnSOD,SOD1)、CAT、GSH-Px活力值明顯降低(P<0.01),提示缺血性腦損傷后抗氧化酶的活力明顯下降;與模型組相比,核黃素組腦組織中SOD、SOD1、CAT、GSH-Px活力明顯升高(P<0.01),提示核黃素對缺血后腦組織中抗氧化酶活力具有明顯的保護作用;而錳SOD(Mn-SOD,SOD2)的活力在各組間差異未見顯著性。
4 討論
核黃素在機體中有遞氫作用,是機體一些重要的氧化還原酶的輔酶,參與組織的呼吸過程。已發現160多種含有核黃素的酶,它們多參與體內生物氧化、呼吸鏈代謝等。美國《心臟病雜志》曾報道:補充B族維生素尤其是核黃素,會減低腦卒中、心肌梗死等疾病的發病率[6]。但是尚沒有文獻報道核黃素與缺血性腦損傷的直接關系。
為了觀察核黃素對缺血性腦損傷是否有保護作用,我們通過在體和離體兩方面進行了實驗研究。在體實驗選用大鼠MCAO模型[7],結果發現核黃素明顯抑制MCAO引起的腦梗死面積、腦水腫、亞細胞結構損傷;離體實驗選用原代培養神經元OGD模型,結果發現核黃素明顯保護神經元OGD后的細胞活力和亞細胞結構。這些結果從在體和離體兩方面證明了核黃素對缺血性腦損傷具有明顯的抑制作用。
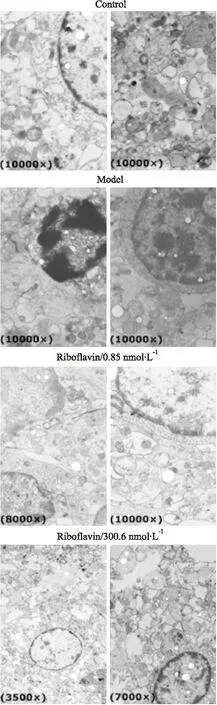
Fig 5 Riboflavin inhibited subcellular structure injury in neurons induced by OGD
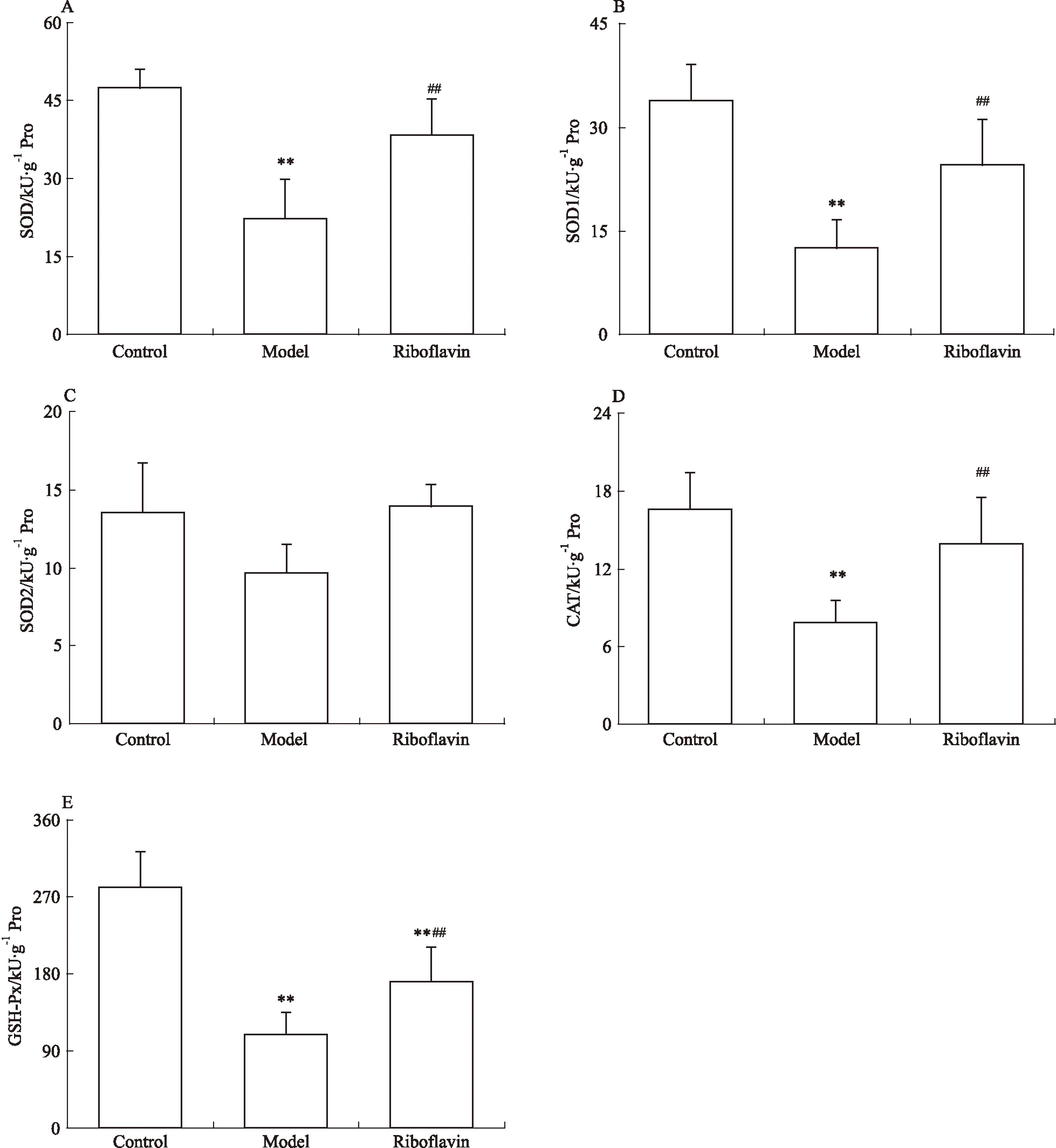
Fig 6Riboflavin protected anti-oxidant enzyme activity in rats after MCAO(n=6).
**P<0.01vscontrol;##P<0.01vsmodel
氧化應激被學術界廣泛認為是缺血性腦損傷的機制之一[8],加之核黃素在體內主要參與氧化還原反應,那么核黃素對缺血性腦損傷的保護作用是否也有抗氧化應激的機制參與?氧化應激是體內自由基增多引起的,進而導致細胞結構和功能病變,最終導致細胞出現凋亡甚至壞死[9]。自由基是細胞正常代謝的中間產物。SOD、CAT、GSH-Px屬于體內天然的抗氧化酶促防御系統[10]。SOD能清除超氧陰離子自由基[11],CAT能清除過氧化氫[12],GSH-Px能清除細胞質中的H2O2阻斷脂質過氧化連鎖反應[13]。我們通過對大鼠MCAO后腦組織中的酶活力進行檢測發現,核黃素明顯提高SOD1、GSH-Px和CAT的酶活力,提示核黃素對MCAO誘導的大鼠腦組織抗氧化酶活力下降具有明顯的抑制作用。
此外,報道顯示核黃素有良好的抗凝作用,對心腦血管疾病的防治作用優于阿司匹林[14];加之,核黃素無明顯毒副作用[15],這些都為核黃素應用于缺血性腦損傷的防治提供了可行性。
總之,本課題研究通過在體和離體實驗證明了核黃素對缺血性腦損傷的保護作用,這種保護作用的機制包括保護缺血后腦組織中的抗氧化酶SOD、GSH-Px和CAT的酶活性。基于此研究的核黃素抗缺血性腦損傷效應,提示核黃素在代謝中的角色及其缺乏與公共健康的關系值得深度探索。
(致謝:本實驗在上海海軍醫學研究所防護醫學研究室完成。感謝儲智勇博士,鄒贏鋅博士,欒潔博士的幫助和指導。)
[1]Gariballa S,Ullegaddi R. Riboflavin status in acute ischemic stroke[J].EurJClinNutr, 2007, 61(10):1237-40.
[2]Betz A L,Ren X D,Ennis S R,Hultquist D E.Riboflavin reduces edema in focal cerebral ischemia[J].ActaNeurochirSuppl(Wien),1994,60:314-7.
[3]Ward M, Wilson C P, Strain J J, et al. B-vitamins, methylenetetrahydrofolate reductase(MTHFR) and hypertension[J].IntJVitamNutrRes, 2011, 81(4):240-4.
[4]Abdollahi A, Omranipour R. Is increase of homecysteine, anti-cardiolipin, anti-phospholipid antibodies associated with breast tumors[J].ActaMedIran,2015, 53(11):681-5.
[5]Zou Y X, Zhang X H, Su F Y, et al. Importance of riboflavin kinase in the pathogenesis of stroke[J].CNSNeurosciTher, 2012, 18(10):834-40.
[6]Shite J, Qin F, Mao W, et al.Antioxidant vitamins attenuate oxidative stress and cardiac dysfunction in tachycardia-induced cardiomyopathy[J].JAmCollCardiol,2001, 38(6):1734-40.
[7]葛建彬,顧錦華,李梅,等. 銀杏內酯A對小鼠腦缺血/再灌注損傷的保護作用及其抑制NF-κB信號通路下調p53、Caspase-3表達的機制[J]. 中國藥理學通報, 2012, 28(8):1105-10.
[7]Ge J B, Gu J H, Li M, et al. Neuroprotective effects of Ginkgo lide A on a mouse model of transient focal cerebral ischemia associated with inhibition of NF-κB signaling pathway and down regulation of the levels of P53 and Caspase-3[J].ChinPharmacolBull, 2012, 28(8):1105-10.
[8]Dong X,Zheng L,Lu S, Yang Y. Neuroprotective effects of pretreatment of ginsenoside Rb1 on severe cerebral ischemia-induced injuries in aged mice:involvement of anti-oxidant signaling[J].GeriatrGerontolInt,2015,Dec29.doi:10.1111/ggi.12699.
[9]Gong G,Xiang L,Yuan L, et al.Protective effect of glycyrrhizin,a direct HMGB1 inhibitor,on focal cerebral ischemia/reperfusion-induced inflammation,oxidative stress,and apoptosis in rats[J].PLoSOne,2014,9(3):e89450.
[10]Albuguergue R V, Malcher N S, Amado L L, et al.Invitroprotective effect and antioxidant mechanism of resveratrol induced by dapsone hydroxylamine in human cells[J].PLoSOne,2015,10(8):e0134768.
[11]Zhang S,Cao Y,Xie L, et al. Effect of superoxide dismutaseentrapped liposomes and protein transduction domain superoxide dismutase on human umbilical vein endothelial cells[J].MolMedRep, 2014, 9(4):1427-33.
[12]Tabassum R,Vaibhav K,Shrivastava P,et al. Perillyl alcohol improves functional and histological outcomes against ischemia-reperfusion injury by attenuation of oxidative stress and repression of COX-2, NOS-2 and NF-κB in middle cerebral artery occlusion rats[J].EurJPharmacol, 2015, 747:190-9.
[13]Hazini A, Cemek M, Ildak ⅰ, et al. Investigation of ischemia modified albumin, oxidant and antioxidant markers in acute myocardial infarction[J].PostepyKardiolInterwencyjnej, 2015, 11(4):298-303.
[14]Fiqueiredo J C,Levine A J,Grau M V, et al.Vitamins B2,B6,and B12 and risk of new colorectal adenomas in a randomized trial of aspirin use and folic acid supplementation[J].CancerEpidemiolBiomarkersPrev,2008,17(8):2136-45.
[15]Mack C,Hulquist D E,Shlafer M. Mycocardial flavin reductase and riboflavin:a potential role in decreasing reoxygenation injury[J].BiochemBiophysCommum,1995,212(1):35-40.
Riboflavin inhibited ischemia brain damage in rats
RUAN Ming-hua1,ZOU Ying-xin2,LUAN Jie2, CHU Zhi-yong2
(1.JiangxiUniversityofTraditionalChineseMedicine,Nanchang330004,China;2.NavalMedicalResearchInstitute,Shanghai200433,China)
AimTo investigate the protective effect of riboflavin on ischemia brain damage and the mechanism.MethodsTheinvivoexperiments were processed in male SD rats. Rats were randomly arranged into control group,model group and riboflavin group.The rats in riboflavin group were intraperitoneally injected riboflavin at the dose of 1 mg·kg-1for seven consecutive days.Then the rats in model and riboflavin groups were carried out middle cerebral artery occlusion(MCAO) operation.After 24 h, all rats were sacrificed and the brain tissue was dissected to observe the infarct area, the edema and the ultrastructure damage. The brain tissue was dyed by triphenyl tetrazolium chloride. The brain edema was observed by the weight of ischemia-side semi-brain. The ultrastructure was observed by electron microscope.Theinvitroexperiments were processed in primary culture neurons by exposed to oxygen and glycose deprivation(OGD).The viability of neurons was assayed by MTT method. The enzyme activity of superoxide dismutase(SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) was assayed to explore the mechanism.ResultsRiboflavin significantly decreased the infarct area(P<0.01), inhibited the brain edema(P<0.01) and inhibited the ultrastructure damage in rats after MCAO;riboflavin protected the viability(P<0.01)and the ultrastructure of neurons exposed to OGD. The enzyme activity of antioxidant SOD1(P<0.01),CAT(P<0.01) and GSH-Px(P<0.01) was protected by riboflavin in MCAO model.No difference was found in the activity of SOD2. ConclusionRiboflavin inhibits ischemia brain damage, and the protection of the activity of antioxidants is involved in the mechanism.
riboflavin; rat;ischemia brain damage;middle cerebral artery occlusion;oxygen and glycose deprivation;neurons;antioxidase
2016-04-01,
2016-05-09
國家自然科學基金資助項目(No 81402922)
阮名花(1990-),女,碩士生,研究方向:藥理學,E-mail:416978642@qq.com;
儲智勇(1969-),男,博士,副研究員,研究方向:藥理學,通訊作者,E-mail:zhiyongchuleader@163.com
A
1001-1978(2016)08-1115-07
R-332;R322.81;R346.32;R743.310.22;R977.22
網絡出版時間:2016-7-19 10:43網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.034.html