白楊素對TNF-α誘導慢性暴露TGF-β卵巢癌OVCAR-3細胞系球形成的影響
李 朵,彭耀金,陳 阿,崔迎紅,孫姝雯,曹建國
(湖南師范大學醫(yī)學院,湖南 長沙 410013)
?
白楊素對TNF-α誘導慢性暴露TGF-β卵巢癌OVCAR-3細胞系球形成的影響
李朵,彭耀金,陳阿,崔迎紅,孫姝雯,曹建國
(湖南師范大學醫(yī)學院,湖南 長沙410013)
doi:10.3969/j.issn.1001-1978.2016.08.020
目的研究白楊素對腫瘤壞死因子-α(TNF-α)誘導慢性暴露轉(zhuǎn)化生長因子-β(TGF-β)卵巢癌OVCAR-3細胞系球形成的影響,并探討其作用機制是否涉及下調(diào)NF-κB(p65)蛋白表達。方法TNF-α(10 μg·L-1)處理TGF-β(5 μg·L-1)預暴露12 d的卵巢癌OVCAR-3細胞24 h,球形成率測定法檢測不同濃度(5.0、10.0、20.0 μmol·L-1)白楊素對球形成率的影響;Western blot檢測NF-κB(p65)蛋白表達;NF-κB(p65) siRNA轉(zhuǎn)染探討作用機制。結(jié)果TNF-α(10 μg·L-1)聯(lián)合慢性暴露TGF-β(5 μg·L-1)處理增高OVCAR-3細胞系球形成率。白楊素能有效地拮抗致炎因子誘導卵巢癌細胞自我更新作用,呈劑量依賴性(P<0.05),并伴隨著NF-κB(p65)蛋白表達下調(diào)。與對照siRNA相比,NF-κB(p65) siRNA轉(zhuǎn)染OVCAR-3細胞NF-κB(p65)蛋白表達下調(diào),并明顯增強白楊素抑制球形成作用。結(jié)論下調(diào)NF-κB(p65)蛋白表達參與白楊素抑制TNF-α(10 μg·L-1)聯(lián)合慢性暴露TGF-β(5 μg·L-1)處理誘導卵巢癌OVCAR-3細胞系球形成作用。
卵巢癌;白楊素;球形成率;TNF-α;TGF-β;NF-κB(p65)
卵巢癌早期即可在腹腔內(nèi)種植擴散,因其生長隱秘、迅速,約70%的患者初診時已屬晚期,其死亡率在女性生殖系統(tǒng)惡性腫瘤中居首位,嚴重威脅著女性的生命健康[1]。據(jù)腫瘤干細胞學說,人們推定卵巢癌干細胞可能是卵巢癌發(fā)生、轉(zhuǎn)移、侵襲、復發(fā)和耐藥的根本原因,因此,清除腫瘤干細胞是改善卵巢癌治療效果的策略之一[2-3]。有研究表明,轉(zhuǎn)化生長因子β(transforming growth factor-β, TGF-β)、腫瘤壞死因子α(tumor necrosis factor-α, TNF-α)或兩者共同誘導獲得腫瘤干細胞特性[4-6]。白楊素(chrysin, ChR)作為一種蜂膠中含量最高的天然黃酮類化合物,近期發(fā)現(xiàn)它具有抑制腫瘤干細胞自我更新的作用[7-10]。本文主要檢測白楊素是否具有逆轉(zhuǎn)TNF-α處理慢性暴露TGF-β誘導人卵巢癌OVCAR-3細胞系球形成作用,并探討其作用機制是否涉及抑制核因子-κB(nuclear factor-kappa B, NF-κB)活性。
1 材料與方法
1.1受試物與試劑白楊素購自美國Sigma 公司,用二甲基亞砜(dimethyl sulfoxide, DMSO)溶解,實驗組培養(yǎng)體系中DMSO 的最高終濃度為不影響細胞生長速率的濃度(0.1%)。鼠抗人NF-κB(p65)抗體購自美國Santa Cruz Biotechnology公司;鼠抗人β-actin單克隆抗體購自美國Sigma-Aldrich公司。NF-κB(p65) siRNA依據(jù)GenBank(基因登記號. M61909)設計;NF-κB(p65) siRNA和亂序?qū)φ誷iRNA購自上海Invitrogen公司。NF-κB(p65) siRNA序列為:5’-GCCTTAATAGTAGGGTAAGTT-3’。亂序?qū)φ誷iRNA序列為:5’-UUCUCCGAACGUGUCACGUTT-3’。Lipofectamine RNAiMAX購自美國Invitrogen公司。TGF-β和TNF-α購自北京義翹神州生物技術有限公司。
1.2細胞與球培養(yǎng)人卵巢癌OVCAR-3細胞系細胞購自中國科學院細胞庫。按照文獻[11-12]所述方法,進行細胞培養(yǎng)和球培養(yǎng),分別得到單層貼壁生長細胞和非黏附克隆性生長的球(球體直徑 ≥ 50.0 μm)細胞。
1.3球形成率測定實驗分組設計為Mock組:完全培養(yǎng)基對照組;TGF-β組: TGF-β(5.0 μg·L-1)處理OVCAR-3細胞12 d;TGF-β+TNF-α組:TGF-β(5.0 μg·L-1)處理OVCAR-3細胞12 d,或者在不同濃度白楊素(5、10、20 μmol·L-1)存在或者缺失情況下,TNF-α(10.0 μg·L-1)聯(lián)合TGF-β(5.0 μg·L-1)處理24 h。分別收集細胞,并以無血清干細胞條件培養(yǎng)基懸浮細胞,調(diào)節(jié)細胞密度為1×106·L-1,每孔1.0 mL,接種于24孔超低黏附培養(yǎng)板,培養(yǎng)8 d,計數(shù)每孔球數(shù)目。球形成率計算公式如下:球形成率/% = 每孔腫瘤球均數(shù)/每孔接種活細胞總數(shù)(1 000個細胞)×100%。

1.5NF-κB p65 siRNA轉(zhuǎn)染按照文獻[8]方法,用DMEM培養(yǎng)基懸浮卵巢癌OVCAR-3細胞,并調(diào)節(jié)細胞密度為5×107·L-1, 每孔2.0 mL,接種于6孔細胞培養(yǎng)板。培養(yǎng)24 h, 細胞達到約50%融合,按照供應商說明書的方法和步驟,用Lipofectamine RNAiMAX試劑將50 nmol·L-1NF-κB(p65) siRNA或亂序?qū)φ誷iRNA(Control siRNA)轉(zhuǎn)染入細胞。轉(zhuǎn)染24 h后進行相應TGF-β(5.0 μg·L-1)、TNF-α(10.0 μg·L-1)、白楊素處理。
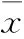
2 結(jié)果
2.1TNF-α誘導TGF-β慢性暴露卵巢癌OVCAR-3細胞球形成干細胞條件培養(yǎng)基超低黏附板懸浮培養(yǎng)OVCAR-3細胞系細胞8 d,形成非黏附克隆性球。用球形成率測定法對比Mock、TGF-β和TNF-α+TGF-β 3組卵巢癌OVCAR-3細胞系球形成率。結(jié)果顯示,與Mock組相比,TGF-β能增高卵巢癌OVCAR-3細胞系腫瘤球形成率,且TNF-α能進一步增強TGF-β誘導卵巢癌OVCAR-3細胞系球形成能力作用(Fig 1)。

Fig 1 Influence of inflammatory factor TGF-β and TNF-α on rate of tumor sphere formation of ovarian OVCAR-3 cells
Treatment with TGF-β and TGF-β plus TNF-α increased the rate of tumor sphere formation of ovarian OVCAR-3 cells.*P<0.05vsuntreated OVCAR-3 cells;#P<0.05vsOVCAR-3 cells treated with 5.0 μg·L-1TGF-β alone.
2.2白楊素抑制TNF-α誘導TGF-β慢性暴露卵巢癌OVCAR-3細胞系球形成采用不同濃度(5.0、10.0、20.0 μmol·L-1)白楊素處理TGF-β+TNF-α組OVCAR-3細胞,球形成率測定法檢測細胞自我更新能力作用。Fig 2結(jié)果顯示,不同濃度白楊素以濃度依賴方式抑制TGF-β慢性暴露合并TNF-α處理誘導卵巢癌OVCAR-3細胞系球形成作用(P<0.05)。
2.3白楊素逆轉(zhuǎn)TNF-α聯(lián)合TGF-β慢性暴露上調(diào)卵巢癌OVCAR-3細胞NF-κB(p65)蛋白表達作用與Mock組相比,TGF-β組和TGF-β+TNF-α組卵巢癌OVCAR-3細胞NF-κB(p65)蛋白表達增強(Fig 3A)。結(jié)果說明TGF-β和TNF-α聯(lián)合處理能有效地激活人卵巢癌OVCAR-3細胞NF-κB經(jīng)典信號傳導通路。不同濃度白楊素(5.0、10.0、20.0 μmol·L-1)孵育TGF-β慢性暴露合并TNF-α處理的卵巢癌OVCAR-3細胞,抗NF-κB(p65)抗體進行Western blot分析。結(jié)果如Fig 3B所示,白楊素以濃度依賴方式抑制TNF-α處理合并TGF-β慢性暴露增高卵巢癌OVCAR-3細胞NF-κB(p65)蛋白表達水平(P<0.05)。

Fig 2 Effect of chrysin on rate of tumor sphere formation of OVCAR-3 cells induced by inflammatory factor
Chrysin suppressed self-renew of ovarian stem-like cells increased by inflammatory factor in a dose dependent manner.*P<0.05vsOVCAR-3 cells treated without chrysin;#P<0.05vsOVCAR-3 cells treated with 5.0 μmol·L-1chrysin.
2.4NF-κB(p65) siRNA與白楊素合用對致炎因子誘導卵巢癌OVCAR-3細胞NF-κB(p65)蛋白表達和球形成的影響與亂序?qū)φ?siRNA轉(zhuǎn)染細胞比較,NF-κB(p65) siRNA轉(zhuǎn)染下調(diào)TGF-β和TNF-α聯(lián)合處理誘導卵巢癌OVCAR-3細胞NF-κB(p65)蛋白表達(Fig 4A)和抑制球形成(Fig 4B)。同時,NF-κB(p65) siRNA轉(zhuǎn)染協(xié)作白楊素抑制TNF-α處理合并TGF-β慢性暴露誘導卵巢癌OVCAR-3細胞自我更新和NF-κB(p65)蛋白表達水平增高作用。
3 討論
致炎因子TGF-β和TNF-α誘導腫瘤細胞上皮間充質(zhì)轉(zhuǎn)化表型,從而賦予腫瘤干細胞功能和特性[4]。比較腫瘤球形成率大小是評價腫瘤細胞干細胞特性的一個重要指標,腫瘤球形成作用提高表示細胞的自我更新能力增強。本文采用TNF-α聯(lián)合慢性暴露TGF-β方案處理卵巢癌OVCAR-3細胞,球形成率測定結(jié)果說明TGF-β(5.0 μg·L-1)聯(lián)合慢性暴露TNF-α(10 μg·L-1)處理能有效地增強卵巢癌OVCAR-3細胞系細胞自我更新能力。結(jié)果顯示,致炎因子促成OVCAR-3細胞系卵巢癌干樣細胞表型。

Fig 3 Inhibitory effect of chrysin on expression level of NF-κB(p65) in OVCAR-3 cells increased by inflammatory factor
A: Comparison of the expression level of NF-κB(p65) in OVCAR-3 cells cultured with or without the inflammatory factor.*P<0.05vsuntreated OVCAR-3 cells;#P<0.05vsOVCAR-3 cells treated with 5.0 μg·L-1TGF-β; B: Chrysin significantly reduced the expression level of NF-κB(p65) in OVCAR-3 cells treated with TNF-α and TGF-β in a dose-dependent manner.*P<0.05vsOVCAR-3 cells treated without chrysin.#P<0.05vsOVCAR-3 cells treated with 5.0 μmol·L-1chrysin.

Fig 4 Inhibitory effects of chrysin enhanced by NF-κB (p65) siRNA
A: NF-κB(p65) siRNA enhanced chrysin downregulating NF-κB(p65) expression in OVCAR-3 cells; B: NF-κB(p65) siRNA potentiated inhibitory effect of chrysin on the rate of tumor sphere formation of OVCAR-3 cells.*P<0.05vscontrol siRNA transfected OVCAR-3 cells;#P<0.05vs5.0 μmol·L-1chrysin treated control siRNA transfected OVCAR-3 cells
卵巢癌是女性常見的生殖系統(tǒng)惡性腫瘤,手術治療、放化療是目前治療卵巢癌的主要方法。目前,治療卵巢癌的有效方案以鉑類為基礎的化療方案為主,但是其不良反應大,影響患者治療效果[13]。近年來,白楊素的抗腫瘤作用越來越受到人們關注,許多研究表明白楊素具有預防和治療腫瘤作用[7-10]。本研究發(fā)現(xiàn)白楊素以劑量依賴方式抑制TNF-α聯(lián)合慢性暴露TGF-β誘導OVCAR-3細胞系球形成并下調(diào)NF-κB(p65)蛋白表達,這些結(jié)果說明,白楊素具有抑制致炎因子誘導卵巢癌干樣細胞自我更新作用。
NF-κB(p65)在細胞生長分化與凋亡、炎癥反應以及腫瘤發(fā)生等生物學過程中具有重要作用,它一直是人們關注的藥物作用靶點[14-16]。Li等[11]研究報道,TNF-α誘導TGF-β慢性暴露人乳腺上皮細胞和乳腺癌細胞Twist1表達需要NF-κB(p65),表明這個過程涉及激活經(jīng)典NF-κB信號傳導途徑。本文結(jié)果也證實TNF-α聯(lián)合慢性暴露TGF-β誘導上調(diào)OVCAR-3細胞NF-κB(p65)蛋白表達。為了探索NF-κB(p65)蛋白表達是否參與白楊素抑制致炎因子誘導卵巢癌OVCAR-3細胞系細胞自我更新作用,我們利用NF-κB(p65) siRNA轉(zhuǎn)染技術初步探討了白楊素逆轉(zhuǎn)慢性暴露TGF-β聯(lián)合TNF-α誘導卵巢癌OVCAR-3細胞系球形成的作用機制。結(jié)果顯示,NF-κB(p65) siRNA轉(zhuǎn)染協(xié)作白楊素抑制致炎因子誘導卵巢癌OVCAR-3細胞系細胞自我更新作用,提示聯(lián)合其他相關藥物可增強白楊素的抑制作用。這些結(jié)果為應用白楊素干預致炎因子誘導OVCAR-3卵巢癌干樣細胞表型提供了證據(jù),并闡釋了抑制炎癥與腫瘤聯(lián)系的關鍵性轉(zhuǎn)錄因子NF-κB活性為白楊素的作用機制之一。
(致謝:本研究在湖南師范大學藥物工程重點實驗室完成,感謝所有給予幫助的老師和同學。)
[1]Emons G, Kurzeder C, Schmalfeldt B, et al. Temsirolimus in women with platinum-refractory/resistant ovarian cancer or advanced/recurrent endometrial carcinoma. A phase Ⅱ study of the AGO-study group(AGO-GYN8)[J].GynecolOncol, 2016, 140(3): 450-6.
[2]于風勝, 李藝, 崔恒. 卵巢癌干細胞及卵巢癌治療[J]. 中國實用婦科與產(chǎn)科雜志, 2014, 30(1): 14-7.
[2]Yu F S, Li Y, Cui H. Ovarian cancer stem cells and treatment of ovarian cancer[J].ChinJPractGynecolObstet, 2014, 30(1): 14-7.
[3]Bar J K, Grelewski P, Lis-Nawara A, et al. The role of cancer stem cells in progressive growth and resistance of ovarian cancer: true or fiction[J]?PostepHigMedDosw, 2015, 69: 1077-86.
[4]Kong F, Zhu Y, Yuan H, et al. FOXM1 regulated by ERK pathway mediates TGF-beta 1-induced EMT in NSCLC[J].OncolRes, 2014, 22(1): 29-37.
[5]Karin M, Greten F R. NF kappa B: Linking inflammation and immunity to cancer development and progression[J].NatRevImmunol, 2005, 5(10): 749-59.
[6]Watabe T, Miyazono K. Roles of TGF-beta family signaling in stem cell renewal and differentiation[J].CellRes, 2009, 19(1): 103-15.
[7]Ren K, Cao X, Liu Z, et al. 8-bromo-5-hydroxy-7-methoxychrysin targeting for inhibition of the properties of liver cancer stem cells by modulation of Twist signaling[J].IntJOncol, 2013, 43(5): 1719-29.
[8]Quan M, Xiao L, Liu Z, et al. 8-bromo-7-methoxychrysin inhibits properties of liver cancer stem cells via downregulation of beta-catenin[J].WorldJGastroenterol, 2013, 19(43): 7680-95.
[9]周亭芳, 李高峰, 李朵, 等. 白楊素增強輻射誘導宮頸癌HeLa細胞系球形成細胞凋亡[J]. 湖南師范大學學報(醫(yī)學版), 2015, 12(3): 1-3.
[9]Zhou T F, Li G F, Li D, et al. Chrysin enhance radiation-induced apoptosis of sphere-forming cells from cervical cancer Hela cell line[J].JHunanNormUniv(MedSci), 2015, 12(3): 1-3.
[10]曹曉正, 楊小紅, 曹建國, 等. 8-溴-7-甲氧基白楊素逆轉(zhuǎn)人宮頸癌SiHa細胞系球形成細胞上皮-間葉樣表型轉(zhuǎn)化[J]. 中國藥理學通報, 2014, 30(5): 668-71.
[10]Cao X Z, Yang X H, Cao J G, et al. 8-bromo-7-methoxychrysin reverses EMT of the sphere-forming cells derived from cervical cancer SiHa cell line[J].ChinPharmacolBull, 2014, 30(5): 668-71.
[11]Li C, Xia W, Huo L, et al. Epithelial-mesenchymal transition induced by TNF-alpha requires NF-kappa B-mediated transcriptional upregulation of Twist1[J].CancerRes, 2012, 72(5): 1290-300.
[12]Qiu X, Wang Z, Li Y, et al. Characterization of sphere-forming cells with stem-like properties from the small cell lung cancer cell line H446[J].CancerLett, 2012, 323(2): 161-70.
[13]唐敏, 李鴻, 周國梅, 等. 大黃酸調(diào)控Rac1/LIMK1/cofilin信號通路抑制卵巢癌細胞運動與侵襲[J]. 中國藥理學通報, 2016, 32(3): 366-72.
[13]Tang M, Li H, Zhou G M, et al. Rhein inhibits the movement and invasion of human ovarian carcinoma cells through Rac1/LIMK1/cofilin signaling pathway[J].ChinPharmacolBull, 2016, 32(3): 366-72.
[14]Arora R, Yates C, Gary B D, et al. Panepoxydone targets NF-κB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer[J].PLoSOne, 2014, 9(6): 1-12.
[15]Dolcet X, Llobet D, Pallares J, et al. NF-κB in development and progression of human cancer[J].VirchowsArch, 2005, 446(5): 475-82.
[16]Pateras I, Giaginis C, Tsigris C, et al. NF-kappa B signaling at the crossroads of inflammation and atherogenesis: searching for new therapeutic links[J].ExpertOpinTherTar, 2014, 18(9): 1089-101.
Effect of chrysin on sphere formation of ovarian cancer OVCAR-3 cells induced by TNF-α following chronic exposure to TGF-β
LI Duo, PENG Yao-jin, CHEN A, CUI Ying-hong, SUN Shu-wen, CAO Jian-guo
(MedicalCollege,HunanNormalUniversity,Changsha410013,China)
AimTo investigate the effect of chrysin(ChR) on sphere formation of ovarian cancer OVCAR-3 cell line induced by treatment with tumor necrosis factor-α(TNF-α) following chronic exposure to transforming growth factor-β(TGF-β), and its mechanism underlying whether this action is involved in down-regulation of NF-κB(p65) protein expression.MethodsAfter pre-exposure to TGF-β(5 μg·L-1) for 12 d, OVCAR-3 cells were treated with TNF-α(10 μg·L-1) for 24 h, tumor sphere-forming assay was used to detect the rate of tumor sphere formation of OVCAR-3 cells treated with or without various concentrations of ChR(5.0,10.0 and 20.0 μmol·L-1).The protein expression of NF-κB(p65) was analyzed using Western blot. Transfection with NF-κB(p65) siRNA was used to explore the mechanism by which ChR inhibited self-renew of OVCAR-3 cells.ResultsAfter co-treatment of TNF-α(10 μg·L-1) and chronic exposure to TGF-β(5 μg·L-1), the rate of sphere formation of ovarian cancer OVCAR-3 cells was increased. ChR effectively reduced sphere-forming capacity of ovarian cancer cells induced by inflammatory factor in a dose dependent manner(P<0.05), and the protein expression level of NF-κB(p65) was down-regulated. Compared with the cells transfected with control siRNA, the expression of NF-κB(p65) protein was down-regulated in cells transfected with NF-κB(p65) siRNA, and the NF-κB(p65) siRNA significantly enhanced the inhibitory effect of ChR on the sphere-forming capacity of OVCAR-3 cells.ConclusionsThe inhibitory effects of ChR on sphere-forming capacity of ovarian cancer OVCAR-3 cells induced by co-treatmemt of TNF-α with chronic exposure to TGF-β are involved in down-regulation of NF-κB(p65) protein expression.
ovarian cancer; chrysin; sphere formation; TNF-α; TGF-β; NF-κB(p65)
2016-03-21,
2016-04-20
湖南師范大學青年科學基金資助項目(No 醫(yī)140666);國家自然科學基金面上項目(No 81172375)
李朵(1988-),女,碩士,實驗師,研究方向:抗腫瘤藥物藥理學,E-mail:liduo1022@163.com;
曹建國(1956-),男,博士,教授,博士生導師,研究方向:抗腫瘤藥物藥理學,通訊作者,E-mail:caojianguo2005@126.com
A
1001-1978(2016)08-1133-05
R329.24;R394.2;R737.310.22;R977.6;R979.1
網(wǎng)絡出版時間:2016-7-19 10:43網(wǎng)絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.040.html