趨化因子受體D6、DARC在人乳腺癌組織中的表達研究*
景周宏,曹 勇,熊忠訊,江歌麗,劉曉渝,曾曉華
(重慶市腫瘤研究所乳腺外科 400030)
?
論著·臨床研究
趨化因子受體D6、DARC在人乳腺癌組織中的表達研究*
景周宏,曹勇,熊忠訊,江歌麗,劉曉渝,曾曉華△
(重慶市腫瘤研究所乳腺外科400030)
目的研究乳腺癌組織中趨化因子受體D6與Duffy抗原趨化因子受體(DARC)表達水平,探討與乳腺癌臨床分期及相關病理指標之間的關系。方法收集乳腺癌患者癌組織標本120例,均為病理確診,應用免疫組織化學SP法檢測在各標本中D6和DARC表達水平,統計分析D6、DARC蛋白表達與乳腺癌臨床分期、淋巴結轉移、雌激素受體(ER)、孕激素受體(PR)、人表皮生長因子受體-2(HER-2)表達的相關性。結果D6、DARC在乳腺癌及癌旁正常乳腺中均有表達,癌旁正常乳腺組織中陽性表達率分別為71.7%、68.3%,在乳腺癌的陽性表達率分別為68.3%、65.0%。D6、DARC 的表達情況與乳腺癌臨床分期及是否發生腋淋巴結轉移密切相關(P<0.01)。D6、DARC的表達與患者ER、PR及HER-2的表達等病理指標無關(P>0.05)。結論D6、DARC在乳腺癌發展中呈現負性調節作用,其在乳腺癌中表達的高低與HER-2、ER及PR等臨床病理指標無明顯相關性。
乳腺腫瘤;免疫組織化學;淋巴轉移;受體,趨化因子;Duffy抗原趨化因子受體;D6;表達
乳腺癌是嚴重危害婦女健康的惡性腫瘤之一,每年約有50萬患者死于該病[1]。趨化因子是目前研究較熱的一類與腫瘤發病及進展密切相關的小分子蛋白,其主要通過趨化并激活白細胞相關途徑來完成干擾腫瘤發生、發展的目的[2-6]。近年來,非典型性趨化因子結合物(ACBs)如Duffy抗原趨化因子受體(DARC)、D6 等的發現表明體內存在趨化因子的轉錄后調節機制[7-8]。這些不下傳信號的趨化因子結合蛋白即ACBs 也被稱為誘餌受體或清道夫,在復雜的趨化因子體內調控平衡中起到極為關鍵作用,參與多種關于趨化因子反應過程。近期文獻及相關研究報道,在乳腺癌患者的預后性研究中,D6 及DARC 與乳腺癌密切相關,其干預腫瘤發病及進展主要通過過表達抑制腫瘤成瘤和轉移來完成[9-13]。
本研究通過免疫組織化學SP法分別檢測D6、DARC 在乳腺癌組織及癌旁正常乳腺組織中的表達情況,著重分析在乳腺癌組織中表達高低與患者臨床分期、淋巴結轉移、雌激素受體(ER)、孕激素受體(PR)、人表皮生長因子受體-2(HER-2)等臨床病理指標的相關性,初步探討D6、DARC 表達與乳腺癌發展的相關性,旨在提供新的關于乳腺癌進展及預后的參考資料。
1 資料與方法
1.1一般資料收集本院2012年8月至2013年8月乳腺外科病理確診為乳腺癌患者癌組織標本120例,所有病例均為女性,臨床資料完整,中位年齡54歲(34~78歲)。所有入選病例均為Ⅰ~Ⅲ期可手術切除的患者,術前均未接受過放、化療。按AJCC和UICC(第7版,2009年)TNM分期,Ⅰ期31例,Ⅱ期65例,Ⅲ期24例;淋巴結轉移陽性54例,淋巴結轉移陰性66例;ER 陽性79例,陰性41例;PR 陽性70例,陰性50例;Her-2陽性22例,陰性98例。所有病例中,93例浸潤型導管癌,6例乳腺單純癌,7例乳腺黏液腺癌,7例乳腺髓樣癌,7例其他類型乳腺癌,選取手術切除標本中正常乳腺組織(癌旁大于3 cm)作為對照。
1.2方法
1.2.1主要試劑小鼠抗人D6 單克隆抗體購自美國SANTA CRUZ公司;小鼠抗人DARC 單克隆抗體購自美國R&D公司;ER、PR、HER-2 抗體及SP 試劑盒均購自北京中衫金橋生物技術有限公司。
1.2.2免疫組織化學方法采用SP法對120例女性乳腺癌石蠟標本分別進行D6、DARC 蛋白表達檢測,將乳腺癌組織切片置入pH 8.0 乙二胺四乙酸(EDTA)液高壓修復,試驗按照SP檢測試劑盒說明書進行,抗稀釋度1∶50, 二氨基聯苯胺(DAB)溶液顯色、復染、脫水、透明、封片。陽性對照選取已知的陽性病例,而陰性對照中選取磷酸鹽緩沖液(PBS) 代替一抗。
1.2.3結果判定所有切片觀察視野均含低倍和高倍鏡,采取雙盲閱片方式,由兩位高年資病理醫師完成。結果判定如下:D6、DARC 陽性細胞表達定位于細胞質,偶見細胞膜陽性表達,以腫瘤細胞的細胞質和(或)細胞膜出現棕黃色顆粒為陽性細胞。按切片中腫瘤細胞陽性細胞率和著色強度分別記分。(1)按陽性細胞百分率記分:<5%,0分;5%~<25%,1分;25%~<50%,2分;50%~<75%,3分;≥75%,4分。(2)按著色強度記分為:無著色,0分;淡黃色,1分;黃色,2分;棕黃色,3分。最后以上述兩者乘積計分:0分為陰性;大于1分為陽性(≥6分表示高表達,<6分表示低表達)[14]。
1.3統計學處理采用SPSS 17.0統計軟件進行分析,計數資料用率表示,采用Pearson檢驗比較乳腺癌與癌旁正常乳腺組織中各指標表達差異、乳腺癌中各指標表達情況、臨床分期、淋巴結轉移狀況、ER、PR、HER-2 等臨床病理參數的差異。以P<0.05為差異有統計學意義。
2 結 果
2.1D6、DARC 在乳腺癌及癌旁正常乳腺組織中的表達在120 例乳腺癌癌旁正常乳腺導管上皮細胞中, D6、DARC 陽性分別為86、82例,陽性表達率為71.7%、68.3%;120例乳腺癌中,D6、DARC 陽性分別為82例、78例,陽性表達率為68.3%、65.0%。D6、DARC 在乳腺癌組織及癌旁正常乳腺組織均有表達,兩者差異無統計學意義(χ2=0.300,P=0.584),見圖1。
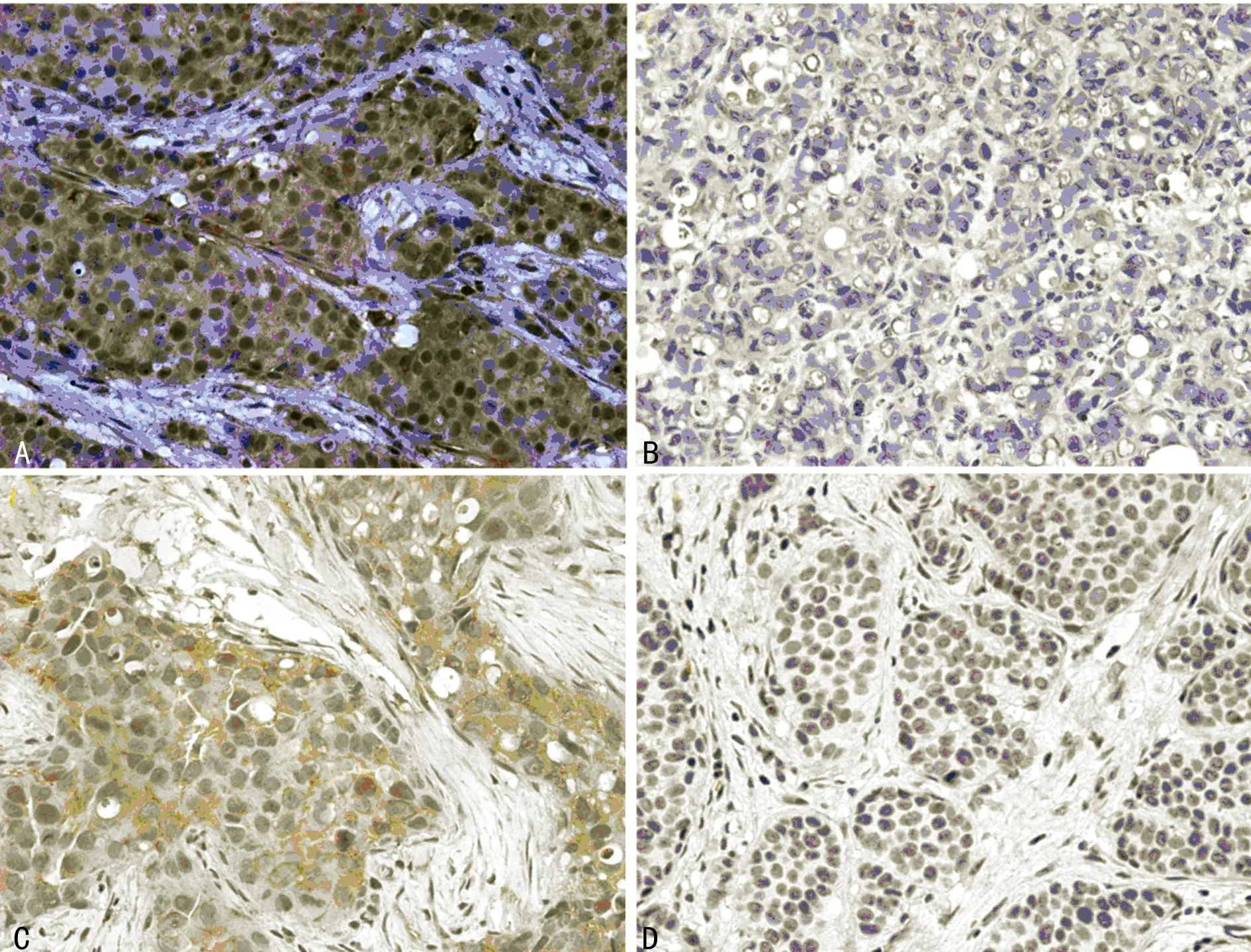
A:D6 陽性表達;B:D6 陰性表達;C:DARC 陽性表達;D:DARC 陰性表達。
圖1D6、DARC陽性及陰性表達(×200)
2.2D6、DARC 與乳腺癌臨床分期及淋巴結轉移的關系本研究中,Ⅰ期乳腺癌患者為31例,其中D6及DARC陽性表達率分別為80.65%、74.19%;Ⅱ期乳腺癌患者為65例,其中D6 及DARC 陽性表達率分別為53.85%、60.00%;Ⅲ期乳腺癌患者為24例,其中D6 及DARC 陽性表達率分別為16.67%、20.83%。54例發生腋窩淋巴結轉移,其中D6、DARC 陽性表達率分別為25.96%、22.22%;66例無腋窩淋巴結轉移,其中D6、DARC 陽性表達率分別為78.79%、83.33%,D6、DARC的表達情況與乳腺癌臨床分期及是否發生腋窩淋巴結轉移密切相關(P<0.01),見表1。
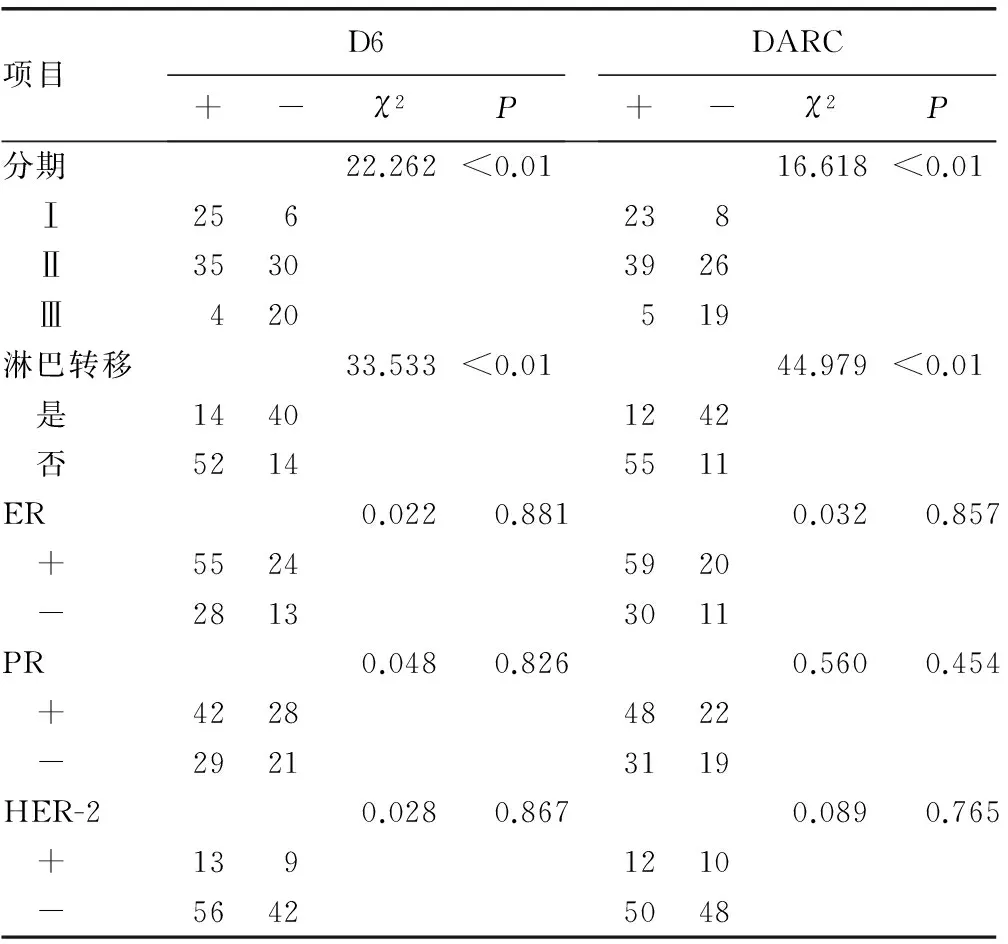
表1 D6、DARC與乳腺癌臨床病理參數的關系(n)
2.3D6、DARC與乳腺癌病理參數的關系ER陽性及陰性患者D6陽性表達率分別為69.62%、68.29%,DARC陽性表達率分別為74.68%、73.17%;PR陽性及陰性患者D6陽性表達率分別為60.00%、58.00%,DARC陽性表達率分別為68.57%、62.00%;HER-2陽性及陰性患者D6陽性表達率分別為59.09%、57.14%,DARC陽性表達率分別為54.55%、51.02%。由此可見乳腺癌組織中D6、DARC表達水平與ER、PR及HER-2表達狀態差異無統計學意義(P>0.05),見表1。
3 討 論
近年來,得益于手術、化療、放療、靶向治療、生物免疫治療等多種手段的綜合運用,乳腺癌病死率已大大降低,腫瘤患者的無瘤生成率也得到極大改善。但乳腺癌發病及進展系多基因、多階段共同作用的結果,其強侵襲能力、較早淋巴轉移、易復發等特點一直以來都是治療的難點,嚴重制約腫瘤的治療效果,也導致90%乳腺癌患者死于轉移[15]。
趨化因子是一類相對分子質量為(8~12)×103的小分子分泌型蛋白,由70~100個氨基酸組成,主要為吸引白細胞定向移行至感染部位,在炎性反應中發揮重要作用。根據半胱氨酸殘基數量和位置可將趨化因子分為CXC、CC、C、CX3C 4個亞類[6]。多種趨化因子及其活性受體均可由乳腺癌細胞產生,并在乳腺癌發病及進展中起到廣泛的作用:CXCL1、CXCL8、CCL18 等趨化因子具有促乳腺癌作用,而CCL19、CCL21 等則可能有抗乳腺癌作用[4,6]。
D6亦稱CCBP2 (chemokine binding protein 2)、CMKBR9 (chemokine binding receptor 9)、CCR9 (CC chemokine receptor 9)或CCR10,具有7次跨膜結構,其天冬酰胺替代天冬氨酸,即第2次跨膜改變對D6 的誘餌功能可能起到重要作用[16-17]。皮膚淋巴管、小腸、胎盤、肺的內皮細胞均有D6 的高表達,其中以淋巴管內皮細胞為最高,研究表明D6 不能傳遞信號,其主要作用為中和、呈遞及轉運趨化因子。D6 與多種腫瘤發生、發展都有重要關系,在小鼠大腸炎與結腸癌的相關研究表明,D6 表達使小鼠患大腸炎相關性癌癥易感性明顯增加[17]。另有研究顯示MCF-7、MDA-MB-231等多種人乳腺癌細胞系均可表達D6,其中在裸鼠人乳腺癌移植瘤生長及肺轉移受抑制的標本中,D6 均處于過表達狀態[13]。
Duffy血型物質(Duffy blood group,DBG),即Duffy抗原(Duffy antigen) 為DARC,是一類可同時結合CC 族和CXC 族趨化因子的糖蛋白[18]。由于DRY(Asp-Arg-Tyr) 堿基序列的缺失,導致細胞胞內信號轉導無法完成,因此也被稱為趨化因子誘餌受體。DARC 在肺毛細血管后靜脈、神經、肌肉、骨髓、胰、腎臟的內皮細胞上都有表達,但DARC 只表達于靜脈系統[19]。研究證實DARC 在肺癌、黑色素瘤及前列腺癌發病中具有負性調節作用[20-23]。國內學者也證實DARC與乳腺癌的發生及轉移有關[24]。DARC 一方面通過清除CCL2、CXCL8 等成血管性趨化因子抗腫瘤,同時也包含基因水平的腫瘤相關調控[23]。
乳腺癌轉移所致相關臟器損害、衰竭是患者死亡的主要原因,究其原因主要在于靶器官所表達趨化因子,而乳腺癌組織表達趨化因子受體,兩者結合導致了腫瘤轉移的發生,由此可見,腫瘤轉移與靶器官表達趨化因子高低密切相關。本試驗對120例乳腺癌組織中D6、DARC 的表達情況進行研究發現,乳腺癌細胞上D6、DARC 的表達與乳腺癌的臨床分期及淋巴結轉移存在明顯負性相關性,而在關于病理相關標志物ER、PR、HER-2研究中,D6、DARC 表達與病理學標志物表達無明顯相關性。
隨著研究的不斷深入,D6、DARC 等ACB所表現出的廣泛結合力及強大的趨化因子清除力,已不斷運用到腫瘤相關研究中。乳腺癌的發生、發展亦被證實與更多的趨化因子有關,趨化因子的多靶點高效調控即將成為可能,給乳腺癌的治療帶來新的思路,為乳腺癌等腫瘤的治療提供具有革命性意義的新的治療途徑。
[1]Li J,Zhang BN,Fan JH,et al.A nation-wide multicenter 10-year (1999-2008) retrospective clinical epidemiological study of female breast cancer in China[J].BMC Cancer,2011,11(364):1-11.
[2]Hamanishi J,Mandai M,Matsumura N,et al.Activated local immunity by CC chemokine ligand 19-transduced embryonic endothelial progenitor cells suppresses metastasis of murine ovarian cancer[J].Stem Cells,2010,28(1):164-173.
[3]林刻智,林峰,鄭雙,等.趨化因子CXCL14在結直腸癌組織中的表達及其臨床相關性研究[J].中國病理生理雜志,2014,30(2):355-358,373.
[4]Balkwill FR.The chemokine system and cancer[J].J Pathol,2012,226(2):148-157.
[5]Zlotnik A,Yoshie O.The chemokine superfamily revisited[J].Immunity,2012,36(5):705-716.
[6]Zlotnik A,Burkhardt AM,Homey B.Homeostatic chemokine receptors and organ-specific metastasis[J].Nat Rev Immunol,2011,11(9):597-606.
[7]Cancellieri C,Vacchini A,Locati M,et al.Atypical chemokine receptors:from silence to sound[J].Biochem Soc Trans,2013,41(1):231-236.
[8]Graham GJ,Locati M,Mantovani A,et al.The biochemistry and biology of the atypical chemokine receptors[J].Immunol Lett,2012,145(1/2):30-38.
[9]Liu XF,Li LF,Ou ZL,et al.Correlation between Duffy blood group phenotype and breast cancer incidence[J].BMC Cancer,2012,12(374):1-6.
[10]Nibbs RJ,Graham GJ.Immune regulation by atypical chemokine receptors[J].Nat Rev Immunol,2013,13(11):815-829.
[11]Vetrano S,Borroni EM,Sarukhan A,et al.The lymphatic system controls intestinal inflammation and inflammation-associated Colon Cancer through the chemokine decoy receptor D6[J].Gut,2010,59(2):197-206.
[12]Chew AL,Tan WY,Khoo BY.Potential combinatorial effects of recombinant atypical chemokine receptors in breast cancer cell invasion:a research perspective[J].Biomed Rep,2013,1(2):185-192.
[13]Wu FY,Ou ZL,Feng LY,et al.Chemokine decoy receptor d6 plays a negative role in human breast cancer[J].Mol Cancer Res,2008,6(8):1276-1288.
[14]龔迪和,丁克峰.趨化因子CCL28在乳腺癌中的表達及意義[J].中國癌癥雜志,2014,24(4):304-309.
[15]Marx V.Tracking metastasis and tricking cancer[J].Nature,2013,494(7435):133-136.
[16]Graham GJ,Locati M.Regulation of the immune and inflammatory responses by the ′atypical′ chemokine receptor D6[J].J Pathol,2013,229(2):168-175.
[17]Lee KM,Nibbs RJ,Graham GJ.D6:the ′crowd controller′ at the immune gateway[J].Trends Immunol,2013,34(1):7-12.
[18] Meny GM.The Duffy blood group system:a review[J].Immunohematology,2010,26(2):51-56.
[19]Huang W,Qin W,Lv L,et al.Duffy antigen/receptor for chemokines correlates with inflammatory reaction in rats with venous hypertension:implication for the pathogenesis of primary chronic venous disease[J].Vasa,2014,43(1):47-54.
[20]Shen H,Schuster R,Stringer KF,et al.The duffy antigen/receptor for chemokines (DARC) regulates prostate tumor growth[J].FASEB J,2006,20(1):59-64.
[21]Bandyopadhyay S,Zhan R,Chaudhuri A,et al.Interaction of KAI1 on tumor cells with DARC on vascular endothelium leads to metastasis suppression[J].Nat Med,2006,12(8):933-938.
[22]Khanna P,Chung CY,Neves RI,et al.CD82/KAI expression prevents IL-8-mediated endothelial gap formation in late-stage melanomas[J].Oncogene,2014,33(22):2898-2908.
[23]Horton LW,Yu Y,Zaja-Milatovic S,et al.Opposing roles of murine duffy antigen receptor for chemokine and murine CXC chemokine receptor-2 receptors in murine melanoma tumor growth[J].Cancer Res,2007,67(20):9791-9799.
[24]Yu KD,Wang X,Yang C,et al.Host genotype and tumor phenotype of chemokine decoy receptors integrally affect breast cancer relapse[J].Oncotarget,2015,6(28):26519-26527.
Study of D6 and DARC expression in breast cancer*
JingZhouhong,CaoYong,XiongZhongxun,JiangGeli,LiuXiaoyu,ZengXiaohua△
(DepartmentofBreastSurgery,ChongqingCancerInstitute,Chongqing400030,China)
ObjectiveTo observe and study the expression of chemokine D6 and DARC in breast cancer,and to analyse their association with cTNM stage and pathological features of breast cancer.MethodsExpressions of chemokine D6 and DARC in 120 breast cancer patients were determined by IHC(immunohistochemistry) technique(SP).The corresponding normal breast tissues in paraneoplastic were also detected.The level of D6 and DARC in 120 breast cancer were analysed whether it was associated with cTNM stage,axillary lymph node status,ER status,PR status and HER-2 status.ResultsD6 and DARC were expressed in both breast cancer and normal breast tissues in paraneoplastic.The positive expression rate of D6 and DARC in normal paraneoplastic breast tissues were 71.7% and 68.3%.The positive expression rate of D6 and DARC in breast cancer were 68.3% and 65.0%.The expression of DARC and D6 was closely related to the clinical stage of breast cancer and whether the axillary lymph node metastasis occurred (P<0.01).The expression of D6 and DARC were not associated with ER,PR and HER-2 status(P>0.05).ConclusionThe level of D6 and DARC expression might play negative regulatory role in breast cancer staging.The level of expression is not significantly correlated with pathological features of breast cancer.
breast neoplasms;immunohistochemistry;lymphatic metastasis;receptors,chemokine;DARC;D6;expression
10.3969/j.issn.1671-8348.2016.14.014
重慶市衛生局重點項目(2012-1-125)。作者簡介:景周宏(1984-),住院醫師,碩士,主要從事乳腺外科研究。△
,E-mail:qq-zxh@126.com。
R737.9
A
1671-8348(2016)14-1915-03
2015-11-08
2016-01-11)

