青蒿-鱉甲藥對配伍治療系統(tǒng)性紅斑狼瘡小鼠的代謝組學研究
陳 娟,鄧 軍,周 佳,謝志軍,甘 靜,溫成平(.浙江中醫(yī)藥大學基礎醫(yī)學院,浙江杭州 30053;.浙江省醫(yī)學科學院安全性評價研究中心,浙江杭州 3003)
青蒿-鱉甲藥對配伍治療系統(tǒng)性紅斑狼瘡小鼠的代謝組學研究
陳娟1,鄧軍2,周佳1,謝志軍1,甘靜1,溫成平1
(1.浙江中醫(yī)藥大學基礎醫(yī)學院,浙江杭州310053;2.浙江省醫(yī)學科學院安全性評價研究中心,浙江杭州310013)
網(wǎng)絡出版時間:2016-4-26 11:06網(wǎng)絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.052.html
目的研究系統(tǒng)性紅斑狼瘡(SLE)小鼠(MRL/lpr)經(jīng)青蒿-鱉甲藥對治療后血清代謝物的變化,探討SLE發(fā)病及藥物作用機制。方法采集對照組、SLE模型組和青蒿-鱉甲藥對治療組(低、高劑量組)小鼠的血清樣本,應用高效液相色譜-四級桿-飛行時間質(zhì)譜聯(lián)用系統(tǒng)(HPLC-Q-TOF/ MS),對樣本進行代謝圖譜分析。應用Mass Hunter和MPP軟件處理數(shù)據(jù),數(shù)據(jù)模式識別采用有監(jiān)督的偏最小二乘法-判別分析(PLS-DA)。結果代謝組學分析發(fā)現(xiàn),SLE模型小鼠存在較明顯的脂代謝紊亂。與模型組相比,藥物組可以改善狼瘡鼠體內(nèi)脂質(zhì)代謝異常,影響SLE疾病血栓的發(fā)生發(fā)展;并且可以改善SLE小鼠急性期的炎癥反應,減少其病理損害。結論青蒿-鱉甲藥對通過調(diào)節(jié)SLE小鼠的脂質(zhì)代謝及炎癥反應對其發(fā)揮一定的治療作用。
青蒿-鱉甲藥對;系統(tǒng)性紅斑狼瘡;小鼠;血清;代謝組學;液相色譜-四級桿-飛行時間質(zhì)譜
藥對是中藥配伍形式中的一種,從某種角度上講,藥對的配伍與應用具有特別的意義。所謂中藥藥對又稱對藥、對子藥、姐妹藥,專指臨床上常用的相對固定的兩味藥物的配伍形式,是中藥配伍中的最小單位[1]。由于研究單味藥難以反映出其在復方中的真實作用,而復方由于藥味多,作用關系復雜,對其研究也難以得出準確結論。“藥對”作為藥配伍中的雛形,對其研究恰好可以彌補上述不足。復方中的核心藥對,在中藥理論中具有相互增效并調(diào)和藥性,引藥歸經(jīng)的作用。
系統(tǒng)性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種自身免疫性疾病。研究認為,SLE的發(fā)生主要由于先天腎陰虧虛,以致五臟之精生化乏源,形成以陰虛內(nèi)熱為本的狼瘡體質(zhì)[2]。根據(jù)病因病機特點,結合癥狀分析,及古代醫(yī)家選方用藥特點,辨證論治,范永升等[3]確立了解毒祛瘀滋陰療法,按照以法制方的原則,通過處方、藥物篩選及臨床經(jīng)驗,確立解毒祛瘀滋陰方,青蒿、鱉甲為該方的核心組分,兩藥相配,有“青蒿不能直入陰分,有鱉甲領之入也;鱉甲不能獨出陽分,青蒿領之出也”之妙。
代謝組學借助高通量、高靈敏度與高精確度的現(xiàn)代技術,分析生物樣本如血液、尿液中的內(nèi)源性代謝物,可以根據(jù)代謝物的變化,發(fā)現(xiàn)生物標志物,闡明藥物作用的整體效應,包括協(xié)同作用,其思想具有與中醫(yī)理論整體觀念相一致的特點。作為系統(tǒng)生物學的重要組成部分,代謝組學已被廣泛應用于各類復雜疾病的作用機制研究[4]。其中,超高效液相質(zhì)譜聯(lián)用(UPLC/Q-TOFMS)是目前用于分析的一種強有力的方法[5]。本實驗擬選擇解毒祛瘀滋陰方中的青蒿、鱉甲作為藥對配伍,應用代謝組學技術研究其干預狼瘡鼠后血清代謝標志物的變化規(guī)律,篩選、鑒定與疾病相關的代謝標記物,探討青蒿-鱉甲藥對對SLE的治療機制。
1 材料
1.1實驗動物2月齡C57BL/6小鼠12只,MRL/ lpr狼瘡鼠36只,由上海斯萊克實驗動物有限責任公司提供,實驗動物生產(chǎn)許可證號:SCXK(滬)2012-0002,實驗用基礎飼料由浙江中醫(yī)藥大學動物實驗中心提供[6]。
1.2實驗藥品與試劑青蒿、鱉甲生藥材由浙江中醫(yī)藥大學飲片廠提供。青蒿鱉甲提取液由浙江中醫(yī)藥大學附屬醫(yī)院制劑室制備(濃度:含生藥量0.5 g每毫升),-20℃保存?zhèn)溆茫?]。甲酸(分析純,阿拉丁公司),甲醇(色譜級,美國Tedia公司),乙腈(色譜級,美國Tedia公司),質(zhì)譜參比液和校準液為美國安捷倫公司所提供。
1.3實驗儀器1260 infinity高效液相色譜儀,E-clipse Plus C18色譜柱,Agilent 6520 Q-TOF/MS質(zhì)譜系統(tǒng),均購自美國Agilent公司;Centrifuge 5417R高速冷凍離心機(德國,Eppendorf公司);Milli-Q Biocel純水儀(美國,Millipore公司);Mass Hunter軟件(美國,Agilent Technologies公司);Mass Profiler Professional(MPP)軟件(美國,Agilent Technologies公司)。
2 方法
2.1動物實驗36只MRL/lpr小鼠♀,12只C57BL/6小鼠♀,由浙江中醫(yī)藥大學動物實驗中心飼養(yǎng)(SPF級)。適應性喂養(yǎng)1周后,分為對照組(C57BL/6小鼠)、模型組及青蒿-鱉甲治療組(低、高劑量)。對照組及模型組每日灌胃生理鹽水1次,每只0.5 mL。低、高劑量組以相當于正常成人每日用量5、10倍劑量給藥,分別為0.1、0.2 mL· (10 g)-1(水煎液),每日1次,連續(xù)飼養(yǎng)用藥2個月。采血前小鼠禁食12 h,眼球取血,收集血液3 000 r·min-1離心15 min,分離血清,-80℃保存?zhèn)溆茫?]。
2.2血清樣本前處理血清樣本在室溫下解凍后,離心后取出100 μL,加入300 μL乙腈沉淀蛋白[7],渦旋震蕩1 min,靜置10 min,然后4℃低溫高速離心10 min(12 000 r·min-1),400 μL血清樣品用0.22 μm微孔濾膜過濾,棄去初始濾液,樣品即可進行液相質(zhì)譜分析。從4個實驗組樣本中抽取等體積血清混合制成質(zhì)控樣本,前處理方法與待測樣本相同。
2.3色譜條件與質(zhì)譜條件依據(jù)本實驗室前期建立的條件進行優(yōu)化,最終確定的色譜條件:流動相A 為0.1%甲酸水溶液,B為0.1%甲酸乙腈溶液,采用梯度洗脫(0~2 min,20%B;2~13 min,20%~75%B;13~18 min,75% ~85%B;18~25 min,85%~95%B),后運行時間為5 min。自動進樣器溫度為4℃,柱溫為35℃。
對質(zhì)譜系統(tǒng)進行優(yōu)化,優(yōu)化后的主要參數(shù)是:采用電噴霧離子源ESI正離子模式。掃描范圍m/z 50 ~1 000,干燥氣為N2,干燥氣溫度為350℃,正離子模式毛細管電壓分別為4 000 V,碎裂電壓為170 V,錐孔電壓為65 V,霧化器壓力為275.8 kPa。使用Centroid模式保存質(zhì)譜數(shù)據(jù),數(shù)據(jù)采集速率為2 spectrum·s-1。數(shù)據(jù)采集過程中,參比液實時監(jiān)測校準質(zhì)譜系統(tǒng)。二級質(zhì)譜數(shù)據(jù)采集時,碰撞能分別設置為40 eV,二級質(zhì)譜采集速率為2 spectrum·s-1[8]。
2.4數(shù)據(jù)處理使用Agilent Mass Hunter分析軟
件中分子特征提取 (molecular feature extraction,MFE)處理代謝物信息。提取離子豐度閾值為200,基峰豐度閾值為1 000,正離子模式加和離子種類為[M+H]+。提取后代謝物信息包括保留時間、精確質(zhì)量數(shù)和豐度,將提取后的數(shù)據(jù)轉(zhuǎn)存為CEF格式文件,利用MPP軟件進行數(shù)據(jù)預處理。使用PLS-DA的載荷圖篩選出對分類貢獻較大的化合物,進一步通過 VIP(variable importance in projection)值(>1.5)確定生物標志物,利用方差分析對數(shù)據(jù)進行統(tǒng)計學分析。利用PLS-DA對數(shù)據(jù)矩陣進行模式識別。根據(jù)精確的質(zhì)量數(shù)和二級質(zhì)譜圖,利用METLIN、HMDB和PubChem等數(shù)據(jù)庫鑒定潛在標記物。
3 結果
3.1LC-MS分析如Fig 1所示,實驗得到各組血清樣本的TIC圖之間存在一定差異。為保證數(shù)據(jù)的可靠性,在采集過程中,每間隔8個樣本進樣一次質(zhì)控樣本,以監(jiān)測系統(tǒng)的穩(wěn)定性。分析質(zhì)控樣本的TIC圖,分保留時間(前、中、后),采用5個特征峰的離子精確質(zhì)量、保留時間和峰面積數(shù)據(jù)。結果顯示,所選特征峰的保留時間偏移<0.01 min,各個峰面積RSD<10%,精確質(zhì)量的數(shù)漂移值小于2 ppm。由此可見,在血清樣本數(shù)據(jù)采集過程中,系統(tǒng)穩(wěn)定,采集數(shù)據(jù)可靠。
3.2數(shù)據(jù)分析對4組小鼠的代謝圖譜進行PCA主成分分析(Fig 2),發(fā)現(xiàn)SLE模型組和對照組明顯地分離,說明2組小鼠血清中代謝物種類或者數(shù)量上存在一定差異。在此基礎上,我們進一步采用PLS-DA對各組數(shù)據(jù)進行分型,由得分圖結果可以看出(Fig 3),SLE組較對照組有明顯的向左偏移。青蒿-鱉甲配伍治療后,代謝圖譜偏移得到有效的緩解,治療組與對照組在得分圖中趨于靠近,表明代謝產(chǎn)物差異相對減小,說明青蒿-鱉甲藥對配伍對SLE小鼠有治療作用。
3.3差異代謝物的鑒定根據(jù)差異代謝物的精確相對分子質(zhì)量和二級質(zhì)譜圖,鑒定差異代謝物。其中10種差異代謝物得到鑒定(Tab 1),各個差異代謝物在各組中的峰面積變化如Fig 4所示。
3.4代謝物變化趨勢血清中代謝物的變化趨勢反映了機體代謝變化,SLE發(fā)病或藥物干預都可能會引起正常代謝圖譜的改變。對照組和SLE模型組的PLS-DA分析,鑒定出10個SLE的代謝標記物(Tab 1),分析這些代謝標記物在給藥前后相對含量的變化(Fig 4),發(fā)現(xiàn)在SLE模型組中代謝標記物含量與對照組相比差異有顯著性(P<0.05),說明SLE對小鼠血清中代謝物含量有較大的影響。青蒿-鱉甲藥對治療組小鼠代謝標記物中,血小板活化因子(Lyso-PAF C-16,enantio-PAF C-16)、L-α-溶血卵磷脂(L-α-Lyso phosphatidylcholine)、G9a/ GLP組蛋白甲基轉(zhuǎn)移酶抑制劑(UNC0638)、L-丁酰基肉堿(Butyryl-L-carnitine,C4)、前列腺素 B3 (PGB3)和乙烷磺酸[(Z)-2-tetracos-15-enamido ethanesulfonic acid]較SLE模型組含量差異有顯著性(P<0.05),代謝標記物含量回調(diào)作用明顯。這些代謝標記物含量的回調(diào),體現(xiàn)了青蒿-鱉甲藥對配伍對SLE模型小鼠疾病代謝的調(diào)節(jié)作用。
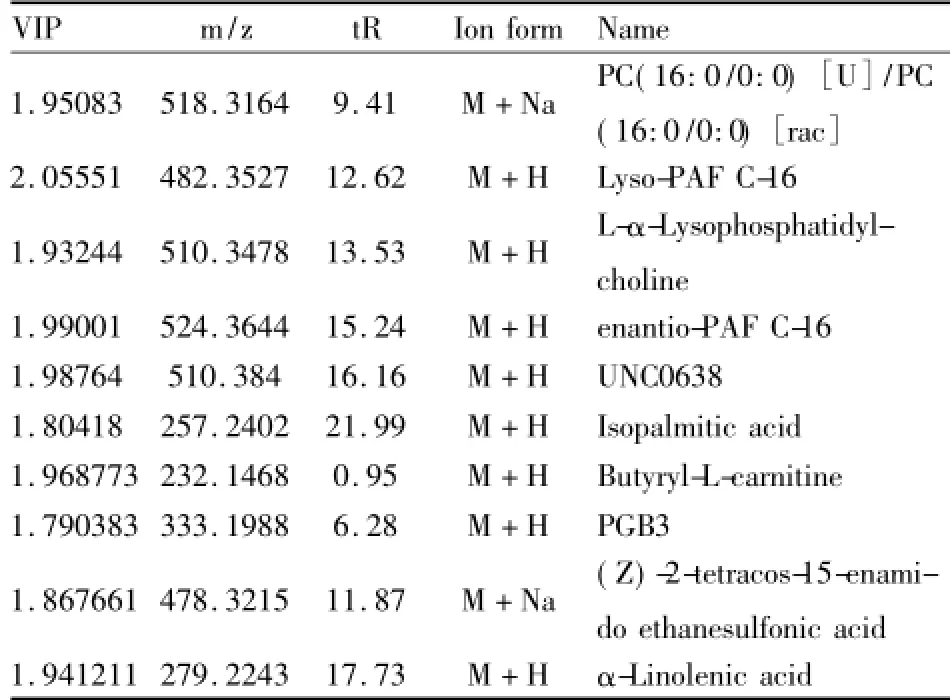
Tab 1 Identification results of differential metabolites
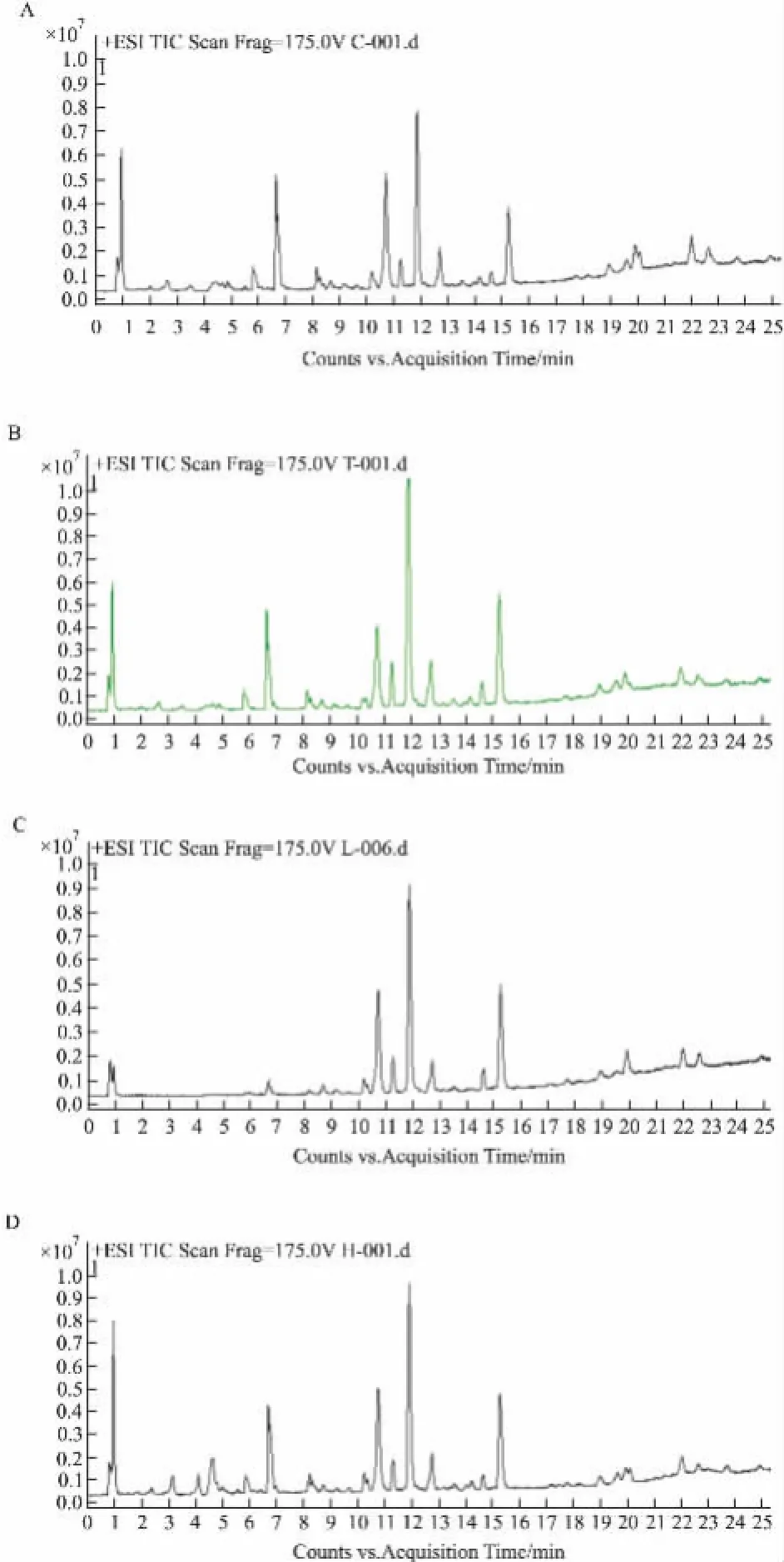
Fig 1 Representative TIC chromatograms of control group(A),SLE model group(B)and Qinghao-Biejia treatment group[low(C)and high(D)dose]
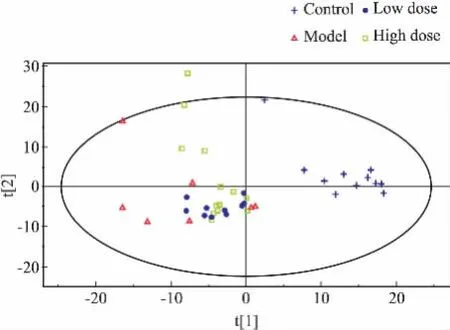
Fig 2 Score plots of PCA analysis in positive ion mode
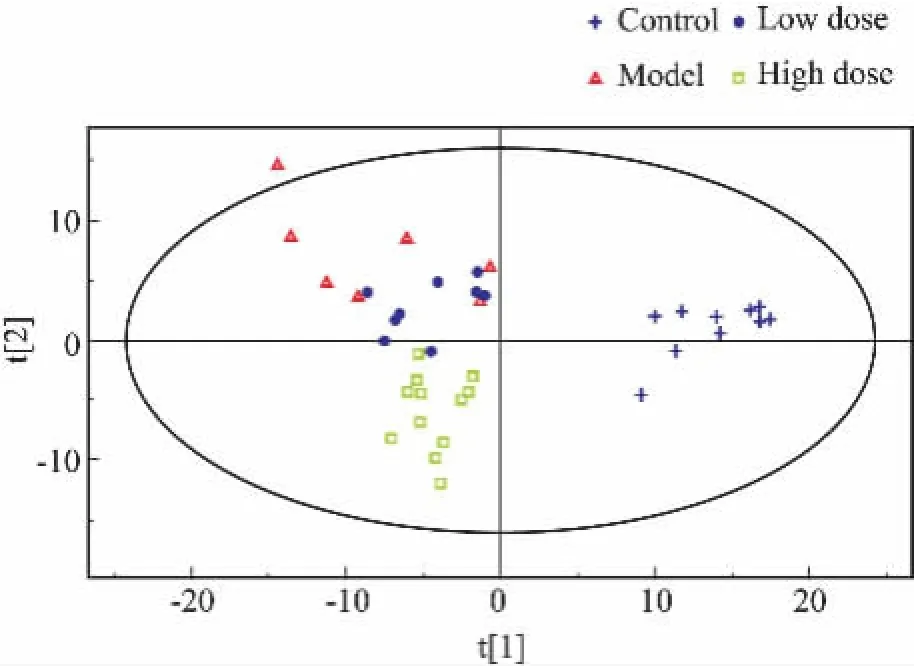
Fig 3 Score plots of PLS-DA analysis in positive ion mode
4 討論
正常組小鼠、模型狼瘡鼠及給藥組狼瘡鼠的血清經(jīng)過PCA和PLS-DA分析,結合圖譜表明,與模型組相比,青蒿-鱉甲治療組可以降低狼瘡鼠體內(nèi)L-α-溶血卵磷脂(溶血磷脂1,LPC)的含量。溶血磷脂是磷脂的降解產(chǎn)物,由于最常用的磷脂為卵磷脂,因而溶血磷脂一般是指LPC,其具有高度細胞毒性,可破壞細胞膜的磷脂層。體內(nèi)卵磷脂代謝產(chǎn)生LPC的過程由磷脂酶A1和磷脂酶A2催化。磷脂酶A2可催化甘油磷脂的第2位酯鍵斷裂,生成溶血磷脂
Fig 4Charts of different metabolite peak area*P<0.05,**P<0.01 vs SLE model 1,即L-α-溶血卵磷脂。磷脂酶A2參與自身免疫病的病理損傷過程,它又與自由基的產(chǎn)生密切相關。有研究表明,SLE患者體內(nèi)磷脂酶A2活性較正常人升高,且活動期較非活動期增高,可能的機制為磷脂酶A2水解膜磷脂產(chǎn)生的LPC及其代謝產(chǎn)物,產(chǎn)生多器官損害[9-10]。本研究結果顯示,模型組血清中LPC含量較正常組明顯升高,結合以上觀點,可以判斷與SLE疾病的發(fā)展有密切關系,青蒿-鱉甲治療組干預后LPC水平明顯下調(diào),說明該藥對的干預可以減弱LPC對細胞的毒性作用和對器官的損害,有助于SLE疾病的緩解和治療。
補體系統(tǒng)是機體免疫應答過程中的一個重要的效應系統(tǒng),具有溶病毒、溶細胞、溶菌等免疫調(diào)節(jié)作用,并有清除免疫復合物以及炎癥介質(zhì)作用。C4是補體經(jīng)典激活途徑的一個重要組分。補體的各組分在不同激活物的作用下,可循經(jīng)典途徑或替代途徑被順序活化,參與機體的特異性和非特異性效應機制;同時,補體活化也可能導致對機體組織的損傷。研究發(fā)現(xiàn),補體異常與SLE疾病的發(fā)生發(fā)展有密切的關系。無論臨床觀察還是動物實驗均證實,補體成分在SLE發(fā)病中的作用具有雙重性,一方面補體蛋白缺陷或水平低下個體易患SLE,補體的存在對抵抗SLE的發(fā)生提供一定的保護作用;另一方面,補體活化的直接作用和對免疫細胞功能的影響可加重SLE的病理損害,影響SLE病程的發(fā)展和臨床表現(xiàn)[11]。本研究結果表明,模型組小鼠C4表達水平升高,C4含量升高常見于風濕熱的急性期。經(jīng)典理論認為,自身抗原和抗體結合形成免疫復合物,進而激活補體,造成炎癥反應和組織損傷。提示可能與狼瘡鼠急性期炎癥相關,而青蒿-鱉甲治療組尤其是高劑量組明顯降低了C4的含量,提示青蒿鱉甲藥對可以改善SLE小鼠急性期的炎癥反應,減少其病理損害。該結果進一步證實了我們前期的研究成果[6],發(fā)現(xiàn)青蒿-鱉甲藥對能抑制小鼠血清中炎性因子IL-6的分泌,明顯降低血清中IFN-γ的水平,從而減少了因自身免疫復合物的分泌而造成的病理性損害[12]。
血小板活化因子(platelet activating factor,PAF)主要由中性粒細胞、血小板和巨噬細胞等產(chǎn)生,是具有廣泛生物活性的磷脂類遞質(zhì),參與人體多種生理、病理過程。PAF需和PAF受體結合才能產(chǎn)生生物活性。SLE患者經(jīng)常合并動、靜脈血栓形成,是血栓栓塞性疾病的高危因素。2009年,美國研究1 930例SLE病例的結果顯示,22%的SLE患者合并動、靜脈血栓。SLE發(fā)生血栓性疾病的危險性是其它風濕性疾病的9.6倍[13-14]。臨床和實驗證實,血栓形成的病理過程會伴有不同程度的血小板活化,活化的血小板釋放出許多生物活性物質(zhì),這些活性物質(zhì)可以使SLE體內(nèi)的免疫復合物沉積于小血管內(nèi)膜、腎小球基底膜、關節(jié)等部位,激活補體引起炎癥等[13]。且有報道研究發(fā)現(xiàn),PAF水平與SLE疾病活動性指數(shù)相關,可作為評估SLE病情活動性的指標之一[15]。本研究結果發(fā)現(xiàn),高劑量藥物治療組可以明顯降低Lyso-PAF C-16和enantio-PAF C-16的水平,因此推測青蒿-鱉甲干預后可以抑制PAF的活化,從而影響SLE血栓的發(fā)生發(fā)展。
由必需脂肪合成而來的前列腺素,可以使細胞對激素變得敏感。必需脂肪的缺乏,或者將必需脂肪轉(zhuǎn)換成前列腺素的營養(yǎng)素(如維生素B3、維生素C和生物素等)的缺乏,都會造成與激素失調(diào)相關的癥狀。狼瘡鼠模型組前列腺素B3(PGB3)與正常對照組相比明顯降低,但藥物組干預后PGB3水平明顯升高,恢復正常,提示青蒿-鱉甲可以改善SLE引起的激素水平紊亂的狀況。
綜上所述,通過運用代謝組學技術鑒定疾病及用藥后狼瘡鼠血清差異代謝物,發(fā)現(xiàn)青蒿-鱉甲藥對配伍作用后影響了體內(nèi)一些疾病相關代謝物,尤其是脂質(zhì)代謝和免疫相關因子,推測其可能為藥物作用的關鍵靶點,為治療SLE疾病復方的開發(fā)和進一步研究奠定了理論基礎。
(致謝:本文實驗在浙江中醫(yī)藥大學基礎醫(yī)學院中醫(yī)臨床基礎研究所完成,在整個研究完成過程中得到了溫成平教授、丁興紅教授、孔宏偉副研究員及謝志軍副研究員的悉心指導和熱忱幫助,在此深表謝意!)
[1]楊鴻珠,龔雨萍.中藥藥對的研究進展與研究[J].中國中西醫(yī)結合雜志,2010,30(2):218-20.
[1]Yang H Z,Gong Y P.Research progress and thinking of Chinese herbal medicine[J].Chin J Integr Tradit West Med,2010,30 (2):218-20.
[2]徐莉,季巾君,范永升,等.解毒祛瘀滋腎方對MRL/lpr狼瘡小鼠腎組織GRα的調(diào)控作用研究[J].中國中西醫(yī)結合雜志,2011,31(11):1527-30.
[2]Xu L,Ji J J,F(xiàn)an Y S,et al.Study on the regulation of Jiedu Quyu Zishen Recipe on glucocorticoid receptor α in the renal tissue of MRL/Ipr mice[J].Chin J Integr Tradit West Med,2011,31 (11):1527-30.
[3]范永升,溫成平,吳國琳,等.解毒祛瘀滋陰法對系統(tǒng)性紅斑狼瘡類固醇性骨質(zhì)疏松癥的防治作用研究[J].中華中醫(yī)藥雜志,2005,20(11):667.
[3]Fan Y S,Wen C P,Wu G L,et al.Investigation into preventive and therapeutic effects of Jieduquyuziyin methods in treating corticosteroid osteoporosis in systemic lupus erythematosus[J].China J Tradit Chin Med Pharm,2005,20(11):667.
[4]盧偉,馬曉麗,蘭怡.兩色金雞菊醇提物對自發(fā)性高血壓大鼠尿液的代謝組學研究[J].中國藥理學通報,2014,30 (9):1311-5.
[4]Lu W,Ma X L,Lan Y.Effect of alcohol extract from Coreopsis tinctoria Nutt.on spontaneous hypertension rats by metabolomic methods[J].Chin Pharmacol Bull,2014,30(9):1311-5.
[5]Ma Y,Zhang P,Yang Y,et al.Metabolomics in the elds of oncology:a review of recent research[J].Mol Biol Rep,2012,39:7505-11.
[6]甘靜,謝志軍,陳娟,等.青蒿-鱉甲藥對配伍對MRL/lpr狼瘡小鼠IL-6、IFN-γ分泌及狼瘡性腎炎病理改變的影響[J].江西中醫(yī)藥大學學報,2015,27(4):69-71.
[6]Gan J,Xie Z J,Chen J,et al.Effects of Qinghao-Biejia group on the production of IL-6,IFN-γ and pathologic change of lupus nephritis in MRL/lpr mice[J].J Jiangxi Univ Tradit Chin Med,2015,27(4):69-71.
[7] 張璠璠,王宇光,梁乾德,等.基于UPLC-TOF-MS研究冰片對丹參酮ⅡA在大鼠體內(nèi)藥代動力學的影響[J].中國藥理學通報,2014,30(6):862-6.
[7]Zhang F F,Wang Y G,Liang Q D,et al.UPLC-TOF-MS based profiling approach in evaluation of effect of borneol on pharmacokinetics of Tanshinone IIA in mice[J].Chin Pharmacol Bull,2014,30(6):862-6.
[8] 胡金波,谷恒存,丁興紅,等.基于HPLC-Q-TOF/MS的代謝組學方法用于解毒祛瘀滋陰方對系統(tǒng)性紅斑狼瘡干預作用的研究[J].中國中藥雜志,2013,38(21):3747-52.
[8]Hu J B,Gu H C,Ding X H,et al.Study on intervention effect of Jieduquyuziyinprescriptionsystemiclupuserythematosusby HPLC-Q-TOF/MS[J].China J Chin Mater Med,2013,38(21):3747-52.
[9]李翠奇,陳服文,饒漢珍.SLE患者血清過氧化脂質(zhì)和維生素E與磷脂酶A2活性的檢測[J].中華皮膚科雜志,2000,33 (2):125.
[9]Li C Q,Chen F W,Rao H Z.Detection of serum lipid peroxide and vitamin E and phospholipase A2 activity in SLE patients[J]. Chin J Dermatol,2000,33(2):125.
[10] Pruzangki W,Vadas P.Phospholipase A2-a mediator between proximal and distal effectors of inflammation[J].Immunol Today,1991,12(5):143-6.
[11]毛立群,郭小芹.補體在系統(tǒng)性紅斑狼瘡中的作用[J].國外醫(yī)學內(nèi)科學分冊,2006,33(4):157-9.
[11]Mao L Q,Guo X Q.The role of complement in systemic lupus erythematosus[J].Foreign Med Sci(Sect Intern Med),2006,33 (4):157-9.
[12]張麗明,段姚堯,董小青.Th22細胞及其效應因子IL-22與炎癥性皮膚病關系的研究進展[J].中國藥理學通報,2014,30 (7):905-7.
[12]Zhang L M,Duan Y R,Dong X Q.Research progress of Th22 and IL-22 in inflammatory skin disorders[J].Chin Pharmacol Bull,2014,30(7):905-7.
[13]馬新駿,張愛華,李小亮,等.血小板活化和內(nèi)皮細胞損害對系統(tǒng)性紅斑狼瘡影響的臨床研究[J].血栓與止血學,2013,19 (1):9-11.
[13]Ma X J,Zhang A H,Li X L.The study on the activation of platelet and injury of endothelial cell effects on systemic lupus erythematosus[J].Chin J Thromb Hemo,2013,19(1):9-11.
[14]Kaiser R,Cleveland C M,Criswell L A.Risk and protective factors for thrombosis in systemic lupus erythematosus results from a large multi-ethnic cohort[J].Ann Rheum Dis,2009,68(2):238-41.
[15]徐祖森,蔡華華.系統(tǒng)性紅斑狼瘡患者血漿血小板活化因子水平及其與血漿脂質(zhì)過氧化物水平關系的研究[J].中國麻風皮膚病雜志,2005,21(6):429-31.
[15]Xu Z S,Cai H H.The study of plasma level of platelet activating factor and its relationship with plasma lipid peroxidation in systemic lupus erythematosus[J].China J Lepr Skin Dis,2005,21(6):429-31.
Metabonomic study of traditional Chinese herb pair,
Qinghao-Biejia in treating systemic lupus erythematosus mice
CHEN Juan1,DENG Jun2,ZHOU Jia1,XIE Zhi-jun1,GAN Jing1,WEN Cheng-ping1
(1.College of Basic Medical Science,Zhejiang Chinese Medical University,Hangzhou310053,China;2.Safety Evaluation Research Center,Zhejiang Academy of Medical Sciences,Hangzhou310013,China)
AimsTo study the changes of serum metabolites in systemic lupus erythematosus(SLE)mice (MRL/lpr)by treatment of Qinghao-Biejia and to explore the pathogenesis of SLE and mechanism of drug action.MethodsThe serum samples of control group,SLE model group and Qinghao-Biejia treatment group (low and high dose)were collected,the metabolic profile of samples was analyzed by high performance liquid chromatography-quadrupole-time of flight mass spectrometry system(HPLC-Q-TOF/MS).Software of Mass Hunter and Mass Profiler Professional(MPP)were used to process the data.A supervised mode of partial least squares-discriminant analysis(PLS-DA)was applied to recognize the data pattern.Results There were obvious disorders of lipid metabolism in SLE model.Compared with control group,Qinghao-Biejia treatment group improved lipid metabolism,affected the thrombosis development of SLE;and Qinghao-Biejia treatment group reduced the pathological damage by improving inflammatory acute phase of SLE in mice.ConclusionQinghao-Biejia treatment plays a therapeutic role in repairing the imbalance by multidimensional metabolic pathways in SLE mice.
traditional Chinese herb pair,Qinghao-Biejia;systemic lupus erythematosus;mice;serum;metabonomics;high performance liquid chromatography coupled with Q-TOF/MS
10.3969/j.issn.1001-1978.2016.05.026
A
1001-1978(2016)05-0727-06
R-332;R282.74;R289.1;R344;R364.5;R446.11;R593.241.053.1
2016-01-08,
2016-02-06
國家公益性行業(yè)科研專項(No 2015468001);國家自然科學基金資助項目(No 81373633,81273680);浙江省重大科技專項(No 2014C03062-1);浙江省科技廳公益性應用研究計劃項目(No 2013C37100)
陳娟(1984-),女,博士,講師,研究方向:中西醫(yī)藥理學,中醫(yī)藥系統(tǒng)生物學,E-mail:mytw_00@163.com;溫成平(1972-),男,博士,教授,博士生導師,研究方向:中醫(yī)防治風濕性免疫疾病,通訊作者,E-mail:wengcp@ 163.com

