糖皮質激素在抑郁模型大鼠中對海馬BDNF基因選擇性剪切的影響*
薛楠陳建鳴張宇李建國張策
論著
糖皮質激素在抑郁模型大鼠中對海馬BDNF基因選擇性剪切的影響*
薛楠①陳建鳴①張宇①李建國①張策①
目的:探討糖皮質激素在抑郁模型大鼠中對海馬腦源性神經營養因子(BDNF)基因選擇性剪切的影響,為抑郁癥的病因學研究和治療提供理論基礎。方法:選取SD雄性大鼠30只,隨機分為對照組、高劑量組及低劑量組,每組10只,適應性飼養5 d,各組大鼠給藥前均進行強迫游泳試驗和敞箱試驗。高低劑量組分別口服皮質酮(CORT)100 μg/mL和25 μg/mL 21 d,從第15天起CORT濃度降為原來的50%,第18天起降為原來的25%,對照組口服2.4%酒精溶液21 d。21 d后,各組大鼠均再次進行強迫游泳試驗和敞箱試驗,每周進行體重測量,之后在高低劑量組中選取其中一組制備成功的抑郁大鼠作為模型組,大鼠斷頭后提取海馬組織進行分區,使用聚合酶鏈反應(PCR)對海馬各區BDNF mRNA進行檢測。結果:給藥后,高低劑量組漂浮時間均較給藥前增加,比較差異均有統計學意義(P<0.05);給藥后,高低劑量組運動總距離、站立次數及中心時間均較給藥前降低,比較差異均有統計學意義(P<0.05);高劑量組體重增長值始終低于對照組,低劑量組前2周與對照組比較無明顯差異,但第3周體重增長值減小,明顯低于對照組,比較差異有統計學意義(P<0.05);除BDNF mRNAⅥCA1區和BDNF mRNAⅧ CA3區外,BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ,BDNF mRNAⅧ的轉錄表達量模型組均較對照組降低。結論:連續口服糖皮質激素可以制備出理想的大鼠抑郁癥模型,抑郁大鼠海馬區BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ和BDNF mRNAⅧ的轉錄量降低。
抑郁癥; 糖皮質激素; 腦源性神經營養因子; 選擇性剪切
First-author's address:Shanxi Medical University,Taiyuan 030001,China
抑郁癥(major depressive disorder,MDD)是一種以情緒低落、快感缺失、焦慮、思維遲緩和食欲體重下降等為特點的精神疾病[1]。目前臨床認為,抑郁癥主要由周圍生活中應激性事件的刺激,致使體內糖皮質激素持續增多,大腦中情緒相關回路中神經遞質失衡引起[3]。本文采取慢性口服糖皮質激素的方式制備大鼠抑郁模型。
腦源性神經營養因子(BDNF)在海馬腦區廣泛分布,對神經元的再生與修復起著重要作用,抑郁會導致該蛋白表達降低[4-5]。因此,當抑郁發生時,BDNF的基因轉錄表達非常重要。BDNF基因包含多個不同的啟動子控制著不同的非編碼區和1個編碼區,不同的非編碼區與編碼區組合形成不同的轉錄本,隨著環境不同或者條件刺激不同,海馬神經元包含不同啟動子的BDNF mRNA表達出現差異,進而影響BDNF蛋白的表達。本文旨在觀察抑郁模型大鼠海馬腦區包含不同啟動子的BDNF mRNA表達的差異,即選擇性剪切的影響,現報道如下。
1 材料與方法
1.1實驗材料 SD雄性大鼠30只,由山西醫科大學動物實驗中心提供;FST-100睡眠剝奪與強迫游泳實驗系統(成都泰盟軟件有限公司),OFT-100開場活動實驗箱及視頻分析系統(成都泰盟軟件有限公司),Corticosterone(皮質甾酮)Aladdin industrial corporation,GE9612T-S基因擴增儀(杭州柏恒科技有限公司),LineGene 9640熒光定量PCR儀(杭州博日科技有限公司),總RNA抽提純化試劑盒(上海生工生物工程股份有限公司),Real Time PCR反轉錄試劑盒(TAKARA),實時熒光定量PCR反應試劑盒(TAKARA),PCR引物均由Invitrogen(上海)有限公司合成。
1.2實驗方法 將30只大鼠隨機分為對照組、高劑量組及低劑量組,每組10只,隨機分于15籠,稱取體重,2只/籠。所有大鼠均置于12 h晝夜循環的條件下自由攝食飲水,適應性飼養5 d。各組大鼠給藥前均進行強迫游泳試驗和敞箱試驗。高低劑量組分別口服皮質酮(CORT)100 μg/mL 和25 μg/mL 21 d,從第15天起CORT濃度降為原來的50%,第18天起降為原來的25%,對照組口服2.4%酒精溶液21 d。21 d后,各組大鼠均再次進行強迫游泳試驗和敞箱試驗,每周進行體重測量,之后在高低劑量組中選取其中一組制備成功的抑郁模型大鼠,對該組大鼠進行斷頭快速提取海馬組織進行分區,使用聚合酶鏈反應(PCR)對海馬各區BDNF mRNA進行檢測。
1.3配藥方法 (1)高劑量組(100 μg/mL):稱取CORT 60 mg,溶于14.4 mL 100%純酒精,混勻后,用飲用水稀釋至2.4%;(2)低劑量組(25 μg/mL):稱取15 mg CORT粉末,溶于14.4 mL 100%純酒精,混勻后,用飲用水稀釋至2.4%;對照組:量取14.4 mL 100%純酒精,用飲用水稀釋至2.4%[6]。將各組配好的600 mL溶液分別置于5個水瓶(120 mL/瓶),于每日上午9時給予大鼠口服,共21 d。
1.4評價指標
1.4.1強迫游泳實驗 強迫游泳裝置尺寸直徑20 cm、高50 cm,置于安靜的房間。裝置內水深度為35 cm,水溫23~25 ℃。將大鼠單獨放入游泳裝置,觀察記錄5min內的不動時間,全過程使用攝像頭記錄。游泳期間,主要觀察實驗鼠在水中的掙扎和漂浮行為,掙扎:大鼠的四肢激烈運動,并同時伴隨前肢伸出水面;漂浮:大鼠四肢沒有運動或僅有后肢輕微的運動而漂浮在水面上。采用大鼠的不動時間作為抑郁嚴重程度的評價指標。
1.4.2敞箱實驗 時間安排在上午進行,以減少晝夜節律導致的誤差。實驗在安靜環境下進行,將動物放在箱底中心,觀察5 min內大鼠后肢站立次數、水平運動總距離,在四周與中心所待的時間。水平活動反映動物的活動度,一定程度上反映動物的探究行為,直立活動反映動物對新異環境探究程度。1.4.3 熒光定量PCR 經過口服高低劑量皮質酮均可以制備出較為理想的抑郁大鼠模型,因此,最終選取高劑量組作為抑郁模型組進行斷頭快速提取海馬組織且進行分區。Total RNA的提取:稱取分區后的大鼠海馬組織25 mg左右在液氮中研磨成粉末,加入450 μL Buffer Rlysis-AG,放置2 min,將液體全部轉移至收集管中,震蕩2 min,放置3 min。12 000 rpm 4 ℃離心3 min,將上清移至離心管中。加入1/2體積的無水乙醇,混勻。將溶液轉移至吸附柱中,放置1 min,室溫12 000 rpm 離心1 min,離心完畢后,倒掉收集管中廢液,加入500 μL GT Solution,靜 置1 min,室 溫10 000 rpm離心1 min,加入500 μL NT Solution,靜置2 min,室溫10 000 rpm 離心1 min,將吸附柱放回收集管中,室溫12 000 rpm 離心2 min。將吸附柱放入RNase-free的1.5 mL離心管中,在吸附膜中央加入20 μL DEPC-treated水,靜置2 min,室溫12 000 rpm 離心2 min,最后將所得到的RNA溶液進行反轉錄。以反轉錄得到的cDNA為模板,大鼠Actin為內參,使用SYBR Premix Ex TaqⅡ試劑盒,用熒光定量PCR儀進行Real Time PCR反應操作,反應結束后,Ct值可自動生成,熒光定量采用相對定量法,目的基因的相對表達量采用2-△△Ct法進行計算。檢測高劑量的模型組和對照組大鼠海馬各區BDNF不同mRNA轉錄本的表達。
1.5統計學處理 采用SPSS 13.0 統計學軟件對數據進行統計分析,計量資料用()表示,兩兩比較采用SNK法,自身給藥前后數據比較采用配對t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1各組強迫游泳實驗比較 高劑量組給藥前后漂浮時間分別為(167.63±7.46)s和(237.19±8.62)s,低劑量組給藥前后漂浮時間分別為(177.12±7.55)s和(235.18±9.33)s,對照組給藥前后漂浮時間分別為(178.86±8.23)s和(178.38±5.86)s,給藥后,高低劑量組漂浮時間均較給藥前增加,比較差異均有統計學意義(P<0.05),見圖1。

圖1 各組強迫游泳實驗比較
2.2各組敞箱實驗比較 給藥后,高低劑量組運動總距離、站立次數及中心時間均較給藥前降低,比較差異均有統計學意義(P<0.05),見表1和圖2。
表1 各組敞箱實驗比較()

表1 各組敞箱實驗比較()
*與給藥前比較,P<0.05
組別 時間 站立次數(次) 運動總距離(mm) 角落時間(s) 中心時間(s)高劑量組(n=10) 給藥前 36.60±2.91 21 949±380.32 225.56±2.19 5.60±0.80給藥后 5.90±0.91* 2405±116.87* 289.48±5.84* 0.16±0.92*低劑量組(n=10) 給藥前 33.50±3.00 20 466±1300.57 226.81±6.46 5.85±0.68給藥后 16.90±1.94* 14 940±1758.65* 266.71±6.14* 0.37±0.19*對照組(n=10) 給藥前 31.71±1.62 21 015±409.04 233.75±5.09 4.96±0.72給藥后 32.57±1.58 20 138±755.94 224.31±4.38 5.88±0.84

圖2 各組敞箱實驗比較
2.3大鼠體重變化比較 高劑量組體重增長值始終低于對照組,低劑量組前2周與對照組比較無明顯差異,但第3周體重增長值減小,明顯低于對照組,比較差異有統計學意義(P<0.05),見表2和圖3。
表2 大鼠體重變化比較(g

表2 大鼠體重變化比較(g
*與對照組比較,P<0.05
組別 第1周 第2周 第3周高劑量組(n=10) 2 9.9±4.0* 29.5±5.73* 13.41±3.07*低劑量組(n=10) 49.1±4.1 50.0±3.96 16.38±3.17*對照組(n=10) 50.04±5.09 50.01±3.22 30.78±1.98
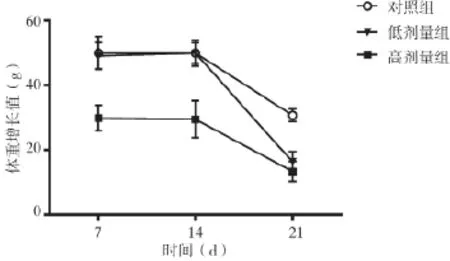
圖3 大鼠體重變化比較
2.4各組BDNF mRNA轉錄本表達量比較 除BDNF mRNAⅥ CA1區和BDNF mRNAⅧ CA3區外,BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ,BDNF mRNAⅧ的轉錄表達量模型組均較對照組降低,見表3和圖4。
表3 各組BDNF mRNA轉錄本表達量比較()

表3 各組BDNF mRNA轉錄本表達量比較()
*與對照組比較,P<0.05
?

續表3


圖4 各組BDNF mRNA比較
3 討論
在上述實驗中,高低劑量組大鼠均出現抑郁樣表現。敞箱實驗中大鼠在角落時間增加,水平運動距離縮短,站立次數降低,這都反應出模型組大鼠的焦慮程度增高。在強迫游泳實驗中,大鼠的漂浮時間增加,表現出絕望和無助,同時體重增長緩慢。這些表現均與抑郁癥狀相同,表明本實驗中抑郁模型是成功的。
大鼠海馬腦區BDNF與TrkB受體結合后可啟動細胞內信號轉導途徑如磷酸脂酶Cr(PLC)、Ras-MAPK激酶途徑、PI3激酶途徑等,從而產生相應分子對神經元起保護、促進再生作用[7-10]。慢性口服糖皮質激素導致抑郁發生時,整個通路發生改變導致BDNF表達減少,海馬神經元萎縮受損,尤其是DG區神經元數目減少,整個情緒神經網絡發生變化,最終影響情緒精神。由于BDNF基因的表達發生變化,導致調控蛋白水平的改變。BDNF基因由不同啟動子控制著不同的非編碼區,而不同的非編碼區與編碼區組合形成不同的異構體。在成年大鼠,包含外顯子Ⅳ、Ⅴ、Ⅵ和Ⅷ的mRNA在全身分布廣泛,包含外顯子Ⅰ、Ⅱ和Ⅲ的mRNA主要在神經系統表達,包含外顯子Ⅶ,ⅨA的mRNA主要在海馬腦區表達。在大鼠CA3區和齒狀回的神經元,包含外顯子Ⅰ和Ⅱ的mRNA表達比CA1區的強烈,情境學習可以增強小鼠CA1區包含外顯子Ⅰ和Ⅵ的BDNFmRNA表達,恐懼刺激主要引起包含外顯子Ⅳ的mRNA表達[11-12]。在海馬中,齒狀回DG區神經元增殖最快,不斷更新,新生神經元替代發揮成熟神經元的作用,而CA1與CA3區則不同,神經元數量及新生能力明顯低于DG區[11]。BDNF的表達受多種因素影響,在細胞內,cAMP激活蛋白激酶,并將CREB磷酸化上調cAMP-CREB通路[13]。增加海馬BDNF mRNA轉錄表達,BDNF蛋白的合成[8,10]。但是,糖皮質激素長期作用,致使BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ,BDNF mRNAⅧ的轉錄表達量明顯降低。BDNF蛋白的表達量隨之降低[14-17]。
表觀遺傳對基因的轉錄表達同樣有重要的影響,常見的表觀遺傳機制包括DNA甲基化、組蛋白修飾及RNA介導基因轉錄等,它們彼此相互作用,通過控制基因表達的時間和空間特異性精確地調節著基因組功能[18]。在多種形式中,組蛋白的共價修飾占有重要地位,乙酰化、甲基化、磷酸化、泛素化和SUMO化等修飾與基因的表達調控密切關聯。特定DNA位點或區域各種組蛋白修飾方式共同構成了“組蛋白密碼”,具有調控相關基因轉錄活化或抑制的功能[19]。組蛋白乙酰化能選擇性開放某些基因的轉錄,增強其表達水平。而組蛋白甲基化既可抑制也可增強基因表達[20]。
本文通過強迫游泳實驗、敞箱實驗研究發現,連續口服糖皮質激素導致抑郁發生后,大鼠海馬腦區BDNF mRNA的選擇性剪切變化,即BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ,BDNF mRNAⅧ的轉錄表達量明顯降低。這一變化也可能由于表觀遺傳對BDNF基因的修飾影響所導致,這還需要更深入的研究。
[1] Willner P,Scheel-Kruger J,Belzung C.The neurobiology of depression and antidepressant action[J].Neurosci Biobehav Rev,2013,37(10Pt1):2331-2371.
[2] Kupfer D J,Frank E,Phillips M L.Major depressive disorder:new clinical, neurobiological,and treatment perspectives[J]. Lancet,2012,379(9820):1045-1055.
[3] Saaltink D J,Vreugdenhil E.Stress,glucocorticoid receptors,and adult neurogenesis:a balance between excitation and inhibition[J].Cell Mol Life Sci,2014,71(13):2499-2515.
[4] Duman C H.Models of depression[J].Vitam Horm,2010,67 (82):1-21.
[5]毛慶秋,黃真.抗抑郁藥與抑郁動物模型[J].國際精神病學雜志,2005,31(4):216-219.
[6] Al-Gelban K S,Al-Amri H S,Mostafa O A.Prevalence of depression,anxiety and stress as measured by the depression, anxiety,and stress scale (DASS-42) among secondary school girls in Abha,Saudi Arabia[J].Sultan Qaboos Univ Med J,2009,9(2):140-147.
[7] Li Y,Luikart B W,Birnbaum S,et al.TrkB regulates hippocampal neurogenesis and governs sensitivity to antidepressive treatment[J].Neuron,2008,59(3):399-412.
[8]韓羽楠,王振宇.鋅與cAMP/PKA-CREB-BDNF信號通路在抑郁癥發病機制中的相關性[J].解剖科學進展,2013,18 (2):167-170.
[9] De Kloet E R,Vreugdenhil E,Oitzl M S,et al.Brain corticosteroid receptor balance in health and disease[J].Endocr Rev,1998,19(3):269-301.
[10]馬學萍,陳慧彬,安書成.應激抑郁發生中糖皮質激素對BDNF信號通路的影響[J].生命科學,2014,25(8):835-839.
[11] Chapman T R,Barrientos R M,Ahrendsen J T,et al.Aging and infection reduce expression of specific brain-derived neurotrophic factor mRNAs in hippocampus[J].Neurobiol Aging,2012,33(4):e1-14.
[12] Lubin F D,Roth T L,Sweatt J D.Epigenetic regulation of BDNF gene transcription in the consolidation of fear memory[J].J Neurosci,2008,28(42):10 576-10 586.
[13] Herold S,Jagasia R,Merz K,et al.CREB signalling regulates early survival,neuronal gene expression and morphological development in adult subventricular zone neurogenesis[J].Mol Cell Neurosci,2011,46(1):79-88.
[14] Hollenberg S M,Weinberger C,Ong E S,et al.Primary structure and expression of a functional human glucocorticoid receptor cDNA[J].Nature,1985,318(6047):635-641.
[15] Holsboer F.The corticosteroid receptor hypothesis of depression[J].Neuropsychopharmacology,2000,23(5):477-501.
[16] De Kloet E R,Fitzsimons C P,Datson N A,et al.Glucocorticoid signaling and stress-related limbic susceptibility pathway:about receptors,transcription machinery and microRNA[J].Brain Res,2009,8(1293):129-141.
[17] Morsink M C,Steenbergen P J,Vos J B,et al.Acute activation of hippocampal glucocorticoid receptors results in different waves of gene expression throughout time[J].J Neuroendocrinol,2006,18(4):239-252.
[18] Graff J,Kim D,Dobbin M M,et al.Epigenetic regulation of gene expression in physiological and pathological brain processes[J].Physiol Rev,2011,91(2):603-649.
[19] Jenuwein T,Allis C D.Translating the histone code[J].Science,2001,293(5532):1074-1080.
[20] Peserico A,Simone C.Physical and functional HAT/HDAC interplay regulates protein acetylation balance[J].J Biomed Biotechnol,2011,1(2011):20-34.
Effects of Glucocorticoids on the Selective Shear of BDNF Gene in the Hippocampus of Rats with Depression
XUE Nan,C
HEN Jian-ming,ZHANG Yu,et al.//Medical Innovation of China,2016,13 (14):001-006
Objective:To explore the effect of glucocorticoid on the brain-derived neurotrophic factor (BDNF) gene in hippocampus of depression model rats,and to provide the theoretical basis for the etiology and treatment of depression.Method:A total of 30 male SD rats were randomly divided into the control group,high dose group and low dose group,each group had 10 rats,they were fed 5 d adaptive,the forced swimming test and open-field test were performed before administration in each group.The high and low dose group were respectively treated with oral corticosterone (CORT) 100 μg/mL and 25 μg/mL for 21 d,CORT concentration reduced to 50% of the original from 15 days,and it down to the original 25% from 18 days,the control group was treated with oral administration of 2.4% alcohol solution for 21 d. After 21 d,rats in each group were again carried on forced swimming test and exposure test and measured weight weekly,after this,for the high and low dose group,one group was selected to prepare a successful model of depression in rats and was selected as the model group. Hippocampal tissue were extracted partition,BDNF mRNA in hippocampal area were detected by using polymerase chain reaction (PCR).Result:After administration,the floating time of the high and low dose group were higher than before administration,the differences were statistically significant(P<0.05).After administration,the total movement distance,stand times,central time in high and low dose group were lower than those beforeadministration,the differences were statistically significant(P<0.05).The body weight gain in high dose group was lower than the control group,there was no significant difference between the low dose group and the control group in the first 2 weeks,but weight gain was significantly lower than the control group at 3 week,the difference was statistically significant(P<0.05).In addition to the BDNF mRNAⅥ CA1 area and BDNF mRNAⅧ CA3 area,the transcriptional expression amount of model group in BDNF mRNAⅡa area,BDNF mRNAⅢ area,BDNF mRNAⅥ area and BDNF mRNAⅦ area were lower than those in the control group,the differences were statistically significant(P<0.05).Conclusion:Continuous oral administration of glucocorticoids can produce an ideal rat model of depression.The transcription of BDNF mRNAⅡa,BDNF mRNAⅢ,BDNF mRNAⅥ,BDNF mRNAⅦ and BDNF mRNAⅧ reduced in the decreased rats hippocampal area.
Depression; Glucocorticoid; Brain-derived neurotrophic factor (BDNF); Alternative splicing
國家自然科學基金資助項目(81371254)
①山西醫科大學 山西 太原 030001
李建國
10.3969/j.issn.1674-4985.2016.14.001
2016-03-14) (本文編輯:李穎)

