一株耐高溫纖維素酶產生菌的分離和鑒定
任世英, 邵 奎, 李 雯, 張 威, 劉 飛
1. 淮陰工學院生命科學與食品工程學院, 江蘇 淮安 223003;2. 淮陰工學院化學工程學院, 江蘇 淮安 223003;3. 江蘇省生物質轉化與過程集成工程實驗室, 江蘇 淮安 223003
?
一株耐高溫纖維素酶產生菌的分離和鑒定
任世英1,3,邵奎1,李雯1,張威1,劉飛2*
1. 淮陰工學院生命科學與食品工程學院, 江蘇 淮安 223003;2. 淮陰工學院化學工程學院, 江蘇 淮安 223003;3. 江蘇省生物質轉化與過程集成工程實驗室, 江蘇 淮安 223003
為獲得耐高溫的纖維素酶產生菌,從農田旁稻草堆底取樣,采用液體濾紙條試管法和纖維素剛果紅平板法,分離到6株能夠在45 ℃生長良好且降解纖維素的耐高溫菌株,分別標為A1-A6,其中菌株A1透明圈直徑和菌落直徑比值為4,DNS法測定還原糖濃度較高,確定為實驗菌株。菌體呈短桿狀,G+,易褪色,具有運動性,過氧化氫酶、淀粉水解、明膠液化、甲基紅試驗、硫化氫、葡萄糖氧化發酵、PHB類脂粒、異染粒、纖維素分解、反硝化試驗呈陽性,乙酰甲基甲醇試驗、吲哚試驗、硝酸鹽還原試驗、卵磷脂酶實驗呈陰性,以FPA酶活為主,羧甲基纖維素酶活為輔。根據細菌形態、生理生化特征,參照《伯杰氏細菌系統鑒定手冊》初步鑒定為纖維單胞菌屬,即Cellulomonas。
纖維素酶產生菌; 纖維素; 耐高溫; 纖維單胞菌屬
纖維素是地球上最豐富的有機物質,是木材、紙張、棉、麻和農副產品的主要成份,是人類最經濟、最廣泛的自然資源[1,2]。纖維素酶(cellulase)又稱纖維素酶系,是一類復雜的復合物,是所有參與降解纖維素并將其最終轉化為葡萄糖的各種酶的總稱[3]。纖維素酶最初是在蝸牛的消化液中發現的,除了已知的許多微生物能分泌纖維素酶外,一些高等動植物也能分泌[4]。微生物產纖維素酶研究較多,已發現許多真菌和細菌都能分解利用纖維素,目前用于研究生產纖維素酶的微生物大多屬于真菌,其中研究較多的是木霉屬、曲霉屬、青霉屬、根霉屬和漆斑霉屬。細菌、放線菌由于分泌的纖維素酶活性較低且胞外分泌型較少相對研究不多[5]。
纖維素酶在工業中有很大的實用價值。可催化纖維素水解,成為低聚合度纖維素和葡萄糖。可利用它把纖維素發酵制糖、酒精和食品。用于飼料添加劑,可破解植物細胞壁,提高飼料利用率。在紡織工業中用于牛仔服的生物水洗,代替傳統的石磨工藝;用于棉布的酶減量處理,使織物手感厚實柔軟;用于棉麻織物可除去織物表面的毛羽,使外觀光潔,減少刺癢感;可增大纖維素無定形區,提供良好的染色條件[6,7]。用于中草藥可提高其有效成分的提取。可以提高酒和其他釀造產品的產率。還可用于蔬菜汁或果汁的生產[8]。開發新型的耐高溫纖維素酶產生菌,并揭示其所產酶的催化特性和熱穩定性機制等,具有重要的理論意義和潛在的應用價值。
本文從稻草堆肥中篩選出6株耐高溫纖維素酶產生菌,通過酶活力比較,選定其中1株作為實驗菌株,并對其生長特性、生理生化特性進行研究,最后進行菌種鑒定,為耐高溫纖維素酶產生菌的研究提供新材料,為耐高溫纖維素酶的工業應用提供理論基礎。
1 材料與方法
1.1材料
1.1.1樣品來源
農田旁陳舊性稻草堆底。
1.1.2培養基[6]
剛果紅纖維素培養基(纖維素酶產生菌初篩):KH2PO40.5 g、MgSO40.25 g、瓊脂粉20 g、纖維素粉1.88 g、剛果紅0.20 g、蒸餾水1 000 mL、pH 7.0。
種子培養基:復合蛋白胨10 g、葡萄糖10 g、酵母膏10 g、pH 7.0、蒸餾水1 000 mL,121 ℃滅菌20 min。
液態發酵培養基:稻草4 g、麩皮l g、(NH4)3PO4營養液((NH4)3PO42.06%、MgSO4·7H2O 0.05%、KH2PO40.01%) 200%(V/W))12.5 mL、調pH至6.0~7.0、蒸餾水1 000 mL,121 ℃滅菌20 min。
保藏培養基:羧甲基纖維素鈉(CMC-Na)5 g、蛋白胨5 g、KH2PO41 g、MgSO4·7H2O 0.5 g、酵母粉0.5 g、瓊脂粉20 g、pH自然、蒸餾水1 000 mL,121 ℃滅菌20 min。
濾紙條培養基:于10 mL試管中加入無機鹽溶液5 mL,加1條定量濾紙條(9 cm×1 cm),垂直立于試管中,并使一部分露出液面,加棉塞,于121 ℃滅菌20 min備用。
高氏1號培養基:可溶性淀粉20 g、KNO31 g、NaCl 0.5 g、K2HPO40.5 g、MgSO40.5 g、FeSO40.01 g、瓊脂20 g、水1 000 mL、pH 7.2~7.4,于121 ℃滅菌20 min。
1.2方法
1.2.1耐高溫纖維素酶產生菌株的篩選
1.2.1.1菌株的初篩
將采集的含菌樣品放入三角瓶,加入50 mL無菌水和少量無菌玻璃珠,振蕩混勻后靜置,吸取上清液進行10-1、10-2、10-3、10-4、10-5和10-6梯度稀釋,取10-5和10-6稀釋液各100 μL涂布于剛果紅纖維素培養基平板,45 ℃恒溫培養2 d,挑取透明圈明顯的菌落,再于平板上劃線分離,重復3次,挑單菌落接種于濾紙條培養基,45 ℃恒溫培養2 d,選出透明圈直徑與菌落直徑比值大的菌株進行復篩。
1.2.1.2菌株的復篩
將初篩得到的單菌落接種于種子培養基,測定發酵液中還原糖含量,將還原糖濃度高的菌株接種于液態發酵培養基,三個平行,45 ℃,130 r/min,搖床振蕩培養48 h,測定粗酶液的CMC酶活力和濾紙酶活力,選擇CMC酶活力和濾紙酶活力較高的菌株為實驗菌株。
1.2.2酶活測定[8]
1.2.2.1葡萄糖標準曲線的繪制
原理:3,5-二硝基水楊酸(DNS)與還原糖共熱后被還原成棕紅色的氨基化合物,在一定范圍內還原糖的量和反應液的強度成比例關系,利用分光光度計測出其在540 nm處的吸光度,得出還原糖的量。
葡萄糖標準溶液的配制:將葡萄糖置于110 ℃烘箱中烘2 h至恒重,稱取0.108 g,溶解并定容至100 mL。
取14支具塞試管,依次編號為0,1,2,3,4,5和6并作平行實驗。由于反應體系總體積不同,所以需作不同標準曲線,所加的量也有所不同,現以總體積為9 mL體系為例:
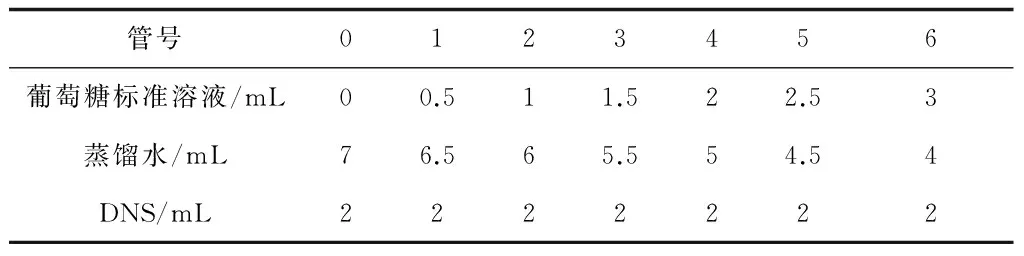
表1 葡萄糖標準曲線繪制
搖勻后置于沸水浴中加熱5 min,冷卻定容至25 mL,搖勻后以0號管為對照,測定OD540值,以葡萄糖含量(μmol/mL)為橫坐標,OD540值為縱坐標,繪制標準曲線[9]。
1.2.2.2粗酶液制備
將菌種由培養斜面接種到50 mL(裝于250 mL錐形瓶)種子培養基,45 ℃,130 r/min搖床振蕩培養24 h,按2%的接種量加入到100 mL發酵培養基(裝于500 mL錐形瓶),45 ℃,130 r/min搖床振蕩培養48 h,5 000 r/min離心10 min,所得上清液即為粗酶液。
1.2.2.3羧甲基纖維素鈉鹽(CMC-Na)酶活性測定
原理:纖維素酶對CMC-Na有降解能力,生成葡萄糖等還原糖,再用DNS法顯色,用標準葡萄糖溶液作標準液,在540 nm處測其吸光度,以每分鐘生成相當于1 μmol的葡萄糖為一個酶活單位(1 U/mL)[10]。
取3支帶有20 mL刻度的試管,1支管作空白對照,2支管作平行樣品管。每支樣品管中加1 mL粗酶液,置于50 ℃水浴鍋中預熱2 min,然后在3支試管中分別加入4 mL已預熱至50 ℃的底物溶液,反應5 min取出,每管立即分別加入1 mL 2 mol/L氫氧化鈉溶液和2 mL DNS顯色液,搖勻后在對照管中再加入1 mL粗酶液。將3支試管放入沸水浴中,5 min后立即取出,流水冷卻,用蒸餾水定容至20 mL,于540 nm處測OD值。
酶活力計算:從標準曲線中查出葡萄糖μmol數。

其中:5為酶與底物作用時間(min);Ew為粗酶液的體積(mL);U是指在特定條件下,每分鐘催化纖維素水解成1 μmol葡萄糖的酶量[6]。
1.2.2.4濾紙酶活力(FPA)的測定[11]
濾紙是聚合度和結晶度都居“中等”的纖維性材料,以其為底物經纖維素酶水解后生成還原糖的量來表征纖維素酶系總的糖化能力的方法,此方法應用廣泛,它反映了三類酶組分的協同作用,統稱濾紙酶活[10-12]。
取1 mL稀釋10倍的粗酶液,加入l mg濾紙條、1 mL pH 5.0的檸檬酸緩沖溶液于55 ℃保溫60 min,再加入3 mL DNS試劑,于沸水中煮15 min,采用DNS法測定OD540,對查葡萄糖標準曲線,以每分鐘酶液產生1 μmol還原糖所需的酶量為一個酶活單位(1 U/mL)。
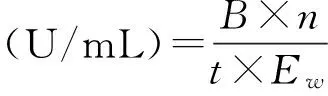
其中:B為從標準曲線中查得的凈葡萄糖量(μmol);n為粗酶液稀釋倍數;Ew為測定時吸取稀釋粗酶液毫升數(mL);t為酶與底物作用時間(min)。
1.2.3生長曲線繪制
發酵培養過程中,每隔2 h取培養液,測定其OD600,繪制生長曲線。
1.2.4菌種鑒定
對分離純化的菌株進行形態觀察和生理生化測試,參照《伯杰氏細菌系統鑒定手冊》第八版及相關文獻,初步對菌株進行鑒定。
2 結果與討論
2.1耐高溫纖維素酶產生菌株的篩選
通過初篩,挑出6株能在纖維素-剛果紅瓊脂培養基上產生明顯透明圈的菌株,標記為A1-A6,透明圈直徑、菌落直徑和其比值見表2,由表2可知A1菌株的透明圈直徑和菌落直徑比最大,一般認為具有較高纖維素酶活性的菌株在平板上能較快地產生較大的透明圈。6株耐高溫纖維素酶產生菌,其菌落特征、細胞形態和革蘭氏染色結果見表3,菌落多為白色、不透明,桿狀居多,全部為革蘭氏陽性菌。通過測定發酵液中還原糖含量(表4)進行復篩,得知菌株A1的酶活力最高,達到0.0914 U/mL。結合其他特征最終確定菌株A1為實驗菌株[13,14]。
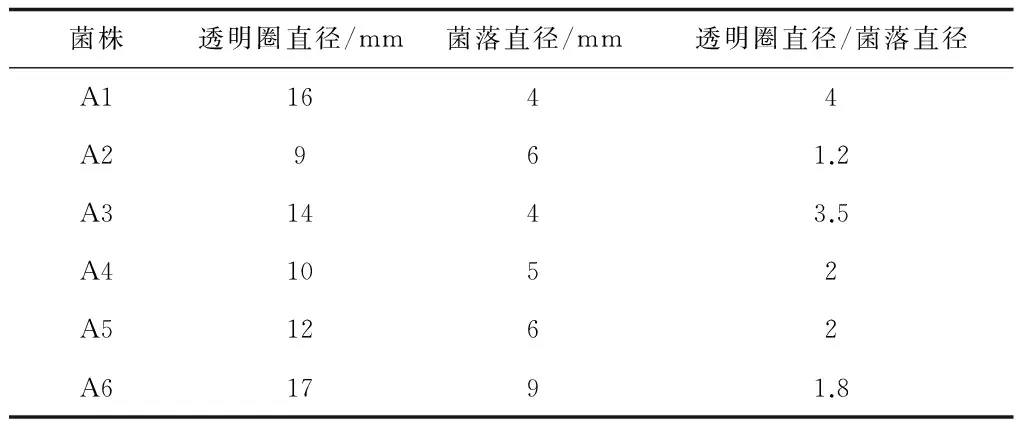
表2 6株耐高溫纖維素酶產生菌透明圈直徑和菌落直徑比

表3 6株耐高溫纖維素酶產生菌的菌落和個體形態特征
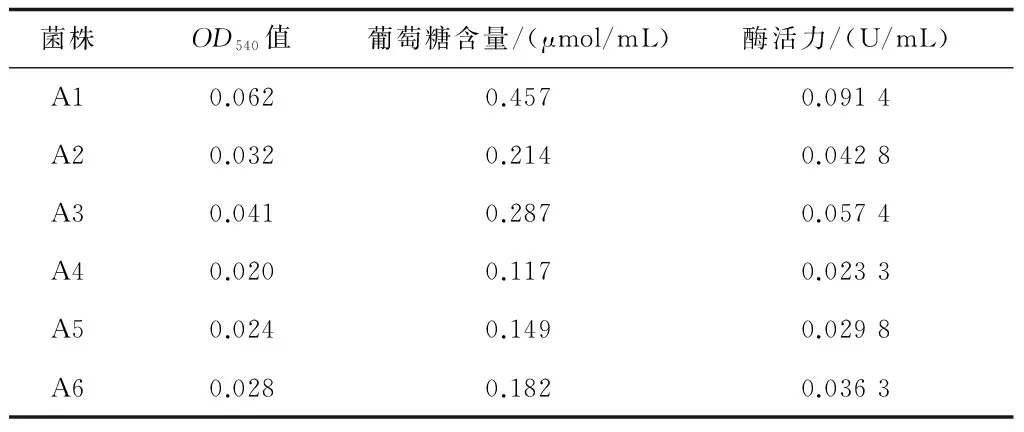
表4 還原糖濃度測定
2.2菌株A1生長曲線
由菌株A1的生長曲線(圖1)可見,0 h ~12 h處于停滯期,12 h ~20 h處于對數生長期,22 h菌株達到最大生長量,OD600約為1.2,隨后進入穩定期,維持較長穩定期,對于纖維素酶的產生有利。
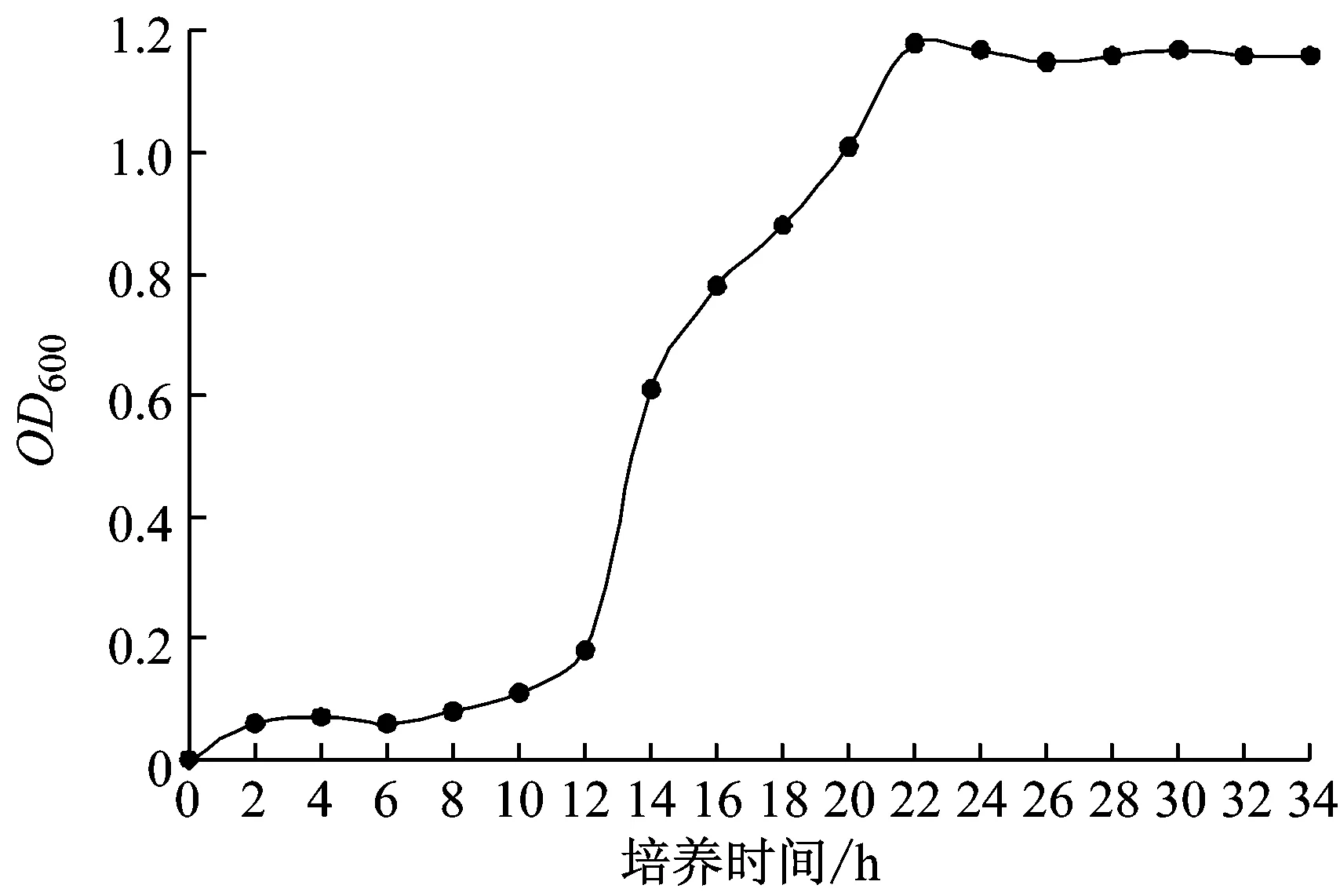
圖1 菌株A1的生長曲線
2.3菌株A1產酶活性測定
2.3.1葡萄糖標準曲線繪制
通過配置一系列不同濃度的葡萄糖標準溶液,利用DNS法對其在540 nm下的吸光度進行測量,繪制標準曲線,得到方程為:y=0.123 4x+0.005 6,R2=0.995,表明OD540和葡萄糖濃度之間呈很好的線性關系,通過該方程可計算出溶液中葡萄糖的濃度。
2.3.2菌株A1產酶活性特點
通過CMC-Na和FPA兩種方法測定菌株A1所產纖維素酶活性(圖2)。在CMC-Na方法中,4 h有酶產生,可測到酶活,24 h酶活達到最高,隨后酶活緩慢下降;FPA方法中,4 h可測到酶活,16 h達到最高,隨后下降,到20 h后幾乎保持不變。FPA法測得酶活比CMC法測得酶活高,因為纖維素酶是由多種酶組成的混合酶系,不同組分的酶相互協同有利于提高纖維素酶的活力,推測A1產生的纖維素酶一般以FPA酶活為主,CMC酶活為輔[15]。
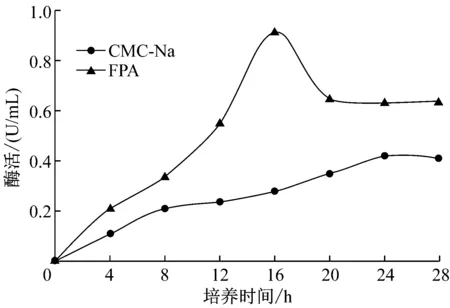
圖2 菌株A1產酶特性
2.4菌種鑒定
2.4.1形態觀察
在高氏1號培養基中插片取樣,經顯微鏡觀察,菌絲呈綠色絲狀分枝。菌株A1在剛果紅纖維素培養基表面氣生菌絲呈白色蔓延,菌落呈灰白色同心圓形、邊緣不整齊、齒狀、表面光滑濕潤、不透明。在高氏1號培養基表面菌株周圍呈黃綠色,菌落背面呈黃褐色。在顯微鏡下菌體呈短桿狀,革蘭氏染色呈陽性,但易褪色。
2.4.2生理生化鑒定
菌株A1的生理生化特性如表5所示。

表5 菌株A1的生理生化特征
注:“+”表示為陽性,“-”表示為陰性
根據菌落及菌體形態,結合生理生化鑒定結果,查閱《伯杰氏細菌系統鑒定手冊》(第八版)將菌株A1初步鑒定為纖維單胞菌屬,即Cellulomonas。
3 結論
細菌纖維素酶產量較低,而且其所產纖維素酶主要為葡聚糖內切酶,大多數對結晶纖維素沒有降解活性,且所產生的酶是胞內酶或吸附在細胞壁上,不分泌到培養液中,增加了提取純化的難度,所以工業上很少采用細菌作為生產菌種[16,17]。但是細菌產生的纖維素酶除了傳統的內切、外切纖維素酶外,還會分泌一種纖維小體到胞外,這種纖維小體由多種纖維素酶和半纖維素酶組成,具有較高的水解纖維素的能力,在纖維素廢棄物的處理上具有很大的應用潛力。
本研究同時采用液體濾紙條試管法和纖維素剛果紅平板法,從稻草堆底篩選到耐高溫纖維素酶產生菌株A1,通過其產酶特點、細菌形態、生理生化特征初步鑒定為纖維單胞菌屬,即Cellulomonas。該屬中的菌為革蘭氏陽性,易褪色。常以一根或少數鞭毛運動。不生孢子,不抗酸。兼性厭氧,有的菌株在厭氧條件下可生長但很差。在蛋白胨-酵母膏瓊脂上的菌落通常凸起,淡黃色。化能異養菌,可呼吸代謝也可發酵代謝。從葡萄糖和其他碳水化合物在好氧和厭氧條件下都產酸。接觸酶陽性。能分解纖維素。還原硝酸鹽到亞硝酸鹽。最適生長溫度30 ℃。廣泛分布于土壤和腐敗的蔬菜[18,19]。模式菌株為產黃纖維單胞菌(Cellulomonasflavigena)。菌株A1的透明圈直徑與菌落直徑比為4,對纖維素有很好的降解能力,能夠在45 ℃環境以上生長,推測它在堆肥的高溫階段分解纖維素等復雜化合物,對堆肥的最終成熟起關鍵作用[20,21]。菌株A1能夠在45 ℃的高溫下生長,同時產生纖維素酶,為其在高溫條件下進行應用提供了可能。可以通過分子生物學手段對其進行鑒定,應用基因工程技術來改造菌種,克隆表達高活性、高穩定性、高產量的纖維素酶也是一個研究的熱點趨勢。
[1]魏志文,趙艷霞,張梅梅等. 1株纖維素分解菌的初步鑒定及酶活檢測[J]. 江蘇農業科學,2010,2010(1):329-331.
[2]劉丹,王紅英,吳星等. 纖維素酶產生菌及其發酵條件優化[J]. 工業微生物,2015,45(4):19-25.
[3]宋俊洲. 大麥芽過程中酶和淀粉特性的研究[學位論文]. 遼寧:大連工業大學,2010.
[4]張強,楊巖. 一株纖維素酶產生菌的篩選鑒定[J]. 四川理工學院學報(自然科學版),2008,21(5):67-70.
[5]陳源源,沈微,石貴陽等. 微生物資源庫中產纖維素酶菌株的篩選及其酶學性質研究[J]. 工業微生物,2011,41(6):15-19.
[6]王亮,尚會建,楊立彥等. 纖維素酶的應用研究進展[J]. 河北工業科技,2010,27(6):22-26.
[7]韓峰,孫彩云,宋小焱等. 擬康氏木霉(Trichodermapseudokoningii)UV Ⅲ纖維素酶合成的誘導與阻遏[J]. 工業微生物,2003,33(1):23-26.
[8]劉國棟. 纖維素酶水解纖維素的方法[學位論文]. 重慶:重慶理工大學,2010.
[9]王開勝. 野油菜黃單胞桿菌纖維素酶基因原核表達及其固定化研究[學位論文]. 上海:上海交通大學,2012.
[10]王冠,徐麗,丁皓等. 飼用纖維素酶檢測方法的研究[J]. 飼料工業,2012,33(6):38-40.
[11]顏霞,柳曉東,楊俊杰. 高溫纖維素酶產生菌的篩選鑒定及其酶性質研究[J].太陽能學報,2011,32(6):35-39.
[12]胡蓉,張姝,吳建偉等. 家蠅纖維素酶的檢測及酶活性與其發育的關系[J]. 應用與環境生物學報,2013,19(3):444-448.
[13]魯雄. 高溫纖維素酶產生菌的篩選鑒定及其酶性質研究[學位論文]. 福建:福建農林大學,2012.
[14]耿冰,郭美錦,張嗣良等. pH控制下綠色木霉(Trichodermaviride)流加發酵生產纖維素酶[J]. 工業微生物,2009,39(4):21-26.
[15]徐楊. 纖維素酶高產菌的誘變選育及其酶學性質的研究[學位論文]. 吉林:吉林農業大學,2011.
[16]張偉,石麗娜,付寧等. 耐高溫纖維素酶產生菌的篩選鑒定及酶譜分析[J]. 湖北農業科學,2012,51(9):12-16.
[17]胡佳俊,朱仁懿,高旻天.Acremonium纖維素酶在玉米芯糖化中的應用[J]. 工業微生物,2015,45(5):1-6.
[18]張楠,楊興明,徐春陽等. 高溫纖維素降解菌的篩選和酶活性測定及鑒定[J].南京農業大學學報,2010,33(3):82-87.
[19]金偉. 耐高溫產纖維素酶真菌的篩選及產酶特性研究[學位論文]. 武漢:武漢工業學院,2012.
[20]張楠,劉東陽,楊興明等. 分解纖維素的高溫真菌篩選及其對煙桿的降解效果[J]. 環境科學學報,2010,30(3):549-555.
[21]Hendrick CW, Doyle JD, Hugley B. A new solid medium for enumerating cellulose utilizing bacteria in soid[J]. Applied and Environmental Microbiology, 1995, 61(5):2016-2019.
Isolation and identification of high temperature resistant bacterium for producing cellulase
REN Shi-ying1, 3, SHAO Kui1, LI Wen1, ZHANG Wei1, LIU Fei2
1. School of Life Science and Food Engineering, Huaiyin Institute of Technology, Huaian 223003, Jiangsu, China; 2. Faculty of Chemical Engineering, Huaiyin Institute of Technology, Huaian 223003, Jiangsu, China; 3. Jiangsu Provincial Engineering Laboratory for Biomass Conversion and Process Integration, Huaiyin Institute of Technology, Huaian 223007, Jiangsu, China
In order to obtain high temperature resistant strains producing cellulase for the application in the high-temperature industrial cellulose degrading field, filter paper disintegration and CMC-Congo red staining were used to initially screen the cellulose-degrading strains at 45 ℃. 6 target strains were isolated from piles of rice straw in farmland and temporarily marked as A1~A6. A1 was chosen as experimental strain owning to its higher ratio with 4 of clear circle diameter to colony diameter and higher reducing sugar concentration, which was short rod, G+and easily fade, motile. Test results such as catalase, amylolysis, gelatin liquefaction, methyl red test, hydrogen sulfide production, glucose fermentation, PHB, metachromatic granule staining, cellulose degradation, denitrification test were positive. Test results such as Voges-Proskauer test, indole test, nitrate reduction test, lecithinase were negative. The enzyme property produced by strain A1 showed its major enzymatic activity was CMC and secondary FPA. According to its enzymatic activity, cell and colony morphology, physiological and biochemical properties, strain A1 was preliminarily classified as genusCellulomonas.
cellulase-producing bacterium; cellulose; high temperature resistant;Cellulomonas
10.3969/j.issn.1001-6678.2016.04.004
國家自然科學基金項目(51308245);江蘇省淮安市科技計劃項目(HAN2015026);江蘇省生物質轉化與過程集成工程實驗室開放課題(JPELBCPL2013004和JPELBCPL2014006)。
任世英(1980~),女,博士。E-mail:rsy1314@163.com。
劉飛,男,博士。E-mail:hyitliu@163.com。

