丙氨酰谷氨酰胺對體外培養人頰黏膜成纖維細胞生物活性的影響研究*
車坷科,劉 鑫,卿尚蘭,張熙承
(重慶市人民醫院:1.藥學部;2.口腔科 400014)
?
丙氨酰谷氨酰胺對體外培養人頰黏膜成纖維細胞生物活性的影響研究*
車坷科1,劉鑫2△,卿尚蘭2,張熙承2
(重慶市人民醫院:1.藥學部;2.口腔科400014)
目的研究丙氨酰谷氨酰胺(Ala-Gln)溶液對體外培養的人頰黏膜成纖維細胞的生長、蛋白合成和堿性磷酸酶(ALP)活性的影響。方法實驗分為對照組(N組)、Ala-Gln組(A組)和Gln組(G組),A、G組各設推薦濃度的8、4、2、1、1/2、1/4和1/8倍7個梯度濃度,在體外培養的人頰黏膜成纖維細胞中分別加入上述各組溶液。培養至12、24、36、48、60和72 h,用流式細胞儀計數細胞并繪制細胞生長曲線;用酶聯免疫檢測對應時段各自ALP水平,72 h時檢測各組細胞蛋白水平。結果N組在72 h內細胞數量并未明顯變化,ALP水平隨著時間推移有所增加,但變化幅度小于A、G組(P<0.05);A、G組在24 h以內都能明顯促進細胞生長,ALP的水平也明顯提高(P<0.05),且以1/2倍推薦濃度組最為顯著;各藥物濃度組細胞蛋白水平均高于N組(P<0.05)。結論Ala-Gln能促進頰黏膜成纖維細胞生長,濃度過高或過低可影響細胞持續生長,以1/2倍推薦濃度(即Ala-Gln濃度為16.5 mg/mL)時細胞生長情況最好。
口腔黏膜;成纖維細胞;堿性磷酸酶;丙氨酰谷氨酰胺;細胞生長
口腔復發性阿弗他潰瘍(recurrent aphthous ulcer,RAU)是最常見的口腔黏膜病,是以口腔黏膜自發性、復發性潰瘍為特點的一種疾病,普通人群的發病率為20%左右;RAU的局部治療目前以消炎、止痛、防止繼發感染、促進愈合為原則[1]。谷氨酰胺(Glutamine,Gln)是免疫細胞及成纖維細胞等快速增殖細胞的主要能量來源[2],除了具有增加葡萄糖胺、氨基己糖、黏蛋白的生物合成和促進潰瘍組織再生等生物活性外,還具有有效調節免疫應答、改善機體代謝狀況、提高機體抗氧化能力等藥理作用[3-4]。由于Gln在水溶液中溶解度低且不穩定[5],目前臨床使用具有化學穩定性好、水溶性強、能耐受高溫消毒等優點的丙氨酰谷氨酰胺(Ala-Gln)為Gln的供體,通過在細胞外發生的水解,為機體提供穩定的Gln[6]。本文就Ala-Gln對體外培養的人頰黏膜成纖維細胞(fibroblast)的生長、蛋白合成和堿性磷酸酶(alkaline phosphatase,ALP)活性進行研究,并與對應含量的Gln進行對比,以期為Ala-Gln治療RAU的臨床研究及應用提供理論依據。
1 材料與方法
1.1材料
1.1.1細胞來源標本采自重慶市人民醫院口腔科在頰黏膜取送活檢的組織中的正常組織,均征得患者本人及其家屬同意并簽署知情同意書。
1.1.2主要試劑和儀器Ala-Gln(重慶萊美藥業股份有限公司,批號F151210),Gln(武漢千潤生物工程有限公司贈送,批號140618),D-Hanks緩沖液(自配,含100 U/mL青霉素,100 μg/mL鏈霉素);DMEM 培養基、RPMI-1640培養液、胰蛋白酶、優等胎牛血清(FBS)和Ⅰ型膠原酶(美國Gibco公司);二甲基亞砜(DMSO,美國MPBIO公司);四甲基偶氮唑鹽(MTT,美國Amresco公司);二氧化碳細胞恒溫培養箱(美國Forma Scientic公司);CKC-TR-2W型倒置顯微鏡(日本Olympus公司);酶聯免疫檢測儀(芬蘭Labsystems dragon MK3公司);YJ-875型超凈化工作臺(蘇州凈化設備廠);96孔培養板(北京中杉金橋生物技術有限公司);波形絲蛋白、角蛋白一抗及即用型SABC試劑盒(武漢博士德生物工程有限公司);二喹啉甲酸(BCA)蛋白濃度測定試劑盒(上海美季生物有限公司);堿性磷酸酶試劑盒(南京建成生物公司)。
1.2方法
1.2.1人頰黏膜成纖維細胞的原代培養、分離純化及鑒定[7-8]無菌條件下取出頰黏膜組織,剔除壞死組織及血漬,磷酸鹽緩沖液(PBS)沖洗3次,青霉素、鏈霉素浸泡0.5 min,PBS沖洗2次,剪成約0.5 mm×0.5 mm,加入0.25%胰蛋白酶37 ℃孵箱消化30 min,加入0.2% Ⅰ型膠原酶振蕩消化30~60 min,至組織完全溶解,用含10% FBS的DMEM等體積中和,200目過濾,1 000 r/min離心5 min,棄去上清,用含15% FBS的DMEM培養基重懸細胞,接種至25 cm2培養瓶。于 37 ℃ 5% CO2飽和溫度培養箱中培養。48 h后去除未貼壁細胞。此后每72小時換液1次,倒置顯微鏡下觀察細胞形態,用機械刮出法及酶消化法去除成纖維細胞,細胞達到80%~90%匯合時,用0.25%的胰酶消化,按(4~6)×103/cm2傳代。取第3代對數生長期成纖維細胞,用SABC法進行波形蛋白、角蛋白免疫組織化學染色,鑒定細胞來源。
1.2.2實驗分組及處理根據加藥情況,將加入Ala-Gln溶液的定為A組;加入Gln溶液的定為G組;含20% FBS的RPMI-1640培養基培養細胞作為對照,定為N組。根據Ala-Gln產品使用說明書中的推薦濃度,結合預實驗結果,將Ala-Gln溶液的基礎濃度定為33 mg/mL,折算Gln溶液的基礎濃度為22 mg/mL,然后按加入溶質的量共設立8、4、2、1、1/2、1/4和1/8倍7個濃度梯度組,分別用A8、A4、A2、A1、A1/2、A1/4、A1/8和G8、G4、G2、G1、G1/2、G1/4、G1/8表示。
Gln溶液的配制方法:按照上述濃度梯度的設置,稱取Gln原料藥適量,溶于滅菌PBS(pH 7.4)中,超聲助溶,配制好的儲備液于0 ℃冰箱中儲存。Ala-Gln溶液的配制方法同Gln。
1.2.3細胞生長情況的檢測取第5代傳代的成纖維細胞,胰蛋白酶消化貼壁培養的細胞,終止消化后添加15% FBS培養基,用移液管反復輕輕吹打成單細胞懸浮液,按1∶3的接種比例傳代培養。將長好的貼壁細胞消化后,以細胞密度為0.75×106/mL轉入搖瓶進行擴大培養。待細胞形態良好,以每瓶100 mL培養基均勻接入250 mL三角瓶中(接種密度為1.0×106/mL),按照1.2.2項的分組情況加入對應濃度的溶液,置于37 ℃培養箱內培養。每隔12 h取樣,流式細胞儀計數細胞,并將本實驗重復進行3次。
1.2.4細胞蛋白水平檢測細胞以1×105/mL 的密度接種于96孔板,每孔1.0 mL。血清饑餓12 h后,各濃度組加入96孔板中,每種濃度加6孔;對照組加含0.5% FBS的DMEM。96孔板置于CO2培養箱中培養72 h后,棄去孔內液體,用pH 7.4的PBS沖洗3次,吸干,每孔加入150 μL 0.5% Trton X-100裂解過夜后,取200 μL裂解液按蛋白濃度試劑盒說明用酶聯免疫檢測儀于450 nm波長測吸光度值,根據標準曲線將吸光度值換算成蛋白水平(μg/mL)。
1.2.5細胞ALP活性檢測取第5代頰黏膜成纖維細胞,以1×105/mL的細胞濃度接種于96孔培養板,10% DMEM培養基共培養4 d,棄孔內液體,加入Triton X-100,4 ℃過夜,進行如下實驗:在12、24、36、48、60和72 h時,取上述各孔液體及空白對照的蒸餾水一并轉入另一個96孔板。按ALP試劑盒說明依次按比例加入緩沖液、基質液,水浴,加入對硝基苯磷酸二鈉(PNPP)顯色劑后在酶聯免疫檢測儀上于405 nm波長下測吸光度值,間接反映細胞ALP活性。根據標準曲線將吸光度值換算成ALP水平(U/mgprot),并將ALP用蛋白水平進行校正。
1.3統計學處理采用SPSS17.0統計學軟件進行分析,多組均數的比較采用單因素方差分析,兩兩之間比較用Tamhane′s T2檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1體外培養的人頰黏膜成纖維細胞情況胞體呈梭型或不規則三角形,中央有卵圓形核,胞質向外伸出2~3個長短不等的突起,生長時呈放射狀。經SABC法染色鑒定培養細胞表現為角蛋白染色陰性,胞質不著色,波形絲蛋白染色陽性,細胞胞質棕黃色著色,說明細胞來源于中胚層,為結締組織源性細胞。見圖1~3。
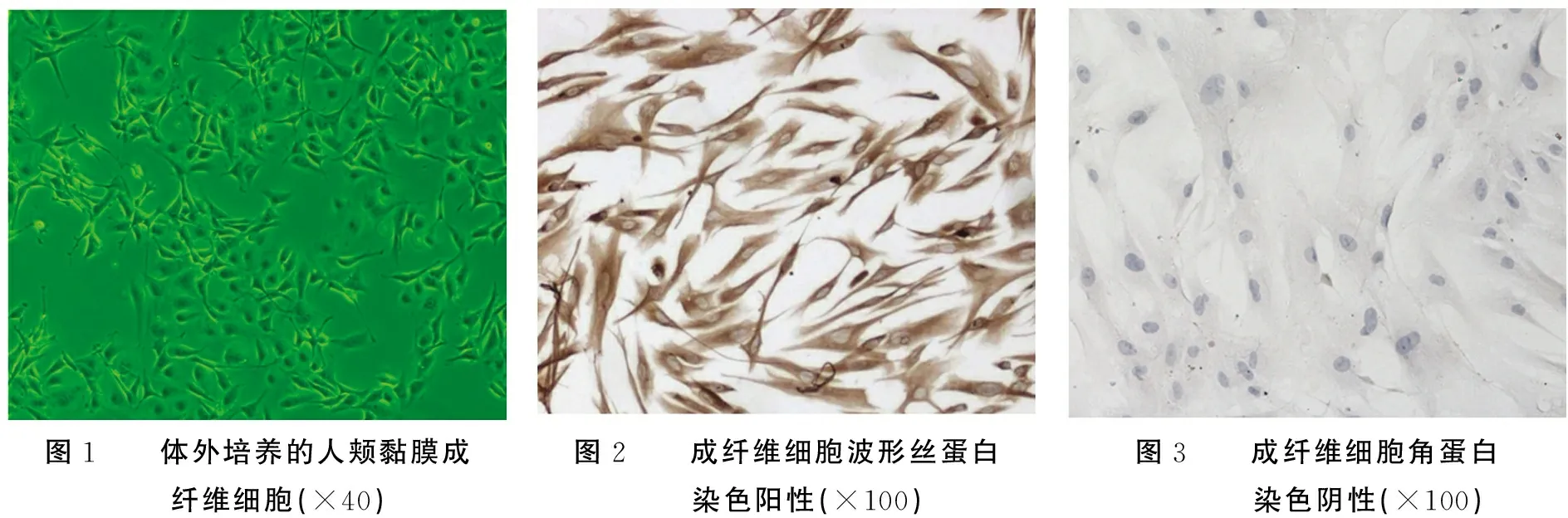
圖1 體外培養的人頰黏膜成纖維細胞(×40) 圖2 成纖維細胞波形絲蛋白染色陽性(×100) 圖3 成纖維細胞角蛋白染色陰性(×100)
2.2細胞生長情況N組細胞的生長和凋亡處于一種平衡,細胞數并未明顯變化,在(1.00~1.01)×106/mL;加入兩種藥物后,特別是24 h以內,都能明顯促進細胞生長(P<0.05);其中,A8、A4和G8、G4從24 h后,細胞數目未明顯變化;48 h后,A2和G2細胞數目增長開始逐漸減慢,而A1/8和G1/8細胞數目開始下降;60 h后,A1和G1細胞數目增長開始逐漸減慢。在整個72 h內,A1/2、A1/4和G1/2、G1/4細胞數目都能保持持續增長的狀態,特別是A1/2在72 h時達到了4.20×106/mL,為本項實驗數據最大值;無論是A組或者G組,1/4濃度組的生長曲線低于1/2濃度組,但A組和G組對應濃度組之間,差異無統計學意義(P>0.05)。見圖4。
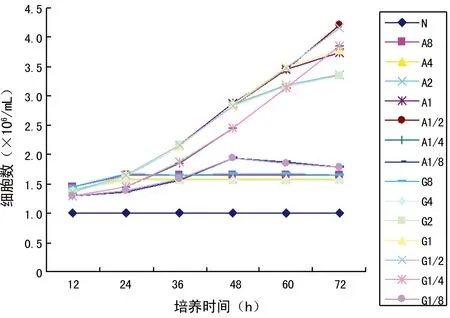
圖4 各組頰黏膜成纖維細胞生長曲線
2.3細胞蛋白水平各藥物濃度組細胞蛋白水平均高于N組(673.68 mg/mL),A1/2和G1/2細胞蛋白水平為各自組別最高,分別為1 407.51、1 393.35 mg/mL,而A組和G組同梯度濃度的細胞蛋白水平比較,差異無統計學意義(P>0.05)。見圖5。
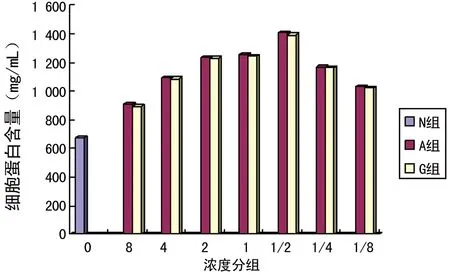
圖5 各組頰黏膜成纖維細胞蛋白水平比較
2.4細胞ALP活性N組細胞的ALP水平隨著時間推移有所增加,但變化幅度不如A、G組明顯,在加入Ala-Gln或Gln后,特別是24 h內,ALP的水平顯著提高;其中,A8、A4和G8、G4從24 h后,ALP水平未明顯變化;48 h后,A2和G2 ALP增長幅度開始逐漸減慢,而A1/8和G1/8 ALP水平開始下降,但仍較N組有顯著升高;60 h后,A1和G1 ALP水平增長開始逐漸減慢。72 h內A1/2、A1/4和G1/2、G1/4 ALP水平都能保持持續增長的狀態,特別A1/2在72 h時達到了53.48 U/mgprot;無論是A組或G組,1/4濃度組各時間點ALP的水平都低于1/2濃度組,但A和G組同梯度濃度組之間,ALP水平差異無統計學意義(P>0.05)。見圖6。
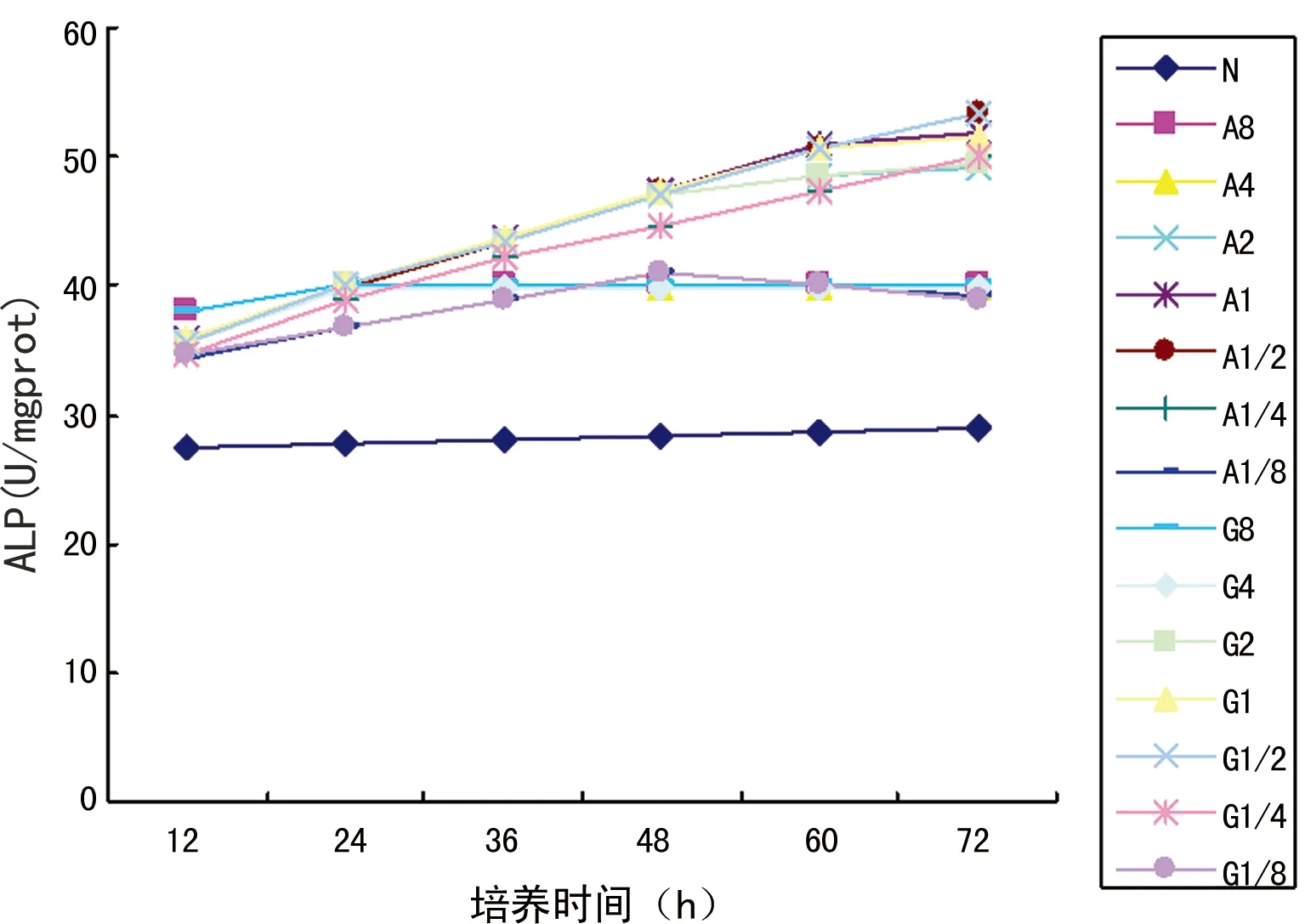
圖6 各組頰黏膜成纖維細胞ALP活性比較
3 討 論
RAU的治療目前多采用口腔局部用藥[9],常用的藥物包括生長因子、中藥制劑、生物制劑、人工合成藥物、免疫調節劑、微量元素補充劑等,但由于病因復雜、藥物價格及患者依從性等原因,其療效和推廣應用都受到了很大的限制[10]。本研究采用Ala-Gln,從促進潰瘍愈合和增強黏膜局部免疫力等方面治療RAU,從而克服目前臨床上RAU治療方面的不足。這一研究方案和初步研究成果已獲得國家發明專利授權(專利號ZL 2013 1 0375582.7)。
細胞增殖是生物生長、發育、繁殖的基礎,目前常用MTT法檢測細胞的增殖效應,但不能較好地反映細胞活性情況;而流式細胞儀是對細胞進行自動分析和分選的裝置,可以快速測量、存貯、顯示懸浮在液體中的分散細胞的一系列重要的生物物理、生物化學方面的特征參量,并可以根據預選的參量范圍把指定的細胞亞群從中分選出來,經過設定,可以計數活細胞和檢測細胞活力[11]。蛋白水平的變化可反映細胞功能的活躍程度,細胞增殖與蛋白合成呈正相關,活細胞數量增加,其蛋白水平也應相應增多[12]。ALP是參與組織形成、代謝和再生的一種重要物質,可作為評價細胞分化和成熟的一種指標,目前已發現ALP1、ALP2、ALP3、ALP4、ALP5與ALP6 6種同工酶,而其中ALP5來自上皮和成纖維細胞[13],測定ALP活性可以評價細胞分化情況。因此,本文確定了細胞總數、蛋白水平、ALP活性3個指標綜合考察Ala-Gln對人頰黏膜成纖維細胞生物活性的影響。
結果顯示,A8、A4、G8和G4組,12 h內細胞數目和ALP水平均明顯高于對照組,但24 h后二者幾乎較12 h時無明顯變化,可能由于氨的生成較多,Gln的利用受到抑制,Gln在生成谷氨酸后經過脫氫途徑的量減少,更多地向轉氨途徑,與脫氫途徑相比,細胞通過轉氨途徑產生的氨較少,對細胞生長產生的抑制作用也較小。這與高氨濃度抑制細胞生長、細胞需要調整能量代謝的速率與生物合成的速率相協調的觀點相符;而在細胞培養過程中,氨對細胞的生長有明顯的抑制作用,遵循二級抑制模型,其模型常數Ka為4.46(mmol/L)2[14]。本研究中,A2和G2組在48 h后,以及A1和G1組在60 h后出現細胞生長和分化減緩,可能與Gln分解造成的氨濃度增高有關。A1/2、A1/4、G1/8和G1/4組72 h內一直保持較好的生長曲線,48 h內細胞的生長和ALP水平與對照組比較差異有統計學意義(P<0.05);48 h后,G1/2和G1/4組的細胞生長和ALP水平相對于A1/2和A1/4組稍偏低,但其差異無統計學意義(P>0.05),推測原因為Gln在水溶液中不穩定,可能與Gln有效成分降低和Gln分解造成氨水平增高有一定關聯,也應予以綜合考慮。A1/8和G1/8組從一開始就生長緩慢,ALP水平偏低,與其他濃度組的差異有統計學意義(P<0.05),60 h后均停止生長并逐漸下降;而A1/2和G1/2組較A1/4和G1/4組的細胞生長好,ALP水平也較高,差異有統計學意義(P<0.05),說明Ala-Gln和Gln對細胞生長和分化的影響存在濃度依耐性。
在細胞蛋白水平方面,無論是A組還是G組,在1/8~1/2濃度,其蛋白水平呈濃度依賴性。1/2濃度組蛋白水平也明顯高于1倍濃度組,而2~8倍濃度組水平明顯降低,可能是Gln代謝和分解產生了高濃度的氨,對細胞的生長有抑制作用。另外,實驗結果顯示A組的細胞蛋白水平及
ALP水平略高于G組,估計與Ala-Gln代謝過程中產生的丙氨酸作為另一種氨基酸來源參與細胞生長有關。
綜上所述,Ala-Gln可以提高人頰黏膜成纖維細胞的ALP和細胞蛋白水平,促進細胞生長,提高細胞活性,當Ala-Gln濃度過高或過低可影響細胞持續生長,以1/2倍推薦濃度(即Ala-Gln濃度為16.5 mg/mL)時細胞生長情況最好。
[1]Babaee N,Baradaran M,Mohamadi H,et al.Therapeutic effects of Zataria Multiflora essential oil on recurrent oral aphthous lesion[J].Dent Res J (Isfahan),2015,12(5):456-460.
[2]Tarakji B,Gazal G,Al-Maweri SA,et al.Guideline for the diagnosis and treatment of recurrent aphthous stomatitis for dental practitioners[J].J Int Oral Health,2015,7(5):74-80.
[3]劉壽榮,黃文豹.谷氨酰胺對急性肝功能不全大鼠的防治作用[J].中國現代應用藥學雜志,2015,22(6):508-510.
[4]Pradelli L,Povero M,Muscaritoli M,et al.Updated cost-effectiveness analysis of supplemental glutamine for parenteral nutrition of intensive-care patients[J].Eur J Clin Nutr,2015,69(5):546-551.
[5]Stehle P,Kuhn KS.Glutamine:An obligatory parenteral nutrition substrate in critical care therapy[J].Biomed Res Int,2015,2015:545467.
[6]Jakopin M.Murabutide revisited:a review of its pleiotropic biological effects[J].Curr Med Chem,2013,20(16):2068-2079.
[7]章靜波.組織和細胞培養技術[M].3版.北京:人民衛生出版社,2014:66.
[8]王春,向學熔,楊鑫,等.鹽酸小檗堿抑制人頰黏膜成纖維細胞炎癥反應的初步實驗研究[J].重慶醫學,2010,39(10):1222-1223.
[9]張優琴,江春霞,王智巍,等.復發性口腔潰瘍的臨床治療進展[J].中國藥房,2015,26(35):5030-5032.
[10]Kalaev VN,Artiukhov VG,Nechaeva MS.Micronucleus test of human oral buccal epithelium:problems,progress and prospects[J].Tsitol Genet,2014,48(6):62-80.
[11]薛雅蓉,莊重,劉智慧.設計利用現代科學儀器 緊跟科學前沿的細胞生物學實驗[J].實驗技術與管理,2013,30(6):163-166.
[12]Ivanov KP.Modern medical problems of energy exchange in humans[J].Vestn Ross Akad Med Nauk,2013,6(1):56-59.
[13]Bishop N.Clinical management of hypophosphatasia[J].Clin Cases Miner Bone Metab,2015,12(2):170-173.
[14]黃劍峰,王佳鳴,崔磊.氨對人表皮角質細胞生長和代謝的影響[J].中國醫藥生物技術,2007,2(2):123-129.
The influence of alanyl-glutamine on the bioactivity of human buccal fibroblasts in vitro*
Che Keke1,Liu Xin2△,Qing Shanglan2,Zhang Xicheng2
(1.Department of Pharmacy;2.Department of Stomatology,People′s Hospital of Chongqing,Chongqing 400014,China)
ObjectiveTo study the influence of alanyl-glutamine (Ala-Gln) on the cells growth,protein synthesis,and alkaline phosphatase (ALP) bioactivity of human buccal fibroblasts in vitro.MethodsThe human buccal fibroblasts in vitro were divided into the control group(group N ),Ala-Gln group (group A) and Gln group (group G).Group A and G set up 7 gradient concentrations(8,4,2,1,1/2,1/4,1/8 times recommended concentration) respectively,then cultured for 12,24,36,48,60 and 72 h.Flow cytometry was used to count cells,and drew cell growth curve as well.In addition,the ALP concentration in the corresponding period was detected by using euzymelinked immunosorbent assay,the total protein content of the cells was detected after 72 h.ResultsThe amount of cells in group N did not change obviously within 72 h,ALP contents increased over time but the changes in group A and G were more significant(P<0.05).The cell growths in group A,G were obviously accelerated within 24 h,and the content of ALP also increased significantly (P<0.05).The change of 1/2 times recommended concentration group was significantly better than that of other concentration groups.The cell protein contents of each drug concentration group were higher than group N(P<0.05).ConclusionAla-Gln can accelerate the growth of buccal fibroblasts.However,when the concentration is too high or too low,the sustaining growth of cells is depressed.The 1/2 times recommended concentration of Ala-Gln(16.5 mg/mL) is more reasonable.
mouth mucosa;fibroblasts;alkaline phosphatase;alanyl-glutamine;cell growth
重慶市衛生和計劃生育委員會醫學科研項目(2013-02-098,2015MSXM067)。作者簡介:車坷科(1981-),主管藥師,在讀博士,主要從事臨床藥物治療學與生物藥劑學研究。△
,E-mail:ares_young@163.com。
論著·基礎研究10.3969/j.issn.1671-8348.2016.22.002
R963
A
1671-8348(2016)22-3028-03
2016-02-08
2016-03-15)

