熱處理光滑念珠菌對(duì)大鼠氣道上皮細(xì)胞Dectin-1、IL-6和TNF-α表達(dá)的影響*
張 雪,駱雪萍△,白 劍,王玉春,吳呈霖,趙 瑩
(1.桂林醫(yī)學(xué)院第二附屬醫(yī)院重癥醫(yī)學(xué)科,廣西桂林 541100;2.桂林醫(yī)學(xué)院,廣西桂林 541004;3.桂林醫(yī)學(xué)院第二附屬醫(yī)院檢驗(yàn)科,廣西桂林 541100)
?
·論著·
熱處理光滑念珠菌對(duì)大鼠氣道上皮細(xì)胞Dectin-1、IL-6和TNF-α表達(dá)的影響*
張雪1,駱雪萍1△,白劍2,王玉春3,吳呈霖1,趙瑩1
(1.桂林醫(yī)學(xué)院第二附屬醫(yī)院重癥醫(yī)學(xué)科,廣西桂林 541100;2.桂林醫(yī)學(xué)院,廣西桂林 541004;3.桂林醫(yī)學(xué)院第二附屬醫(yī)院檢驗(yàn)科,廣西桂林 541100)
目的探討大鼠氣道上皮(RTE)細(xì)胞與熱處理光滑念珠菌孵育后Dectin-1、IL-6和TNF-α的表達(dá)及意義。方法以體外培養(yǎng)的RTE細(xì)胞與熱處理光滑念珠菌孵育后分別于2、4、6 h觀察RTE細(xì)胞形態(tài)變化,以未與光滑念珠菌孵育的RTE細(xì)胞為對(duì)照組。用Western blot法檢測(cè)Dectin-1蛋白的表達(dá);實(shí)時(shí)熒光定量PCR檢測(cè)IL-6和TNF-α mRNA的表達(dá);ELISA法檢測(cè)上清液IL-6和TNF-α的分泌。結(jié)果隨著孵育時(shí)間的延長(zhǎng),RTE細(xì)胞破壞逐漸加重及Dectin-1、IL-6和TNF-α 的表達(dá)呈進(jìn)行性增高。孵育2 h組與對(duì)照組比較、孵育4 h組與孵育2 h組比較、孵育6 h組與孵育4 h組比較,Dectin-1、IL-6和TNF-α 的表達(dá)差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。結(jié)論RTE細(xì)胞具有天然免疫功能,其Dectin-1參與了對(duì)熱處理光滑念珠菌的識(shí)別,并激活I(lǐng)L-6和TNF-α的分泌,介導(dǎo)炎性反應(yīng)。IL-6起負(fù)性調(diào)節(jié)作用。
熱處理光滑念珠菌;Dectin-1受體;大鼠氣道上皮細(xì)胞;腫瘤壞死因子α;白細(xì)胞介素6
近年由于廣譜抗菌藥物、免疫抑制劑等的應(yīng)用,使侵襲性真菌感染(invasive fungal infection,IFI)的發(fā)病率增高,尤以重癥監(jiān)護(hù)病房(ICU)最多見(jiàn)[1]。ICU患者多以侵襲性肺部真菌感染(invasive pulmonary fungal infection,IPFI)最為常見(jiàn),IPFI已成為導(dǎo)致重癥患者死亡的主要原因之一。以往IFI的病原菌以白色念珠菌為主,近年非白色念珠菌所占比例明顯增加,其中光滑念珠菌和熱帶念珠菌占較大比例,有報(bào)道光滑念珠菌幾乎成為ICU非白色念珠菌中首位致病菌[2]。本研究通過(guò)大鼠氣道上皮(rat tracheal epithelia,RTE)細(xì)胞與熱處理光滑念珠菌孵育,探討熱處理光滑念珠菌對(duì)RTE 細(xì)胞Dectin-1受體、IL-6和TNF-α表達(dá)的影響。
1 材料與方法
1.1細(xì)胞培養(yǎng)RTE細(xì)胞購(gòu)于北京協(xié)和細(xì)胞資源中心。培養(yǎng)于DMEM F12 1∶1混合培養(yǎng)基中(含10%胎牛血清及青鏈霉素)。常規(guī)培養(yǎng)、傳代,培養(yǎng)條件37 ℃、5%CO2細(xì)胞培養(yǎng)箱生長(zhǎng)。
1.2菌種標(biāo)準(zhǔn)光滑念珠菌,編號(hào)9627,購(gòu)自上海酶聯(lián)生物科技有限公司。將光滑念珠菌標(biāo)準(zhǔn)菌株接種于沙堡培養(yǎng)基,在37 ℃真菌培養(yǎng)箱培養(yǎng)48 h后,挑取菌落于高溫高壓滅菌PBS沖洗2次,配制成懸液,血球計(jì)數(shù)板倒置顯微鏡下計(jì)數(shù),1 200 rpm 4 ℃離心棄上清,用無(wú)菌PBS緩沖液重懸,于56 ℃環(huán)境下進(jìn)行熱處理30 min[3],4 ℃儲(chǔ)存?zhèn)溆谩?/p>
1.3RTE細(xì)胞與熱處理光滑念珠菌孵育實(shí)驗(yàn)
1.3.1孵育前細(xì)胞準(zhǔn)備棄培養(yǎng)基,PBS沖洗,棄PBS,胰酶消化,終止消化,離心,血球計(jì)數(shù)板倒置顯微鏡下計(jì)數(shù),調(diào)整細(xì)胞密度至5×105/mL,每孔各取1 mL細(xì)胞懸液加入6孔板,放入培養(yǎng)箱培養(yǎng)24 h。
1.3.2孵育實(shí)驗(yàn)及分組稀釋光滑念珠菌液,計(jì)數(shù),調(diào)整濃度為5×106/mL,每孔加100 μL菌液,孵育復(fù)數(shù)(multiplicity of infection,MOI)為1[4]。第1次向六孔板任意一孔加入菌液后,每隔2 h,分別再向其他六孔板任意一孔加入菌液,總共加菌液3次,分別標(biāo)記孵育6 h組、孵育4 h組和孵育2 h組。再?gòu)氖S嗫字须S機(jī)選取一孔,此標(biāo)記為對(duì)照組。
1.4Western blot檢測(cè)Dectin-1蛋白終止各組孵育,將細(xì)胞收集加入蛋白裂解液,離心提取上清液。應(yīng)用BCA定量法計(jì)算蛋白濃度。經(jīng)十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,將凝膠中蛋白轉(zhuǎn)移至PVDF膜上。TBS-T洗膜,封閉后,與一抗孵育,次日與二抗孵育。TBS-T洗膜后加入化學(xué)發(fā)光試劑,X線膠片曝光。應(yīng)用Image J軟件分析并計(jì)算各組條帶灰度值。
1.5實(shí)時(shí)熒光定量PCR檢測(cè)IL-6和TNF-α終止各組孵育,收集細(xì)胞加入1 mL Trizol,按照說(shuō)明書(shū)提取RNA。以2 μg總RNA為模板,按照說(shuō)明書(shū)配制逆轉(zhuǎn)錄反應(yīng)體系,合成cDNA第一鏈。IL-6引物序列:上游5′-ACA GCG ATG ATG CAC TGT CA-3′,下游5′-ACG GAA CTC CAG AAG ACC AG-3′;TNF-α引物序列:上游5′-CAC CAC GCT CTT CTG TCT ACT-3′,下游5′-AGA TGA TCT GAG TGT GAG GGT C-3′;β-acting引物序列:上游5′-GGA GAT TAC TGC CCT GGC TCC TA-3′,下游5′-GAC TCA TCG TAC TCC TGC TTG CTG-3′。實(shí)時(shí)熒光定量PCR反應(yīng)條件:94 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40循環(huán)。基因相對(duì)表達(dá)量以2-△△Ct表示。
1.6上清液ELISA檢測(cè)IL-6和TNF-α因子終止各組孵育,分別取100 μL共培養(yǎng)細(xì)胞上清液,按ELISA 檢測(cè)試劑盒說(shuō)明進(jìn)行,繪制曲線,得出各組IL-6和TNF-α的表達(dá)濃度。
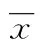
2 結(jié) 果
2.14組RTE細(xì)胞光鏡觀察RTE細(xì)胞與熱處理光滑念珠菌孵育光鏡下見(jiàn)對(duì)照組RTE細(xì)胞形態(tài)清晰、完整;孵育2、4、6 h組可見(jiàn)RTE細(xì)胞形態(tài)不完整,邊緣模糊。孵育2 h 組與對(duì)照組比較、孵育4 h組與孵育2 h組比較、孵育6 h組與孵育4 h組比較,RTE細(xì)胞碎片及光滑念珠菌孢子逐漸增多。見(jiàn)圖1。
2.24組Dectin-1受體蛋白的表達(dá)及比較Western blot印跡見(jiàn)圖2。4組Dectin-1的表達(dá)見(jiàn)表1。孵育2 h組與對(duì)照組比較、孵育4 h組與孵育2 h組比較、孵育6 h組與孵育4 h組比較,Dectin-1蛋白的表達(dá)差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。

A:對(duì)照組;B:孵育2 h組;C:孵育4 h組;D:孵育6 h組。
圖14組RTE細(xì)胞與熱處理光滑念珠菌孵育光鏡觀察(×20)

1:對(duì)照組;2:孵育2 h組;3:孵育4 h組;4:孵育6 h組。

圖2 4組RTE細(xì)胞受體Dectin-1蛋白表達(dá) 表1 4組Dectin-1蛋白的表達(dá)
a:P<0.05,與對(duì)照組比較;b:P<0.05,與孵育2 h組比較;c:P<0.05,與孵育4 h組比較。
2.34組IL-6和TNF-α mRNA實(shí)時(shí)熒光定量PCR結(jié)果及比較實(shí)時(shí)熒光定量PCR(圖3~6)示待測(cè)基因的熒光信號(hào)真實(shí)可信。 RTE細(xì)胞與熱處理光滑念珠菌孵育后,4組IL-6和TNF-α mRNA的表達(dá)見(jiàn)圖7、8,表2、3。孵育2 h組與對(duì)照組比較、孵育4 h組與孵育2 h組比較、孵育6 h組與孵育4 h組比較,IL-6和TNF-α mRNA的表達(dá)均明顯增高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。

圖3 IL-6 mRNA擴(kuò)增產(chǎn)物溶解曲線分析

圖4 IL-6 mRNA實(shí)時(shí)熒光定量PCR擴(kuò)增曲線

圖5 TNF-α mRNA擴(kuò)增產(chǎn)物溶解曲線分析

圖6 TNF-α mRNA實(shí)時(shí)熒光定量PCR擴(kuò)增曲線

圖7 4組RTE細(xì)胞中IL-6 mRNA 實(shí)時(shí)熒光定量PCR表達(dá)

圖8 4組RTE細(xì)胞中TNF-α mRNA實(shí)時(shí) 熒光定量PCR的表達(dá)表2 4組IL-6 mRNA實(shí)時(shí)熒光定量PCR的表達(dá)

組別IL-6mRNA對(duì)照組1.0000±0.00000孵育2h組1.6310±0.10742a孵育4h組2.1915±0.16894b孵育6h組3.5987±0.13098c
a:P<0.05,與對(duì)照組比較;b:P<0.05,與孵育2 h組比較;c:P<0.05,與孵育4 h組比較。

表3 4組TNF-α mRNA實(shí)時(shí)熒光定量PCR的表達(dá)
a:P<0.05,與對(duì)照組比較;b:P<0.05,與孵育2 h組比較;c:P<0.05,與孵育4 h組比較。
2.44組IL-6和TNF-α因子ELISA檢測(cè)的結(jié)果及比較ELISA顯示,孵育2 h組與對(duì)照組比較、孵育4 h組與2 h組比較,孵育6 h組與4 h組比較,IL-6和TNF-α的表達(dá)均顯著升高(P<0.05)。見(jiàn)表4、5。

表4 4組上清液IL-6因子的表達(dá)
a:P<0.05,與對(duì)照組比較;b:P<0.05,與孵育2 h組比較;c:P<0.05,與孵育4 h組比較。

表5 4組上清液TNF-α因子的表達(dá)
a:P<0.05,與對(duì)照組比較;b:P<0.05,與孵育2 h組比較;c:P<0.05,與孵育4 h組比較。
3 討 論
當(dāng)真菌進(jìn)入呼吸道,首先接觸氣道上皮細(xì)胞。一般情況下當(dāng)纖毛清除系統(tǒng)有效運(yùn)行時(shí)真菌能被迅速清除。當(dāng)宿主免疫力低下、免疫狀態(tài)抑制或吸入真菌數(shù)量遠(yuǎn)遠(yuǎn)超過(guò)氣道防御屏障清除能力時(shí),真菌即可侵入機(jī)體導(dǎo)致真菌感染。此時(shí),氣道上皮細(xì)胞的早期識(shí)別能力和免疫趨化等天然免疫功能顯得尤為重要。以往氣道上皮細(xì)胞僅被認(rèn)為起著機(jī)械物理屏障作用,但隨著深入研究發(fā)現(xiàn)氣道上皮細(xì)胞還是呼吸道應(yīng)對(duì)病原微生物感染產(chǎn)生免疫應(yīng)答的前哨細(xì)胞(sentinel cell)。更重要的是氣道上皮細(xì)胞可通過(guò)病原識(shí)別受體(pathogen recognition receptor,PRR)識(shí)別真菌并構(gòu)成強(qiáng)大的免疫屏障,從而成為抵抗真菌等病原微生物入侵機(jī)體的第一道防線[5]。
真菌侵入機(jī)體后,首先通過(guò)PRR對(duì)真菌表面病原相關(guān)分子模式(pathogen associated molecular pattern,PAMP)進(jìn)行識(shí)別啟動(dòng)天然免疫。PRR是啟動(dòng)整個(gè)天然免疫應(yīng)答的樞紐[6]。真菌細(xì)胞壁任何成分都可能是潛在的 PAMP,位于細(xì)胞壁最內(nèi)層的β-葡聚糖是重要的PAMP。由于β-葡聚糖被甘露聚糖-甘露糖蛋白層覆蓋,從而阻止PRR對(duì)其的直接識(shí)別。當(dāng)細(xì)胞壁破壞時(shí)β-葡聚糖被釋放,宿主受體對(duì)暴露的β-葡聚糖碎片識(shí)別啟動(dòng)天然免疫。本研究發(fā)現(xiàn)隨著RTE細(xì)胞與熱處理光滑念珠菌孵育時(shí)間的延長(zhǎng),RTE細(xì)胞形態(tài)完整性逐漸破壞,細(xì)胞溶解、被吞噬現(xiàn)象越來(lái)越嚴(yán)重,細(xì)胞碎片逐漸增多,菌群數(shù)量不斷增多,甚至幾乎覆蓋全部RTE細(xì)胞。以上現(xiàn)象均提示熱處理的光滑念珠菌仍具有很強(qiáng)致病性,通過(guò)熱處理[3]可使光滑念珠菌細(xì)胞壁內(nèi)層的β-葡聚糖暴露,而暴露了的β-葡聚糖是光滑念珠菌致病的重要成分,這與本研究團(tuán)隊(duì)在大鼠整體實(shí)驗(yàn)中的研究結(jié)果一致[7]。
C型凝集素受體(C-type lectin receptors,CLR)是天然免疫中重要的PRR之一,CLR能誘導(dǎo)細(xì)胞內(nèi)信號(hào)傳導(dǎo)[8]。CLR家族中的樹(shù)突狀細(xì)胞相關(guān)性Dectin-1與真菌感染密切相關(guān),是識(shí)別真菌β-葡聚糖重要的PRR[9]。Dectin-1由胞外糖識(shí)別結(jié)構(gòu)域(carbohydrate recognition domains,CRDs)、跨膜區(qū)域和細(xì)胞質(zhì)免疫受體酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs,ITAM)結(jié)構(gòu)域構(gòu)成[10]。正常情況下Dectin-1呈低表達(dá)。本實(shí)驗(yàn)研究結(jié)果顯示隨著RTE細(xì)胞與熱處理光滑念珠菌孵育時(shí)間延長(zhǎng),Dectin-1的表達(dá)呈進(jìn)行性升高,具有時(shí)間依賴性。由此可見(jiàn),RTE細(xì)胞不僅具有氣道的屏障功能,同時(shí)還有抗真菌的天然免疫功能,其Dectin-1是識(shí)別光滑念珠菌β-葡聚糖的重要PRR。
Dectin-1識(shí)別β-葡聚糖后還可誘發(fā)一系列的下游細(xì)胞因子的表達(dá)及炎性反應(yīng)。Li等[11]研究發(fā)現(xiàn)用白色念珠菌β-葡聚糖體外刺激人急性單核白血病細(xì)胞,能引起固有免疫反應(yīng)并使下游因子TNF-α、IL-6和IL-8表達(dá)增加。Gow等[3]研究也發(fā)現(xiàn)用人外周血單核細(xì)胞、鼠腹膜巨噬細(xì)胞分別與白色念珠菌孵育,熱處理組白念珠菌釋放更高的TNF-α、IL-6、IL-10和IFN-γ等因子。本實(shí)驗(yàn)結(jié)果同樣顯示RTE細(xì)胞與熱處理光滑念珠菌孵育后IL-6 和TNF-α mRNA的表達(dá)、IL-6 和TNF-α的分泌均隨孵育時(shí)間延長(zhǎng)而顯著上調(diào),與Li等[11]和Gow等[3]用白色念珠菌β-葡聚糖與細(xì)胞孵育TNF-α和IL-6等因子表達(dá)水平明顯升高的研究結(jié)果一致。Leal等[12]研究發(fā)現(xiàn)敲除Dectin-1基因的小鼠真菌感染時(shí)IL-1β等細(xì)胞因子生成受阻,粒細(xì)胞浸潤(rùn)減少和菌絲清除能力下降,尤其是在高表達(dá)β-葡聚糖真菌感染時(shí)上述表現(xiàn)更明顯。然而,目前對(duì)于IL-6在真菌感染中發(fā)揮的作用尚未完全明確,甚至有爭(zhēng)議。傳統(tǒng)認(rèn)為在真菌感染期間,IL-6的分泌對(duì)于機(jī)體是起保護(hù)防御作用的。但近期研究[13]顯示,在真菌性血流感染中IL-6和TNF-α的分泌量與疾病的嚴(yán)重程度有關(guān)。本實(shí)驗(yàn)研究發(fā)現(xiàn)隨著IL-6和TNF-α表達(dá)的進(jìn)行性增高,RTE細(xì)胞被侵蝕、溶解更加顯著,提示IL-6起了負(fù)性調(diào)節(jié)的作用,與真菌性血流感染的研究結(jié)果相似。由此可見(jiàn),在真菌感染過(guò)程中,過(guò)強(qiáng)的免疫反應(yīng)及過(guò)度的免疫應(yīng)答會(huì)引起大量的炎性介質(zhì)釋放產(chǎn)生局部免疫損傷,這些對(duì)宿主自身是不利的。
綜上所述,具有氣道重要屏障功能的RTE細(xì)胞同樣具有抗真菌的天然免疫功能。RTE細(xì)胞的Dectin-1參與了對(duì)熱處理光滑念珠菌的識(shí)別,經(jīng)熱處理的光滑念珠菌仍具有較強(qiáng)的致病性,其暴露了的β-葡聚糖可直接作為PAMP被RTE細(xì)胞Dectin-1識(shí)別,并誘導(dǎo)下游細(xì)胞因子及炎性因子IL-6和TNF-α的表達(dá)。IL-6作為免疫反應(yīng)中的重要的細(xì)胞因子在RTE細(xì)胞光滑念珠菌感染中起到了負(fù)性調(diào)節(jié)作用。因此,充分認(rèn)識(shí)Dectin-1及IL-6可能在免疫學(xué)方面為臨床抗真菌治療提供一個(gè)新的靶點(diǎn)。
[1]Groll AH,Lumb J.New developments in invasive fungal disease[J].Future Microbiol,2012,7(2):179-184.
[2]Paramythiotou E,Frantzeskaki F,Flevari A,et al.Invasive fungal infections in the ICU:how to approach,how to treat[J].Molecules,2014,19(1):1085-1119.
[3]Gow NA,Netea MG,Munro CA,et al.Immune recognition of Candida albicans beta-glucan by dectin-1[J].J Infect Dis,2007,196(10):1565-1571.
[4]Seider K,Gerwien F,Kasper L,et al.Immune evasion,stress resistance,and efficient nutrient acquisition are crucial for intracellular survival of Candida glabrata within macrophages[J].Eukaryot Cell,2014,13(1):170-183.
[5]Che CY,Jia WY,Xu Q,et al.The roles of surfactant protein D during Aspergillus fumigatus infection in human corneal epithelial cells[J].Int J Ophthalmol,2012,5(1):13-17.
[6]Evans SE,Xu Y,Tuvim MJ,et al.Inducible innate resistance of lung epithelium to infection[J].Annu Rev Physiol,2010,72:413-435.
[7]吳呈霖,駱雪萍,吳曄,等.大鼠侵襲性肺部熱處理光滑念珠菌感染肺組織Dectin-1和IL-10的表達(dá)[J].廣東醫(yī)學(xué),2014,35(22):3468-3470.
[8]Gringhuis SI,Kaptein TM,Wevers BA,et al.Dectin-1 is an extracellular pathogen sensor for the induction and processing of IL-1β via a noncanonical caspase-8 inflammasome[J].Nat Immunol,2012,13(3):246-254.
[9]Dambuza IM,Brown GD.C-type lectins in immunity:recent developments[J].Curr Opin Immunol,2015,32:21-27.
[10]Marakalala MJ,Kerrigan AM,Brown GD.Dectin-1:a role in antifungal defense and Consequences of genetic polymorphisms in humans[J].Mamm Genome,2011,22(1/2):55-65.
[11]Li M,Liu ZH,Chen Q,et al.Insoluble beta-glucan from the cell wall of Candida albicans induces immune responses of human THP-1 monocytes through Dectin-1[J].Chin Med J (Engl),2009,122(5):496-501.
[12]Leal SM,Cowden S,Hsia YC,et al.Distinct roles for Dectin-1 and TLR4 in the pathogenesis of Aspergillus fumigatus keratitis[J].PLoS Pathog,2010,6:e1000976.
[13]梁珺,張洲,徐元宏.TNF-α、IL-6、IL-10、VCAM-1、E-Selectin在真菌性血流感染中的作用[J].安徽醫(yī)科大學(xué)學(xué)報(bào),2013,48(1):47-50.
Effects of heat-treated candida glabrata on the expression of Dectin-1,the production of IL-6 and TNF-α in rat tracheal epithelial cells*
ZhangXue1,LuoXueping1△,BaiJian2,WangYuchun3,WuChenglin1,ZhaoYing1
(1.DepartmentofICU,theSecondAffiliatedHospitalofGuilinMedicalCollege,Guilin,Guangxi541100,China;2.GuilinMedicalCollege,Guilin,Guangxi541004,China;3.DepartmentofClinicalLaboratory,theSecondAffiliatedHospitalofGuilinMedicalCollege,Guilin,Guangxi541100,China)
ObjectiveTo explore the effects of co-cultured heat-treated candida glabrata with rat tracheal epithelial (RTE) cells on the expression of Dectin-1 and the production of IL-6 and TNF-α.MethodsRTE cells in vitro were co-cultured with heat-treated candida glabrata bacteria liquid for 2,4,6 h,while without co-cultured RTE cells were used as control group.We observed the morphological changes of RTE cells,detected the protein expressions of Dectin-1 by Western blot,used real-time PCR to detecte the mRNA expressions of IL-6 and TNF-α and measured protein expression of IL-6 and TNF-α by ELISA.ResultsWith the passing of time,the RTE cells were damaged extensively and the expression of Dectin-1,IL-6 and TNF-α became more and more significant.Obviously,there had significant difference in the expression of Dectin-1,IL-6 and TNF-α between the co-cultured 2 h group and the control group,the co-cultured 4 h group and the co-cultured 2 h group,the co-cultured 6 h group and the co-cultured 4 h group (P<0.05).ConclusionRTE cells have natural immune function.The Dectin-1 involves in the recognition of heat-treated Candida glabrata,activating secretion of IL-6 and TNF-α and mediating inflammatory reaction.IL-6 plays a negative regulation role.
heat-treated candida glabrata;Dectin-1 receptor;rat tracheal epithelial cells;tumor necrosis factor-α;interleukins-6
10.3969/j.issn.1671-8348.2016.07.001
廣西醫(yī)療衛(wèi)生重點(diǎn)科研課題(重2012007);廣西自然科學(xué)基金資助項(xiàng)目(2013GXNSFAA019209)。作者簡(jiǎn)介:張雪(1987-),住院醫(yī)師,碩士,主要從事重癥感染方面的研究。△
,E-mail:xueping-l@sohu.com。
R519
A
1671-8348(2016)07-0865-04
2015-09-14
2015-11-26)

