不同艾灸因素對阿爾茨海默小鼠PI3K/AKT通路與皮質β淀粉樣蛋白沉淀的影響
劉耀萌 劉鈞天 黃 暢 韓 麗 趙百孝
(北京中醫藥大學針灸推拿學院,北京,100029)
?
不同艾灸因素對阿爾茨海默小鼠PI3K/AKT通路與皮質β淀粉樣蛋白沉淀的影響
劉耀萌劉鈞天黃暢韓麗趙百孝
(北京中醫藥大學針灸推拿學院,北京,100029)
目的:觀察艾灸、艾煙、無煙灸干預對APP/PS1小鼠大腦皮質PI3K/AKT通路相關指標和β淀粉樣蛋白沉淀的影響,從能量代謝的角度探索艾灸不同作用因素在防治阿爾茨海默病中的機制。方法:將32只5個月齡雄性APP/PS1阿茨海默病模型小鼠隨機分為模型組、艾灸組、艾煙組、無煙灸組,每組各8只,并將8只同月齡雄性C57BL/6小鼠作為空白對照組。空白組、模型組小鼠每日常規抓取、固定于正常環境;艾灸組與無煙灸組小鼠每日抓取、固定后取關元穴灸治;艾煙組小鼠每日抓取、固定后暴露于10~15 mg/m3艾煙環境。所有干預20 min/d,6 d/周,共8周。于第10周取材。ELISA法檢測各組小鼠大腦皮質中IRS-1、PI3K、AKT、GSK-3α、IDE的含量,剛果紅染色檢測大腦皮質區β淀粉樣蛋白沉淀情況。結果:皮質中IRS-1含量比較顯示,模型組低于空白組(P<0.01),艾灸組、艾煙組高于模型組(P<0.01,P<0.05);腦中PI3K含量比較顯示,模型組低于空白組(P<0.01),艾灸組、艾煙組高于模型組(P<0.05);腦中AKT含量比較顯示,模型組低于空白組(P<0.05),艾灸組、艾煙組、無煙灸組高于模型組(P<0.05),艾灸組高于無煙灸組(P<0.05);腦中GSK-3α含量比較顯示,模型組高于空白組(P<0.01),艾灸組、艾煙組、無煙灸組低于模型組(P<0.01,P<0.05,P<0.05)。模型組小鼠在皮質內可觀察到明顯的橘紅色Aβ沉積,空白對照組明顯少于模型組(P<0.01)。艾煙組、艾煙組、無煙灸組在相同皮質區域中,淀粉樣蛋白沉淀均有不同程度的減少。結論:艾灸與艾煙可以調整APP/PS1阿爾茨海默病小鼠的腦部能量代謝,此外艾煙還可以增加對β淀粉蛋白的清除,減緩小鼠皮質內β淀粉蛋白沉淀的產生速度,以延緩AD病理進程。
阿爾茨海默病;艾灸;艾煙;無煙灸;PI3K/AKT通路;胰島素降解酶
阿爾茨海默病(Alzheimer Disease,AD)是一種起病隱匿的慢性退行性神經病變,多發于65歲以上老年人。患者以短期記憶喪失為發病初期表現,隨著病情進一步發展,可觀察到學習和記憶功能進行性損害及其他大腦功能受累[1],包括意識錯亂、判斷能力障礙、語言障礙、焦慮、強迫癥和幻覺,甚至出現躁狂或抑郁[2]。據世界衛生組織(WHO)和國際阿爾茨海默病協會(ADI)統計,2015年全球有超過4600萬人罹患癡呆,其中亞洲患者比例最大,約有2300萬患者,預計2050年,全球癡呆患者數量將高達13150萬人次[3]。阿爾茨海默病是引起癡呆的最常見原因,也是現代人的第六大死亡因素,雖然全世界每年對AD進行了大量的研究,但臨床上仍然缺乏對抗AD的特效藥。
艾灸療法作為中醫學特色療法,已有數千年歷史,對阿爾茨海默病的預防和治療具有一定效果。根據中醫基礎理論,艾灸具有溫補元氣、培腎固本的功效,而老年癡呆病位在腦,患者元氣不足,臟腑虧虛,則髓海無以充養。
艾燃燒生成物是艾灸過程中艾絨燃燒產生的煙氣,與以往所認為的艾灸最主要的效應因素是溫熱刺激所不同的是,本課題組在前期研究中通過固相微萃取-氣相色譜-質譜聯用技術發現艾燃燒過程中可產生26種成分,主要為芳香族化合物、酯類、烷烴或含羥基類化合物,它們也存在諸如改善機體氧化損傷、增強神經元保護功能、調節線粒體功能等生物活性[4-6]。
APP/PS1雙轉基因小鼠是國際公認的,以Aβ為主要致病因素的阿爾茨海默病動物模型,雄性小鼠在6個月齡時即可觀察到大腦皮質、海馬區出現老年斑[7]。本實驗在前期研究的基礎上,將艾灸的不同作用因素分離開來,將溫熱刺激和艾燃燒生成物的作用分別作為干預因素,以APP/PS1小鼠作為阿爾茨海默病模型,以腦組織中PI3K/AKT通路作為作用靶點,來評估艾灸不同因素對阿爾茨海默病病理進程的影響。
1 材料與方法
1.1實驗動物及分組本實驗選用5個月齡雄性APP/PS1雙轉基因小鼠作為阿爾茨海默病模型,小鼠體重為(26.32±2.2)g,以具有相同遺傳背景的同月齡雄性野生C57BL/6小鼠作為空白對照組,小鼠體重為(26.62±1.96)g。所有小鼠均為SPF級,購買于北京華阜康生物科技股份有限公司(動物許可證號:SLXK京2009-0007),飼養于北京中醫藥大學SPF屏障實驗室,飼養環境由人工控制,干凈衛生,通風良好,每日光照12 h,定期紫外線消毒,保持環境溫度為20~25 ℃,相對濕度為50%~65%。所有小鼠單籠飼養,予普通飼料喂養(購買自北京維通利華實驗動物有限公司),所有小鼠自由進食飲水。
小鼠適應性喂養1周后,干預8周。將32只APP/PS1小鼠按隨機數字表法分為模型組、艾灸組、艾煙組、無煙灸組,共4組,將8只C57BL/6小鼠作為空白對照組。
1.2主要實驗材料、儀器及試劑定制普通艾條、無煙艾條:規格為直徑0.5 cm×長度20 cm,均購買自河南安陽漢醫艾絨有限公司;自制小鼠固定器:呈拱橋狀,規格約為150 mm×65 mm,底部由白色樹脂片制成,中間留有小孔,可暴露小鼠腹部;拱部由透明有機玻璃制成,四周留有小孔,可供小鼠將頭部、四肢、尾部伸出并固定;自制固定器支架:規格為30 cm×12 cm×30 cm,玻璃材質,上層可放置小鼠固定器,下層可放置艾條;自制玻璃缸:規格為80 cm×80 cm×60 cm,玻璃材質,頂部可揭開,中間留有操作孔,直徑約5 cm;光散射式數字粉塵測試儀:型號為P5L2C,購買自北京賓達綠創科技有限公司;小鼠胰島素受體基底1(IRS-1)ELISA實驗試劑盒(E03I0403),小鼠磷脂酰肌醇(-3)激酶(PI3K)ELISA實驗試劑盒(E03P0185),小鼠蛋白激酶(AKT)ELISA實驗試劑盒(E03P0661),小鼠糖原合成酶激酶3α(GSK-3α)ELISA實驗試劑盒(E03G0264),小鼠胰島素降解酶(IDE)ELISA實驗試劑盒(E03I0332),均購買自上海藍基生物科技有限公司。
1.3實驗步驟適應性喂養1周后,將32只APP/PS1小鼠按隨機數字表法分為模型組、艾灸組、艾煙組、無煙灸組,共4組,將8只C57BL/6小鼠作為空白對照組。參照《實驗針灸學》,采取模擬人體解剖部位與骨度分寸法取小鼠關元穴,予以下實驗干預。
1.3.1空白暴露將空白組與模型組小鼠分別抓取,放入自制固定器中,使其頭部、四肢、尾部固定,關元穴暴露,固定器置于支架上,每日暴露20 min。
1.3.2艾灸、無煙灸干預1)艾灸干預:將小鼠抓取,放入自制固定器中,使其頭部、四肢、尾部固定,關元穴暴露,固定器置于支架上,將點燃的艾條置于固定器下層,使其正對小鼠關元穴,適時調整艾條高度,使艾條頂部與小鼠皮膚距離保持為3~4 cm,艾灸過程中將光散射式數字粉塵測試儀置于支架旁,每隔3 min測量1次,使艾煙濃度穩定在10~15 mg/m3,每日干預20 min。
2)無煙灸干預:將小鼠抓取,放入自制固定器中,使其頭部、四肢、尾部固定,關元穴暴露,固定器置于支架上,將點燃的無煙艾條置于固定器下層,使其正對小鼠關元穴,適時調整艾條高度,使艾條頂部與小鼠皮膚距離保持為3~4 cm,每日干預20 min。
1.3.3艾煙干預將艾煙組小鼠抓取,放入自制固定器中,使其頭部、四肢、尾部固定,關元穴暴露,將固定器放入自制玻璃缸中,將點燃的艾條從玻璃缸蓋上操作孔伸入缸內,使艾煙充滿玻璃缸后迅速拿出艾條,關閉操作孔。將光散射式數字粉塵測試儀置于玻璃缸內,每隔3 min測量1次,使艾煙濃度穩定在10~15 mg/m3,若低于該濃度則通過操作孔補充艾煙,若高于該濃度,則打開操作孔,使艾煙濃度恢復至范圍內,每日干預20 min。
本研究數據均采用SPSS18.0軟件進行統計學分析,數據描述采用(±s)或%表示,計數資料采用χ2檢驗,計量資料采用t檢驗,P<0.05,差異具有統計學意義。
1.3.4取材將所有小鼠用10%水合氯醛腹腔注射麻醉(3 mL/kg),待完全麻醉后,打開小鼠胸腔,將灌注針插入左心室。隨后,緩緩抬起心臟,找到右心房心耳并將其剪開,打開灌流器,慢慢灌注生理鹽水30 mL,待生理鹽水沖洗干凈后,小心開顱剝取小鼠全腦,冰盒上延矢狀縫剖為兩半,一半留取皮質,另一半整塊放入4%多聚甲醛內。
1.3.5標本制作皮質部分按每毫克組織加入5~10 μL裂解液的比例(1∶5~1∶10)加入RIPA裂解液,制成組織勻漿。將勻漿液用低溫離心機離心,保持溫度4 ℃,轉速為12 000 r/min,離心20 min后用移液槍取上清液。
多聚甲醛內的腦組織固定過夜,流水沖洗30 min,用濃度分別為100%、95%、85%、80%的乙醇脫水,二甲苯透明,浸蠟,常規包塊。轉化切片機切片,制備腦冠狀面切片,每片切片厚度約為6 μm。隨后取等間隔的組織切片脫臘脫水,予剛果紅溶液浸染20 min,用堿性乙醇分化,蒸餾水水洗,95%乙醇溶液沖洗,無水乙醇脫水,二甲苯透明,中性樹膠封固。光鏡下(×400)選取細胞數較為恒定的CA3區拍片,比較不同組小鼠的Aβ斑變化。
1.4測試指標及方法采用酶聯免疫吸附法測定腦組織IRS-1、PI3K、AKT、GSK-3α、IDE活性,采用剛果紅染色法測定Aβ淀粉樣蛋白沉淀含量。β淀粉樣蛋白沉淀予剛果紅染色法觀察。
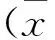
2 結果
2.1各組小鼠皮質中IRS-1、PI3K、AKT、GSK-3α含量比較見表1。

表1 小鼠腦組織中的MDA、NO含量、SOD活性比較
注:與模型組比較*P<0.05,**P<0.01;與無煙灸組比較▽P<0.05。

圖1 各組小鼠皮質區IRS-1含量
各組小鼠皮質區IRS-1含量(見表1,圖1)由高至低分別為:空白組、艾灸組、艾煙組、無煙灸組、模型組。與空白組相比,模型組小鼠大腦皮質IRS-1含量顯著降低(P=0.000);與模型組相比,艾灸組、艾煙組小鼠大腦皮質IRS-1含量升高(P=0.008,P=0.017);艾灸組、艾煙組、無煙灸組之間無統計學意義(P<0.05)。
各組小鼠皮質區皮質區PI3K含量由高至低分別為:空白組、艾灸組、艾煙組、無煙灸組、模型組。與空白組相比,模型組小鼠大腦皮質PI3K含量顯著降低(P=0.000);與模型組相比,艾灸組、艾煙組小鼠大腦皮質PI3K含量升高(P=0.011,P=0.013);艾灸組、艾煙組、無煙灸組之間無統計學意義(P<0.05)。
各組小鼠皮質區AKT含量由高至低分別為:艾灸組、空白組、艾煙組、無煙灸組、模型組。與空白組相比,模型組小鼠大腦皮質AKT含量顯著降低(P=0.000);與模型組相比,艾灸組、艾煙組、無煙灸組小鼠大腦皮質AKT含量升高(P=0.000,P=0.001,P=0.011);與無煙灸組比較,艾灸組AKT含量升高(P=0.032)。
各組小鼠皮質區GSK-3α含量由低至高分別為:空白組、艾灸組、艾煙組、無煙灸組、模型組。與空白組相比,模型組小鼠大腦皮質GSK-3α含量顯著升高(P=0.000);與模型組相比,艾灸組、艾煙組、無煙灸組小鼠大腦皮質GSK-3α含量顯著降低(P=0.002,P=0.018,P=0.048);艾灸組、艾煙組、無煙灸組之間無統計學意義(P<0.05)。
2.2各組小鼠皮質中IDE含量比較見表2。

表2 小鼠腦組織中的IDE含量比較
注:與模型組比較*P<0.05,**P<0.01;與無煙灸組比較▽P<0.05。

圖2 各組小鼠皮質區IDE含量

圖3 空白組皮質中β淀粉樣蛋白沉淀(×20) 圖4 模型組皮質中β淀粉樣蛋白沉淀(×20)

圖5 艾灸組皮質中β淀粉樣蛋白沉淀(×20) 圖6 艾煙組皮質中β淀粉樣蛋白沉淀(×20)
各組小鼠皮質區IDE含量(見表2,圖2)由高至低分別為:空白組、艾煙組、艾灸組、無煙灸組、模型組。與空白組相比,模型組小鼠大腦皮質IDE含量顯著降低(P=0.003);與模型組相比,艾煙組小鼠大腦皮質IDE含量降低(P=0.012);與無煙灸組比較,艾煙組IDE含量升高(P=0.048)。
2.3各組小鼠海馬Aβ沉淀比較經剛果紅染色的APP/PS1小鼠海馬皮質區放大20倍在光學顯微鏡下觀察,空白組小鼠,見圖3。皮質區未見明顯橘紅色染色的物質沉積,細胞排列整齊;模型組小鼠,見圖4。皮質區可見明顯橘紅色Aβ沉積(如箭頭所指),呈點斑片狀,大小不一,細胞排列較散亂、稀疏;艾灸組小鼠,見圖5。皮質區可見少量橘紅色Aβ沉積(如箭頭所指),呈點斑片狀,大小不一,細胞排列較整齊;艾煙組小鼠,見圖6。皮質區可見少量橘紅色Aβ沉積(如箭頭所指),呈點斑片狀,大小不一,細胞排列較整齊;無煙灸組小鼠,見圖7。皮質區可見少量橘紅色Aβ沉積(箭頭所指),呈點斑片狀,大小不一,細胞排列較整齊。

圖7 無煙灸組皮質中β淀粉樣蛋白沉淀(×20)表3 各組小鼠腦組織海馬中淀粉樣 蛋白陽性面積比較(μm2)

組別鼠數淀粉樣蛋白陽性面積(μm2)空白組8877.79±132.59**模型組813640.42±2756.22艾灸組73228.12±578.99**艾煙組83660.92±846.34**無煙灸組73446.23±237.18**
注:與模型組比較**P<0.01。

圖8 各組小鼠腦組織海馬中淀粉樣 蛋白陽性面積比較(μm2)
各組小鼠皮質中Aβ淀粉樣沉淀面積(見表3,圖8)由大到小分別為:模型組、艾煙組、無煙灸組、艾灸組、空白組。與空白組相比,模型組小鼠大腦皮質β淀粉樣蛋白沉淀陽性面積顯著增大(P=0.000);空白組、艾灸組、艾煙組、無煙灸組小鼠均較模型組小鼠陽性面積有顯著減少(P=0.000,P=0.000,P=0.000,P=0.000);艾灸組、艾煙組、無煙灸組之間無統計學意義。
3 討論
磷脂酰肌醇3激酶/蛋白激酶B(Phosphatidylinositol-3-kinase/AKT,PI3K/AKT)信號通路是人體最重要的信號通路之一,它在人體起著承上啟下的作用,人體血糖濃度的調節和胰島素的釋放都需要通過該通路完成[8-9]。向上游看,PI3K/AKT信號通路接受腦內胰島素信號的傳導,并發揮重要作用。外周胰島素通過血腦屏障進入大腦后,人體自身中樞神經系統的神經元也可以在腦內合成胰島素,釋放和在釋放神經遞質,參與長時程記憶的鞏固,同時也在神經元的分化,神經細胞的生長、增殖和修復中發揮著重要作用[10]。當胰島素受體減少,或胰島素受體對胰島素失敏時,可發生類似于阿爾茨海默病的輕型記憶功能減退。同時,臨床研究發現,高達60%的AD患者伴隨有與2型糖尿病密切相關的醫學癥狀,例如高血糖、胰島素抵抗等等,均可表明阿爾茨海默病與PI3K/AKT通路有密切的聯系[11]。
胰島素受體底物-1(Insulin Receptor Stubstrate-1,IRS-1)蛋白是調節腦內胰島素信號轉導的最上游的信號轉導蛋白,胰島素與胰島素受體結合時可使其激活,并發生自身磷酸化,酪氨酸磷酸化的IRS轉化細胞調節生長、代謝下游PI3K,刺激葡萄糖轉換[12]。IRS-1蛋白在腦組織結構和功能維護起關鍵性作用,IRS-1基因敲除小鼠會表現出體積較小,尤其是腦質量顯著減低的特點[13]。IRS-1的含量減少,表明維持神經元存活和代謝的有效激活下游通路的功能障礙。
IRS激活后的下游信號轉導通路,則主要由PI3K途徑來完成。P13K是一種胞內磷脂酰肌醇激酶,AKT也是一個重要的蛋白激酶,是PI3K/AKT信號通路中最重要的下游靶目標,具有抗調亡的作用[14-15]。有研究報道,只有激活AKT的表達才能維持細胞的生存。AKT可以通過激活下游底物蛋白,促使其磷酸化,保護神經元,以發揮其抗凋亡的作用;同時,AKT可以直接起到保護線粒體的功能,通過保護完整的膜電位,來達到抑制調亡的目的[16]。
PI3K/AKT信號通路可調節糖原合酶激酶-3(Glycogen Synthase Kinase-3,GSK-3)的活性。GSK-3是一種多功能的絲氨酸/蘇氨酸蛋白激酶,在中樞神經系統中起著非常重要的作用[17-19]。GSK-3在哺乳動物體內主要分為GSK-3α和GSK-3β 2種亞型,其中GSK-3α參與調節γ分泌酶,通過針對γ分泌酶特異性底物或接近其復合物的底物來調節γ分泌酶的活性,促使Aβ生成。Ryan等也證實了GSK-3α可以通過增加細胞內成熟的APP,導致AD發病[20];被激活的GSK-3β則可作用于Tau蛋白,使其過度磷酸化并導致神經纖維纏結[21-23],這兩方面均能加快阿爾茨海默病的進程。因此當PI3K/AKT信號通路被上調時,AKT激酶會發生磷酸化,AKT的活性被激活,能起到抑制GSK-3α的活性的作用,從這個方向起到抑制Aβ淀粉沉淀生成、阻止細胞調亡的作用。以上過程共同決定了β淀粉樣蛋白通過PI3K/AKT通路生成的情況。
同時,正常情況下,腦內Aβ沉淀的水平既取決于腦內Aβ的生成程度,也取決于其清除程度,Aβ可由多種細胞產生,循環于血液、腦脊液和腦間質液中,大部分與侶伴蛋白分子結合,少數以游離狀態存在。腦內Aβ清除有多種渠道,Aβ從神經元產生后,可通過酶降解、細胞吞噬隔離和向腦脊液(CSF)、外周血液轉運等途徑進行清除,當患者罹患阿爾茨海默病時,Aβ淀粉沉淀的生成消除平衡被打破,因此代謝處于失衡狀態,進一步加重阿爾茨海默病的進程。
胰島素降解酶(Insulin Degrading Enzyme,IDE)則為Aβ清除機制中重要的一種Aβ降解酶,與能量代謝密切相關[24-25]。IDE在人體內廣泛表達,在代謝較快的肝臟、腎臟、腦組織、肌肉和睪丸組織中表達最為豐富。研究發現IDE可以降解多種小分子多肽,如胰島素、胰高血糖素、轉化生長因子、P-內啡肽等[26-27]。腦內神經元和小膠質細胞可以分泌的IDE,降解Aβ[28],通過對IDE基因敲除小鼠Aβ含量的測量發現,不能正常合成IDE則會造成Aβ降解的減少,其減少程度高達50%[29-30]。胰島素和Aβ同時屬于IDE反應的底物,但胰島素對IDE的親和力要遠遠大于Aβ對IDE的親和力,因此當機體產生胰島素抵抗,胰島素代償性分泌含量升高時,過量的胰島素會競爭性的與IDE結合,抑制IDE與Aβ的結合,間接抑制了IDE對Aβ的降解,促進了Aβ的聚集。
本實驗模型組中,8個月齡的APP/PS1小鼠,相較同月齡的C57BL/6小鼠,皮質中IRS-1含量、PI3K含量、AKT含量均下降,GSK-3α含量上升,且差異有統計學意義,說明APP/PS1小鼠腦內PI3K/AKT通路已造成損傷。艾灸、艾煙組可使IRS-1、PI3K含量上升,艾灸、艾煙、無煙灸組可使AKT含量上升、GSK-3α含量下降,說明艾灸、艾煙、無煙灸均可調整PI3K/AKT通路,抑制皮質Aβ生成,且三者作用強度無統計學意義。8月齡的APP/PS1小鼠,相較同月齡的C57BL/6小鼠,皮質中IDE含量下降,且差異有統計學意義,說明APP/PS1小鼠腦內IDE介導的Aβ清除機制已造成損傷。艾煙組可使IDE含量上升,且差異有統計學意義,艾灸、無煙灸組也表現出升高IDE含量的趨勢,說明艾灸、艾煙、無煙灸均可通過加強Aβ淀粉蛋白清除程度,來抑制皮質Aβ生成,且艾煙組表現出的改善作用最強。
[1]Querfurth HW,LaFerla FM.Alzheimer′s disease[J].N Engl J Med,2010,362(4):329-344.
[2]Burns A,Iliffe S.Alzheimer′s disease[J].BMJ,2009,April.doi:10.1136/bmj.b1349.
[3]Prince M,Albanese E,Guerchet M,et al.World Alzheimer Report 2014-Dementia and Risk Reduction:An analysis of protective and modifiable factors; Alzhermer′s Disease International(ADI):London,UK,2014.
[4]靳然,趙百孝,于密密,等.艾燃燒生成物組分固相微萃取氣相色譜質譜法定性分析[J].北京中醫藥大學學報,2011,34(9):632-636.
[5]靳然,于密密,趙百孝,等.氣相色譜法測定艾葉4個揮發性成分的含量[J].藥物分析雜志,2013,33(6):1033-1036.
[6]許煥芳,趙百孝.艾灸療法作用機理淺述[J].上海針灸雜志,2012,31(1):6-9.
[7]朱斌,陳靜,秦紅芳,等.APP/PS1雙轉基因老年性癡呆小鼠早期病理和認知行為變化[J].廣州中醫藥大學學報,2012,29(2):193-196,226.
[8]Monte D S M D L.Contributions of brain insulin resistance and deficiency in amyloid-related neurodegeneration in Alzheimer′s disease[J].Drugs,2012,72(1):49-66.
[9]Muta,Kenjiro,Morgan,et al.p110alpha subunit of PI3K is a crucial component of brain insulin receptor signaling in regulating lumbar sympathetic nerve traffic[J].Jurnalul De Chirurgie,2009,106(11):965-970.
[10]Sm D L M.Insulin resistance and Alzheimer′s disease[J].Bmb Reports,2009,42(8):475-481.
[11]Infantegarcia C,Ramosrodriguez J J,Galindogonzalez L,et al.Long-term central pathology and cognitive impairment are exacerbated in a mixed model of Alzheimer′s disease and type 2 diabetes[J].Psychoneuroendocrinology,2015,65:15-25.
[12]Niswender K D,Stearns W H,Meyers M G,et al.Evidence for IRS-PI3K signaling in the hypothalamic response to insulin and leptin[J].Diabetes,2001,50:A13-A13.
[13]Araki E,Lipes M A,Patti M E,et al.Alternative pathway of insulin signalling in mice with targeted,disruption of the IRS-1 gene[J].Nature,1994,372(6502):186-190.
[14]Moloney A M,Griffin R J,Timmons S,et al.Defects in IGF-1 receptor,insulin receptor and IRS-1/2 in Alzheimer′s disease indicate possible resistance to IGF-1 and insulin signalling[J].Neurobiology of Aging,2010,31(2):224-243.
[15]Steen E,Terry B M,Rivera E J,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer′s disease——is this type 3 diabetes?[J].Journal of Alzheimers Disease Jad,2005,7:63-80.
[16]Bijur G N,Jope R S.Rapid accumulation of Akt in mitochondria following phosphatidylinositol 3-kinase activation[J].Journal of Neurochemistry,2003,87(6):1427-1435.
[17]Sofola O,Kerr F,Rogers I,et al.Inhibition of GSK-3 Ameliorates Aβ Pathology in an Adult-Onset,Drosophila,Model of Alzheimer′s Disease[J].Plos Genetics,2010,6(9):e1001087.
[18]Noh M,Koh S Y,Kim H,et al.Neuroprotective effects of donepezil through inhibition of GSK-3 activity in amyloid-beta-induced neuronal cell death[J].Journal of Neurochemistry,2009,108(5):1116-1125.[19]Pena-Ortega F,Solis-Cisneros A,Ordaz B,et al.Amyloid beta 1-42 inhibits entorhinal cortex activity in the beta-gamma range:role of GSK-3[J].Current Alzheimer Research,2012,9(7):857-863.
[20]Ryan K A,Pimplikar S W.Activation of GSK-3 and phosphorylation of CRMP2 in transgenic mice expressing APP intracellular domain[J].Journal of Cell Biology,2005,171(2):327-335.
[21]Xie H Q,Litersky J M,Hartigan J A,et al.The interrelationship between selective tau phosphorylation and microtubule association[J].Brain Research,1998,798(1-2):173-183.
[22]Wang J Z,Zhang Y.Configuration-specific immunotherapy targeting cis,pThr231-Pro232 tau for Alzheimer disease[J].Journal of the Neurological Sciences,2015,348(s 1-2):253-255.
[23]Sivaprakasam P,Han X,Civiello R L,et al.Discovery of new acylaminopyridines as GSK-3 inhibitors by a structure guided in-depth exploration of chemical space around a pyrrolopyridinone core[J].Bioorganic & Medicinal Chemistry Letters,2015,25(9):1856-1863.
[24]Pérez A,Morelli L,Cresto J C,et al.Degradation of Soluble Amyloid β-Peptides 1-40,1-42,and the Dutch Variant 1-40Q by Insulin Degrading Enzyme from Alzheimer Disease and Control Brains[J].Neurochemical Research,2000,25(2):247-255.
[25]Vekrellis K,Ye Z,Qiu W Q,et al.Neurons regulate extracellular levels of amyloid beta-protein via proteolysis by insulin-degrading enzyme[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,2000,20(5):1657-1665.
[26]Shen Y,Joachimiak A,Rosner M R,et al.Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism[J].Nature,2006,443(7113):870-874.
[27]Wang D S,Dickson D W,Malter J S.β-Amyloid Degradation and Alzheimer′s Disease[J].Biomed Research International,2006(3):58406.
[28]Leissring M A.Enhanced Proteolysis of β-Amyloid in APP Transgenic Mice Prevents Plaque Formation,Secondary Pathology,and Premature Death[J].Neuron,2003,40(6):1087-1093.
[29]Qiu W Q,Walsh D M,Ye Z,et al.Insulin-degrading enzyme regulates extracellular levels of amyloid beta-protein by degradation[J].Journal of Biological Chemistry,1998,273(49):32730-32738.
[30]Farris W,Mansourian S,Yang C,et al.Insulin-degrading enzyme regulates the levels of insulin,amyloid β-protein,and the β-amyloid precursor protein intracellular domain in vivo[J].Proc Natl Acad Sci U S A,2003(7):4162-4167.
(2016-06-28收稿責任編輯:洪志強)
Effect of Different Factors of Moxibustion on PI3K/AKT Signal Pathway and Cortical β-amyloid Protein Precipitation in Brain Tissue of Alzheimer Mice
Liu Yaomeng, Liu Juntian, Huang Chang, Han Li, Zhao Baixiao
(BeijingUniversityofChineseMedicine,SchoolofAcupuncture-MoxibustionandTuina,Beijing100029,China)
Objective:To observe the effect of smoking moxibustion, none-smoking/ heat moxibustion and moxa smoke on PI3K/AKT signal pathway and cortical β-amyloid protein precipitation and discuss the mechanism of them in preventing and treating Alzheimer. Methods: Eight wide-type C57BL/6 normal mice served as normal control group, and 32 APP/PS1 Alzhermer model mice were randomly divided into four groups (n=8/group): 1) No-treatment control group, 2) Moxibustion group, 3) Moxa smoke group, 4) one-smoking moxibustion/heat group. The treatment were given 20 mins a day, 6 days a week for 8 weeks. In group 2 and 3, the moxa stick was pointed above acupoint Guanyuan(CV4). In group 3, mice were exposed to moxa smoke (10~15 mg/m3). However in group 1 and normal control group, no treatment was given. ELISA technique was used to detect the level of IRS-1, PI3K, AKT, GSK-3α, and IDE. In addition, β-amyloid was evaluated using Congo red staining.Results: Compared to group 1, mice in group 2, group 3 and group 4 had significant higher levels of IRS-1, PI3K, AKT and lower levels of GSK-3α (P<0.05). Comparing with group 1, mice in group 4 had significant higher levels of IDE (P<0.05). Mice in group 1 expressed great aggregation of β-amyloid while mice in normal control group had none aggregation of β-amyloid (P<0.05). Mice in group 2, group 3, group 4 had less aggregation of β-amyloid (P<0.05). Conclusion: Moxibustion, moxa smoke and heat-treatment moxibustion play equal role of delaying the pathological process Alzheimer′s disease by PI3K/AKT pathway and can induce less aggregation of β-amyloid.
Alzheimer′s disease; Moxibustion; Moxa smoke; Heat-treatment moxibustion; PI3K/AKT pathway; IDE
國家自然科學基金項目(編號:81373730);國家青年自然基金項目(編號:81403449);國家自然科學基金項目(編號:81574068);國家國際科技合作專項項目(編號:2011DFA31370)
劉耀萌(1990—),女,2013級碩士研究生
趙百孝(1963.03—),博士,教授,博士研究生導師,北京中醫藥大學針灸推拿學院院長,研究方向:艾灸作用與原理,Tel:(010)64286737,E-mail:baixiao100@vip.sina.com
R245.81
A
10.3969/j.issn.1673-7202.2016.08.002

