蜂膠對煙曲霉抑菌機制的體外研究
沈 菲 陳藝杰 徐曉蘭 繆曉青 吳珍紅
(1福建農林大學,福州350002;2福建農林大學蜂療研究所,福州 350002;3天然生物毒素國家地方聯合工程實驗室,福州 350002)
蜂膠對煙曲霉抑菌機制的體外研究
沈菲1,2陳藝杰1,2徐曉蘭1,2,3繆曉青1,2,3吳珍紅1,2,3
(1福建農林大學,福州350002;2福建農林大學蜂療研究所,福州 350002;3天然生物毒素國家地方聯合工程實驗室,福州 350002)
探討蜂膠對煙曲霉的抗菌作用及其作用機制,為蜂膠臨床治療由煙曲霉引起的疾病提供參考依據。本文采用不同濃度(10、20、30、40、50、100、150、200 mg/ml)的蜂膠乙醇提取物(EEP)處理煙曲霉孢子,結果發現,其存在劑量依賴性,接著瓊脂稀釋法測定蜂膠的最小抑菌濃度(MIC),將煙曲霉與1/2MIC50EEP孵育3d后發現,蜂膠組煙曲霉菌絲的重量和呼吸速率顯著低于對照組,且蜂膠組孢子的超微結構嚴重受損。通過半定量PCR分析磷脂腺肌醇信號通路相關的表達情況,發現蜂膠組PKC基因與對照組相比呈現下調趨勢。這些結果暗示,蜂膠能夠抑制煙曲霉的生長,具有治療由煙曲霉引起的疾病的潛力,是一種有前途的生物活性化合物。
蜂膠;煙曲霉;體外研究;PKC;作用機制
引言
蜂膠是蜜蜂采集膠源植物芽孢或樹脂,與上顎腺、蠟腺分泌物混合加工得到的具有特殊芳香性的膠狀產物[1],含有類黃酮、氨基酸、維生素等多種成分[2]。它擁有廣泛的生物屬性,包括抗氧化[3]、抗菌[4]、消炎[5]、保肝[6]、抗腫瘤[7]及免疫調節[8]等。最常見的應用之一就是其對許多革蘭氏陽性和革蘭氏陰性細菌、酵母和真菌的抗菌活性。最近,一些研究表明,蜂膠具有很強的抗真菌活性,如抑制炭疽菌的遺傳轉化及球二孢屬、意大利青霉和青霉屬的生長[9]。
煙曲霉是淺部感染的常見病原菌,主要感染免疫低下患者,其導致的侵襲性曲霉病死亡率達到30~90%。同時煙曲霉也會侵襲皮膚,導致皮膚發炎[10]。目前治療由煙曲霉引起的疾病的藥物主要是化學合成的。隨著這些藥物的廣泛應用,在抗真菌治療中遇到了耐藥性、不良反應多等問題,導致治療真菌感染越來越困難,因此迫切需要尋找天然的抗真菌藥物[11]。
蛋白激酶C(PKC)是由相關蛋白構成的一個大家族[12],參與酵母菌菌絲及哺育動物細胞周期進程的調控和信號傳導[13]。同時PKC參與磷脂酰肌醇信號通路,調節Ca2+離子通路,為生物的生長發育的重要途徑[14]。
蜂膠為天然產品,具有廣譜抗菌、不良反應小、較少出現耐藥等優點。因此,蜂膠可以用于治療真菌引起的疾病。雖然蜂膠抗真菌的研究開發已引起人們的重視,但主要還是局限于蜂膠對白色念珠菌的抑制作用,對其機制的研究和報道很少[15-19]。因此,深入研究蜂膠對煙曲霉的抑菌機理,尋找蜂膠對煙曲霉的作用靶點,為蜂膠治療由煙曲霉引起的疾病提供科學依據。
1 材料
煙曲霉分離株,分離號:AS3.3572,購自上海北諾生物科技有限公司。毛膠購自神蜂科技開發有限公司,陽性藥物伊曲康唑購自某藥店。乳酸酚棉藍染色液為上海源葉生物科技有限公司。微量呼吸儀,SKW-3型,上海科技大學。
2 方法
2.1EEP的制備
將毛膠置于-20℃冰箱中冷凍2 h以上,經粉碎機粉碎后,過80目篩網,粉末按料液比為1∶4加入70%乙醇(v/v),25℃恒溫振蕩48 h后,過濾除雜,40℃真空旋轉蒸發去除酒精,然后放入60℃烘箱干燥至恒重,得到蜂膠浸提膏。用時,70%乙醇配成不同濃度,0.22μm無菌過濾膜過濾滅菌。
2.2孢子懸液的制備
煙曲霉在35℃的恒溫箱中培養3天后,用0.1%的吐溫80的生理鹽水沖洗培養基,無菌紗布除去洗脫液中的菌絲,用血球細胞計數板調整分生孢子懸液的濃度為1.0×106~5.0×106CFU/ml,4℃保存24 h。
2.3不同濃度EEP抑制煙曲霉生長
利用打孔瓊脂培養法分別測定濃度為10、20、30、40、50、100、150 mg/ml的EEP對煙曲霉菌的抑菌圈大小。70%乙醇作為陰性對照,無菌水作為空白對照,伊曲康唑作為陽性對照。
2.4瓊脂稀釋法測定EEP的MIC
EEP按不同體積加入到培養基中,使其終濃度分別為:100 μg/ml、200 μg/ml、300 μg/ml、400 μg/ml、500 μg/ml、1000μg/ml。待冷卻至室溫后,用槍頭吸取5μL孢子懸液扎入培養基中,同時設立溶劑組(加70%乙醇),陽性對照組(添加伊曲康唑),陰性對照組(不加藥物也不加孢子懸液),空白對照組(加無菌水)。35°C連續培養7 d后觀察結果,將固體培養基中無菌落生長的濃度確定為最小抑菌濃度(MIC)。
2.5EEP對煙曲霉菌絲重量及細胞超微結構的影響
2.5.1菌絲稱量
所有菌絲體采用液體培養,加入EEP,使其終濃度為1/2MIC50,加入孢子懸液,使其終濃度為106CFU/ml,同時設立如2.4所示的溶劑組、陽性對照組、空白對照組。35°C、180rpm培養3d后收集菌絲,用pH=7.4的無菌PBS12000rpm離心10min,共漂洗3次,棄去廢液,將菌絲挑出移到一干凈的離心管中,置于干燥箱中干燥至恒重后,稱量菌體干重。
2.5.2顯微觀察
用接種針挑取實驗2.4中1/2MIC50平板上的煙曲霉孢子到載玻片上,用乳酸酚棉藍染色。將載玻片置于普通光學顯微鏡觀察,比較其菌絲及孢子形態和孢子數量的變化。
2.6EEP對煙曲霉呼吸的影響
煙曲霉的呼吸率表示為耗氧量。耗氧量測量是利用微量呼吸儀進行測定的。具體方法如下,0.1ml 1.0× 106CFU/ml孢子懸液和EEP添加進10ml PDA液體培養基中,混勻后吸取2ml到微量呼吸瓶中,添加0.5 ml 0.1mol/L的NaOH吸收瓶中,吸收瓶中另加1×3cm的濾紙片,以增大吸收面。整個反應裝置在35℃水浴搖動培養,每4h記錄液面下降的高度。通過公式:
XO2=K·h(1)
其中:XO2為耗氧量 (uL/h),K為反應瓶常數,h為測壓管開口端液面下降量。
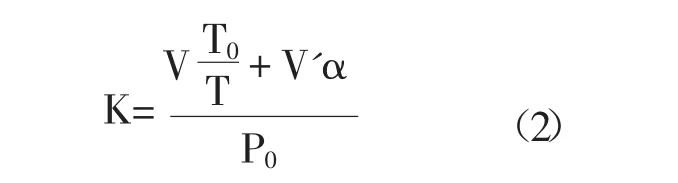
其中:K為反應瓶常數,V為反應瓶至測壓臂右端規定刻度之空間容積減去V'和NaOH溶液、濾紙的體積,V'加入反應瓶中的溶液量,T0為273+水浴溫度(35℃),T為273,α為O2在37℃下液體中的溶解度,P0在一個大氣壓下,壓力計中膽酸鈉液面應呈現的高度,通常以1000計算。
未添加EEP作為空白對照組,添加70%乙醇作為溶劑組。
2.7RNA提取和RT-PCR
1/2MIC50EEP處理煙曲霉后,離心收集菌絲,利用TransZol up(北京全式金有限公司)提取菌絲體的RNA,參照TaKaRa公司PrimeScripTM RT reagent Kit with gDNA Eraser試劑盒合成cDNA。然后用北京艾德萊生物技術有限公司super PCR mix反應體系進行半定量PCR。以GAPDH為內參,引物序列如下。GAPDHF:5’-GAAGAGTGCGACCTATGA-3’和GAPDHR:5’-CGAGATACCAGCCTTGATA-3’)及PKCF:5’-AAGTTCTGTTGGCTCTCA-3’和PKCR:5’-AATCTTGATGTGTCCGTCTA-3’)。PCR條件為:94℃預變性3 min,然后94℃變性30 s,60℃退火30 s,72℃延伸10 min,共36個循環,循環結束后72℃保持10 min。PCR結束后,取5 μL進行瓊脂糖電泳檢測,將瓊脂糖膠拍照后對其條帶用J Image軟件進行灰度分析。
3 數據分析
4 結果
4.1不同濃度EEP對煙曲霉抑制作用
不同濃度蜂膠處理煙曲霉后,蜂膠組抑菌圈直徑顯著高于對照組(P<0.05),且呈現劑量依賴性,但是當蜂膠濃度達到100 mg/ml時達到飽和狀態(如圖1)。
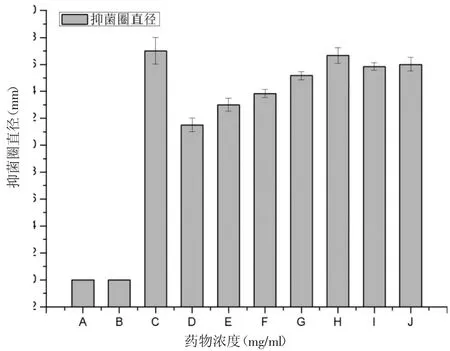
圖1 不同濃度EEP對煙曲霉抑菌圈直徑的影響注:A表示無菌水;B表示溶劑組;C表示陽性對照組;D、E、F、G、H、I、J分別表示10、20、30、40、50、100、150 mg/ml的EEP。
4.2平板稀釋法測定EEP對煙曲霉的MIC
本文比較了煙曲霉在蜂膠含量不同的PDA平板上7d的生長情況,結果顯示當EEP濃度為1000μg/ml時,煙曲霉不能生長,即EEP的MIC為1000μg/ml(圖2)。從圖2中可以看出:空白對照組的生長速度明顯要快于蜂膠組。
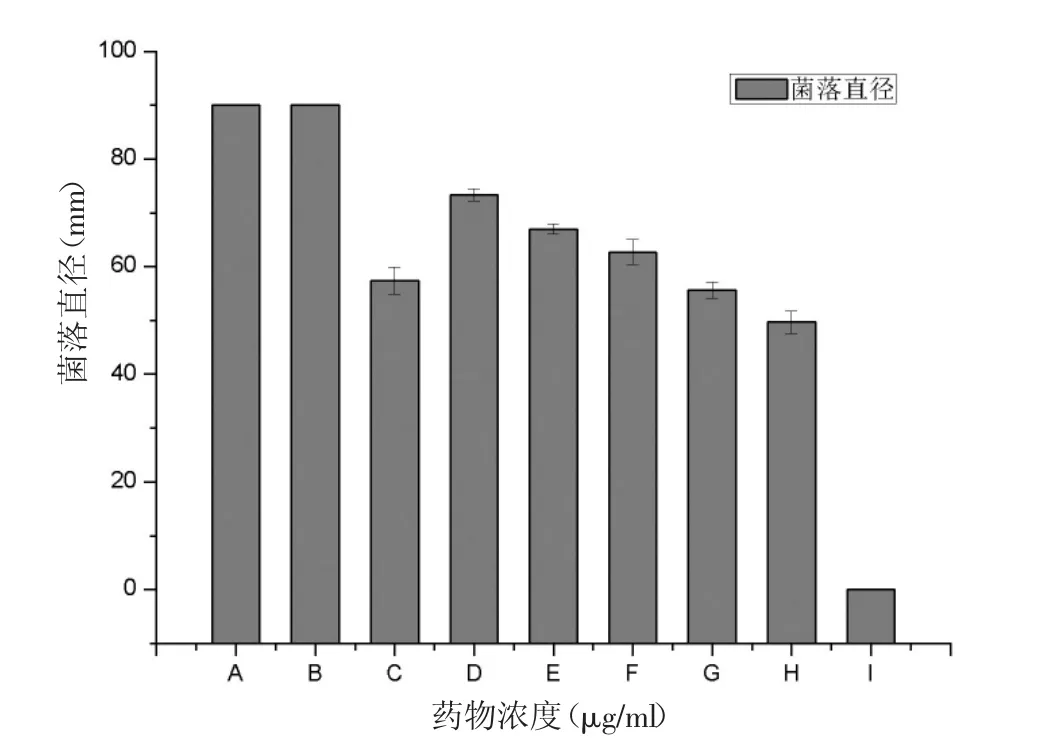
圖2 蜂膠抗煙曲霉瓊脂平板稀釋法藥敏實驗注:A表示空白對照組;B表示溶劑組;C表示陽性對照組;D、E、F、G、H、I分別表示 100、200、300、400、500、1000μg/ml的EEP。
4.3EEP對煙曲霉菌絲重量及超微結構的影響
表1 蜂膠對煙曲霉菌絲重量的影響(±s)

表1 蜂膠對煙曲霉菌絲重量的影響(±s)
注:與空白對照組相比,*P<0.05;n=3
組別 干重(mg)空白對照組 583.0667±10.9294陽性對照組 97.2667±25.34252*溶劑組 444.9333±1.30512*蜂膠組 16.0000±2.45561*
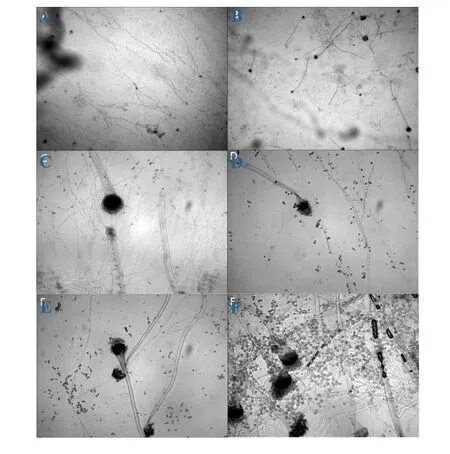
圖3 蜂膠對煙曲霉形態的影響注:A、C表示空白對照組,B、D、E、F表示500μg/ml蜂膠處理組
表1結果表明,對照組煙曲霉的干重為583.0667± 10.9294 mg,而蜂膠組的干重為16.0000±2.4556 mg,陽性對照組的干重為97.2667±25.3425 mg。說明蜂膠和伊曲康唑都抑制了煙曲霉的生長。
乳酸酚棉蘭染色后,在200和400倍光學顯微鏡下可以清楚的看到空白對照組和蜂膠組的煙曲霉,其顯微結構存在顯著差異(圖3):正常煙曲霉的分生孢子梗無分隔,分生孢子頭為柱狀,頂囊呈半圓形,菌絲排列整齊(圖3-A、C);而蜂膠作用后的煙曲霉形態發生了改變,在圖3-B、D、E、F組中,可以看出此時的煙曲霉的分生孢子鏈變長,分生孢子梗出現分隔(圖3-F),部分細胞頂囊發育不完全(圖E);從圖3-A、B的對比可以看出,蜂膠組的煙曲霉菌絲明顯較空白對照組煙曲霉菌絲不規則。
4.4EEP對煙曲霉呼吸的影響
如圖4所示,蜂膠明顯降低煙曲霉孢子的呼吸率。培養20 h后,蜂膠組煙曲霉的耗氧速率(2.067±0.5686 μL/h)顯著低于空白對照組(6.000±0.2646 μL/h)。因此,蜂膠干擾煙曲霉孢子萌發和菌絲的生長階段的能量代謝系統。
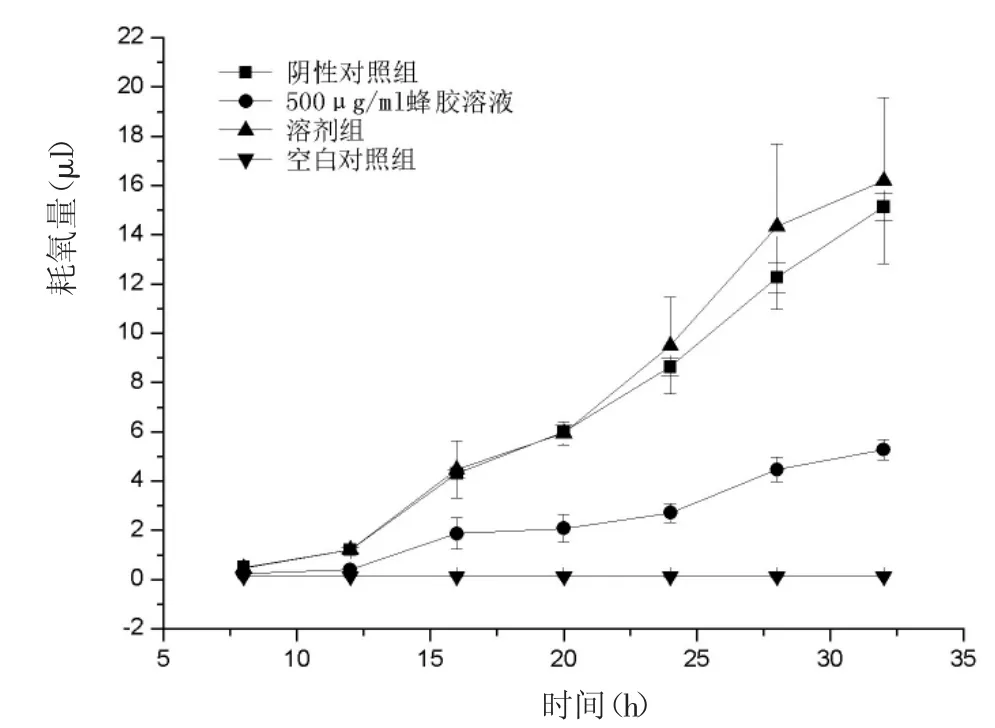
圖4 EEP對煙曲霉呼吸的影響
4.5EEP對煙曲霉PKC基因的影響
將圖5中得到的瓊脂糖電泳圖各條帶進行灰度分析,將目標基因PKC條帶的灰度值與內參基因GAPDH進行比較,發現煙曲霉PKC基因在實驗組中比對照組中表達降低了37.2倍(圖6)。因此,蜂膠對煙曲霉PKC基因的表達有下調作用,推測蜂膠可以通過抑制煙曲霉PKC基因的表達抑制煙曲霉菌的生長。
5 討論與結論
蜂膠是一種比較復雜的化合物,可能的單體化合物有200多種,其中最主要的兩大類成分為黃酮和酚酸。現目前能夠分離出來的活性成分主要有咖啡酸酯、高良姜素、咖啡酸苯乙酯、松屬素等。高良姜素、咖啡、肉桂酸是蛋白酶抑制劑,負責阻止細菌生長和增殖。其他黃酮類化合物,如槲皮素,影響膜電位,從而導致細胞膜透性上升,抑制細菌活性。很明顯,蜂膠的抗菌活性的機制是復雜的[20]。蜂膠具有抗真菌活性主要歸功于黃酮類、酚酸類以及酯類,這些化合物統稱酚類化合物[21]。黃酮類成分中高良姜素、松屬素、槲皮素等已確認對真菌有很強的抑制作用[22];最近,Agüero等人從阿根廷當地的蜂膠中分離出來的木酚素、白楊素、松屬素和高良姜素鑒定為當地蜂膠的主要抗真菌化合物[23]。酚酸類物質及其衍生物也表現強烈的活性,Boonsai等從泰國意蜂蜂膠中分離出了腰果酚,發現腰果酚是泰國意蜂蜂膠的主要抗菌化合物之一,該結果與Silva等研究的巴西蜂膠中抗菌化合物結果一致,酚類化合物的含量越高,抗菌效果越好[24-25]。萜類物質也有很強的抑菌作用:Sirikarn等從Tetragonula laeviceps蜂膠中分離出氧雜蒽酮,三萜烯和木酚素。其中三萜烯是這種蜂膠的主要抗菌活性成分[26]。
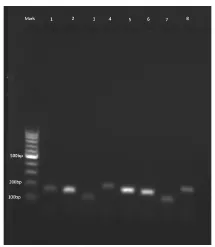
圖5 煙曲霉PKC基因半定量PCR瓊脂糖電泳圖
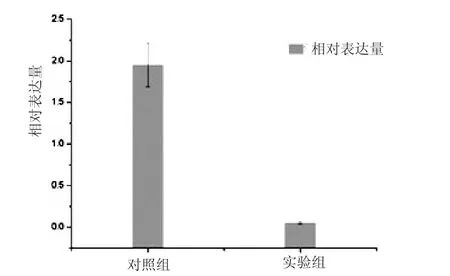
圖6 EEP對煙曲霉PKC基因的影響
FaLcao等人研究了不同蜜源植物的蜂膠對三種真菌的抑制作用,其中對煙曲霉的抗菌活性最強,且隨著酚類物質含量的不同,抗菌活性也有所不同[15]。該結果與本文的研究結果相同,隨著蜂膠濃度的升高,酚類物質的含量也相應升高,所形成的抑菌圈也相應的增大,當濃度達到100 mg/ml時,蜂膠在瓊脂平板中的擴散達到飽和。
煙曲霉的繁殖周期分為二個時期:茵絲發育的營養生長期和產生分生孢子的無性繁殖期[27]。因此,影響煙曲霉繁殖周期都會導致煙曲霉的生長受到抑制。本文的研究結果首次表明,蜂膠可以改變煙曲霉的形態,使其產孢率減少,從而抑制煙曲霉的繁殖與生長。通過電子顯微鏡觀察(如圖3-B、D、E、F),得出很有可能是蜂膠通過某些抗菌活性物質通過滲透方式進入煙曲霉細胞內,干擾細胞內的某些信號通路和相關基因的表達,抑制煙曲霉的生長及分生孢子的產生,從而達到抑制煙曲霉的目的。
呼吸是大多數微生物萌發和生長過程中所需的能量主要來源,破壞微生物的能量系統是某些藥物具有抗菌活性機制之一,如殼聚糖、甘草查爾酮A和C[28-30]。有研究表明,蜂膠中的松屬素對意大利青霉呼吸會產生影響,松屬素通過直接抑制線粒體的呼吸,導致ATP、能量載體減少,進而導致煙曲霉的代謝紊亂[9]。本文首次提出蜂膠抑制煙曲霉的呼吸,抑制孢子萌發與菌絲的生長,干擾菌體的能量代謝系統。
PKC參與磷脂酰肌醇信號通路,參與Ca2+的調節[14]。在磷脂酰肌醇信號通路中磷脂酶C(PLC-β)與PKC為最主要的調控蛋白之一,活化的PLC-β使4,5-二磷酸磷脂酰肌醇(PIP2)水解成1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DG),DG可活化PKC,IP3與其配體結合打開鈣調磷酸酶信號通路。PKC可以使絲氨酸/蘇氨酸殘基磷酸化,導致不同的細胞產生不同的反應,如細胞分泌、細胞增殖和分化等[31]。因此,當PKC基因表達受到抑制后,就會導致鈣調通道及其磷脂酰肌醇信號通路受到影響,可能會導致煙曲霉生長受到抑制。
[1]王儲炎,范濤,吳傳華,等.蜂膠的研究[J].農產品加工.學刊,2009 (1):16-18.
[2]Bankova V S,de Castro S L,Marcucci M C.Propolis:recent advances in chemistryand plant origin[J].Apidologie,2000,31(1):3-16.
[3]Lima B,Tapia A,Luna L,et al.Main flavonoids,DPPH activity,and metal content allowdetermination ofthe geographical origin ofpropolis from the province of San Juan Argentina[J].Journal of agricultural and food Chemistry,2009,57(7):2691-2698.
[4]Majiene D,Trumbeckaite S,Pavilonis A,et al.Antifungal and antibacterial activity of propolis[J].Current Nutrition&Food Science,2007,3(4):304-308.
[5]Büyükberber M,Sava MC,Ba ci C,et al.The beneficial effect of propolis on cerulein-induced experimental acute pancreatitis in rats[J].Turk J Gastroenterol,2009,20(2):122-8.
[6]杜夏,孫麗萍,徐響.蜂膠及活性成分保肝作用的研究進展[J].食品科學,2012,33(5):305-308.
[7]Kawabe M,Lin C,Kimoto N,et al.Modifying effects of propolis on MeIQx promotion of rat hepatocarcinogene sis and in a female rat two-stage carcinogenesis model after multiple carcinogen initiation[J]. Nutrition and cancer,2000,37(2):179-186.
[8]Sforcin J M.Propolis and the immune system:a review[J].Journal ofethnopharmacology,2007,113(1):1-14.
[9]Peng L,Yang S,Cheng Y J,et al.Antifungal activity and action mode of pinocembrin from propolis against Penicillium italicum[J]. Food Science and Biotechnology,2012,21(6):1533-1539.
[10]Jousson O,Léchenne B,Bontems O,et al.Secreted subtilisin gene familyin Trichophyton rubrum[J].Gene,2004,339:79-88.
[11]Iwazaki R S,Endo E H,Ueda-Nakamura T,et al.In vitro antifungal activity of the berberine and its synergism with fluconazole[J]. Antonie van Leeuwenhoek,2010,97(2):201-205.
[12]張文玲,黃秀英,孫方臻.PKC亞型在細胞周期調控中的作用[J].細胞生物學雜志,2002,24(2):90-93.
[13]Darieva Z,Han N,Warwood S,et al.Protein kinase C regulates late cell cycle-dependent gene expression[J].Molecular and cellular biology,2012,32(22):4651-4661.
[14]LENDENFELD T,KUBICEK C.Characterization and properties of protein kinase C from the filamentous fungus Trichoderma reesei[J]. Biochem.J,1998,330:689-694.
[15]Falc o S I,Vale N,Cos P,et al.In Vitro Evaluation of Portuguese Propolis and Floral Sources for Antiprotozoal,Antibacterial and Antifungal Activity[J].PhytotherapyResearch,2014,28(3):437-443.
[16]de Castro P A,Bom V L P,Brown N A,et al.Identification of the cell targets important for propolis-induced cell death in Candida albicans[J].Fungal Genetics and Biology,2013,60:74-86.
[17]Pereira ES,JrMartins RS,lama SM,el a1.Effect of commercial ethanol propolis extracton the in vitro growth of Candida albicans collected fromHIV-seropositive and HIV-seronegalive Brazilian patients with oral candidiasis[J].JOral Sci,2002,44:41-48.
[18]Shinobu CS,Oliveira AC,Longhini R,e ta1.Antifungal activity of propolis extract against yeasts isolated from onychomycosis lesions[J]. MemInst OswaldoCruz,2006,101:493-497.
[19]Unterkircher C,Ota C,Fantinato V,et a1.Antifungal activity of Propolis on different species of Candida[J].Mycoses,2001,44:375-378.
[20]Grenho L,Barros J,Ferreira C,et al.In vitro antimicrobial activity and biocompatibility of propolis containing nanohydroxyapatite [J].Biomedical Materials,2015,10(2):025004.
[21]Ghisalbert E.Propolis:a review[J].Bee World,1979,60:59-84.
[22]Burdock GA.Review of the biological properties and toxicity of
bee propolis[J].Food Chem Toxic,1998,36:347-363.
[23]Agüero M B,Svetaz L,Baroni V,et al.Urban propolis from San Juan province(Argentina):Ethnopharmacological uses and antifungal activity against Candida and dermatophytes[J].Industrial Crops and Products,2014,57:166-173.
[24]Boonsai P,Phuwapraisirisan P,Chanchao C.Antibacterial activity of a cardanol from Thai Apis mellifera propolis[J].International journal of medical sciences,2014,11(4):327.
[25]Silva MSSS,de Lima G,Oliveira EH,et al.Anacardic acid derivatives from Brazilian propolis and their antibacterial activity. Ecletica Quimica.2008;33:53-8.
[26]Sanpa S,Popova M,Bankova V,et al.Antibacterial Compounds from Propolis of Tetragonula laeviceps and Tetrigona melanoleuca(Hymenoptera:Apidae)from Thailand[J].2015.
[27]高磊.天然藥物小檗堿抑制煙曲霉作用機制的研究[D].吉林大學,2012.
[28]de Paulo Martins V,Dinamarco T M,Curti C,et al.Classical and alternative components of the mitochondrial respiratory chain in pathogenic fungi as potential thera peutic targets[J].Journal of bioenergetics and biomembranes,2011,43(1):81-88.
[29]Haraguchi H,Tanimoto K,Tamura Y,et al.Mode of antibacterial action of retrochalcones from Glycyrrhiza inflata[J].Phytochemistry,1998,48(1):125-129.
[30]Raafat D,Von Bargen K,Haas A,et al.Insights into the mode of action of chitosan as an antibacterial compound[J].Applied and environmental microbiology,2008,74(12):3764-3773.
[31]Parekh D B,Ziegler W,Parker P J.Multiple pathways control protein kinase C phosphorylation[J].The EMBO journal,2000,19 (4):496-503.
Propolis on Aspergillus fumigatus antifungal mechanisms in vitro
Shen Fei1,2Chen Yijie1,2Xu Xiaolan1,2,3Miao Xiaoqing1,2,3Wu Zhenhong1,2,3
(1 Fujian Agriculture and Forestry University,Fu Zhou 350002;2 Apitherapy institute of fujian agriculture and forestry university,Fu Zhou 350002;3 Natural biological toxin national local joint engineering laboratory,Fuzhou 350002)
To investigate the effects of propolis on A.fumigatus,so as to provide guidance for clinical treatment of the A.fumigatus infection.Using different concentrations(10,20,30,40,50,100,150,200 mg/ml)of ethanolic extract of propolis(EEP)to deal with A.fumigatus spores found that a dose-dependent relationship between propolis and bacteriostatic ring size.Next,the minimum inhibitory concentrations(MIC)of propolis were determined by agar dilution method,A.fumigatus mycelium weights and spores respiratory rate were significantly inhibited when exposure to 1/ 2MIC50of propolis.Unltrastructure of spore was seriously damaged with propolis incubation for 3d,which was further confirmed by soluble protein loss of A.fumigatus mycelia treated with propolis.Seni-quantitative PCR found Phosphatidylinositol signal pathway related PLC gene expression down-regulated.These results suggest propolis can inhibit the growth of A.fumigates.and have a promising potential to treat pneumonia caused by A.fumigates.
propolis;Aspergillus fumigatus;in vitro;PKC;mechanism
國家蜂產業技術體系項目(CARS-45-KXJ19)
沈菲(1990-),女,湖北孝感人,在讀碩士,研究方向:蜂產品醫療與保健。
吳珍紅(1964-),女,研究員,研究方向:蜂產品醫療與保健,E-mail:wzh516@126.com。

