微擴散法測定銨態氮、硝態氮的15N穩定同位素研究綜述①
溫 騰,曹亞澄,張 珮儀,張金波*( 南京師范大學地理科學學院,南京 20023;2 江蘇省物質循環與污染控制重點實驗室,南京 20023;3 江蘇省地理信息資源開發與利用協同創新中心,南京 20023)
微擴散法測定銨態氮、硝態氮的15N穩定同位素研究綜述①
溫 騰1,2,3,曹亞澄1,張 珮儀1,張金波1,2,3*
(1 南京師范大學地理科學學院,南京 210023;2 江蘇省物質循環與污染控制重點實驗室,南京 210023;3 江蘇省地理信息資源開發與利用協同創新中心,南京 210023)
微擴散法是測定氮轉化過程中銨態氮、硝態氮的15N穩定同位素的重要方法。自20世紀50年代Conway提出微擴散法的基本原理后,隨著分析技術的迅速發展,微擴散法與質譜儀測定技術相結合,被廣泛應用在環境、生態和農業領域中土壤、水體等樣品的測定。雖然微擴散法與傳統蒸餾法相比優點明顯,但其測定結果的準確性、精密性仍受氮回收量、同位素分餾、外源性和內源性的雜質氮污染等因素的影響。如何優化擴散體系,提高測定的準確度是當前微擴散法應用的關注重點。本文綜述了影響微擴散法的多種因素,并總結了優化微擴散體系的方法,以期推動微擴散法在我國氮素轉化研究中的應用。
微擴散;銨態氮;硝態氮;15N
穩定同位素示蹤技術是當前環境、生態和農業各領域研究中的一項重要技術。15N穩定同位素作為一種示蹤劑,已被廣泛應用于陸地和水生態系統的氮轉化研究[1-2]。無機態氮作為氮轉化過程的重要形態,其15N豐度的測定(特別是NH4+和NO3-)尤其重要[3]。目前通用的無機氮測定方法是杜馬法(Dumas):首先從固體或液體樣品中提取出NH4+和NO3-后,在與元素分析儀聯用的質譜儀(EA-IRMS)上經過一系列燃燒、氧化和還原過程,將其轉化為 N2,最后純化后的 N2經質譜測定其15N豐度[4]。如何有效、快速、定量地從樣品中提取NH4+和NO3-是杜馬法的關鍵步驟。傳統常用的方法是蒸餾法(Kjeldahl distillation),但該法需專門的設備和熟練的操作人員,操作過程費時費力,對樣品的氮量要求較高,而且蒸餾過程中易發生樣品間的交叉污染[5]。近年來,一種通過微擴散(micro-diffusion)的方法提取樣品中的NH4+和NO3-被國外學者廣泛采用。與蒸餾法相比,該法操作明顯簡化,樣品制備步驟簡單,樣品間不易交叉污染,對氮量要求較低,不但適用于自然豐度的樣品測試,也適合測定高15N豐度的示蹤樣品[5-7],還能避免高溫蒸餾過程中引起的有機氮分解和同位素分餾。在國外,微擴散法已逐漸替代了傳統的蒸餾法,但在國內該法在15N穩定同位素樣品測定上的應用仍很有限。本文將著重圍繞微擴散法的基本原理、影響微擴散法測定結果的主要因素、優化微擴散法的方法及其在15N穩定同位素示蹤和氮轉化研究中的應用前景幾方面分別介紹。
1 微擴散法的基本原理
早在1939年,Conway和Cooke[8-9]就提出了應用微擴散的方法可定量測定血液、尿液等樣品中的有機氮含量,并在1957年進一步總結闡述了微擴散法的原理、主要步驟和注意事項。隨后,Brooks等[5]及MacKnown和Van Sanford[10]首次將微擴散法應用在土壤樣品的15N穩定同位素測定上。在1990—2010年期間,學者們對該方法做了一系列的改進,不但進一步簡化其操作步驟、縮短操作時間,而且提高了測定結果的準確度和精密度,同時拓寬了該方法的使用范圍,提出了適合不同類型樣品(高豐度或自然豐度樣品,土壤、植株或海水樣品,甚至富含有機氮的樣品)的微擴散方法體系[11-14]。
微擴散法是在一個較小體積的密閉反應容器內(通常為200 ~ 600 ml),加入一定量的樣品(10 ~ 400 ml)后,通過添加MgO、NaOH等堿性試劑,調節樣品溶液的pH為弱堿性,使NH4+轉化為NH3,并在其揮發釋放過程中,被含弱酸性吸收液(硼酸、稀硫酸、KHSO4等)的玻璃纖維或濾紙(5 ~ 20 mm)所吸收的過程[4-5, 9, 14]。整個擴散過程所需的時間視具體樣品和擴散條件而定,可從若干小時到10天不等。擴散可在常溫下(20 ~ 25℃)靜置進行,也可通過加熱或震蕩的方法加速擴散過程。對于NH4+,可在樣品中直接加入MgO等堿性試劑;對于NO3-,則需要加入戴氏合金(Devarda's alloy)將其還原為NH4+,再進行擴散。擴散完成后,將濾紙片小心取出,在無氨的環境中干燥后,放入錫杯中包好,通過EA-IRMS測定濾紙的15N穩定同位素比值,即為樣品的15N穩定同位素比值。
2 微擴散法的主要影響因素
與傳統的蒸餾法相比,微擴散法優點明顯,但要實現對不同類型 (土壤、水體等)、濃度、豐度的樣品中15N穩定同位素比值的準確測定,需在幾個方面進一步探討和改進:①如何提高樣品中的氮回收率,減少擴散過程中的同位素分餾?②如何降低擴散過程中雜質氮的污染,并選擇合適的方法校正?③如何優化擴散體系,縮短擴散所需時間?
2.1 氮回收量和同位素分餾
在微擴散過程中,NH4+在堿性溶液中釋放出NH3,較輕的14N往往會先于15N揮發出來,因此在樣品中的氮量無法完全回收的情況下,其產生的同位素分餾效應會造成測定值低于實際值。早期有研究指出樣品中的氮量應盡量完全回收,以減少同位素分餾造成的誤差[15]。事實上,要實現氮量的 100% 回收非常困難。微擴散過程是在密閉容器中進行,加入堿性試劑后的放熱效應,會在瓶壁和瓶蓋處出現冷凝小水珠,這些小水珠會和濾紙片競爭吸收NH3,降低氮的回收量[7]。那么,氮量回收不完全引起的同位素分餾是否一定對測定結果有顯著影響呢?Jensen[16]發現,隨著培養時間的延長,樣品中的氮的回收量會顯著升高,但樣品的15N 豐度并無明顯變化;Stark和Hart[14]在比較懸掛法和擴散包法時發現,同樣培養條件下懸掛法的氮回收量顯著低于擴散包法,但校正后兩種方法得到的15N atom% 值無明顯差異;Sigman等[17]在用擴散法測定海水中硝酸鹽的δ15N值時也發現,氮量回收不完全引起同位素分餾的誤差可忽略不計。擴散過程中的同位素分餾,并不一定是氮回收量不完全所致,擴散距離長短、擴散速度快慢等因素,也會產生同位素分餾。因此,在僅需測定樣品15N豐度的情況下,100% 的氮回收量并非必要。當然,過低的氮回收量引起的同位素分餾產生的誤差的確不可小覷,Holmes等[21]運用擴散法測定大體積、低氮量的海水樣品中NH4+的δ15N值時,發現培養時間長短、樣品體積變化都會顯著影響 δ15N值,加長培養時間或減少樣品體積,都可以提高樣品中的氮回收量,減小測定值和理論值的差距,因此低氮量的樣品在擴散過程中應盡量提高其氮回收量,減少同位素分餾效應。此外,測定樣品中總無機氮的豐度時,如果樣品中NH4+和NO3-的15N豐度相差較大,由于在擴散體系中NH4+是先于NO3-釋放出來,這種情況下氮量回收不完全是會引起嚴重的測定誤差[18]。
對微擴散法的實際操作略加改進,可以有效提高樣品中的氮回收量。由于在一定范圍內氮回收量和擴散時間呈正比,延長擴散培養時間可有效提高氮回收率[7, 14, 16]。選擇對NH3吸收能力較強的酸性試劑,或增加濾紙上的酸的用量或濃度,也可以有效提高氮回收率。常見的吸收劑有稀硫酸、KHSO4和硼酸,同等體積下(10 μl),2.5 mol/L的KHSO4能吸附350 μg N,而5 mol/L的H2SO4最多可吸附1 400 μg N[5]。使用水或鹽溶液提取植株、土壤等固體樣品的無機氮時,含K+的鹽溶液較水溶液更能增加氮回收量,這是因為水提液會在濾紙上積累過多水分,水珠的回滴會損失部分氮[16]。減少 NH3的泄漏也可提高氮回收量,由于 NH4+釋放為 NH3的過程極為迅速,加入MgO等堿性試劑后應迅速蓋緊瓶蓋以減少氮的損失;戴氏合金將 NO3-還原為 NH4+的過程產生的 H2會增加瓶內氣壓造成部分 NH3泄漏損失,使得 NO3-的氮回收量往往低于NH4+[7]。目前常見的微擴散體系有懸掛法和擴散包法,擴散包法因加液量大、密封良好、震蕩并倒置培養,可減少漏氣、其他吸收源競爭、水分過飽和等造成的氮損失,因此氮回收量高于懸掛法[14]。對于低氮濃度的樣品,除延長培養時間、加大體積量、使用擴散包法等,也可以通過人為增加樣品中的含氮量,來提高氮的回收率[11]。
2.2 雜質氮的干擾和校正方法的選擇
除了氮的回收量和同位素分餾效應外,外源或內源性的雜質氮干擾也會影響微擴散法測定結果的準確性。外源性的雜質氮主要來自于擴散過程使用的試劑(KCl、水、戴氏合金、MgO等)、擴散器具(濾紙、瓶子等)和大氣環境中的微量 NH3;內源性的雜質氮主要是樣品中的可溶性有機氮(DON)[5-6, 14, 17, 19]。因此,在操作上減少或避免雜質氮的干擾,并采用合適的方法校正測定結果,有助于提高微擴散法的準確度和精密度。
根據確定的原材料配比和冷料斗標定曲線,確定產量為260T/h時的冷料斗分表表值,進料8~10min,放掉熱料倉前3min的料后再取各熱料倉的料500~800kg,進行級配篩分、除塵、密度等方面的檢測和生產配比室內調試工作。
微擴散法使用水或 KCl等溶液提取樣品中的無機氮,添加MgO等堿性試劑調節樣品的 pH,對于NO還需加入戴氏合金將其轉化為 NH。但諸多研究表明,KCl、戴氏合金和MgO中都存在不同含量的雜質氮。Jensen[16]在50 ml 2 mol/L的KCl溶液中檢出8 μg的氮,張英利等[20]在多個批次不同品牌的KCl試劑中檢出1.7 ~ 49.1 mg/kg的氮,這些氮多以NH或NO的形態存在,對擴散法的測定結果有直接影響;戴氏合金也含有一定量的雜質氮,Stark和Hart[14]在不同廠家不同批次的0.4 g合金中檢出3 ~24 μg N,Sigman等[17]發現雖然不同品牌不同批次合金的含氮量差異大,但其δ15N值較穩定,對兩個品牌合金的多次測定結果為-7.5‰ ~-6‰;此外,配制溶液的蒸餾水,加入的MgO粉末也可能含有微量的氮。因此,為減少試劑中雜質氮的干擾,應盡量使用優級純的試劑和不含氮的蒸餾水(如:超純水),對于KCl、合金和MgO等試劑的用量應根據樣品的具體情況進行優化,并盡量使用同一廠家同一批次,研磨過篩成較細的粉末(過 300目篩)以保證其均一性,對于KCl和MgO可通過高溫灼燒(450 ~ 600℃)減少雜質氮,但戴氏合金若高溫加熱反而降低其還原性[17, 21]。
微擴散法使用酸化的濾紙吸收樣品中釋放的NH3,玻璃纖維濾紙(glass-fiber filter)和纖維素濾紙(cellulose filter)是常用的兩類濾紙,但玻纖濾紙因燃燒后易在氧化管中熔化累積,已漸漸被纖維素濾紙取代[18]。為減少雜質氮的干擾,濾紙一般是無灰級的定量濾紙,但仍有微量的NH和NO殘留,兩張直徑7 mm的Whatman no. 2 纖維素濾紙上可檢出約0.16 μg N。通過石英水水洗后高溫烘干的方法,可除去濾紙上的雜質氮[7, 14]。
與蒸餾法相比,為減少樣品間的交叉污染,微擴散法通常使用一次性的容器。如果不能使用一次性容器,則需徹底清洗以防止器皿上殘留氮對樣品的污染。通常玻璃類的器皿,建議使用0.2 mol/L H2SO4浸泡過夜后,自來水反復沖洗、蒸餾水潤洗后烘干;塑料類和不銹鋼類器皿建議使用 0.05 mol/L 新鮮配制的KOH浸泡過夜后,水洗烘干;為混勻擴散體系而加入的玻璃珠也需事先經過酸洗;取用濾紙的鑷子,每次夾取前需依次浸入0.1 mol/L H2SO4和超純水并干燥后方可使用[6, 19]。微擴散的操作應在無水乙醇擦拭過的干凈鋁箔紙上進行,并使用潔凈的一次性手套。
大氣環境中也含有極微量的NH3,可能干擾樣品的測定。因此,整個微擴散操作過程應盡量在無NH3的環境下進行。在濾紙上滴加酸性溶液后,應減少其暴露在大氣中的時間,盡快轉入擴散培養瓶中[4]。已吸收了樣品所釋放的NH3的濾紙片,應在無NH3的環境下干燥(盛有濃硫酸的真空干燥器或冷凍干燥)后再包樣。
內源性雜質氮的主要來源是樣品中的可溶性有機氮(如:葡萄糖胺、氨基酸等)。在高 pH、較高溫度下進行長時間擴散培養,樣品中可溶性有機氮會降解為 NH3,直接干擾測定[17]。Mulvaney和 Khan[22]在不同擴散培養時間對有機氮含量較高的土壤取樣發現,隨著培養時間的延長,樣品的15N豐度先升高,漸趨向平穩后又逐漸下降,推測是樣品中的可溶性有機氮降解為NH3稀釋了樣品的實際豐度。Holmes等[21]發現擴散培養溫度過高(≥50℃)會促進樣品中的DON分解,Sigman等[17]還發現加入過多的MgO或戴氏合金,也會促進DON分解。因此,對于有機氮含量較高的樣品,應優化擴散體系,MgO、戴氏合金用量適度,并盡量在室溫下培養,樣品體積也不宜過多以縮短完成擴散所需的時間,還可增加提取液中的鹽濃度(如:4 mol/L KCl)或增加酸的用量或濃度來加速擴散[17, 22]。此外,樣品中的DON可通過離子交換樹脂去除;對于僅測定 NO的樣品,可通過加入茚三酮將氨基氮轉化為NH3,也可加入一定量MgO后,在 65℃下預培養一段時間以除去樣品中的有機氮[17]。
要準確測定樣品中15N的豐度,除了在操作上盡量減少外源、內源雜質氮的干擾外,可通過設置空白對照,并選用合適的方法校正測定結果。空白對照一般為不添加樣品的提取液,在相同條件下擴散培養,估測體系中的雜質氮量。一般選用公式(1)進行校正[14, 23]:


式中:Mstd是標準樣品的已知含氮量;Estd是通過將標準樣品直接滴加在酸化濾紙上,測定得到的15N豐度,即非擴散條件下標樣的15N豐度;Em是擴散條件下標樣的15N豐度;Eb是空白對照的15N值(假定為0.366 3 atom%)。再將計算得到的空白氮量Mb代入公式(3),就得到校正后的樣品15N豐度值Es。
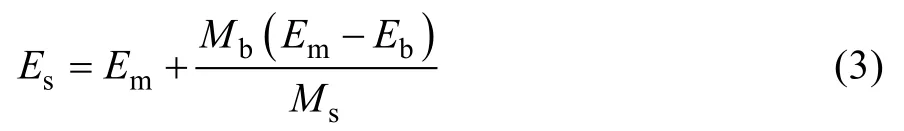
式中:Es為校正后的樣品的 N值;Ms為未擴散培養前樣品的含氮量。Stark和Hart[14]建議,原有的校正方法更適合氮量基本 100% 回收的擴散體系,而在氮量回收不完全的擴散體系中,使用第二種校正方法更為合適。此外,由于樣品中氮的濃度和豐度可能存在較大的差異,Lory和Russelle[7]建議可配置一系列不同濃度、豐度的標準樣品,繪制出標準曲線來校正樣品的測定值,可進一步提高準確度。
2.3 微擴散體系的優化
與蒸餾法相比,微擴散法簡化了操作流程,也無需特定設備,但微擴散法周期較長,往往要在常溫下培養5 ~ 10天,長時間的培養可能引起樣品中可溶性有機氮分解,因此如何加快擴散過程、縮短擴散所需時間,一直是備受關注的問題。一般來說,影響擴散速度快慢的主要因素是樣品體積和擴散容器的大小形狀,其次培養溫度、pH、溶液中的離子強度(如:K+、Na+、CO、OH-)和操作上的改進也會影響擴散速度[7, 9]。
早在1957年,Conway[9]就指出樣品的表面積和體積的比值是決定擴散速度快慢的關鍵。也就是說,同樣體積的樣品置于大容積的培養瓶中擴散速度最快;相同體積的培養瓶,直徑大的瓶子擴散速度快;相同培養瓶中小體積樣品擴散快。低氮濃度的樣品(如:海水樣品)往往需大體積量才能滿足測定需要,由于大體積的樣品需較長時間完成擴散,除使用更大體積的培養瓶提高擴散速度,還可以預濃縮提高樣品中氮的濃度,但濃縮倍數不宜過高,因樣品pH可能隨濃縮而降低,反而不利于擴散過程。Sigman等[17]建議海水樣品的濃縮體積應為初始體積的 15% ~25%。
升高培養溫度、提高樣品溶液的pH或溶液中的離子強度也會加快擴散進程。Khan等[6]通過加熱(45 ~50℃)的方法實現在1.5 ~ 5 h內對10 ~ 20 ml 含4 mg N土壤提取液的完全擴散回收,在5 ~ 8.5 h內對50 ~100 ml 含2 mg N 土壤提取液的擴散回收,擴散時間從至少1 天以上縮短為 1 ~ 8 h。但他同時也指出,培養溫度不宜過高,超過 50℃后雖然擴散速度較之前有所提高,但氮回收率下降,超過 55℃后不但氮回收率繼續減少,擴散速度反而下降,這是因為高溫產生的大量冷凝水可能競爭并降低酸吸收 NH3的能力。Sigman等[17]進一步指出,過高溫度下樣品內的可溶性有機氮易降解,會影響測定結果。不同樣品的最適培養溫度差異大,Mulvaney等[19]發現當溫度超過 30℃,土壤樣品的可溶性有機氮易分解,因此應根據所測樣品的自身特點篩選最適培養溫度。微擴散法需要加入堿性介質(如:MgO、NaOH、Na2CO3)調節樣品溶液的pH,較高的pH不但可促進NH3的釋放擴散,還可促進NO轉化為NH4+[7, 17]。MgO因其堿性溫和最為常用,NaOH的堿性雖強于MgO,但易降解有機氮,Na2CO3一般用于調節 pH較低的樣品溶液。加大堿性物質的用量可有效提高樣品溶液pH,但有研究發現,調節水體樣品的pH至9.7,土壤樣品提取液的pH至10.5后,再升高pH,NO3-轉化速度和 NH3擴散速度都沒有明顯變化[17]。而且,加入過多的堿性物質可能帶入較多雜質氮,反而影響測定結果。通過添加KCl、K2SO4等鹽溶液也能提高樣品溶液的離子強度,這些鹽離子可通過水合作用結合水分子,降低其活性,推動(4)式向右進行,促進NH3的釋放[9]。常用幾種鹽溶液的擴散速度大致為:水<1 mol/L KCl= 0.5 mol/L K2SO4< 2 mol/L KCl < 4 mol/L KCl[19]。雖然提高樣品溶液的鹽濃度可加快擴散,但過高的鹽濃度也會促進可溶性有機氮降解,而且KCl等試劑中也含有不可忽視的雜質氮量。一些其他鹽溶液(如:K2CO3和K2B2O4)雖能促進NH3的釋放,也會增加可溶性有機氮的干擾,使用前需反復評估[25]。

此外,與靜置培養相比,適度的搖床震蕩或攪拌能促進擴散進程,還可以減少壁上的冷凝水附著,增加氮回收量。Lachouani等[26]采用37℃ 下搖培(100 r/min),將擴散所需時間從5天縮短為3天。但若采用懸掛濾紙法擴散培養時,應注意搖床速度不宜過高,否則濺起的樣品溶液易污染濾紙片。由于MgO和戴氏合金幾乎不溶于水,在擴散體系中加入玻璃珠,可輔助混勻試劑促進擴散進程。還可在擴散體系中放入兩片濾紙片,增加吸收面積,來促進擴散、增加氮回收率[18]。
綜上所述,不難看出溫度、pH的升高,KCl、戴氏合金等試劑用量的增加是可以加快擴散反應進程,但也可能帶來外源或內源性的雜質氮干擾。因此,優化擴散體系不只單純加快速度縮短時間,而是綜合考慮擴散速度、試劑用量、雜質氮干擾三方面因素,并根據樣品的特點選擇最適合的擴散培養條件。值得指出的是,目前MgO和戴氏合金的用量通常為0.2 ~0.4 g,對于大部分樣品,這個添加量是過量的,由于MgO和戴氏合金中含有一定量的雜質氮,可根據樣品類型酌情減少用量;不同溫度條件下二者的添加量也有區別,溫度高所需的用量相對少[17];但對于一些有機氮含量高且成分復雜的樣品,如:污水、排泄物等,由于樣品中可能存在某些還原性有機物或金屬螯合物,添加量可能不足,Mulvaney和Khan[22]就發現需在25℃ 下加入1.5 g戴氏合金,或在45 ~ 50℃下加入0.9 g合金,才能完成對4 mg 無機氮的擴散回收。
3 微擴散法的應用前景
在國外,目前微擴散法已基本取代蒸餾法,廣泛用來提取土壤、水等樣品中的NH和NO并測定其δ15N值或15N豐度。但在國內,微擴散法在無機氮15N穩定同位素上的應用并不多見,且主要集中在水體樣品的測定上。肖化云和劉叢強[27]結合離子交換色層法-微擴散法對地下水的NO的δ15N值分析測定,發現在50℃ 時擴散10天,氮回收率達95% 以上,且不會引起氮同位素分餾;胡婧和劉衛國[28]運用微擴散法測定了水體中的NH的δ15N值,發現1.50 mg/L的氯化銨溶液 400 ml,在室溫下擴散 14 天,氮回收率>95% 且不產生氮同位素分餾;并進一步將其用于研究水體中無機氮的污染來源[29-31];孫建飛等[32]將微擴散法應用于土壤15N示蹤試驗中NH和NO的測定,提出適用于豐度和含氮量變化較大的示蹤樣品的微擴散體系;Zhang等[24]將微擴散法與其他方法相結合,提出了適用更小體積(5 ~ 10 ml)、更低NH濃度(15 ~ 60 μmol/L)樣品的15N測定方法。考慮到蒸餾法存在的局限性,推廣微擴散法的應用,不但可簡化操作,節約人、物力,更可提高測定結果的準確性和靈敏度。
近年來在無機氮的15N穩定同位素測定上,各種更靈敏的新方法不斷被報道,例如:通過一系列化學反應將無機氮(NH、NO、NO)轉化為 N2O,測定其15N豐度的化學轉化法[3, 33];利用不含N2O還原酶的反硝化菌將NO轉化為N2O的反硝化法[34-35];運用鉻和疊氮鈉將自然豐度樣品中的NO轉化為N2O的化學法[36-37]等等。這些方法基本通過將無機氮轉化為 N2O氣體,在與微量預濃縮裝置聯用的質譜儀上測定 N2O中的氮、氧同位素比值。雖然這些方法的靈敏度顯著優于微擴散法,但樣品的預處理往往較為繁瑣,涉及微生物的培養和大量試劑的配制,有些反應還會生成劇毒的中間產物(如:HN3),而且樣品在質譜儀上的測定時間長(≥30 min),測定過程需不斷添加液氮,成本較高;而微擴散法操作簡單、安全,樣品是在聯用元素分析儀的質譜儀(EA-IRMS)上測定,所需測定時間短(≤10 min),測試成本較低,適合大批量樣品測定。此外,微擴散法可與化學法或反硝化法相結合,發展出適合不同類型樣品的更高靈敏度的測定方法:Zhang等[24]針對酸性森林土壤的KCl提取液中存在某些還原物質,難以用化學法(BrO-和NH2OH)將NH還原為N2O的問題,將土壤中的NH首先用微擴散法釋放出來,再用化學法將濾紙片上的NH3轉化為 N2O,測試靈敏度達 μmol/L級別;Lachouani等[26]用微擴散法將微量(≥12.4 μmol/L)的NH從土壤中提取出來,再通過反硝化細菌或化學轉化的方法將其轉化為N2O。由此可見,微擴散法作為一種已發展多年、較為成熟的無機氮的提取方法,不但適合于示蹤培養試驗中大批量樣品的15N豐度測定,也可與新的方法結合,發展出適用自然豐度樣品的更為靈敏的δ15N值的測試方法,仍是一種極具應用潛力的方法。
4 結論
在銨態氮、硝態氮的15N穩定同位素測定上,微擴散法已逐漸替代傳統蒸餾法,但其擴散過程受氮回收量、雜質氮等因素影響。100% 的氮回收率并非必要,但提高氮回收量可減少氮同位素分餾,采用擴散包法、適當延長培養時間、優化樣品體積,選擇合適的酸吸收劑和鹽溶液可有效提高氮回收量。外源性(擴散試劑、器具和大氣環境)和內源性(樣品的DON)的雜質氮會影響微擴散法的結果準確性,外源雜質氮可通過使用優級純試劑、優化其用量、高溫加熱等方法,減少試劑中的雜質氮,并充分清潔各種器具以減少氮殘留和交叉污染;內源雜質氮主要是樣品中DON的降解,可通過對培養溫度、培養時間、MgO和戴氏合金用量的綜合優化,或通過預處理去除DON,來減少干擾。此外,選擇合適的校正方法也有助于減少雜質氮對測定結果準確性的影響。最后,擴散體系的優化不只是加快擴散速度、縮短培養時間,而應綜合考慮擴散速度、試劑用量、雜質氮干擾三方面,根據樣品的特點選擇最合適的擴散培養條件。總而言之,微擴散法較蒸餾法優點明顯、前景廣闊,可廣泛應用于無機氮15N穩定同位素的測定,若與其他新方法相結合,還會極大地提高測定方法的靈敏度和準確度。
[1] 程誼, 蔡祖聰, 張金波.15N同位素稀釋法測定土壤氮素總轉化速率研究進展[J]. 土壤, 2009, 41(2): 165-171
[2] 蘭婷, 韓勇, 唐昊冶. 采用15N同位素稀釋法研究不同層次土壤氮素總轉化速率[J]. 土壤, 2011, 43(2): 153-160
[3] 曹亞澄, 鐘明, 龔華, 等. N2O產生法測定土壤無機態氮[J]. 土壤學報, 2013, 50(1): 113-119
[4] Sebilo M, Mayer B, Grably M, et al. The use of the ‘Ammonium Diffusion' method for δ15N-NH4+and δ15NNO3-measurements: Comparison with other techniques[J]. Environmental Chemistry, 2004, 1(2): 99-103
[5] Brooks P, Stark J M, McInteer B, et al. Diffusion method to prepare soil extracts for automated nitrogen-15 analysis[J]. Soil Science Society of America Journal, 1989, 53(6):1 707-1 711
[6] Khan S, Mulvaney R, Mulvaney C. Accelerated diffusion methods for inorganic-nitrogen analysis of soil extracts and water[J]. Soil Science Society of America Journal, 1997,61(3): 936-942
[7] Lory J, Russelle M. Evaluation of a diffusion method for preparing low-nitrogen samples for nitrogen-15 analysis[J]. Soil Science Society of America Journal, 1994, 58(5):1 400-1 404
[8] Conway E J, Cooke R. Ammonia formation in shed blood and a characteristic deaminase of the blood stream[J]. Nature, 1937, 139: 627
[9] Conway E J. Microdiffusion analysis and volumetric error[M]. 4thed. London: Crosby Lockwood and Son, 1957
[10] MacKnown C, Van Sanford D. Nitrogen allocation with altered sink demand in wheat[J]. Crop Science, 1988, 28(1):133-136
[11] Bradley R, Fyles J. Method to avoid isotope discrimination during the diffusion of NH4+from15N-labelled soil extracts[J]. Soil Biology and Biochemistry, 1996, 28(4):695-697
[12] Burke I C, O'Deen L A, Mosier A R, et al. Diffusion of soil extracts for nitrogen and nitrogen-15 analyses by automated combustion/mass spectrometry[J]. Soil Science Society of America Journal, 1990, 54(4): 1 190-1 192
[13] Liu Y, Mulvaney R. Diffusion of Kjeldahl digests for automated nitrogen-15 analysis by the Rittenberg technique[J]. Soil Science Society of America Journal,1992, 56(4): 1 151-1 154
[14] Stark J M, Hart S C. Diffusion technique for preparing salt solutions, Kjeldahl digests, and persulfate digests for nitrogen-15 analysis[J]. Soil Science Society of America Journal, 1996, 60(6): 1 846-1 855
[15] Kazungu J, Dehairs F, Goeyens L. Nutrients distribution patterns in Tudor estuary (Mombasa, Kenya) during rainy season[J]. Kenya Journal of Sciences Series B, 1989, 10:47-61
[16] Jensen E. Evaluation of automated analysis of15N and total N in plant material and soil[J]. Plant and Soil, 1991, 133(1):83-92
[17] Sigman D, Altabet M, Michener R, et al. Natural abundance-level measurement of the nitrogen isotopic composition of oceanic nitrate: An adaptation of the ammonia diffusion method[J]. Marine Chemistry, 1997,57(3): 227-242
[18] Khan S, Mulvaney R, Brooks P. Diffusion methods for automated nitrogen-15 analysis using acidified disks[J]. Soil Science Society of America Journal, 1998, 62(2):406-412
[19] Mulvaney R, Khan S, Stevens W, et al. Improved diffusion methods for determination of inorganic nitrogen in soil extracts and water[J]. Biology and Fertility of Soils, 1997,24(4): 413-420
[20] 張英利, 許安民, 尚浩博, 等. 氯化鉀中雜質銨含量及對土壤銨態氮測定的影響[J]. 土壤通報, 2010(5):1 134-1 137
[21] Holmes R, McClelland J, Sigman D, et al. Measuring15N-NHin marine, estuarine and fresh waters: An adaptation of the ammonia diffusion method for samples with low ammonium concentrations[J]. Marine Chemistry,1998, 60(3): 235-243
[22] Mulvaney R, Khan S. Use of diffusion to determine inorganic nitrogen in a complex organic matrix[J]. Soil Science Society of America Journal, 1999, 63(1): 240-246
[23] Kelley K, Ditsch D, Alley M. Diffusion and automated nitrogen-15 analysis of low-mass ammonium samples[J]. Soil Science Society of America Journal, 1991, 55(4):1 016-1 020
[24] Zhang S, Fang Y, Xi D. Adaptation of micro-diffusion method for the analysis of15N natural abundance of ammonium in samples with small volume[J]. Rapid Communications in Mass Spectrometry, 2015, 29: 1-10
[25] Bremner J, Shaw K. Determination of ammonia and nitrate in soil[J]. The Journal of Agricultural Science, 1955, 46(3):320-328
[26] Lachouani P, Frank A H, Wanek W. A suite of sensitive chemical methods to determine the δ15N of ammonium,nitrate and total dissolved N in soil extracts[J]. Rapid Communications in Mass Spectrometry, 2010, 24(24):3 615-3 623
[27] 肖化云, 劉叢強. 水樣硝酸鹽氮同位素分析預處理方法探討[J]. 巖礦測試, 2002, 21(2): 105-108
[28] 胡婧, 劉衛國. 擴散法—EA-IRMS測定天然水體銨態氮同位素實驗條件研究[J]. 礦物巖石地球化學通報, 2010,29(1): 31-37
[29] 肖化云, 劉叢強. 氮同位素示蹤貴州紅楓湖河流季節性氮污染[J]. 地球與環境, 2004, 32(1): 71-75
[30] 岳甫均, 李軍, 劉小龍, 等. 利用氮同位素技術探討天津地表水氮污染[J]. 生態學雜志, 2010, 29(7): 1 403-1 408
[31] 王麗麗, 吳俊森, 王琦. 水體中硝酸鹽氮同位素分析預處理方法研究現狀[J]. 環境科學與管理, 2011, 36(9):54-58
[32] 孫建飛, 白娥, 戴崴巍, 等.15N 標記土壤連續培養過程中擴散法測定無機氮同位素方法改進[J]. 生態學雜志,2014, 33(9): 2 574-2 580
[33] Laughlin R, Stevens R, Zhuo S. Determining nitrogen-15 in ammonium by producing nitrous oxide[J]. Soil Science Society of America Journal, 1997, 61(2): 462-465
[34] M?rkved P T, D?rsch P, Henriksen T M, et al. N2O emissions and product ratios of nitrification and denitrification as affected by freezing and thawing[J]. Soil Biology and Biochemistry, 2006, 38(12): 3 411-3 420
[35] Sigman D, Casciotti K, Andreani M, et al. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater[J]. Analytical Chemistry, 2001,73(17): 4 145-4 153
[36] McIlvin M R, Altabet M A. Chemical conversion of nitrate and nitrite to nitrous oxide for nitrogen and oxygen isotopic analysis in freshwater and seawater[J]. Analytical Chemistry, 2005, 77(17): 5 589-5 595
[37] 王曦, 曹亞澄, 韓勇, 等. 化學轉化法測定水體中硝酸鹽的氮氧同位素比值[J]. 土壤學報, 2015, 52(3): 558-566
On Progress in Use of Micro-diffusion Method in δ15N-NHand δ15N-NOMeasurements
WEN Teng1,2,3, CAO Yacheng1, ZHANG Peiyi1, ZHANG Jinbo1,2,3*
(1 School of Geography Science, Nanjing Normal University, Nanjing 210023, China; 2 Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, Nanjing 210023, China; 3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China)
Since Conway first outlined fundamental principles of micro-diffusion technique in 1957, it was then adapted to prepare samples for15N isotope measurements. Currently it has been widely developed for nitrogen isotope measurements on ammonium (NH4+) and nitrate (NO3-) in solid and aqueous samples. Compared with traditional distillation method, micro-diffusion technique is advocated because it eliminates cross contamination and requires less operator skill and time. However, the accuracy and sensitivity of this technique is still limited by some factors, including N recovery, isotopic fractionation and blank size. Another main limitation of micro-diffusion is that the results can't be obtained immediately because diffusion is typically performed for at least one to several days. Thus, how to improve the sensitivity and accuracy of this technique and accelerate the diffusion process have become key research focuses. In this paper, aiming to promote using micro-diffusion technique in research of soil nitrogen transformation, the primary principles and factors impacting this technique were briefly summarized and introduced.
Micro-diffusion; Ammonium; Nitrate;15N
S151.9;S154
10.13758/j.cnki.tr.2016.04.002
國家自然科學基金項目(41501254)、江蘇省高校自然科學研究面上項目(15KJB210002)和江蘇高校優勢學科建設工程項目(164320H116)資助。
(zhangjinbo@njnu.edu.cn)
溫騰(1980—),女,福建莆田人,博士,實驗師,主要從事穩定同位素技術與土壤氮轉化研究。E-mail: wenteng@njnu.edu.cn

