基因修飾骨髓間充質干細胞腦源性神經營養因子的表達變化
謝茂松,徐國興,黃禮彬
?
·實驗論著·
基因修飾骨髓間充質干細胞腦源性神經營養因子的表達變化
謝茂松,徐國興,黃禮彬
Abstract
?AIM: To study the changes of brain-derived neurotrophic factor (BDNF) expression in gene modified bone marrow mesenchymal stem cells (BMSC).
?METHODS: BMSC were divided into blank control group (without transfected BMSC),negative control group (empty vector without BDNF gene transfected BMSC) and experimental group (BDNF gene transfected BMSC).The expression of BDNF mRNA in BMSC was measured by Realtime PCR,and the expression of BDNF in BMSC was measured by ELISA.
?RESULTS: The BDNF mRNA expressions of 3,4,5,6,7 and 8-generation BMSC cells in the experimental group were higher than those in the blank control group and negative control group.The differences were statistically significant (P3: F=491.788,P<0.05; P4: F=380.112,P<0.05; P5: F=1854.929,P<0.05; P6: F=224.540,P<0.05; P7: F=619.155,P<0.05; P8: F=10.092,P<0.05).As the BMSC cells in the experimental group passaging,the BDNF mRNA expressions in the experimental group decreased.The difference of BDNF mRNA expression among different passage cells was statistically significant (F=298.603,P<0.05).The BDNF secretion of 3,4,5,6,7 and 8-generation BMSC cells in the experimental group were higher than those in the blank control group and negative control group.The differences were statistically significant (P3: F=520.609,P<0.05; P4: F=734.520,P<0.05; P5: F=152.847,P<0.05; P6: F=80.372,P<0.05; P7: F=96.083,P<0.05; P8: F=38.532,P<0.05).As the BMSC cells in the experimental group passaging,the BDNF secretion decreased.The difference of BDNF secretion among different passage cells was statistically significant (F=230.084,P<0.05).
?CONCLUSION: Long-term expression of BDNF in BMSC can be enhanced by genetic engineering.
目的:研究基因修飾的骨髓間充質干細胞(bone marrow mesenchymal stem cell,BMSC)分泌腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)的表達變化。
方法:實驗分為空白對照組(未經轉染BMSC細胞)、陰性對照組(采用不含BDNF基因的空載質粒轉染的BMSC細胞)和實驗組(采用含BDNF基因的質粒轉染的BMSC細胞)。Realtime PCR測定基因修飾的BMSC細胞BDNF mRNA表達,ELISA測定基因修飾的BMSC細胞BDNF的分泌表達。
結果:實驗組第3、4、5、6、7 和8代BMSC細胞BDNF mRNA表達高于空白對照組和陰性對照組,組間差異具有統計學意義(P3:F=491.788,P<0.05;P4:F=380.112,P<0.05;P5:F=1854.929,P<0.05;P6:F=224.540,P<0.05;P7:F=619.155,P<0.05;P8:F=10.092,P<0.05)。實驗組BMSC細胞隨著細胞傳代,BDNF mRNA表達逐漸下降,不同代數間差異具有統計學意義(F=298.603,P<0.05)。實驗組3、4、5、6、7和8代BMSC細胞BDNF的分泌表達高于空白對照組和陰性對照組,組間差異具有統計學意義(P3:F=520.609,P<0.05;P4:F=734.520,P<0.05;P5:F=152.847,P<0.05;P6:F=80.372,P<0.05;P7:F=96.083,P<0.05;P8:F=38.532,P<0.05)。實驗組BMSC細胞隨著細胞傳代,BDNF的分泌表達逐漸下降,不同代數間差異具有統計學差異(F=230.084,P<0.05)。
結論:通過基因工程可增強BMSC細胞表達BDNF。
骨髓間充質干細胞;腦源性神經營養因子;基因修飾;視網膜變性疾病;治療
引用:謝茂松,徐國興,黃禮彬.基因修飾骨髓間充質干細胞腦源性神經營養因子的表達變化.國際眼科雜志2016;16(10):1816-1819
0 引言
視網膜變性疾病是嚴重的不可逆性致盲眼病。目前此類疾病尚無有效的治療方法[1-2]。細胞移植治療為視網膜變性疾病的治療點亮了希望。骨髓間充質干細胞(bone marrow mesenchymal stem cell,BMSC)由于多向分化潛能、自體取材方便,無免疫原性等優點,是理想的種子細胞[3-4]。腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)可增加突觸可塑性及神經發生,促進神經細胞生存[5-6]。干細胞治療和基因治療有望為視網膜變性疾病的治療提供新的途徑。本項目研究擬通過基因工程增強BMSC表達BDNF神經營養因子,研究基因修飾的BMSC細胞BDNF的表達變化。
1 材料和方法
1.1材料健康清潔級雄性SD大鼠(福建醫科大學實驗動物中心),10只,4~6周齡,體質量80~100g,排除眼部及全身疾病,按照正常晝夜節律,室內溫度25℃,相對濕度40%~65%,置于獨立籠內,可自由攝食、飲水,大鼠的實驗條件及使用過程符合視光與眼科研究協會(Association for research in vision and ophthalmology,ARVO)相關的動物使用規定。純化的BDNF過表達慢病毒液(上海吉瑪制藥技術有限公司)。FITC-小鼠抗CD44單克隆抗體、FITC-小鼠抗CD34單克隆抗體、FITC-小鼠抗CD90單克隆抗體(Santa Cruz公司),DMEM/F12培養液、胎牛血清、胰酶(Gibco公司),大鼠BDNF ELISA試劑盒(R&D公司),RNeasy Mini Kit(Qiagen),PrimeScript?1st strand cDNA Synthesis Kit(Takara),SYBR?Premix Ex TaqTM Kit(Takara)。
1.2方法
1.2.1大鼠BMSC取材和培養鑒定大鼠BMSC培養鑒定方法[7]:健康清潔級4周齡雄性SD大鼠腹腔注射100g/L水合氯醛麻醉后無菌條件下取出雙側脛骨和股骨,無菌PBS沖洗備用。把脛骨和股骨從中間剪斷,用完全培養液(DMEM/F12培養液+200mL/L FBS+50U/mL肝素)10mL反復沖洗骨髓腔,沖洗液經200目不銹鋼標準篩過濾掉大的團塊后充分吹打混勻獲取細胞懸液,接種于25cm2培養瓶中,置于37℃,50ml/L CO2的培養箱(美國Thermo Forma)內培養。3d后首次換液,換液時倒除舊的培養液,加入含0.4g/L EDTA的PBS 4mL潤洗,37℃孵育10min,倒除PBS和未貼壁的細胞,加入新的完全培養液。采用CD44、CD34、CD90對細胞進行鑒定。當細胞融合達80%時進行傳代培養,取第2代細胞用于基因修飾。
1.2.2BDNF基因修飾的BMSC細胞取生長狀態良好的第2代的BMSC,細胞融合率約30%~50%,更換為新鮮完全培養液。調整慢病毒感染復制數MOI為30加入濃縮純化的BDNF過表達慢病毒液(滴度為2×108TU/mL),同時加入稀釋好的Polybrene至終濃度為5μg/mL。輕晃混勻,繼續培養。感染24h后,更換為新鮮完全培養液。熒光顯微鏡下,計數表達綠色熒光的BMSC,計算感染率。
表1BDNF和GAPDH的引物序列
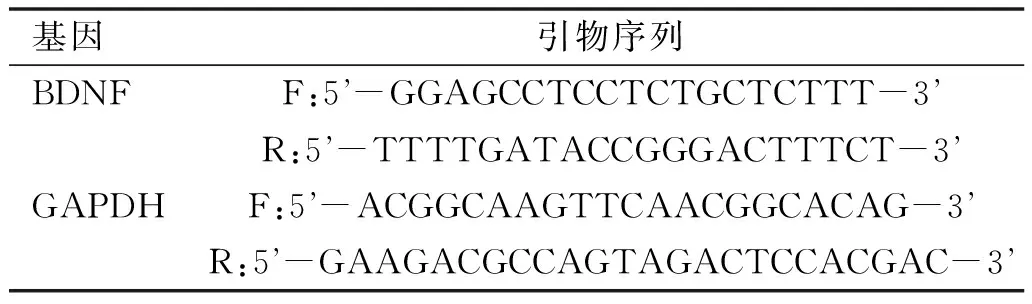
基因引物序列BDNFF:5 -GGAGCCTCCTCTGCTCTTT-3 R:5 -TTTTGATACCGGGACTTTCT-3 GAPDHF:5 -ACGGCAAGTTCAACGGCACAG-3 R:5 -GAAGACGCCAGTAGACTCCACGAC-3
1.2.3實驗分組實驗分為空白對照組(未經轉染BMSC細胞)、陰性對照組(采用不含BDNF基因的空載質粒轉染的BMSC細胞)和實驗組(采用含BDNF基因的質粒轉染的BMSC細胞)。
1.2.4Realtime PCR測定基因修飾的BMSC細胞BDNF mRNA表達取第3代、第4代、第5代、第6代、第7代、第8代和第9代細胞各5×105抽提各組細胞總RNA,逆轉錄成cDNA。BDNF引物序列參照GenBank中的序列,用primer 5.0軟件設計而成,具體序列見表1。以GAPDH為內參,進行Realtime PCR檢測,預變性95℃ 10min,變性95℃ 15s、退火延伸60℃ 60s,共進行40個循環。每次在延伸階段讀取吸光值。PCR結束后,在95℃變性1min。然后冷卻至55℃ 1min,使DNA雙鏈充分結合。收集獲取熒光信號得到擴增曲線、溶解曲線和CT值,通過內參GAPDH校正,采用2-△△CT法分析數據,用相對表達量表示,實驗重復3次。
1.2.5ELISA測定基因修飾的BMSC細胞BDNF的分泌表達取第3代、第4代、第5代、第6代、第7代、第8代和第9代細胞調整BMSCs密度,按3×104/孔接種于6孔板,24h后細胞約為5×104/孔,更換新鮮培養基(2mL/孔),培養12h后收集各組細胞上清液,按照BDNF的ELISA檢測試劑盒說明書進行檢測。每組設3個復孔。
2 結果
2.1基因修飾的BMSC細胞BDNF mRNA表達實驗組第3、4、5、6、7和8代BMSC細胞BDNF mRNA表達高于空白對照組和陰性對照組,組間差異具有統計學意義(P3:F=491.788,P<0.05;P4:F=380.112,P<0.05;P5:F=1854.929,P<0.05;P6:F=224.540,P<0.05;P7:F=619.155,P<0.05;P8:F=10.092,P<0.05,圖1)。實驗組BMSC細胞隨著細胞傳代,BDNF mRNA表達逐漸下降,不同代數間差異具有統計學意義(F=298.603,P<0.05);第3代與第4代,第4代和第5代、第5代與第6代,第6代和第7代組間兩兩比較差異具有統計學意義(P<0.05);第7代與第8代,第8代和第9代組間兩兩比較差異無統計學意義(P>0.05)。
2.2基因修飾的BMSC細胞BDNF的分泌表達實驗組第3、4、5、6、7和8代細胞BMSC細胞BDNF的分泌表達高于空白對照組和陰性對照組,組間差異具有統計學意義(P3:F=520.609,P<0.05;P4:F=734.520,P<0.05;P5:F=152.847,P<0.05;P6:F=80.372,P<0.05;P7:F=96.083,P<0.05;P8:F=38.532,P<0.05,圖2)。實驗組BMSC細胞隨著細胞傳代,BDNF的分泌表達逐漸下降,不同代數間差異具有統計學意義(F=230.084,P<0.05);第3代和第4代、第4代和第5代、第5代和第6代組間兩兩比較差異具有統計學意義(P<0.05);第6代和第7代、第7代和第8代、第8代和第9代組間兩兩比較差異無統計學意義(P>0.05)。
3 討論
視網膜變性疾病是嚴重的不可逆性致盲眼病。視網膜變性疾病如黃斑變性、光感受器細胞變性、視網膜色素上皮變性、Stargardt病等最終均可致盲[1-2]。由于體內視網膜神經細胞不能再生,目前此類疾病尚無有效的治療方法。尋找再生能力強、非視網膜來源的、可替代視網膜細胞功能的自體細胞是移植的理想種子細胞,也是近年視網膜變性疾病治療的研究熱點和焦點。干細胞治療和基因治療有望為視網膜變性疾病的治療提供新的途徑。自體BMSC是理想的種子細胞[3-4]。BMSC可能通過固有的再生能力分化替代變性的視網膜細胞、上調神經營養因子表達、修復變性的視網膜細胞等途徑綜合治療視網膜變性疾病。van Velthoven等[8]研究發現,BMSC可通過分泌BDNF、類表皮生長因子、persephin (PSP)或sonic hedgehog調節神經干細胞增生和分化,改善新生兒缺血缺氧性腦病的預后。BMSC不僅可通過分化替代變性的視網膜細胞,還可通過分泌神經營養因子,挽救修復周圍神經細胞,發揮神經保護作用[5-6]。通過基因工程,可增強BMSC的神經保護功能。
本項目研究在體外成功構建了BDNF過表達的慢病毒載體,將目的基因BDNF導入BMSC中,轉染效率較高。BDNF基因的質粒轉染的BMSC細胞實驗組第3、4、5、6、7和8代BMSC細胞BDNF的mRNA表達高于空白對照組和陰性對照組;ELISA證實了第3、4、5、6、7和8代BMSC細胞BDNF的分泌表達高于空白對照組和陰性對照組。BDNF表達于中樞和周圍神經系統。主要在腦組織合成,上丘和視皮質有豐富的BDNF分布。視網膜Müller細胞、神經節細胞自身和移位的無長突細胞可以分泌BDNF,視網膜的外叢狀層、外核層、內叢狀層、內核層和神經節細胞層均有表達。BDNF的受體主要有兩種:高親和力受體酪氨酸蛋白激酶(Trk)和低親和力的P75NT受體。視網膜的TrkB受體主要位于內叢狀層和神經節細胞層。BDNF與TrkB受體結合后引起Trk蛋白及多種蛋白的磷酸化,激活胞內信號轉導通路(主要包括MAPK/ERK和PI3K/AKT)),營養突觸后的神經元,促進神經元的生長、發育、功能維持,調節軸突和樹突的生長、突觸的形成與功能、細胞的遷移和增生及神經元的存活[9-10]。含有BDNF的培養液中成活的RGC比例多于不含BDNF的培養基[9-10]。視神經夾傷動物模型于造模后立即玻璃體腔注射不同劑量的BDNF,BDNF注射量為30μg時RGC的存活率最高,大的RGC數目較多;而BDNF注射量為90μg時,可最大程度減少中等大小RGC的缺失,保持小、中、大3種RGC的正常比例[11-12]。這提示RGC對不同治療劑量的反應不同。注射1wk后與未處理組比較,玻璃體腔注射BDNF,視神經橫切顯示存活的RGC增多,細胞凋亡延緩[13]。但是外源性BDNF半衰期短,反復眼內注射可能造成眼球損傷,增加眼內感染風險。我們研究發現BDNF基因的質粒轉染的BMSC細胞分泌的BDNF明顯增強,且可持續表達5~6代。這為進一步研究其對視網膜的保護作用奠定了基礎。Saito等[14]用腺相關病毒將BDNF基因轉入虹膜色素上皮細胞,然后將細胞移植入光損傷的大鼠模型視網膜下腔,移植細胞對感光細胞有顯著的保護作用,視乳頭附近多個位置的外核層較對照組厚,抑制TrkB-T1可降低移植細胞的保護作用。這提示通過基因工程增強眼內細胞長期表達BDNF,減少反復注射的風險。

圖1各組BMSC細胞BDNF mRNA表達變化bP<0.01 vs 空白對照組;dP<0.01 vs 陰性對照組。
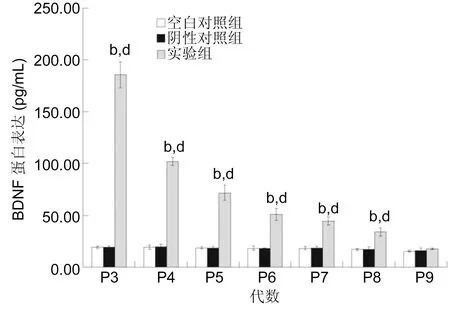
圖2各組BMSC細胞BDNF的分泌變化bP<0.01 vs 空白對照組;dP<0.01 vs 陰性對照組。
本研究發現,實驗組BMSC細胞隨著細胞傳代,BDNF mRNA表達和蛋白分泌逐漸下降。第7代與第8代,第8代和第9代的BDNF mRNA表達,組間兩兩比較差異無統計學意義,第6代和第7代,第7代和第8代,第8代和第9代的BDNF的蛋白分泌組間兩兩比較差異無統計學意義。這可能是由于體外傳代培養時細胞快速增殖,細胞內BDNF基因的表達減弱或攜帶BDNF基因的細胞比例減少。這提示一方面可通過傳代的代數來控制移植細胞在眼內BDNF的分泌表達。另一方面用于移植的轉染細胞不宜傳代5代以上。
綜上所述,通過基因工程增強BMSC細胞長期表達BDNF,減少反復注射的風險。干細胞治療和基因治療有望為視網膜變性疾病的治療提供新的途徑。
1Holz FG,Schmitz-Valckenberg S,Fleckenstein M.Recent developments in the treatment of age-related macular degeneration.J Clin Invest 2014;124(4):1430-1438
3Siy Uy H,Chan PS,Cruz FM.Stem Cell Therapy: a Novel Approach for Vision Restoration in Retinitis Pigmentosa.Med Hypothesis Discov Innov Ophthalmol 2013;2(2):52-55
4Chen AK,Reuveny S,Oh SK.Application of human mesenchymal and pluripotent stem cell microcarrier cultures in cellular therapy: achievements and future direction.Biotechnol Adv 2013;31(7):1032-1046
5Xu W,Xu GX.Mesenchymal stem cells for retinal diseases.Int J Ophthalmol 2011;4(4):413-421
6Sun C,Lin H,Yu W,et al.Neurotrophic effect of bone marrow mesenchymal stem cells for erectile dysfunction in diabetic rats.Int J Androl 2012;35(4):601-607
7謝茂松,徐國興,李瓊,等.大鼠骨髓間充質干細胞分離培養方法的比較.國際眼科雜志 2007;7(5):1285-1287
8van Velthoven CT,Braccioli L,Willemen HL,et al.Therapeutic potential of genetically modified mesenchymal stem cells after neonatal hypoxic-ischemic brain damage.Mol Ther 2014;22(3):645-654
9Galindo-Romero C,Valiente-Soriano FJ,Jiménez-Lpez M,et al.Effect of brain-derived neurotrophic factor on mouse axotomized retinal ganglion cells and phagocytic microglia.Invest Ophthalmol Vis Sci 2013;54(2):974-985
10Harada C,Azuchi Y,Noro T,et al.TrkB Signaling in Retinal Glia Stimulates Neuroprotection after Optic Nerve Injury.Am J Pathol 2015;185(12):3238-3247
11Chen H,Weber AJ.BDNF enhances retinal ganglion cell survival in cats with optic nerve damage.Invest Ophthalmol Vis Sci 2001;42(5):966-974
12Valiente-Soriano FJ,Nadal-Nicolás FM,Salinas-Navarro M,et al.BDNF Rescues RGCs But Not Intrinsically Photosensitive RGCs in Ocular Hypertensive Albino Rat Retinas.Invest Ophthalmol Vis Sci 2015;56(3):1924-1936
13Watanabe M,Fukuda Y.Survival and axonal regeneration of retinal ganglion cells in adult cats.Prog Retin Eye Res 2002;21(6):529-553
14Saito T,Abe T,Wakusawa R,et al.TrkB-T1 receptors on Muller cells play critical role in brain-derived neurotrophic factor-mediated photoreceptor protection against phototoxicity.Curr Eye Res 2009;34(7):580-588
Changes of brain-derived neurotrophic factor expression in gene modified bone marrow mesenchymal stem cells
Mao-Song Xie,Guo-Xing Xu,Li-Bin Huang
Young and Middle-aged Talent Training Project of Fujian Provincial Health and Family Planning Commission (No.2014-ZQN-ZD-16)
Mao-Song Xie.Department of Ophthalmology,First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,Fujian Province,China.pandaxms1978@163.com
2016-05-09Accepted:2016-09-05
bone marrow mesenchymal stem cell; brain-derived neurotrophic factor; gene modified; retinal degenerative diseases; therapy
福建省衛計委中青年骨干人才培養項目(No.2014-ZQN-ZD-16)
(350005)中國福建省福州市,福建醫科大學附屬第一醫院眼科 福建省眼科研究所
謝茂松,博士,副教授,副主任醫師,研究方向:眼底病。
謝茂松.pandaxms1978@163.com
2016-05-09
2016-09-05
Department of Ophthalmology,First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,Fujian Province,China
Xie MS,Xu GX,Huang LB.Changes of brain-derived neurotrophic factor expression in gene modified bone marrow mesenchymal stem cells.Guoji Yanke Zazhi(Int Eye Sci) 2016;16(10):1816-1819
10.3980/j.issn.1672-5123.2016.10.07

