辣椒乙烯轉錄因子CaERF18的分離與誘導表達
鄭井元劉峰朱春暉
(1.湖南省農業科學院蔬菜研究所,長沙 410125;2.湖南省農業科學院植物保護研究所,長沙 410125)
辣椒乙烯轉錄因子CaERF18的分離與誘導表達
鄭井元1劉峰1朱春暉2
(1.湖南省農業科學院蔬菜研究所,長沙 410125;2.湖南省農業科學院植物保護研究所,長沙 410125)
旨在明確辣椒(Capsicum annuum L. HDA149)與南方根結線蟲(Meloidogyne incognita)不親和互作過程中相關特異性ERF類型轉錄因子的候選基因及其表達模式。應用RT-PCR方法,從南方根結線蟲誘導的辣椒中分離到一個694 bp cDNA序列的乙烯(ERF)轉錄因子基因核心序列,命名為CaERF18,編碼231個氨基酸,含有一個保守的由59個氨基酸構成的ERF結構域,與NtERF118、SlERF4 和 SlERF19 AP2結構域的相似性分別為44.3%、42.6% 和39.3%。表達分析表明,南方根結線蟲侵染可顯著誘導CaERF18的表達,接種線蟲后12 h相對表達量開始升高,12 h升高3.8倍,72 h升高7.2倍。結果表明,CaERF18是一受病原物誘導表達的基因,推測CaERF18在介導辣椒對根結線蟲的抗性作用中可能具有重要的調控功能。
辣椒;根結線蟲;乙烯;轉錄因子;誘導表達
乙烯應答轉錄因子(Ethylene-response factor,ERF)屬于AP2/ERF轉錄因子超家族,共同特征是都含有由57-66個氨基酸殘基組成的保守AP2/ERF結構域,在調控生物和非生物脅迫應答基因表達中發揮重要的轉錄調控作用[1-5]。根據AP2/ERF保守結構域的數量差異和是否含有其他結構域,可將ERF轉錄因子超家族劃分為3個主要的亞族:AP2亞族、ERF亞族和RAV亞族[6]。AP2亞族含有兩個重復的AP2/ERF結構域,ERF亞族只含有一個AP2/ERF結構域,RAV亞族除了含有一個AP2/ERF結構域,還含有一個植物特異性轉錄因子中的保守B3結構域[6]。另外,依據AP2/ERF氨基酸序列的保守性序列特征,通常又將ERF超家族分成兩個亞家族:CBF/DREB和ERF[6]。
ERF轉錄因子在植物生長發育,如花和種子發育、果實成熟,植物非生物脅迫(如低溫、干旱和高鹽脅迫等[7]),以及植物抗病反應中起著重要的作用[8,9]。水稻乙烯轉錄因子OsEATB通過下調赤霉素生物合成酶基因的表達控制節間的生長[10];ERF是植物非生物脅迫的關鍵調節子[11,12],AtERF73應對低氧脅迫[13]、AtRAP2應對低鉀脅迫[14];DREB類型轉錄因子參與植物的高溫和干旱脅迫[15-17];ERF是植物抗病信號轉導路徑的重要調控基因[18],超表達GmERF5的大豆植株能顯著增強對大豆疫霉菌的抗性[19],超表達小麥ERF基因TaPIE1能顯著增強小麥植株對絲核菌(Rhizoctonia cerealis)的抗性[20],辣椒的ERF基因CaERF1、CaJERF1在植物的抗病應答以及非生物脅迫中發揮重要作用[21,22]。因此,篩選、鑒定、分離新的ERF轉錄因子,將為利用生物技術改良植物的抗病、抗逆、生長發育調控提供有效的基因資源。
本研究在辣椒與根結線蟲互作后的轉錄組分析基礎上,依據一系列備選上調表達的基因序列結合ERF基因的保守性,設計序列特異性引物,采用RT-PCR方法,從南方根結線蟲侵染辣椒后的根部組織中分離出一個乙烯應答轉錄因子基因的核心序列,命名為CaERF18,研究這一基因在南方根結線蟲誘導后不同時間的表達特性,初步了解CaERF18基因的結構和誘導特征,為深入闡明CaERF18基因的結構和功能、揭示CaERF18基因介導的辣椒抗根結線蟲機制,最終為利用CaERF18基因改良植物的抗病性和抗逆性鑒定基礎。
1 材料與方法
1.1 材料
辣椒(Capsicum annuum L.)雙單倍體材料HDA149,含有單顯性抗根結線蟲基因Me3,由中國農業科學院蔬菜花卉研究所茆振川博士贈送(最初從法國農業科學院Alain Palloxin 博士處引進),在湖南省蔬菜研究所示范基地擴繁。南方根結線蟲(Meloidogyne incognita)從湖南省蔬菜研究所示范基地采集,經形態學、特異引物PCR鑒定后進行致病性測定,最后采集單卵塊用茄門甜椒擴繁。
1.2 方法
1.2.1 總RNA的提取和cDNA的合成 辣椒種子消毒后播種于育苗缽內,幼苗長至4-5片真葉時移栽,移栽10 d后接種南方根結線蟲二齡幼蟲,每株接種1 000條,分別在取樣之后的第12、36和72 h取1.5-2.0 cm長的根尖組織,液氮冷凍后置于-80℃的冰箱中,取用時混合磨樣。總RNA采用天根生化科技有限公司的“TRNzol A+總RNA提取試劑盒”,總RNA的質量和完整性用1%的瓊脂糖凝膠電泳鑒定。第1鏈cDNA的合成采用SuperScript?Ⅲ First-Strand Synthesis System(Invitrogen)試劑盒。
1.2.2 CaERF18部分序列的克隆與分析 根據南方根結線蟲侵染辣椒后的轉錄組數據分析結果,發現一條含有約900 bp的序列顯著上調表達,初步預測是一個具有特定結構的轉錄因子,根據此序列的結構特征設計一對特異引物CaERF18-F(5'-AAGAATCGGTTCTCGCAAAAG-3')和CaERF18-R(5'-ATTATCATCCTCAGTTTCACAG-3'),以1.2.1合成的cDNA模板進行PCR擴增,20 μL擴增體系(1 μL cDNA、1 μL CaERF18-F、1 μL CaERF18-R、1.6 μL dNTP(2.5 mmol/L)、2 μL 10×buffer、Taq DNA polymerase 0.2 μL(5 U/μL)、13.2 μL ddH2O)。擴增程序為:94℃預變性3 min;94℃ 30 s,58℃ 30 s,72℃ 50 s,35個循環;72℃延伸10 min。電泳后回收目的擴增產物,連接、克隆到T 載體后送上海生工測序。測序結果用Primer、DNAman軟件及NCBI網站的Nucleoide Blast、Protein Blast等程序進行分析。
1.2.3 根結線蟲侵染對CaERF18基因表達的影響 參照1.2.1的方法用南方根結線蟲二齡幼蟲接種辣椒幼苗,以不接種南方根結線蟲的辣椒幼苗為對照,分別在接種后的6、12、24、36和72 h取根尖組織樣品,用液氮速凍、-80℃保存。總RNA提取及cDNA的合成參照1.2.1。
根據CaERF18基因cDNA序列特征,用Primer Premier5.0和Oligo7.0軟件設計實時熒光定量PCR引物,引物為CaERF18-qF(Primer:5'-CGATGATTCTGAGAGCCCAC-3')和CaERF18-qR(Primer:5'-TGCCCTATTACCTGGAAGTTGC-3')。辣椒β-actin為參照基因[23],擴增引物為β-actin-qF(5'-TGCAGG-AATCCACGAGACTAC-3')和β-actin-qR(5'-TACCACCACTGAGCACAATGTT-3')。qRT-PCR以各取樣時間點的根部組織cDNA為模板,20 μL擴增體系中包含10 μL 2×SYBR?Premix Ex TaqTMⅡ(TaKaRa),上、下游引物(10 μmol/L)各0.8 μL,cDNA(第一鏈cDNA合成后稀釋40倍)1.6 μL,加ddH2O至總體積20 μL。PCR反應程序為:94℃預變性30 s;94℃30 s,58℃ 30 s,72℃ 10 s,40個循環;反應完成后分析熔解曲線以及熒光值變化曲線,實驗重復3次。
2 結果
2.1 CaERF18的序列結構
將辣椒植株接種南方根結線蟲,接種后的12、36和72 h分別取根尖組織樣品,混合磨樣提取總RNA,用設計的擴增引物對提取的RNA進行RTPCR擴增,擴增產物經電泳檢測后擴增出 694 bp的專一性片段(圖1)。對擴增產物進行回收、連接、克隆和測序,將測序序列在GenBank中進行Blastn比對和保守結構預測,發現這一序列含有一典型的保守AP2/ERF基序,與煙草(Nicotiana tomentosiformis)NtERF118的相似性達46%,因此將其暫命名為CaERF18。進一步分析推定的231個氨基酸序列發現,序列中含有一個長度為59個氨基酸殘基組成的AP2結構域,以及一段富含R、K氨基酸殘基的類似核定位信號區(圖2),同時將這一推定的氨基酸序列在BaCeILo(http://gpcr2.biocomp. unibo.it/bacello/index.htm)上分析,發現定位于細胞核,說明CaERF18基因是在細胞核中起轉錄調控作用的轉錄因子。
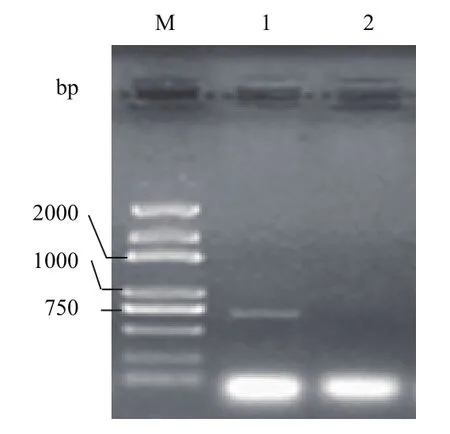
圖1 特異引物RT-PCR擴增電泳圖
為進一步分析比較CaERF18基因與其他種類植物ERF基因的相似性,利用NCBI數據庫中的BlastTP同源搜索,選擇了同源性較高的煙草(Nicotiana tomentosiformis L.)、番茄(Solanum lycopersicum L.)、辣椒(C. annuum L.)、芫菁(Brassica rapal L.)、馬鈴薯(Solanum tuberosum L.)和擬南芥(Arabidopsis thaliana)6個物種中的8個ERF蛋白進行多重氨基酸序列比對,比對采用DNAMAN軟件進行,比對結果(圖3)顯示,8個基因在保守結構域上都具有共同的氨基酸序列。相似性和進化關系(圖4)表明,CaERF18與同科的煙草NtERF118和SlERF119的相似性最高。
2.2 CaERF18的誘導表達特征
用南方根結線蟲二齡幼蟲侵染辣椒材料HDA149,依據線蟲侵染的前期、初期、中期和后期4個時間段,取侵染后不同時間段的根尖組織,提取總RNA,實時熒光定量PCR分析了CaERF18在病原線蟲侵染后的表達特征。結果(圖5)顯示,線蟲接種6 h的相對表達量為0.8倍,12 h后上升到了3.8倍,之后在24 h和36 h的表達量相對較為穩定,分別為3.3倍和3.4倍,到72 h后,相對表達量達到監測的最高值,為7.2倍。根結線蟲侵染的時間段來看,CaERF18的相對表達水平呈上升的趨勢,具有被病原物誘導而顯著上調表達的特征。
3 討論
ERF類型轉錄因子是植物中特有的一類參與植物應對生物和非生物脅迫的轉錄因子[7,19,24]。許多研究認為ERF轉錄因子主要與植物抗逆,如水脅迫、鹽脅迫、耐旱、耐冷、耐熱等相關[7,12,17,25],但越來越多的研究顯示,ERF類型轉錄因子是植物抗病應答反應的關鍵調控因子,在植物的抗病反應中發揮重要作用。超表達GmERF5可增強大豆對大豆疫霉病的抗性[19],TaPIE1通過激活乙烯信號轉導途徑中下游防衛基因和脅迫基因的表達正調控小麥對病原物立枯絲核菌侵染和冷害的防衛反應[20],ERF類型轉錄因子是油菜(B. napus)應對生物脅迫信號轉導中的重要參與者[26]。而很多ERF類型的轉錄因子既參與生物脅迫又參與逆境脅迫[20,26],本實驗通過RT-PCR技術分離到一個辣椒ERF類型轉錄因子的核心cDNA序列,將為下一步從轉錄水平上同時研究辣椒的抗病和抗逆機制提供一個新的候選基因。

圖2 CaERF18 cDNA 核心序列及推定的氨基酸序列

圖3 部分ERF轉錄因子與 CaERF18 蛋白AP2/ERF結構域的比對
多數ERF類型轉錄因子都具有誘導表達的特性,但具有一定的時空特性。根結線蟲侵染辣椒是一個動態的過程,茆振川等[27]研究顯示,用根結線蟲接種辣椒品種HDA149后的0-6 h根結線蟲侵染率為0,12 h有少量線蟲開始侵入,24 h和36 h有大量線蟲侵入,且在線蟲周圍有許多壞死細胞。本研究結果顯示,在線蟲接種后的6 h,CaERF18的相對表達量為0.8倍,此時線蟲還尚未游動到根尖組織附近,沒有觸動辣椒的抗病性反應,而當接種后的12、24和36 h,CaERF18的相對表達量上升到了3.3-3.8倍,說明大量線蟲侵入后誘導的辣椒抗病性反應中抗病相關基因的表達被激活,特別是在線蟲大規模侵入后的72 h,CaERF18的相對表達量達到了7.2倍,而辣椒HDA149含有單顯性抗線蟲基因Me3,推測CaERF18可能參與了這一由Me3基因介導的抗病信號轉導過程,在這一過程中CaERF18由于根結線蟲的大量侵入而被誘導激活和上調表達,可能具有重要的調控作用。在擬南芥中乙烯信號轉導對北方根結線蟲的侵入有強烈的吸引或趨避作用[28],那么辣椒中的乙烯信號轉導對南方根結線蟲而言,是否具有如擬南芥一樣的吸引或趨避作用,需要進一步的實驗進行驗證。此外CaERF18與NtERF118、SlERF119、SlERF4等具有較高的同源性,還具有典型的核定位信號區,推測CaERF18可能同時參與了抗病和抗逆信號轉導。因此分離CaERF18的全長cDNA,詳細了解多種病原物和多種逆境脅迫的表達特性、組織表達特性、調控的下游靶標基因、參與的信號調控網絡等,將為闡明辣椒的抗病和抗逆分子機制提供新的基因資源,為今后的抗病和抗逆育種提供新思路。
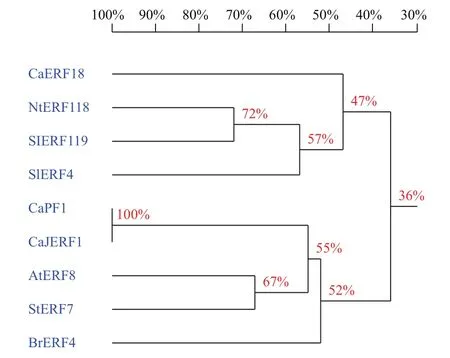
圖4 CaERF18 與其他作物ERF類型轉錄因子同源性比對

圖5 CaERF18 在南方根結線蟲接種的辣椒中表達的實時熒光定量PCR分析
4 結論
通過RT-PCR方法從辣椒中分離到一個新的ERF類型轉錄因子核心序列,序列分析顯示該基因具有一個由59個氨基酸殘基組成的典型AP2/ERF類型轉錄因子保守結構域和一個核定位信號區。qRT-PCR分析表明,CaERF18受病原物南方根結線蟲的侵染而上調表達,接種南方根結線蟲6、12、24、36和72 h的相對表達量分別為0.8、3.8、3.3、3.4和7.2倍。
[1]Zhang G, Chen M, Chen X, et al. Phylogeny, gene structures, and expression patterns of the ERF gene family in soybean(Glycine max L. )[J]. J Exp Bot, 2008, 59(15):4095-4107.
[2]Zhuang J, Cai B, Peng RH, et al. Genome-wide analysis of the AP2/ ERF gene family in Populus trichocarpa[J]. Biochem Biophys Res Commun, 2008, 371(3):468-474.
[3]Hu L, Liu S. Genome-wide identification and phylogenetic analysis of the ERF gene family in cucumbers[J]. Genetics and Molecular Biology, 2011, 34(4):624-633.
[4]Yan HW, Hong L, Zhou YQ, et al. A genome-wide analysis of the ERF gene family in sorghum[J]. Genetics and Molecular Research:GMR, 2013, 12(2):2038-2055.
[5]Rao G, Sui J, Zeng Y, et al. Genome-wide analysis of the AP2/ERF gene family in Salix arbutifolia[J]. FEBS Open Bio, 2015(5):132-137.
[6]Nakano T, Suzuki K, Fujimura T, et al. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiol, 2006,140(2):411-432.
[7]Li MY, Xu ZS, Huang Y, et al. Genome-wide analysis of AP2/ERF transcription factors in carrot(Daucus carota L. )reveals evolution and expression profiles under abiotic stress[J]. Mol Genet Genomics, 2015, 290(6):2049-2061.
[8]Xu ZS, Chen M, Li LC, et al. Functions and application of the AP2/ ERF transcription factor family in crop improvement[J]. J Integr Plant Biol, 2011, 53(7):570-585.
[9]Zhang JY, Wang QJ, Guo ZR. Progresses on plant AP2/ERFtranscription factors[J]. Hereditas, 2012, 34(7):835-847.
[10]Qi W, Sun F, Wang Q, et al. Rice ethylene-response AP2/ERF factor OsEATB restricts internode elongation by down-regulating a gibberellin biosynthetic gene[J]. Plant Physiol, 2011, 157(1):216-228.
[11]Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AP2/ERF family transcription factors in plant abiotic stress responses[J]. Biochim Biophys Acta, 2012, 1819(2):86-96.
[12]Yang H, Yu C, Yan J, et al. Overexpression of the Jatropha curcas JcERF1 gene coding an AP2/ERF-type transcription factor increases tolerance to salt in transgenic tobacco[J]. Biochemistry Biokhimiia, 2014, 79(11):1226-1236.
[13]Yang CY, Hsu FC, Li JP, et al. The AP2/ERF transcription factor AtERF73/HRE1 modulates ethylene responses during hypoxia in Arabidopsis[J]. Plant Physiol, 2011, 156(1):202-212.
[14]Kim MJ, Ruzicka D, Shin R, et al. The Arabidopsis AP2/ERF transcription factor RAP2. 11 modulates plant response to lowpotassium conditions[J]. Mol Plant, 2012, 5(5):1042-1057.
[15]Sakuma Y, Maruyama K, Osakabe Y, et al. Functional analysis of an Arabidopsis transcription factor, DREB2A, involved in droughtresponsive gene expression[J]. Plant Cell, 2006, 18(5):1292-1309.
[16]Qin F, Sakuma Y, Tran LS, et al. Arabidopsis DREB2A-interacting proteins function as RING E3 ligases and negatively regulate plant drought stress-responsive gene expression[J]. Plant Cell, 2008,20(6):1693-1707.
[17]Sato H, Mizoi J, Tanaka H, et al. Arabidopsis DPB3-1, a DREB2A interactor, specifically enhances heat stress-induced gene expression by forming a heat stress-specific transcriptional complex with NF-Y subunits[J]. Plant Cell, 2014, 26(12):4954-4973.
[18]Gutterson N, Reuber TL. Regulation of disease resistance pathways by AP2/ERF transcription factors[J]. Curr Opin Plant Biol,2004, 7(4):465-471.
[19]Dong L, Cheng Y, Wu J, et al. Overexpression of GmERF5, a new member of the soybean EAR motif-containing ERF transcription factor, enhances resistance to Phytophthora sojae in soybean[J]. J Exp Bot, 2015, 66(9):2635-2647.
[20]Zhu X, Qi L, Liu X, et al. The wheat ethylene response factor transcription factor pathogen-induced ERF1 mediates host responses to both the necrotrophic pathogen Rhizoctonia cerealis and freezing stresses[J]. Plant Physiol, 2014, 164(3):1499-1514.
[21]蔡漢陽, 肖卓麗, 嚴雁, 等. 辣椒CaERF4的全長cDNA克隆及其表達分析[J]. 熱帶作物學報, 2014(6):1102-1107.
[22]張秋平, 楊宇紅, 茆振川, 等. 辣椒乙烯反應轉錄因子基因CaJERF1的克隆及誘導表達[J]. 園藝學報, 2012, 39(4):705-712.
[23]Chen R, Li H, Zhang L, et al. CaMi, a root-knot nematode resistance gene from hot pepper(Capsium annuum L.)confers nematode resistance in tomato[J]. Plant Cell Reports, 2007, 26(7):895-905.
[24]Lata C, Mishra AK, Muthamilarasan M, et al. Genome-wide investigation and expression profiling of AP2/ERF transcription factor superfamily in foxtail millet(Setaria italica L. )[J]. PLoS One, 2014, 9(11):e113092.
[25]Wang X, Han H, Yan J, et al. A new AP2/ERF transcription factor from the oil plant Jatropha curcas confers salt and drought tolerance to transgenic tobacco[J]. Applied Biochemistry and Biotechnology, 2015, 176(2):582-597.
[26]Zhuang J, Zhu B. Analysis of Brassica napus ESTs:gene discovery and expression patterns of AP2/ERF-family transcription factors[J]. Mol Biol Rep, 2014, 41(1):45-56.
[27]茆振川, 謝丙炎, 楊宇紅, 等. 辣椒 Me3 基因介導抗根結線蟲相關基因的SSH分析[J]. 園藝學報, 2007, 34(6):1453-1458.
[28]Fudali SL, Wang C, Williamson VM. Ethylene signaling pathway modulates attractiveness of host roots to the root-knot nematode Meloidogyne hapla[J]. Mol Plant Microbe Interact, 2013, 26(1):75-86.
(責任編輯 馬鑫)
Isolation and Induced Expression of Ethylene Transcription Factor Gene CaERF18 from Capscium annuumm
ZHENG Jing-yuan1LIU Feng1ZHU Chun-hui2
(1. Institute of Vegetables, Hunan Academy of Agricultural Sciences,Changsha 410125;2. Plant Protection Institute, Hunan Academy of Agricultural Sciences,Changsha 410125)
To clarify the candidate genes and expression of one ERF transcription factor in pepper(Capsicum annuum L. HDA149)during the incompatible interaction between HDA149 and Meloidogyne incognita,the core sequence of an ethylene transcription factor gene CaERF18 was isolated from pepper induced by M. incognita with RT-PCR. The cDNA core sequence was 694 bp,encoding 231 amino residues containing a conserved ERF motif of 59 amino acids that shared 44.3%,42.6% and 39.3% identities with the motif of NtERF118,SlERF4 and SlERF19,respectively. The expression analysis revealed that the expression of CaERF18 was significantly induced by M. incognita,the relative expression level of CaERF18 began to increase at 12 h with 3.8 times,and 7.2 times(peak)of the control at 72 h after inoculation with M. incognita. The expression of CaERF18 was strongly up-regulated by the nematode inoculation,which implied that the gene might play an important regulatory role in the resistant interaction of C. annuum to nematode.
pepper;root-knot nematode;ethylene;transcription factor;induced expression
10.13560/j.cnki.biotech.bull.1985.2016.03.014
2015-06-12
國家自然科學基金項目(31201498),湖南省農業科學院創新項目(2014YB09)
鄭井元,男,博士,副研究員,研究方向:蔬菜病害;E-mail:zhengjingyuan2004@163.com

