TGF-β1誘導馬鹿茸MSCs軟骨分化及c-myc基因的表達
韓春梅王姍姍高慶華,鄭永富馬夢婷張勤
(1.塔里木大學動物科學學院,阿拉爾 843300;2.新疆生產建設兵團塔里木畜牧科技重點實驗室,阿拉爾 843300;3.中國農業大學動物科技學院,北京100193)
TGF-β1誘導馬鹿茸MSCs軟骨分化及c-myc基因的表達
韓春梅1,3王姍姍1高慶華1,2鄭永富1馬夢婷2張勤3
(1.塔里木大學動物科學學院,阿拉爾 843300;2.新疆生產建設兵團塔里木畜牧科技重點實驗室,阿拉爾 843300;3.中國農業大學動物科技學院,北京100193)
鹿茸間充質干細胞(MSCs)是維持茸再生與骨化的重要組織,旨在研究鹿茸MSCs的軟骨分化及原癌基因c-myc對該過程的調控作用。利用成年塔里木馬鹿生長60 d的鹿茸第2代間充質干細胞(MSCs,P2),通過TGF-β1(10 ng/mL濃度)刺激,誘導塔里木馬鹿茸間充質干細胞向軟骨分化,采用免疫組化和阿利新藍染色鑒定誘導結果,并通過qPCR方法檢測軟骨分化過程中c-myc基因的表達變化。結果顯示,MSCs在誘導后的第9天開始出現細胞形態變化,由梭形向多角形轉變,原來菊花狀的分布逐漸向鋪路石狀變化,至14 d可觀察到軟骨陷窩,21 d軟骨細胞基質明顯,并開始出現細胞凋亡。非誘導組28 d細胞出現凋亡,細胞內發現空泡。35 d兩組細胞凋亡明顯,細胞折光性變差,間隙變大。阿利新藍染色鑒定,誘導至第14天細胞基質中開始出現大量陽性染色。免疫組化實驗檢測,誘導至21 d的細胞基質中出現棕色Col II陽性反應物,隨培養時間增加顏色加深,并集中分布在細胞及其周圍基質中。在軟骨分化進程中,第7、14、21和28天,誘導組c-myc基因表達與非誘導組相比顯著下調(P<0.05),但誘導至35 d,誘導組c-myc表達與非誘導組相比無顯著差異(P>0.05)。在TGF-β1刺激下,塔里木馬鹿茸MSCs可以分化成軟骨,原癌基因c-myc下調表達誘導鹿茸MSCs進入凋亡狀態并分化為軟骨細胞。
馬鹿茸;間充質干細胞;軟骨分化;轉化生長因子β1;c-myc基因
鹿茸是哺乳動物唯一能夠割后再生的器官,其割后再生與快速生長類似腫瘤的特性,吸引了國內外眾多科學家的興趣。鹿茸間充質干細胞位于茸皮的真皮層下,是一類新的干細胞。在鹿茸不同生長期,間充質細胞層的厚度不斷變化,從生長早期到后期即骨化期,逐漸變薄。一系列研究[1-5]發現鹿茸的間充質細胞層(MSCs)來源于位于鹿額外脊的骨膜干細胞,由間充質細胞分化成集落生成單位成纖維細胞,然后分化成軟骨細胞進而形成骨細胞,是維持鹿茸的生長發育的源泉之一。在鹿茸整個生長過程中,不斷發生著這樣的變化,來實現鹿茸的生長[6,7]。但該理論的分子生物學證據國內外很少有相關報道。
原癌基因c-myc對干細胞的增殖分化起著關鍵的作用。對塔里木馬鹿茸c-myc基因的研究發現,不同生長期鹿茸不同組織中的c-myc基因有明顯時空表達變化[8],說明c-myc基因與鹿茸的組織分化和細胞生長密切關聯。但c-myc在MSCs軟骨分化過程行使何種功能,其表達是分化的結果還是原因均無相關報道。
轉化生長因子(TGF-β1)是MSCs軟骨分化不可缺少的作用因子[9,10]。Kocamaz等[11]利用10 ng/μL TGF-β1成功誘導了20日齡雞的骨髓間充質干細胞(hMSCs)向軟骨分化。Christopher等[12]用相同劑量的TGF-β1刺激山羊MSCs,3周后RT-PCR檢測II型膠原蛋白(COL2)和聚集蛋白聚糖的表達顯著高于非誘導組。Mueller等[13]在人hMSCs軟骨分化的研究中發現,10 ng/μL TGF-β1及其不同配體不但能誘導軟骨形成,同時還能促使軟骨肥大化。
本研究利用10 ng/mL TGF-β1誘導塔里木馬鹿茸MSCs軟骨分化,確定體外誘導的最佳條件;并在此過程中研究c-myc基因的表達變化,一方面探討馬鹿茸MSCs體外軟骨的發育模式;另一方面研究c-myc對馬鹿茸軟骨分化機制的影響作用,以期為茸MSCs軟骨分化提供分子依據。
1 材料與方法
1.1 材料
1.1.1 實驗材料 生長60 d的塔里木馬鹿茸體外培養第2代MSCs和軟骨細胞(P2),由塔里木畜牧科技重點實驗室胚胎工程實驗室提供,HeLa細胞由華中農業大學武軍元老師提供。
1.1.2 試劑和儀器 胎牛血清FBS、細胞培養液DMEM、Ⅱ型膠原酶、胰蛋白酶、TGF-β1均為Sigma公司產品,TRIZOL(Invitrogen);反轉錄試劑盒(ThermoFisher),定量PCR試劑盒(Roche),DMSO;CO2加濕培養箱(MCO-15A),eppendorplex熒光定量PCR儀,倒置相差顯微鏡(Nikon);低溫高速離心機(Jouan);生物顯微鏡(舜宇);血細胞計數板;無菌操作臺等。阿利新藍染色試劑盒,羊Col II一抗和免疫組化試劑盒(北京博奧)。
1.2 方法
1.2.1 誘導培養及誘導結果鑒定 選擇5個6孔板,每個孔中加入1 mL 10% FBS-DMEM,約含細胞1×105個。設置其中15孔為對照組,另15孔為誘導組。誘導組每孔于接種P2細胞后第3天,細胞生長至70%融合時,換用軟骨誘導培養基,即含10 ng/mL TGF-β1的10% FBS-DMEM及1×10-7mol/L地塞米松。每2 d半量換液。換液時在倒置顯微鏡下觀察拍照記錄細胞生長情況。在培養至第7、14、21、28和35天時,每個時間點分別收集3個孔的細胞,每孔細胞數約為4.5×105個,在倒置顯微鏡下觀察細胞生長情況,用II型膠原蛋白免疫組化和阿爾新藍染色鑒定軟骨誘導結果。
1.2.2 c-myc基因的定量檢測 對每個時間點收集的細胞,用Invitrogen公司的TRIZOL Reagent? RNA提取試劑盒方法提取RNA,使用ThermoFisher公司的反轉錄試劑盒合成cDNA,1∶10稀釋后待用。根據GenBank數據庫提供的鹿c-myc基因序列和內參基因牛GAPDH基因序列,用Primer 5.0軟件設計PCR的引物(表1)。qPCR反應條件為:95℃ 5 min;95℃ 10 s,60℃ 30 s,40個循環。熔解曲線程序:55-95℃;半定量PCR反應條件:95℃,5 min;95℃ 10 s,65℃ 30 s,72℃ 2 min,28個循環。

表1 qPCR檢測用引物
為比較c-myc軟骨分化過程的基因表達,提取培養至第7天的P2代軟骨細胞和HeLa細胞的RNA,反轉錄后備用。
1.2.3 統計學處理 基因表達倍增值用2-△△Ct法計算,利用SPSS17.0 軟件包對對照組和誘導組的基因表達差異進行顯著性檢驗,P <0.05有統計學意義。
2 結果
2.1 誘導結果
倒置顯微鏡下觀察:誘導組培養至第9天后開始出現細胞形態變化。一些細胞的形態開始從梭形變成圓形、多角形,隨培養時間的延長,更多的細胞形態發生類似變化。原本菊花狀的細胞分布逐漸向鋪路石狀變化。至14 d可觀察到軟骨陷窩,培養至21 d軟骨細胞基質明顯,同時發現凋亡細胞。空白組培養至28 d細胞出現凋亡,細胞內發現空泡。35 d兩組細胞凋亡明顯,凋亡細胞體積縮小,形態近似圓形,凸起,中心呈空泡狀,細胞折光性變差,間隙變大(圖1)。
阿利新藍染色發現,誘導至第14天細胞基質中出現大量藍色陽性染色,即聚集蛋白聚糖的軟骨細胞表面標志,隨培養時間延長著色面積加大(圖2)。免疫組化實驗發現誘導至21 d,細胞基質出現棕色Col II陽性反應物,隨培養時間顏色加深集中分布在細胞內及其周圍基質中(圖3)。對照組細胞無相應反應變化。
2.2 c-myc基因表達定量檢測
通過qPCR定量檢測誘導不同時間點c-myc基因的表達結果(圖4)發現,第14、21和28天,誘導組c-myc基因的相對表達量(倍增值)分別為0.323、0.224和0.319,而對照組的分別為0.574、0.72和0.457,兩組間差異顯著(P<0.05);但35 d兩組間沒有顯著差異(P>0.05)。第14-35天4個時間點誘導組的基因表達量與P2代軟骨細胞中的表達量(倍增值為0.222)比較沒有顯著差異(P>0.05),但與第7天對照組的表達量相比均有顯著差異(P<0.05)。對照組中,第7、14和21天3個時間點的基因表達量無顯著差異(P>0.05),但顯著高于第28和35天的表達量(P<0.05)。
定量PCR未檢測到HeLa細胞的c-myc的表達量,盡管通過半定量PCR結果,HeLa細胞的內參基因與目的基因均有表達,且表達量相似(圖5)。
3 討論
Wang等[13]通過在人MSCs軟骨分化的培養基質中添加血清和TGF-β1誘導劑對培養細胞凋亡的影響實驗,發現培養基中加入血清組在培養的第7天細胞數與細胞活力均明顯下降,用TUNEL法染色檢測培養21 d的細胞,確定加血清培養組細胞凋亡比對照組顯著。而加10 ng/mL TGF-β1誘導劑組則未發現TUNEL陽性染色細胞,認為血清培養可誘導細胞凋亡而TGF-β1可阻止分化過程的細胞凋亡。Walenda等[14]2013年研究了不同濃度TGF-β1對hMSCs軟骨分化過程細胞增殖分化的影響,認為1 ng/mL TGF-β1不影響細胞早衰,但因為TGF-β1能刺激細胞快速分裂而使細胞提早進入復制抑制。本實驗結果發現誘導組細胞衰亡(第21天)早于空白組(第28天),這與Walenda的實驗結果相似。但體外培養細胞早衰與培養時間有一定關系[15],因此,關于馬鹿茸MSCs的體外擴增與分化生長特性還需進一步研究。

圖1 誘導組MSCs軟骨分化不同時間點細胞形態變化(100×)
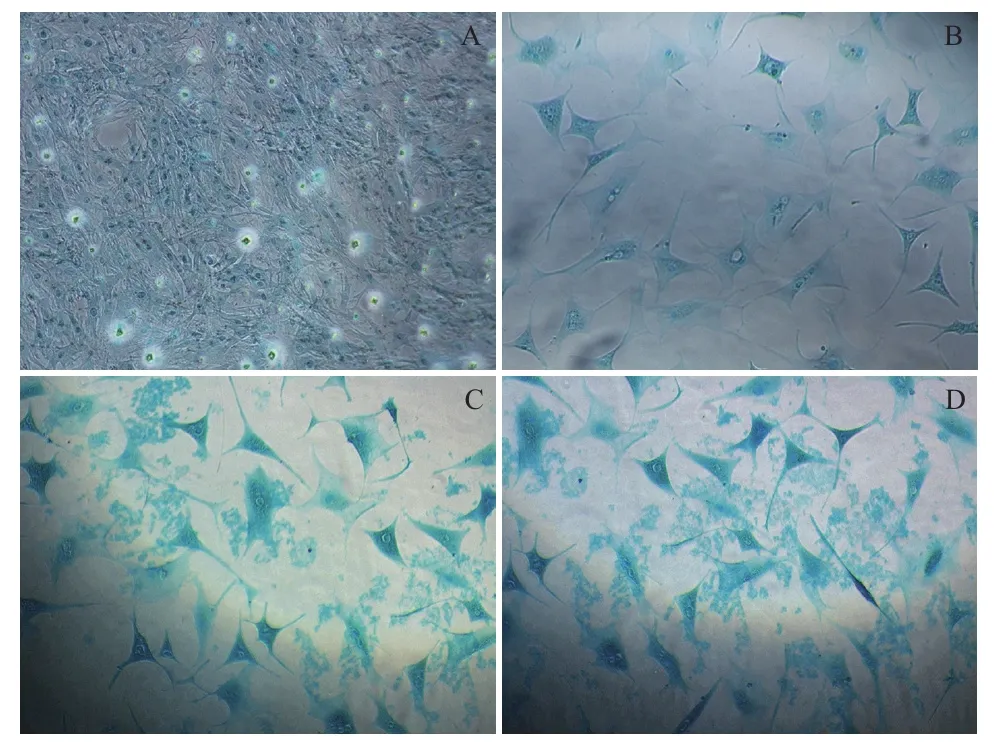
圖2 誘導組MSCs軟骨分化阿利新藍染色結果(100×)
圖3 誘導組MSCs軟骨分化免疫組化檢測結果(100×)
鹿茸MSCs是鹿茸軟骨及骨細胞的細胞庫,對比不同生長期鹿茸間充質細胞層發現,從30-60 d,即生長高峰,該組織層的厚度逐漸增加,而生長高峰過后,其厚度逐漸變薄。這一形態的變化,可證實茸MSCs不斷向軟骨分化以維持鹿茸的快速生長。C-myc基因上調表達時細胞處于增殖狀態,但細胞處于分化狀態時c-myc基因則下調表達[16]。

圖4 qPCR檢測MSCs軟骨分化不同時間點c-myc表達量

圖5 半定量PCR檢測MSCs軟骨分化不同時間點c-myc表達變化
現已證實,TGF-β1蛋白主要通過影響其信號通路下游基因SMAD4/SMAD3蛋白復合物來誘導干細胞軟骨分化。TGF-β1蛋白促使該復合物表達加強,刺激細胞基質分泌,誘導軟骨分化調控因子SRY-related gene 9(sox9)的轉錄,以加強軟骨的表面標志collagen II蛋白的表達[17,18];另一方面TGF-β1蛋白能夠阻止該復合物與Wnt信號通路中LEF/TCF作用元件結合,抑制c-myc基因的激活[17,19],表現為分化過程c-myc基因的表達下調。本實驗結果顯示,TGF-β1誘導P2鹿茸MSCs的軟骨分化過程中,軟骨分化的早期,空白組即非TGF-β1處理的間充質細胞c-myc基因的表達量顯著高于誘導組基因的表達量。說明c-myc下調表達時鹿茸干細胞處于分化階段。
但c-myc基因下調表達也誘導細胞凋亡。該機制可通過抑癌基因P53完成。P53綁定在c-myc基因啟動子區,通過其組氨酸H4乙酰化阻止c-myc基因啟動,誘導細胞生長停滯進而凋亡。在一些細胞中c-myc介導的細胞凋亡不需要P53參與也能發生[20]。該理論解釋了鹿茸MSCs誘導組與空白組28 d后c-myc表達下調與細胞凋亡的因果關系。
C-myc 作為大多數惡性腫瘤的標志性基因,在很多腫瘤組織中上調表達。本實驗用HeLa細胞作為實驗材料之一,目的是比較鹿茸MSCs與腫瘤細胞在c-myc基因表達量上的差異。當cDNA以1∶10稀釋后,定量PCR結果未檢測到HeLa細胞c-myc基因的表達值,該結果表明鹿茸MSCs的基因表達量高于HeLa細胞。但原癌基因c-myc在HeLa細胞中是否像其它腫瘤細胞上調表達無相關文獻報道。
Liu等[21]在鼠MSCs軟骨分化過程,超表達Wnt11基因,結果發現MSCs G0/G1細胞周期停滯;聚集蛋白聚糖與Collagen II的表達量顯著高于對照組,同時sox9也大量表達。因此認為除了TGF-β信號通路,非經典的Wnt信號也參與了MSCs的軟骨分化進程。
本實驗以TGF-β1為誘導劑誘導鹿茸MSCs軟骨分化的過程,c-myc基因呈下調表達。這與體內軟骨分化的結果是一致的[22-24]。但c-myc基因對鹿茸生長再生的調控作用機制還需要對其信號通路做進一步的研究。
4 結論
在TGF-β1刺激下,塔里木馬鹿茸MSCs可以分化成軟骨;原癌基因c-myc下調表達誘導鹿茸MSCs分化;誘導分化軟骨細胞與MSCs進入凋亡狀態。
[1]Li CY, Colin GM, Shirley K, et al. Clark. Identification of key tissue type for antler regeneration through pedicle periosteum deletion[J]. Cell Tissue Res, 2007, 328:65-75.
[2] Li CY, James MS, Dawn EC. Histological examination of antler regeneration in red deer(Cervus elaphus)[J]. The Anatomical Record Part A, 2005, 282A:163-174.
[3]Debra KB, Li CY, Geoff A, et al. Red deer cloned from antler stem cells and their differentiated progeny[J]. Biology of Reproduction,2007, 77:384-394.
[4]Li CY, James MS. Deer antlerogenic periosteum:a piece of postnatally retained embryonic tissue?[J]. Anat Embryol, 2001,204:375-388.
[5]Gao XH, Yang FH, Zhao HP, et al. Antler transformation is advancedby inversion of antlerogenic periosteum implants in sika deer(Cervus nippon)[J]. The Anatomical Record, 2010, 293:1787-1796.
[6]Andrea M, Istvan G, Ena K. Identification of differentially expressed genes in the developing antler of red deer Cereus alphas[J]. Mol Genet Genomics, 2007(277):237-248.
[7]Kierdorf U, Kierdorf H. Deer antlers-a model of mammalian appendage regeneration:An extensive review[J]. Gerontology,2011, 57:53-65.
[8]韓春梅, 高慶華, 李世軍, 等. 原癌基因c-myc在塔里木馬鹿茸不同生長期的表達[J]. 中國獸醫學報, 2012, 32(10):1536-1542.
[9]Goessler UR, Bugert P, Bieback K, et al. In vitro analysis of the expression of TGF-β- superfamily members during chondrogenic differentiation of mesenchymal stem cells and chondrocytes during differentiation in cell culture[J]. Cell Mol Biol Lett, 2005, 10(2):345-362.
[10]Martin F, Lehmann M, Schl?ger P, et al. Differentiation capacity of chondrocytes in microtissues depends on TGF-β subtype[J]. J Biochip Tissue Chip, 2012, S2:002. doi:10. 4172/2153-0777. S2-002.
[11]Erdogan K, Duygu G, Ayse C. Implication of C-type natriuretic peptide-3 signaling in glycosaminoglycan synthesis and chondrocyte hypertrophy during TGF-β1 induced chondrogenic differentiation of chicken bone marrow-derived mesenchymal stem cells[J]. J Mol Hist, 2012, 43:497-508.
[12] Christopher GW, Tae KK, Anya T, et al. In vitro chondrogenesis of bone marrow-derived mesenchymal stem cells in a photopolymerizing hydrogel[J]. Tissue Engineering, 2003, 9(4):679-688.
[13]Wang CY, Chen LL, Kuo PY, et al. Apoptosis in chondrogenesis of human mesenchymal stem cells:Effect of serum and medium supplements[J]. Apoptosis, 2010, 15:439-449.
[14]Walenda G, Abnaof K, Joussen S, et al. TGF-beta1 Does Not induce senescence of multipotent mesenchymal stromal cells and has similar effects in early and late passages[J]. PLoS One, 2013, 8(10):e77656. doi:10. 1371/journal. pone. 0077656.
[15]Fu RG, Wu JJ, Xue RL, et al. Premature senescence and cellular phenotype transformation of mesangial cells induced by TGFB1[J]. Renal Failure, 2013, 35(8):1142-1145.
[16]Laura S, Gerard IE. The ups and down of myc biology[J]. Curr Opin Genet, 2010, 20(1):91-99.
[17]Michael BM, Maria F, Johannes Z, et al. Hypertrophy in mesenchymal stem cell chondrogenesis:Effect of TGF-β isoforms and chondrogenic conditioning[J]. Cells Tissues Organs, 2010,192:158-166.
[18]Furumatsu T, Tsuda M, Taniquchi N, et al. The Smad3 induces chondrogenesis through the activation of SOX9 via CREB-binding Protein/p300 recruitment[J]. Journal of Biological Chemistry,2010, 280:8343-8350.
[21]Liu S, Zhang E, Yang M, et al. Overexpression of Wnt11 promotes chondrogenic differentiation of bone marrow-derived mesenchymal stem cells in synergism with TGF-β[J]. Mol Cell Biochem, 2014,390:123-131.
[19]Lim SK, Hoffmann FM. Smad4 cooperates with lymphoid enhancerbinding factor 1/T cell-specific factor to increase c-myc expression in the absence of TGF-β signaling[J]. PNAS, 2006, 103(49):18580-18585.
[20]Hoffman B, Liebermann DA. c-MYC in apoptosis and cancer[J]. Oncogene, 2008, 27:6462-6472.
[22]Chen WH, Lai MT, Wu AT, et al. In vitro stage-specific chondrogenesis of mesenchymal stem cells committed to chondrocytes[J]. Arthritis Rheum, 2009, 60(2):450-459.
[23]Gurusinghe S, Strappe P. Gene modification of mesenchymal stem cells and articular chondrocytes to enhance chondrogenesis[J]. BioMed Research International, 2014, Article ID 369528. http://dx. doi. org/10. 1155/2014/369528.
[24]Paula AC, Martins TM, Zonari A, et al. Human adipose tissuederived stem cells cultured in xeno-free culture condition enhance C-MYC expression increasing proliferation but bypassing spontaneous cell transformation[J]. Stem Cell Res Ther, 2015, 6(1):76.
(責任編輯 馬鑫)
TGF-β1-induced Differentiation of Wapiti Antler Mesenchymal Stem Cells to Cartilage and Expression Profile of Gene c-myc
HAN Chun-mei1,3WANG Shan-shan1GAO Qing-hua1,2ZHENG Yong-fu1MA Meng-ting2ZHANG Qin3
(1. College of Animal Sciences,Tarim University,Alar 843300;2. Key Laboratory of Tarim Animal Husbandry Science & Technology,Xinjiang Production & Construction Group,Alar 843300;3. College of Animal Science and Technology,China Agricultural University,Beijing 100193)
Antler mesenchymal stem cells(MSCs)play a pivotal role on the antler regeneration and ossification. To investigate the chondrogenic differentiation of antler MSCs and the regulation role of the proto-oncogene c-myc in this process,the second passage cells(MSCs,P2)of 60 d antler from adult Tarim wapiti were induced to chondrogenesis by the stimulation of transforming growth factor TGF-β1(10 ng/mL)in vitro. The inducing effects were identified by Alcian blue staining and immunohistochemics,and the expressions of gene c-myc during this process were detected by qPCR. The results demonstrated that,on the day 9 after induction,some MSCs begun to change from spindle-shaped to rounded or polygon,and the chrysanthemums-shaped pattern of the original MSCs gradually changed to paving stone like;the cartilage capsules were observed on the day 14,and the cartilage extracellular matrix was obvious and cell apoptosis appeared on the day 21. While the cells in the control group were observed to have apoptosis on the day 28,and the cavitations were discovered in the cells. On the day 35,massive cell apoptosis of both groups were observed,and the cell refraction became weak and the gaps between cells became larger. Theidentification by Alcian blue staining revealed that heavy positive staining emerged in the cellular matrix from the day 14 after stimulating. The detection by immunohistochemistry demonstrated that positive brown Col II reactant was in the cellular matrix from the day 21 after stimulating,and the color became darker along with the culture time,mainly distributed in the cells and their surround matrix. In the cartilage differentiation process from the day 7 to 28,the expressions of gene c-myc in the cells of the induced group were significantly lower than that of control group(P<0.05),while there was no significant difference after the day 35(P>0.05). In conclusion,Tarim wapiti antler MSCs differentiated into cartilage under the stimulation of TGF-β1. The down-regulated expression of proto-oncogene c-myc induced the apoptosis of antler MSCs and then differentiation to chondrogenic cells.
wapiti antler;mesenchymal stem cells;differentiation;transforming growth factor β1;c-myc gene
10.13560/j.cnki.biotech.bull.1985.2016.03.018
2015-06-05
國家自然科學基金項目(30860188)
韓春梅,女,碩士,教授,研究方向:動物遺傳育種與繁殖;E-mail:chunmeihan224@163.com
張勤,男,博士,教授,研究方向:動物遺傳育種與繁殖;E-mail:qzhang@cau.edu.cn

