Fe/羥基磷灰石多相類Fenton體系有效降解結晶紫染料廢水
郭效軍,韓 曉,嚴虎東
(西北師范大學化學化工學院,蘭州 730070)
?
Fe/羥基磷灰石多相類Fenton體系有效降解結晶紫染料廢水
郭效軍,韓曉,嚴虎東
(西北師范大學化學化工學院,蘭州730070)
以結晶紫溶液為模擬染料廢水,Fe/HAP為催化劑,對該多相類Fenton體系的催化活性進行了研究,探討了H2O2投加量、催化劑投加量、pH值、反應溫度、溶液初始濃度對結晶紫去除效果的影響。結果表明在H2O2用量為1 mL,催化劑投加量為1 g/L,pH值為9,降解溫度為30 ℃,濃度為40 mg/L的結晶紫溶液脫色率在96%以上。
類Fenton; 非均相催化; Fe/HAP; 結晶紫
1 引 言
隨著現代工業的發展,大量的有機工業品、殺蟲劑、染料等排入環境,直接或間接的對水體造成了污染[1]。處理污水的方法有很多,活性污泥法、混凝中和法、沉淀(或氣浮)法等屬于常規的水處理技術,簡便易行,但效果不佳。焚燒、膜分離等方法處理效果良好,但存在技術要求高、投資大、成本高等不足。Fenton法是一種高效、無選擇性的化學處理方法。但傳統Fenton法在強酸性下反應,過氧化氫利用率低,活性組分流失嚴重,催化劑難以重復利用,處理成本較高[2-4]。有報道稱將鐵負載在樹脂、層狀粘土和活性炭上,可有效減少Fe組分的流失[5-7]。作為一種功能材料,羥基磷灰石[Ca10(PO4)6(OH)2, hydroxyapatite, HAP]可用于污水中重金屬的脫除,也可作為催化劑的載體[8,9]。結晶紫是一種應用廣泛的染料,性質穩定,毒副作用明顯,難以生物降解,因此有效處理結晶紫染料廢水具有重要的現實意義。Chen[10]對CuFe2O4在微波輻射下降解結晶紫的行為進行了研究。Ameen[11]研究了氧化鋅光催化降解結晶紫的行為。郭效軍[12]以Mg-Al CLDHs和H2O2組成的類芬頓體系催化降解結晶紫染料廢水。
本文在HAP上負載一定量金屬Fe制成Fe/HAP催化劑,在H2O2存在下,對該多相類Fenton體系降解結晶紫(C25H30N3Cl·9H2O,Crystal Violet,簡稱CV)溶液的行為進行研究,考察Fe/HAP用量、H2O2用量、pH值、反應溫度、溶液初始濃度等因素的影響。
2 實 驗
2.1實驗試劑和儀器
試劑:結晶紫(化學純);氫氧化鈉(分析純);30%過氧化氫;鹽酸(分析純);催化劑Fe/HAP由本實驗室自制;結晶紫儲備液質量濃度為1000 mg/L,實驗時稀釋至所需濃度。
儀器:PHS-3C精密pH計;80-2型低速離心機;BS124S電子天平;SHA-B型恒溫振蕩器;79HW-1恒溫磁力攪拌器;UV-8453A型紫外分光光度計。
2.2實驗方法
催化劑的制備:準確稱取10 g自制的羥基磷灰石(HAP),浸漬于1000 mg/L的Fe(III)溶液中。在體系pH值為2~3時,于恒溫振蕩器振蕩12 h(振蕩速度為200 r/min)。過濾,去離子水洗滌至中性,并于105 ℃干燥后,研磨備用。
降解實驗:將50 mL一定濃度的結晶紫溶液移入100 mL具塞錐形瓶中,分別加入一定量的催化劑和氧化劑,在一定溫度下于恒溫振蕩器中振蕩。反應一段時間后取樣,采用紫外分光光度計分析離心分離所得上層清液。以如下公式計算結晶紫溶液的脫色率:
(1)
其中:T-結晶紫溶液的脫色率;A0-降解前結晶紫溶液的吸光度值;A-降解一段時間后所得清液的吸光度值。
3 結果與討論
3.1催化劑的表征
圖1為HAP和Fe/HAP的X射線衍射圖譜。根據圖1,將羥基磷灰石放入1000 mg/L的Fe(III)溶液浸漬后,羥基磷灰石的主要特征衍射峰仍然清晰可見,但是(300)、(321)、(410)、(402)等晶面的衍射峰已基本上消失,特征衍射峰寬化明顯表明一些衍射峰發生了合并。以上說明羥基磷灰石經Fe3+溶液浸泡后,Fe3+已負載其上,可能其結構中部分Ca2+被Fe3+取代。
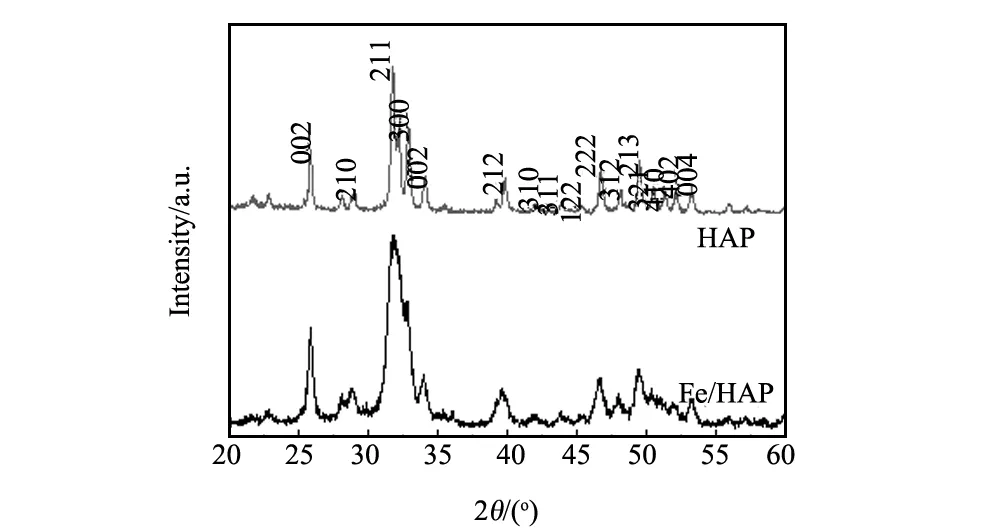
圖1 HAP和Fe/HAP的X射線粉末衍射圖Fig.1 XRD spectra of HAP and Fe/HAP

圖2 樣品的傅里葉紅外光譜圖Fig.2 FT-IR spectra of Fe/HAP and HAP
圖2為HAP以及Fe/HAP的傅里葉變換紅外光譜圖。由圖2可見,Fe/HAP在580 cm-1處的吸收峰歸屬為Fe-O的伸縮振動和彎曲振動,說明鐵負載的羥基磷灰石已經形成[13,14]。這與前面所述XRD分析結果相一致。
3.2pH值的影響
催化劑加入量為0.05 g,H2O2加入量為1 mL,溫度為30 ℃,反應時間40 min時,不同pH值下多相類芬頓體系對40 mg/L結晶紫溶液的降解情況如圖3所示。pH值較小時,結晶紫溶液的脫色率隨著pH值增加而增大;pH值為9時脫色率達到最大;pH值大于9以后,pH值增加,脫色率表現出緩慢減少的趨勢。這是由于堿性條件有利于體系中存在較高濃度的·OH自由基[15],使其脫色率較高;但堿性太強時,H2O2將快速分解為H2O和O2,降低了體系中·OH自由基的濃度,使脫色效果變差。故在隨后的實驗中pH均選為9。

圖3 pH值對結晶紫溶液脫色率的影響Fig.3 Effect of pH value on the decolorization rate of CV solution
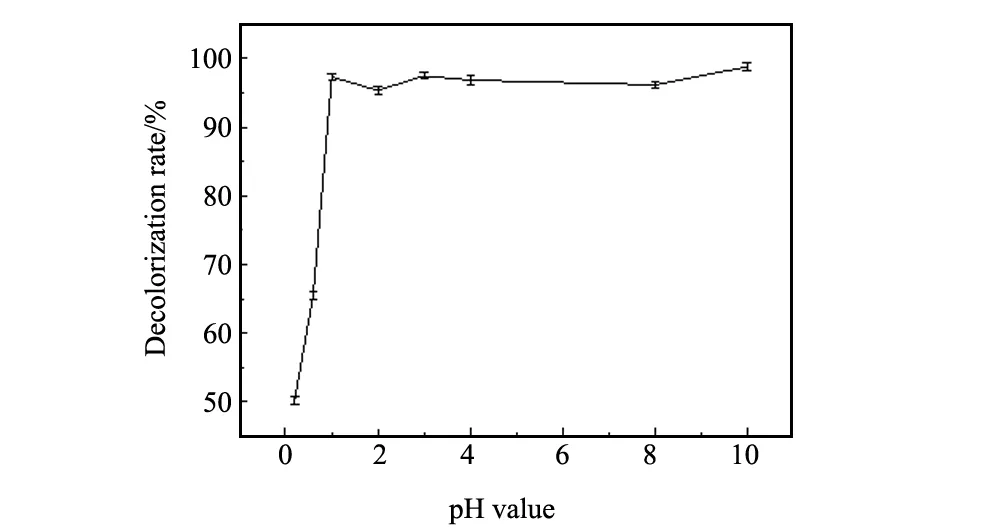
圖4 催化劑用量對結晶紫溶液脫色率的影響Fig.4 Effect of catalyst dose on the decolorization rate of CV solution
3.3催化劑用量的影響
pH值為9,H2O2加入量為1 mL,溫度為30 ℃,反應時間40 min時,不同催化劑加入量下多相類芬頓體系對40 mg/L結晶紫溶液的降解行為如圖4。由圖4可知,增大催化劑的投加量,會使更多的H2O2轉化為·OH,如果催化劑用量足夠,將顯著增加結晶紫溶液的脫色率;當催化劑用量增加到一定值后,由于降解過程持續地進行,溶液中染料分子的濃度逐漸降低,使染料分子與·OH接觸幾率減少,再多的催化劑用量也不能使脫色率明顯提高。因此催化劑用量選為1 g/L。
3.4H2O2用量的影響
催化劑加入量為0.05 g,pH值為9,溫度為30 ℃,反應時間40 min時,不同H2O2加入量下多相類芬頓體系對40 mg/L結晶紫溶液的降解情況如圖5所示。當H2O2投加量增加時,由于體系中存在較多的·OH,結晶紫溶液脫色率的增加非常明顯;當H2O2投入量達到一定值后,再增加H2O2用量,脫色率變化不大,表明過多的氧化劑對脫色率的提高已沒有大的作用。過量的H2O2或者無效分解,或者與溶液中的活性物種·OH發生競爭[16]。因此隨后實驗中H2O2加入量為1 mL。

圖5 氧化劑用量對結晶紫溶液脫色率的影響Fig.5 Effect of oxidant dose on the decolorization rate of CV solution

圖6 初始濃度對結晶紫溶液脫色率的影響Fig.6 Effect of initial concentration on the decolorization rate of CV solution
3.5溶液初始濃度的影響
催化劑加入量為0.05 g,pH值為9,H2O2加入量為1 mL,溫度為30 ℃,反應時間40 min時,多相類芬頓體系對不同濃度結晶紫溶液的降解情況如圖6所示。由圖6可知,初始濃度增加,脫色率升高,當結晶紫初始濃度為40 mg/L時,廢水脫色率達到最大;溶液濃度繼續增大,廢水脫色率逐漸下降。較高的初始濃度將增大反應物與·OH自由基接觸的幾率,有利于降解反應的進行;當溶液濃度增大到一定值后,由于反應體系中·OH自由基相對不足,減少了反應物與·OH自由基接觸的幾率,導致脫色率下降。
3.6反應溫度的影響
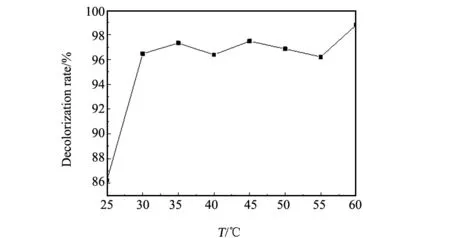
圖7 溫度對結晶紫溶液脫色率的影響Fig.7 Effect of temperature on the decolorization rate of CV solution
催化劑加入量為0.05 g,pH值為9,H2O2加入量為1 mL,反應時間40 min時,不同溫度下多相類芬頓體系對40 mg/L結晶紫溶液的降解情況如圖7所示。由圖7可知,選定溫度下結晶紫溶液的脫色率均大于96%且變化不大。故在操作中將反應溫度選為30 ℃。
3.7多相類Fenton催化反應機理
關于多相類Fenton催化反應機理,目前主要有兩種機理。一種認為過氧化氫在固相催化劑表面以Haber-Weiss機制產生羥基自由基并在催化劑表面對有機化合物進行氧化降解[17]。另一種是Lin等[18]提出的鐵氧化合物絡合-催化機理。研究表明多相類Fenton體系在酸性條件下,自由基機理占主導作用;中性條件下,兩種作用機理同時共存;堿性條件下,非自由基機理占主導[19,20]。因此在本實驗的反應條件下(pH=9),Fe負載HAP催化H2O2降解結晶紫的反應按非自由基機理進行,催化作用主要由鐵氧化物的表面催化反應所致。其具體的機理有待進一步深入研究。
4 結 論
以Fe/HAP為催化劑,研究了該多相類Fenton體系降解結晶紫模擬染料廢水的行為。考察了pH值、反應時間、反應溫度、催化劑用量、氧化劑用量、溶液起始濃度等因素的影響。結果顯示Fe/HAP投加量為1 g/L、pH為9、H2O2用量為1 mL、反應溫度為30 ℃、染料濃度為40 mg/L時,結晶紫溶液脫色率在96%以上。
[1] 何立平,楊迎春,徐成華,等.Fe/活性炭多相類Fenton法濕式氧化羅丹明B廢水的研究[J].環境工程學報,2009,3(8):1433-1437.
[2] 陽立平,肖賢明.Fenton法在焦化廢水處理中的應用及研究進展[J].中國給水排水,2008,24(18):9-13.
[3] Badawy M I,Ghaly M Y,Gad-Allah T A.Advanced oxidation processes for the removal of organophosphonm pesticides from wastewater[J].Desalination,2006,194:166-175.
[4] Ince N H,Gokce T G.Impacts of pH and molecular structure on ultrasonic degradation of Azo dyes[J].Ultrasonics,2004,42:591-596.
[5] Liou R M,Chen S H,Hung M Y,et al.Fe(III) supported on resin as effective catalyst for the heterogeneous oxidation of phenol in aqueous solution[J].Chemosphere,2005,59(1):117-125.
[6] Guelou E,Barrault J,Fournier J,et al.Active iron species in the catalytic wet peroxide oxidation of phenol over pillared clays containing iron[J].AppliedCatalysisB,2003,44:1-8.
[7] Ramirez J H,Maldonado-Hodar F J,Perez-Cadenas A F,et al.Azo dye orange II degradation by heterogeneous Fenton-like reaction using carbon-Fe catalysts[J].AppliedCatalysisB,2007,75(3): 312-323.
[8] Corami A,Mignardi S,Ferrini V.Cadmium removal from single- and multi-metal (Cd+Pb+Zn+Cu) solutions by sorption on hydroxyapatite[J].JournalofColloidandInterfaceScience,2008,317(2): 402-408.
[9] Sandrine B,Ange N,Didier B,et al.Removal of aqueous lead ions by hydroxyapatite: Equilibria and kinetic process[J].JournalofHazardousMaterials,2007,139:443-446.
[10] Chen H,Yang S,Chang J,et al.Efficient degradation of crystal violet in magnetic CuFe2O4aqueous solution coupled with microwave radiation[J].Chemosphere,2012,89(2):185-189.
[11] Ameen S,Akhtar M S,Nazim M,et al.Rapid photocatalytic degradation of crystal violet dye over ZnO flower nanomaterials[J].MaterialsLetters,2013,96:228-232.
[12] 郭效軍,李海如,李雨甜.Mg-Al CLDHs/H2O2體系降解結晶紫染料廢水的研究[J].硅酸鹽通報,2015,34(5):1223-1228.
[13] Kaushik A,Khan R,Solanki P R, et al.Iron oxide nanoparticles-chitosan composite based glucose biosensor[J].BiosensorsandBioelectronics,2008,24:676-683.
[14] Kaushik A,Pratima R S,Anees A A,et al.Iron oxide-chitosan nanobiocomposite for urea sensor[J].SensorsandActuatorsB,2009,138:572-580.
[15] Du Y K,Rabani J.Flocculation-induced homolysis of hydrogen peroxide in aqueous colloid solution of titanium dioxide nanoparticles[J].JournalofPhysicalChemistryB,2006,110:6123-6128.
[16] Pham A L T,Lee C,Doyle F M,et al.A silica-supported iron activating hydrogen peroxide at neutral pH values[J].EnvironmentalScienceandTechnology,2009,43, 8930-8935.
[17] Xue X F,Hanna K,Abdelmoula M,et al.Adsorption and oxidation of PCP on the surface of magnetite: kinetic experiments and spectroscopic investigations[J].AppliedCatalysisB:Environmental,2009,89(3/4): 432-440.
[18] Lin S S,Gurol M D.Catalytic decomposition of hydrogen Peroxide on iron oxide: kineties, mechanism, and implications[J].EnvironmentalScienceandTechnology,1998,32:1417-1423.
[19] Kwan W P,Voelker B M.Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fenton-like systems[J].EnvironmentalScienceandTechnology,2003,37:1150-1158.
[20] Kwan W P,Voelker B M.Decomposition of hydrogen peroxide and organic compounds in the presence of dissolved iron and ferrihydrite[J].EnvironmentalScienceandTechnology,2002,36:1467-1476.
Efficient Degradation of Crystal Violet in Simulated Dye Wastewater Using Fe/HAP/H2O2Reagents
GUOXiao-jun,HANXiao,YANHu-dong
(College of Chemistry & Chemical Engineering,Northwest Normal University,Lanzhou 730070,China)
The catalytic efficiency of Fe/HAP which is used to promote heterogeneous Fenton-like reaction was examined by employing crystal violet as a model compound. The influencing factors such as the dosage of hydrogen peroxide and Fe/HAP, reaction temperature, pH value and initial dye concentration were also discussed. When the dosage of H2O2and Fe/HAP were 1 mL and 1 g/L, respectively, and pH value was 9, the removal rate of Crystal Violet whose initial concentration was 40 mg/L was over 96% at 30 ℃.
Fenton-like;heterogeneous catalysis;Fe/HAP;crystal violet
甘肅省高等學校基本科研業務費
郭效軍(1969-),男,博士,副教授.主要從事能源與功能材料化學方面的相關研究
TQ175
A
1001-1625(2016)04-1249-5

