大樣本體檢人群中亞臨床甲狀腺功能減退與腎功能的相關性研究
王坤林 陳吉海 婁青林 唐偉 卞茸文
?
大樣本體檢人群中亞臨床甲狀腺功能減退與腎功能的相關性研究
王坤林陳吉海婁青林唐偉卞茸文
目的探討亞臨床甲狀腺功能減退(甲減)患者甲狀腺功能與腎功能之間的關系。方法從我院2012年8月至2013年8月42269例健康體檢的對象中篩選出544例亞臨床甲減患者作為研究對象,并從甲狀腺功能正常的人群中篩選出性別及年齡匹配的個體544例作為正常對照組,計算2組人群預估的腎小球濾過率(eGFR),并將eGFR <60 ml/(min·1.73m2)定義為慢性腎功能不全(CKD)。結果人群中亞臨床甲減的總體發病率為4.61%,女性發病率為5.96%,男性發病率為3.89%,女性發病率高于男性。亞臨床甲減組與正常對照組之間肌酐(Cr)、eGFR、游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)、促甲狀腺素(TSH)水平以及CKD的患病率差異均有統計學意義(P<0.05)。相關分析研究提示,2組eGFR均與TSH呈顯著負相關(P<0.01),與FT3呈顯著正相關(P<0.01),而與FT4的關系則不顯著(P>0.05)。結論甲狀腺功能與腎功能之間密切相關,常規監測亞臨床甲減患者的腎功能具有一定的臨床意義。
亞臨床甲狀腺功能減退; 預估的腎小球濾過率; 促甲狀腺激素; 慢性腎臟病
亞臨床甲狀腺功能減退癥(subclinical hypothyroidism,SCH),是以血液中促甲狀腺激素(TSH)水平升高,而游離甲狀腺素(FT4)、游離三碘甲狀腺原氨酸(FT3)在正常范圍為特點的一種常見的內分泌代謝性疾病,隨著近年來甲狀腺疾病的研究進展,這一疾病狀態已逐漸被臨床所重視。目前關于甲狀腺功能紊亂如甲狀腺功能亢進(甲亢)及甲狀腺功能減退(甲減)等對腎臟功能的影響國內外已不斷有所報道,然而在SCH狀態下甲狀腺激素水平的變化與腎功能之間的關系目前仍鮮有報道。本文通過對我院大樣本健康體檢人群中SCH患者的甲狀腺激素(TH)水平及腎功能指標的觀察,旨在探討甲狀腺功能與腎功能之間的相互關系。
1 資料與方法
1.1研究人群及入選標準從我院2012年8月至2013年8月42269例健康體檢人群中篩選出SCH患者544例(SCH組),其入選標準符合:(1)有完整的臨床資料,如一般信息、甲狀腺功能、腎功能及相關病史等,同時符合SCH的診斷標準[1];(2)排除既往有明確甲減或甲亢病史或治療過程中出現過SCH、甲狀腺相關腫瘤及其術后、垂體病變、慢性腎炎、腎病綜合征、腎上腺皮質功能減退等疾病。另選擇544例甲狀腺功能正常的個體作為正常對照組,其年齡及性別組成與SCH組相匹配。
1.2研究方法通過專業的研究調查表對體檢人群進行病史采集,包括一般情況、飲食和生活習慣、既往病史、家族史及藥物服用史等,同時按國際標準由專業人員測定清晨空腹體質量、身高、血壓等,計算體質量指數(BMI)。留取體檢人群清晨空腹血,并對其血清各項指標進行檢測,其中空腹血糖(FBG)、血脂譜、腎功能等使用全自動生化分析儀(Hitachi 7020),血清脂質成分包括總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)和低密度脂蛋白膽固醇(LDL-C)等水平均通過酶法定量,甲狀腺功能包括TSH、FT3、FT4等水平通過電化學發光法進行檢測(Roche E170)。甲狀腺相關指標參考值范圍分別如下:TSH 0.34~5.6 μIU/ml,FT3 3.67~10.43 pmol/L,FT4 7.46~21.1 pmol/L。研究人群腎功能的情況通過預估的腎小球濾過率(estimated glomerular filtration rate,eGFR)進行評估,采用校正簡化的MDRD公式進行計算:eGFR [ml/(min·1.73m2)]=175×肌酐(Scr,mg/dL)-1.234×年齡 (歲)-0.179(若為女性×0.79)[2];其中慢性腎臟疾病(chronic kidney disease, CKD)定義為 eGFR <60 ml/(min·1.73 m2)[3]。
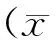
2 結果
2.1一般資料及生化指標比較本研究中有甲狀腺功能資料的對象共11813例,其中男7738例,女4075例,其中SCH患者544例,男301例,女243例。SCH的總體發生率為4.61%,男性發病率為3.89%,女性發病率為5.96%,男女比例為0.65:1,女性發病率高于男性。SCH組FBG、肌酐(Cr)、TSH水平高于正常對照組(P<0.05或P<0.01),eGFR、FT3、FT4則低于正常對照組(P<0.01)。正常組CKD患病率為3.45%,亞臨床甲減組CKD共35例,患病率為6.4%,2組間差異有統計學意義(P=0.035)。見表1。
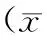

項目正常對照組SCH組年齡(歲)62±1462±14女性(n,%)243(44.7)243(44.7)BMI24.15±3.1624.19±3.12SBP(mmHg)131±19132±19DBP(mmHg)79±1180±11FBG(mmol/L)5.79±1.375.62±1.09*TC(mmol/L)5.10±1.075.06±0.96LDL-C(mmol/L)2.92±0.742.87±0.76HDL-C(mmol/L)1.26±0.291.25±0.29TG(mmol/L)1.58±2.141.60±1.13BUN(mIU/L)5.47±1.255.50±1.31Cr(pmol/L)73.12±15.3576.30±16.74*eGFR[ml/(min·1.73m2)]82.83±12.5679.57±12.27*TSH(mIU/L)2.20±0.818.04±4.56*FT3(pmol/L)4.61±0.754.46±0.61*FT4(pmol/L)16.47±2.1115.09±2.15*CKD(n,%)19(3.4)35(6.4)
注:與正常對照組比較,*P<0.05,**P<0.01
2.2腎功能與甲狀腺功能相關性Pearson相關分析結果顯示,在總體、正常對照組以及SCH組中,eGFR與TSH均呈顯著負相關(r分別為-0.112,-0.136,-0.106,P均<0.01),與FT3均呈顯著正相關(r分別為0.157,0.141,0.151,P均<0.01),而與FT4無明顯相關(P>0.05)。
3 討論
大量臨床研究證實,甲狀腺與腎臟關系密切,兩者之間相互調節、相互影響[4]。甲狀腺激素在維持腎臟的發育、正常結構、水和電解質平衡、腎小球濾過率(glomerular filtration rate,GFR)等方面發揮著重要作用。原發性甲減可以減少腎臟的血流,降低GFR,從而升高Cr水平,甲減患者的GFR比正常人下降約20%~30%左右,并且可隨著治療后甲狀腺功能的改善而逐漸恢復[5-6]。CKD患者往往合并甲狀腺功能紊亂,且該人群甲減的發病率明顯高于非CKD人群[7],因此,探討甲狀腺功能異常與腎臟疾病的相互影響對于2種疾病的診治都具有較大的意義。
在本研究中,SCH組的eGFR為(79.57±12.27)ml/(min·1.73 m2),而正常對照組則為(82.83±12.56)ml/(min·1.73 m2),前者顯著低于后者(P<0.01),且2組的CKD患病率也有著顯著差異(P<0.05),提示甲狀腺功能的輕度下降在一定程度上導致腎功能的下降。國外有研究對患有CKD 2~4期的SCH病人進行甲狀腺激素替代治療,結果發現該治療可延緩80%的患者進展為CKD5期的時間。在接受上述治療前,患者eGFR平均每年下降4.31 ml/(min·1.73 m2),而接受治療后,患者eGFR下降速度明顯放緩,平均每年為1.08 ml/(min·1.73 m2)[8-9]。綜合本研究結果,推測對SCH尤其是伴有CKD的患者適當給予補充TH以糾正其SCH狀態,可在一定程度上保護及改善其腎臟功能。
本研究結果還發現eGFR與FT3呈顯著正相關(r=0.151,P<0.01),而與TSH呈顯著負相關(r=-0.106,P<0.01),進一步提示TH可影響腎臟的功能,TH是決定eGFR的一個主要因素之一,而FT3是甲狀腺激素在細胞內發揮生理作用的活化形式,也是影響腎功能的主要的TH,這與我們的研究結果相一致。目前關于TH水平變化對腎臟功能影響的可能機制主要有以下幾點:一方面,甲狀腺功能的異常可引起腎臟血流動力學的改變。TH能夠對心血管系統產生直接的影響,其水平持續低下時可導致外周血管的阻力增加,心臟收縮能力及心搏出量下降,腎臟血流量減少,從而使得GFR下降[10]。TH還可調節腎素-血管緊張素系統以及腎小管鈉鉀泵等的活性從而對腎臟的水、鹽代謝產生影響,進而可能影響GFR[11]。另一方面,甲狀腺疾病往往伴發機體的免疫異常,這種免疫學異常可同時對腎臟功能產生一定損傷,從而誘發繼發性腎臟疾病,臨床又稱AITD-N。Shima等[12]曾對同時患有Graves病和膜性腎病患者的腎組織進行活檢以及免疫熒光檢查,結果發現在其腎臟組織中可檢測到甲狀腺過氧化物酶抗體的存在。然而關于免疫因素在兩者之間的作用機制目前仍未完全明確。
綜上所述,甲狀腺功能的異常可通過多種作用機制并發腎臟功能的改變,兩者之間密切相關。臨床上對甲狀腺功能異常的患者可常規評估其GFR,從而及時發現某些潛在的腎功能改變,另一方面,對于腎功能異常的患者積極檢測其甲狀腺相關激素水平往往能夠早期發現異常并給予及時有效的治療。在臨床實踐中,我們必須綜合考慮到甲狀腺功能及腎臟功能之間的多種關系,避免誤診、誤治,從而作出更加合理的、個體化的治療決策。
[1]Garber JR,Cobin RH,Gharib H,et al.Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association[J].Thyroid,2012,22(12): 1200-1235.
[2]Kong X,Ma Y,Chen J,et al.Evaluation of the chronic kidney disease epidemiology collaboration equation for estimating glomerular filtration rate in the Chinese population[J].Nephrol Dial Transplant,2013,28(3):641-651.
[3]Emara M,Zahran A,Abd EH,et al.How to best define patients with moderate chronic kidney disease[J].Nephron Clin Pract,2008,110(4):c195-206.
[4]Amato AA,Santos GM,Neves Fde A.Thyroid hormone action in chronic kidney disease[J].Curr Opin Endocrinol Diabetes Obes,2008,15(5):459-465.
[5]Bernet VJ.Reversible renal insufficiency attributable to thyroid hormone withdrawal in a patient with type 2 diabetes mellitus[J].Endocr Pract,2004,10(4): 339-344.
[6]Karanikas G,Schutz M,Szabo M, et al.Isotopic renal function studies in severe hypo-thyroidism and after thyroid hormone replacement therapy[J].Am J Nephrol, 2004,24(1):41-45.
[7]Lo JC,Chertow GM, Go AS,et al.Increased prevalence of subclinical and clinical hypothyroidism in persons with chronic kidney disease[J].Kidney Int,2005,67(3):1047-1052.
[8]Shin DH,Lee MJ,Lee HS,et al.Thyroid hormone replacement therapy attenuates the decline of renal function in chronic kidney disease patients with subclinical hypothyroidism[J].Thyroid,2013,23(6):654-661.
[9]Shin DH,Lee MJ,Kim SJ, et al.Preservation of renal function by thyroid hormone replacement therapy in chronic kidney disease patients with subclinical hypothyroidism[J].J Clin Endocrinol Metab,2012,97(8):2732-2740.
[10]Vargas F,Moreno JM,Rodriguez-Gomez I,et al.Vascular and renal function in experimental thyroid disorders[J].Eur J Endocrinol,2006, 154(2):197-212.
[11]Segarra AB,Ramirez M,Banegas I,et al.Influence of thyroid disorders on kidney angiotensinase activity[J].Horm Metab Res,2006,38(1):48-52.
[12]Shima Y, Nakanishi K, Togawa H,et al.Membranous nephropathy associated with thyroid-peroxidase antigen[J].Pediatr Nephrol,2009,24(3):605-608.
Association of subclinical hypothyroidism with renal function in a larger health check-up population
WANGKun-lin,CHENJi-hai,LOUQing-lin,TANGWei,BIANRong-wen.
DepartmentofEndocrinology,JiangsuProvinceGeriatricHospital,Nanjing210024,China
ObjectiveTo explore the relationship of subclinical hypothyroidism(SCH) with renal function.Methods544 cases of SCH (SCH group) and 544 healthy control (control group) matched in sex and age were enrolled and evaluated from the database of 42269 adults in the health check-up center of Jiangsu Province Official Hospital from August 2012 to August 2013. Estimated glomerular filtration rate (eGFR) was calculated using Chinese modified Modification of Diet in Renal Disease (CMDRD) equation, while moderate chronic kidney disease (CKD) was defined as eGFR <60 ml/(min·1.73 m2).ResultsThe prevalence of SCH was 4.61% in total,5.96% in women and 3.89% in men respectively. There were significant difference in the levels of creatinine(Cr), eGFR, free triiodothyronine(FT3), free thyronine(FT4), thyroid stimulating hormone(TSH), and the incidence rate of CKD between two groups. A significant negative correlation was observed between TSH and eGFR in two groups(P<0.01), while positive correlation was found between FT3 and eGFR (P<0.01). There was no significant correlation between FT4 and eGFR in two groups(P>0.05).ConclusionsThere is a close relationship between the biochemical parameters of renal function and SCH status, and monitoring renal function in SCH patients has important clinical significance.
subclinical hypothyroidism; estimated glomerular filtration rate; thyroid stimulating hormone; chronic kidney disease
國家自然科學基金項目(71373132)
210024江蘇省南京市,江蘇省老年醫院內分泌科
卞茸文,Email:bianrw@126.com
R 581.2
A
10.3969/j.issn.1003-9198.2016.09.019
2016-01-18)

