內蒙古白音敖包沙地云杉生長季非結構性碳水化合物含量動態
王逸然 鄭成洋 曾發旭
?
內蒙古白音敖包沙地云杉生長季非結構性碳水化合物含量動態
王逸然 鄭成洋?曾發旭
北京大學城市與環境學院生態學系, 北京 100871; ?通信作者, E-mail: zhengcy@pku.edu.cn
為更好地了解我國北方常綠針葉樹中非結構性碳水化合物(NSC)的季節動態變化規律, 以我國特有樹種——沙地云杉()為研究對象, 對生長季沙地云杉葉、枝、根、樹皮等不同器官中的NSC含量進行測定。結果顯示, 沙地云杉不同器官中淀粉含量的變化規律基本上一致, 5月達到最大值, 此后逐漸下降, 8—10 月均維持在較低水平, 說明芽萌發時所需的淀粉可能來自4—5月光合產物的積累; 可溶性糖含量在 5 月略低, 此后逐漸上升, 10 月達到最高, 增加的可溶性糖可能并非來自當年生長期結束前所積累的淀粉。分析結果表明, 溫度、降水等氣候因子與沙地云杉不同器官中淀粉、可溶性糖及 NSC 含量的相關性并不顯著。
沙地云杉; 非結構性碳水化合物; 季節動態; 溫度和降水
碳水化合物是植物光合作用的主要產物, 依據其存在形式, 可分為結構性碳水化合物和非結構性碳水化合物(NSC)[1-2]。NSC 主要由以蔗糖、葡萄糖等為主的可溶性糖和淀粉組成, 其代謝活動和含量變化直接影響植物的生長發育, 可以反映樹木生長過程中碳同化和消耗的平衡關系[3]。了解當前氣候條件下植物組織中 NSC 含量的季節動態變化, 有助于了解植物在一年中的生長情況以及植物對環境條件的適應機制, 可以幫助預測未來氣候變化條件下樹木的響應, 并為全球碳循環變化的模擬提供理論依據[4-5]。一些生態學熱點問題也可以通過研究樹木NSC含量的動態變化來解釋, 例如, 木本植物如何響應持續升高的 CO2濃度水平及全球溫度[6], 樹線形成的原因[7-8], 植物如何應對干旱、低溫等環境脅迫[9-10]。
已有研究表明, 樹木 NSC 的季節變化規律受樹木生活型、生長型和環境氣候的影響[5], 表現出復雜的規律性。Hoch 等[11]在瑞士對溫帶常見的包括落葉闊葉樹、落葉針葉樹和常綠針葉樹在內的10 種樹木的葉、枝和樹干中 NSC 含量進行了研究, 結果表明, 落葉樹葉中的淀粉、可溶性糖及總 NSC含量表現出較一致的動態變化趨勢, 6 月生長初期最高, 此后不斷減少, 至 10 月落葉前最低; 常綠針葉樹葉中的淀粉及 NSC 含量在 4 月顯著升高, 可溶性糖含量變化并不顯著。Würth 等[12]對 17 種主要熱帶樹種的研究表明, 熱帶樹木 NSC 含量的季節變化與水分條件有關, 旱季 NSC 含量高于雨季。不同樹種 NSC 含量的季節動態也有明顯的種間差異[13–15]。Newell等[16]的研究結果顯示, 4 月旱季結束時, 馬鞭椴()的 NSC 含量最高, 腰果木()的 NSC 峰值則出現在8, 9 月的雨季。Michelot等[17]的研究發現, 山毛櫸()樹干中的可溶性糖含量在 4—8 月呈現先減后增的趨勢, 無梗花櫟()則呈現明顯的遞增趨勢。
目前, 關于樹木NSC含量季節變化的研究尚存在不足。多數研究中的采樣頻率較低, 僅選取生長初期、生長旺盛期和生長末期等若干時間節點進行采樣(例如Hoch等[11]僅在3, 4, 6, 8和10月進行5 次采樣), 不能很好地反映植物在生長季的NSC動態變化規律。另外, 多數研究中樣本種類不夠全面, 只選取葉、枝、根、樹干等器官中的 2~3 種, 或只針對某一種器官進行研究, 對常綠針葉樹的葉和枝采樣時也未考慮其年齡[18–20], 部分研究中實驗材料采用木本植物的幼苗[21–23], 缺乏對成熟樹木個體各器官中NSC含量的完整年際動態監測。
沙地云杉()是我國珍稀瀕危樹種, 分布范圍窄, 面積小[24]。沙地云杉林是陸地上非常特殊的森林生態系統類型, 是沙地森林草原景觀的重要組成部分, 也是一道天然屏障, 對防風固沙、控制土壤沙化有重要作用[25]。目前尚沒有對這一特殊物種非結構性碳水化合物季節動態的研究。本研究通過對生長季成熟沙地云杉個體葉、枝、根、樹干等不同器官中可溶性糖和淀粉含量的測定, 揭示沙地云杉各器官中可溶性糖及淀粉含量的生長季變化規律, 了解沙地云杉在當前氣候條件下的生長情況, 從而為這一特殊的森林生態系統類型如何響應未來氣候變化提供基礎數據。
1 材料與方法
1.1 研究區概況
內蒙古自治區白音敖包自然保護區位于赤峰市克什克騰旗西北部、渾善達克沙地東部邊緣, 地理坐標為 117°05′—117°20′E, 43°30′—43°36′N, 海拔1300~1500 m, 年均溫為–1.4℃, 1月均溫為–23.4℃, 7 月均溫為 17.4℃, 全年無霜期平均為 78 天, 年降水量360~440 mm, 年平均蒸發量為 1035.6 mm[26-27]。沙地云杉集中分布在白音敖包地區的沙地上, 面積約 15 hm2, 林相整齊, 長勢好, 面積大, 是該保護區主要的保護對象[27]。沙地云杉應屬于蒙古植物分布區唯一的特有樹種, 但沙地云杉林種類組成中也常混有興安、華北植物分布區成分, 草原植物資源十分豐富, 主要以旱生草本植物為主[28]。
1.2 樣品采集與分析
在保護區內選取5棵長勢相似、生長健康、光照條件良好、生長在不同坡位和坡向的沙地云杉(表 1), 采集每棵樹的葉、枝、樹皮(韌皮部和形成層)、根等器官, 其中葉和枝均分為當年新生、一年生和兩年生以上(老) 3 個齡級進行采樣, 根按徑級分為粗根(≥5 mm)和細根(<5 mm)進行采樣。葉和枝樣品均采自距地面 3~5 m 朝東南方向的固定位置, 以避免方位及冠層高度的影響[29]。每棵樹每個器官每次采集 3 個樣品, 將其淀粉及可溶性糖含量的均值作為該器官的值。每次采集時間均為下午13: 00—15: 00, 以消除日動態差異的影響。2013年4—10月生長季期間, 每月月初、月中、月末各采集樣品 1 次。因天氣寒冷, 故根和樹皮樣品從 4月末開始采集。沙地云杉根系發達, 個體密度低, 采集根樣品時采用粗根追蹤, 并取分支根后回填原土, 盡量減小擾動面積。沙地云杉5月底至6月初芽開始萌發, 故當年生新葉與當年生新枝樣品從 6月開始采集。所有植物樣品均在采集后1小時內經液氮冷凍處理, 低溫保存, 帶回實驗室研磨。
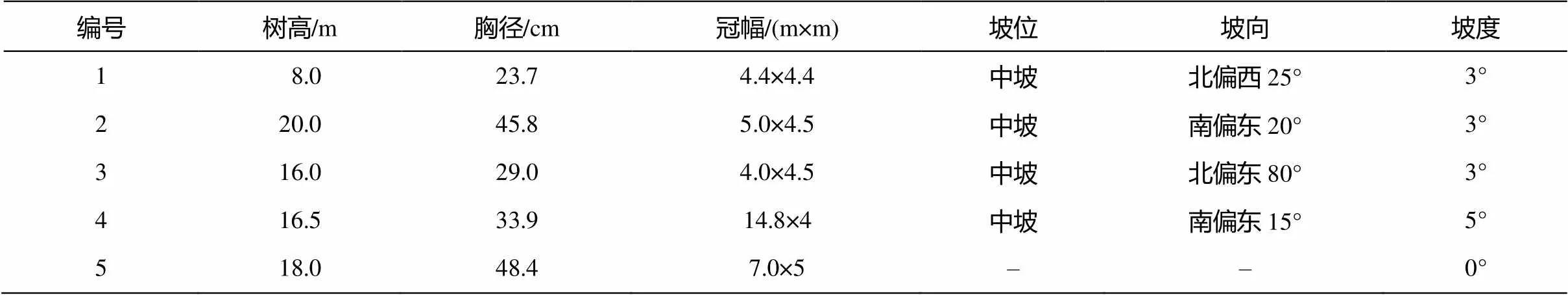
表1 5株沙地云杉采樣個體的基本特征
將研磨后的樣品加 80%乙醇, 沸水浴加熱, 提取樣品中的可溶性糖。上清液采用硫酸蒽酮法測定可溶性糖含量, 固體提取物采用Smith等[30]的酶解法測定淀粉含量。可溶性糖及淀粉含量均以干物質中的葡萄糖百分比(%DM)表示。
從中國氣候數據共享網(http://cdc.cma.gov.cn)選擇距采樣點最近的林西縣氣象臺站(43°36′N, 118°04′E)的氣候記錄, 獲得白音敖包地區 2013 年的溫度和降水數據。將每月所采3次樣品中淀粉、可溶性糖含量的均值作為該月沙地云杉的淀粉及可溶性糖含量, NSC 含量為淀粉和可溶性糖含量之和。采用方差分析(ANOVA)和 Tukey 多重比較法分析不同個體、不同組織中淀粉、可溶性糖及NSC 濃度差異的顯著性。采用 Pearson 相關分析法, 對 NSC 含量與氣候數據進行相關性分析。統計分析采用SPSS 16.0完成。
2 結果分析
2.1 不同器官中淀粉、可溶性糖及 NSC 含量
將5棵沙地云杉各組織中的淀粉及可溶性糖含量進行方差分析, 結果表明, 每種組織 5 棵沙地云杉個體間的淀粉及可溶性糖含量差異不顯著(表 2)。
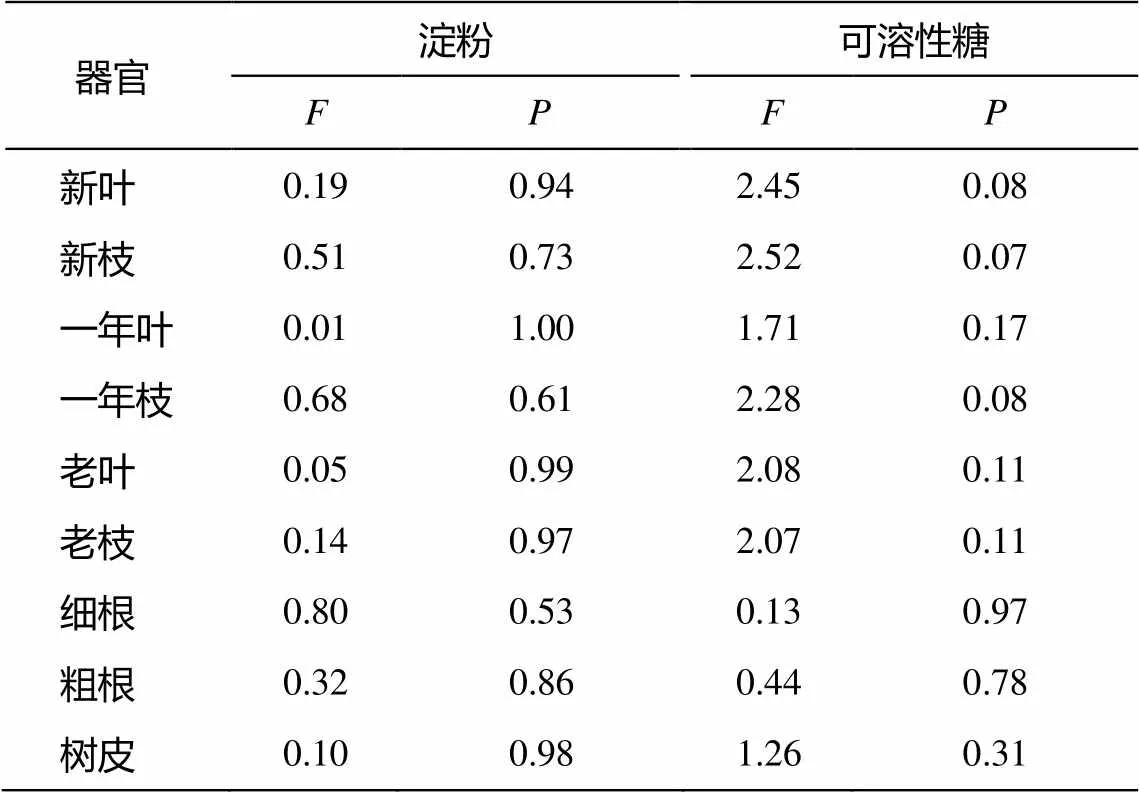
表2 樹木個體間淀粉及可溶性糖含量的差異
將 5 棵沙地云杉所測得淀粉及可溶性糖含量的結果求算術平均值, 并用方差分析和 Tukey多重比較法分析不同組織中淀粉(表 3)、可溶性糖(表 4)及NSC (表5)含量差異的顯著性。
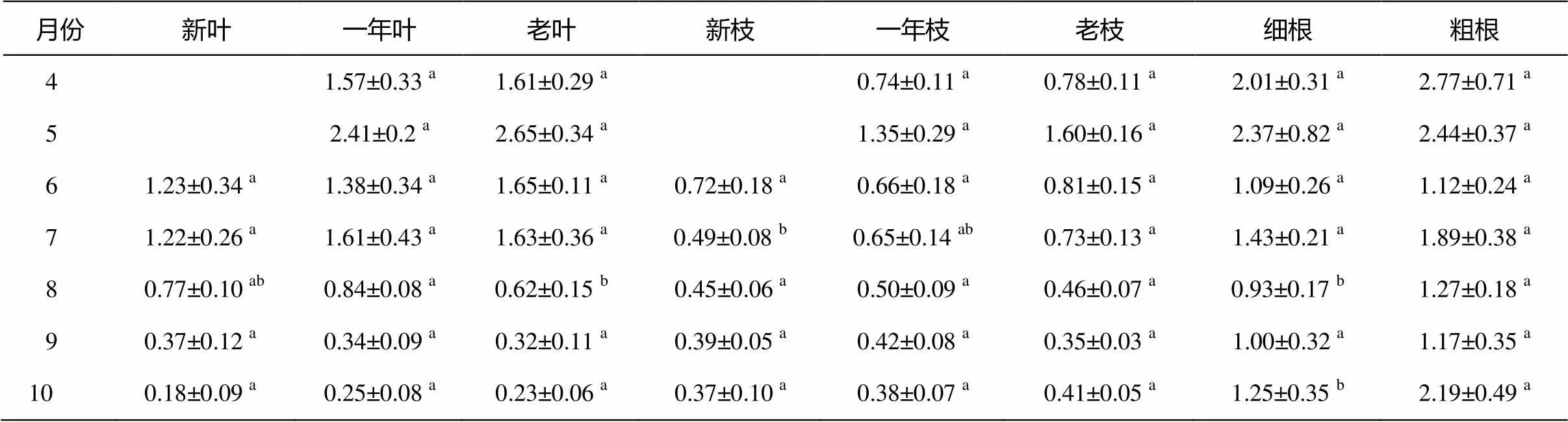
表3 沙地云杉不同器官中淀粉含量比較
注: 數據為“算術平均值±標準差(=5)”, 小寫字母表示差異顯著(<0.05)。
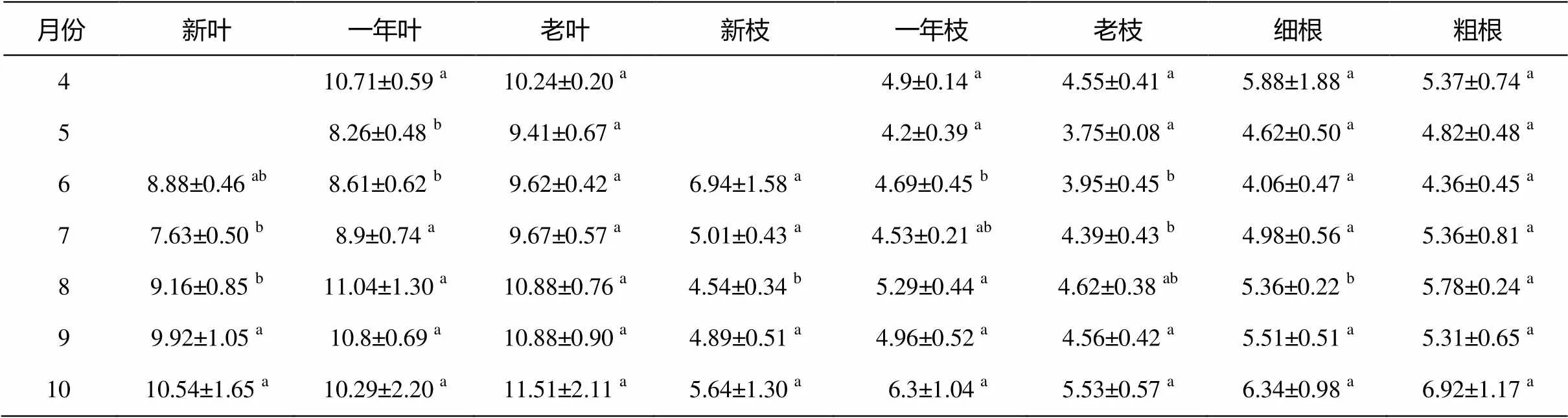
表4 沙地云杉不同器官中可溶性糖含量比較
注: 數據為“算術平均值±標準差(=5)”, 小寫字母表示差異顯著(<0.05)。
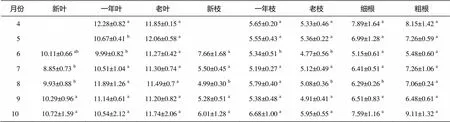
表5 沙地云杉不同器官中NSC含量比較
注: 數據為“算術平均值±標準差(=5)”, 小寫字母表示差異顯著(<0.05)。
沙地云杉當年生葉、一年生葉和老葉中的淀粉含量有相似的季節動態變化規律, 且淀粉含量無顯著差異。除7月新枝中的淀粉含量顯著低于一年生枝和老枝外, 其他月份當年生枝、一年生枝和老枝中的淀粉含量無顯著差異, 且有相似的季節動態變化規律。粗根中的淀粉含量略高于細根, 其中 8 月與 10 月差異顯著, 但粗根和細根中淀粉含量的季節動態變化規律相似。
沙地云杉當年生葉、一年生葉和老葉中可溶性糖含量的季節動態變化規律基本上一致, 但7, 8月當年生新葉中的可溶性糖含量顯著低于一年生葉和老葉。與葉不同, 6 月新枝中的可溶性糖含量顯著高于一年生枝和老枝。此外, 當年生新枝、一年生枝和老枝中的可溶性糖含量季節動態變化規律相似。除8月外, 粗根和細根中的可溶性糖含量無顯著差異, 且年動態變化規律相似。
沙地云杉當年生葉、一年生葉和老葉中 NSC含量的季節動態變化規律基本上一致, 但7, 8月當年生新葉中的NSC含量顯著低于一年生葉和老葉, 5, 6 月老葉中的NSC含量顯著高于一年生葉。與葉不同, 6月時新枝中的NSC含量顯著高于一年生枝和老枝, 8月一年生枝中的NSC含量顯著高于當年生新枝和老枝。除8月外, 粗根和細根中的NSC含量無顯著差異, 且季節動態變化規律相似。
2.2 生長季淀粉、可溶性糖及 NSC 含量的變化趨勢
2.2.1 不同器官中淀粉含量的變化趨勢
沙地云杉葉中的淀粉含量在一年中波動變化顯著(圖1(a))。4—7 月, 沙地云杉葉中淀粉含量較高, 5月最高可達2.5%DM左右, 此后葉中淀粉含量迅速減少, 8—10月, 葉中淀粉含量均維持在較低水平, 冬季最低時不足0.5%DM。
枝中的淀粉含量在一年中的變化規律與葉相似(圖 1(b)), 4 月迅速上升, 5 月最高可達1.5%DM左右, 此后迅速下降至0.8%DM左右, 6—10月持續下降, 9, 10月最低可達0.4%DM左右。與葉中的淀粉含量相比, 枝中淀粉含量的最高值偏低約 40% DM, 最低值略高于葉。
根與樹皮中的淀粉含量最高值出現在 4 月(圖1(c)), 但由于根與樹皮的樣品采集從4月下旬開始, 故所顯示的4月的淀粉含量應偏高。根中淀粉含量4—5 月最高, 達到2.5%DM左右, 但此后并非呈逐漸下降趨勢, 在 7 月和 10 月均出現淀粉含量增加的現象, 整個生長季中的最低值約為 1%DM。樹皮中的淀粉含量變化規律與葉和枝基本上一致, 5 月達到最高(約 3.5%DM)后便逐漸下降, 10 月降至1%DM以下。
2.2.2 不同器官中可溶性糖含量的變化趨勢
與淀粉含量的變化情況不同, 沙地云杉各器官中的可溶性糖含量在生長季中的波動變化幅度均不大, 且變化趨勢與淀粉含量相反。
5月葉中的可溶性糖含量最低, 7 月開始呈上升趨勢, 可溶性糖含量維持在8%DM~12%DM (圖2(a))。枝中的可溶性糖含量與葉呈現相同的變化規律, 可溶性糖含量約為4%DM~6%DM (圖 2(b))。根與樹皮中的可溶性糖含量 6 月最低, 分別約為4%DM和6%DM, 此后根中的可溶性糖含量逐月上升, 10 月達到6.5%DM左右, 而樹皮中的可溶性糖含量 6—7 月迅速上升, 達 8.5%DM 左右(圖2(c))。
2.2.3 不同器官中可溶性糖與淀粉含量比值的變化趨勢
可溶性糖和淀粉含量的比值可以在一定程度上反映非結構性碳水化合物的代謝和轉化。圖 3 顯示, 所有器官每月的可溶性糖和淀粉含量的比值均大于 1, 表明在生長季沙地云杉不同器官中可溶性糖含量始終高于淀粉含量。葉中可溶性糖和淀粉含量的比值 4—7 月保持在 6 左右的相對穩定水平, 其中 5 月最低, 約為3.5, 從 8 月開始快速上升, 10月最高, 可達 50 以上。枝中可溶性糖和淀粉含量的比值與葉表現出較為一致的變化規律, 4—7 月保持在 6 左右(其中新葉略高, 約為 10), 5 月最低(約為2~4), 此后不斷上升, 但 10 月的最高值只有 15左右。根中可溶性糖和淀粉含量的比值在生長季波動幅度更小, 4—7 月在 2~4 之間波動, 5 月最低, 8—9 月上升到 5 左右, 達到最大值, 10 月又略有下降。樹皮中可溶性糖和淀粉含量的比值則表現為從4月(約為2)至10月(約為 11)不斷上升的趨勢。
2.2.4 不同器官中NSC含量的變化趨勢
中國“以乳企為核心的縱向一體化”產業鏈重塑政策包括三個方面:一是在養殖端,大力推進奶牛養殖規模化和生鮮乳收購環節內部化;二是在加工端,通過企業兼并、重組實現乳品加工環節高集中度化;三是以乳企為核心,推進向上游的縱向一體化。
因為沙地云杉中的可溶性糖含量始終高于淀粉含量, 且至少高出 2 倍以上, 所以沙地云杉中的NSC含量季節動態變化規律與可溶性糖含量相似(圖4)。
葉中的 NSC 含量在 10%DM~12%DM 之間波動, 6 月相對較低。枝中的NSC含量 4—9 月穩定在 5%DM~6%DM, 10 月略高。根與樹皮中的 NSC含量 6 月最低, 分別為 5.5%DM 和 7.5%DM左右, 此后根中的NSC含量逐漸升高, 10月最高可達8%DM左右, 而樹皮中的NSC含量7月升至最高(10.5%DM左右), 8—10月呈逐漸下降趨勢。
2.3 淀粉、可溶性糖與氣候因子的關系
白音敖包地區2013年的月均溫、月降水數據如圖5所示。淀粉、可溶性糖及NSC含量與溫度、降水的相關性分析見表6。
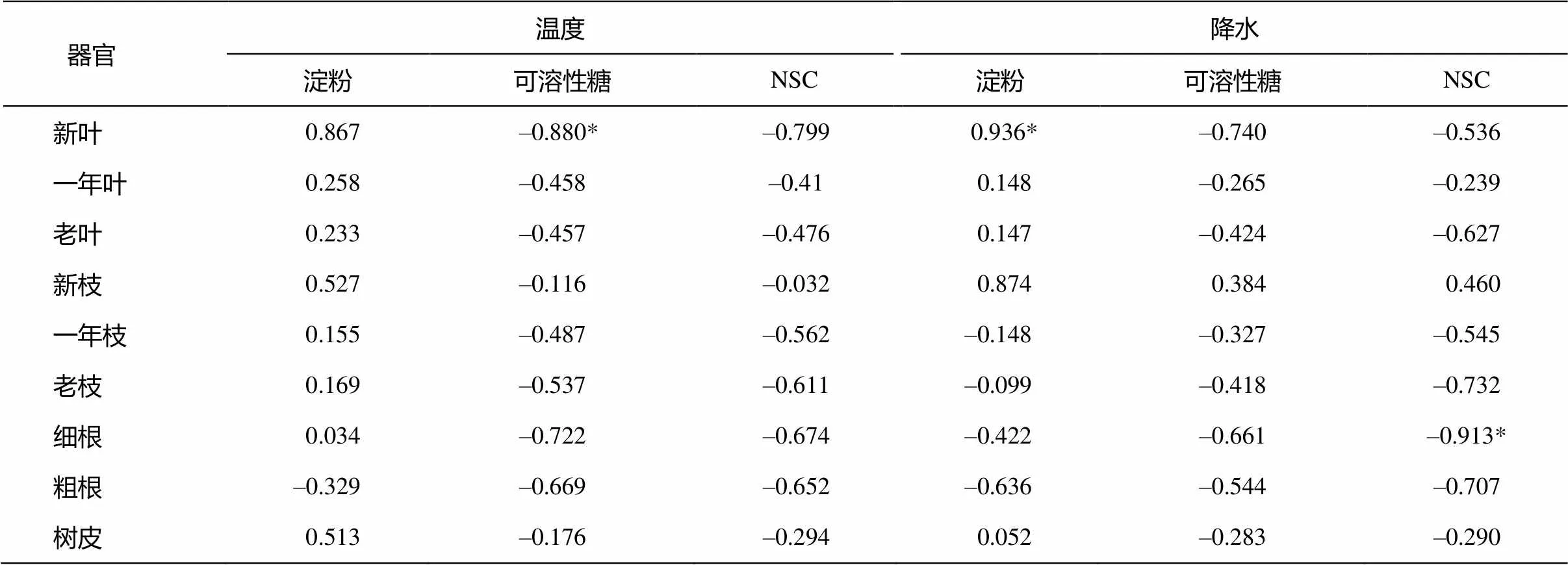
表6 沙地云杉不同器官中淀粉、可溶性糖及 NSC 含量與月均溫和月降水量的相關系數
注: *表示在0.05水平顯著。
白音敖包地區4—5月升溫較快, 此時沙地云杉中淀粉含量也快速增加, 但可溶性糖含量呈下降趨勢。7—8月全年氣溫達到最高值, 此時可溶性糖含量呈上升趨勢, 淀粉含量卻呈不斷下降趨勢, 8月淀粉含量已經呈現出較低水平。9—10月氣溫快速下降, 除根外的其他器官淀粉含量降至最低, 根中的淀粉含量略有上升; 可溶性糖含量隨著溫度的不斷降低呈不斷增加的趨勢。除粗根外, 不同器官中的淀粉含量與月均溫均呈正相關關系且不顯著。除新葉中的可溶性糖含量與月均溫呈顯著的負相關關系外, 其他各器官中的可溶性糖含量與月均溫均呈不顯著的負相關關系。不同器官中的 NSC 含量與月均溫均呈不顯著的負相關關系。
白音敖包地區 5 月降水量最小, 此時可溶性糖含量有所下降, 但淀粉含量達到生長季的最高值。6—8月是該地區降水最集中的月份, 其中 6 月是全年降水量最大的月份, 這可能是導致淀粉含量在 6月快速下降并低于 7 月的一個原因。老枝、一年生枝、細根和粗根中的淀粉含量與月降水量呈不顯著的負相關關系, 其他各器官中的可溶性糖含量與月降水量均呈正相關關系, 其中新葉表現為顯著的正相關關系。不同器官中的可溶性糖含量與月降水量均呈不顯著的負相關關系。除新枝外, 其他器官中的 NSC 含量均與月降水量呈負相關關系, 其中細根表現為顯著的負相關關系。
3 結果與討論
非結構性碳水化合物的含量變化可直接反映植物體內的碳供需關系及植物在生長季中的生長情況。沙地云杉各器官中淀粉含量的最高值均出現在5月芽萌發前, 8—10 月均維持在較低水平, 而可溶性糖含量的變化規律與此相反, 5月相對偏低, 最高值出現在 10 月。這一動態變化規律與沙地云杉的生長節律相關, 也與Hoch 等[11]、Hou 等[31]、Chen等[32]的結果一致。徐文鐸[27]指出, 白音敖包地區的沙地云杉約在 5 月中旬進入活躍生長期, 一般在5月底至6月初芽開始萌發, 5月下旬至6月進入生長高峰, 當進入 7 月, 開始出現持續高溫天氣時, 沙地云杉的生長逐漸減緩, 直至最終進入休眠期, 停止生長。
沙地云杉當年生新葉中的可溶性糖含量在萌發生長初期比一年生葉和老葉偏低, 同一時期當年生新枝中的可溶性糖含量卻比一年生枝和老枝偏高。可溶性糖是直接參與植物生長的重要營養物質, 在芽萌發初期, 新葉及新枝的形成需要大量可溶性糖, 且剛剛形成的新葉光合能力尚不穩定, 因此新葉和新枝中的可溶性糖含量會與老葉和老枝存在差異。一般認為, 可溶性糖是可直接用于細胞新陳代新的能源物質, 而淀粉難以直接利用, 是植物組織內主要的長期儲存物質之一[33], 所以在展葉、快速生長和繁殖期時, 可溶性糖處于較低水平。沙地云杉可溶性糖含量在生長季末期處于較高水平, 可溶性糖與淀粉的比值在 8—10 月隨溫度下降不斷升高, 這一結果與Wong等[34]的研究一致。生長末期及冬季休眠期植物組織中可溶性糖大量積累, 可能與增加細胞中溶質的濃度、降低冰點、提高抗凍性有 關[35]。可溶性糖也是木本植物應對溫度和水分等環境脅迫的必需物質儲備。已有研究顯示, 冬季溫度降低時, 植物中的可溶性物質逐漸增加以增強抗寒性, 春季溫度上升, 解除環境脅迫時降低[36, 37]。另一方面, 可溶性糖作為滲透調節物質, 可以降低水勢, 增加細胞的持水力, 對冷凍引起的脫水具有減緩作用, 對細胞膜也有保護作用[38]。但是, 關于樹木抗寒適應中可溶性糖的來源, 目前尚無定論, 盡管本研究結果顯示在 10 月可溶性糖與淀粉的比值最高, 但沙地云杉中的淀粉含量自 8 月起就處于較低水平, 而可溶性糖含量在 8—10 月仍不斷上升, 因此在冬季為抵御低溫而增加的可溶性糖可能并非來自生長旺盛期所積累的淀粉。
沙地云杉不同器官中 NSC 含量全年相對穩定, 體現出沙地云杉維持一定的 NSC 水平以滿足生長需要以及應對嚴酷環境的適應機制。傳統觀點認為, NSC 的儲存過程是一個被動過程, 即在滿足植物呼吸、生長等過程的需求后, 富余的部分才在植物體內儲存[4,45]。無論是生長旺盛期還是休眠期, 沙地云杉中 NSC 含量全年相對穩定這一結果可以說明, 植物始終需要維持一定的 NSC 儲存量用于維持滲透壓、應對環境脅迫以及經歷極端環境后的重新萌發[46], 用于儲存的NSC可能并不是滿足其他碳消耗后多出部分的被動儲存[47]。
參考文獻
[1]鄭云普, 王賀新, 婁鑫, 等. 木本植物非結構性碳水化合物變化及其影響因子研究進展應用生態學報, 2014, 25(4): 1188–1196
[2]潘慶民, 韓興國, 白永飛, 等. 植物非結構性貯藏碳水化合物的生理生態學研究進展植物學通報, 2002, 19(1): 30–38
[3]Korner C. Carbon limitation in treesJournal of Ecology, 2003, 91(1): 4–17
[4]Chapin F S, Schulze E D, Mooney H A. The ecology and economics of storage in plants. Annual Review of Ecology and Systematics, 1990, 21(1): 423–447
[5]Kozlowski T T. Carbohydrate sources and sinks in woody-plants. Botanical Review, 1992, 58(2): 107–222
[6]Farrar J F, Williams M L. The effects of increased atmospheric carbon-dioxide and temperature on car-bon partitioning, source-sink relations and respiration. Plant Cell and Environment, 1991, 14(8): 819–830
[7]Yu D P, Wang Q W, Liu J Q, et al. Formation mechanisms of the alpine Erman’s birch (Betula ermanii) treeline on Changbai Mountain in Northeast ChinaTrees-Structure and Function, 2014, 28(3): 935–947
[8]Hoch G, Popp M, Korner C. Altitudinal increase of mobile carbon pools in Pinus cembra suggests sink limitation of growth at the Swiss treelineOikos, 2002, 98(3): 361–374
[9]Kasuga J, Arakawa K, Fujikawa S. High accumulation of soluble sugars in deep supercooling Japanese white birch xylem parenchyma cellsNew Phytologist, 2007, 174(3): 569–579
[10]Gruber A, Pirkebner D, Florian C, et al. No evidence for depletion of carbohydrate pools in Scots pine (Pinus sylvestris L.) under drought stressPlant Biology, 2012, 14(1): 142–148
[11]Hüch G, Richter A, Korner C. Non-structural carbon compounds in temperate forest treesPlant Cell and Environment, 2003, 26(7): 1067–1081
[12]Würth M K R, Pelaez-Riedl S, Wright S J, et al. Non-structural carbohydrate pools in a tropical forestOecologia, 2005, 143(1): 11–24
[13]Palacio S, Maestro M, Montserrat-Marti G. Seasonal dynamics of non-structural carbohydrates in two species of mediterranean sub-shrubs with different leaf phenologyEnvironmental and Experimental Botany, 2007, 59(1): 34–42
[14]于麗敏, 王傳寬, 王興昌. 三種溫帶樹種非結構性碳水化合物的分配植物生態學報, 2011, 35(12): 1245–1255
[15]王文娜, 李俊楠, 王會仁, 等. 不同樹種葉片非結構性碳水化合物季節動態比較東北林業大學學報, 2014, 42(4): 46–49
[16]Newell E A, Mulkey S S, Wright S J. Seasonal patterns of carbohydrate storage in four tropical tree speciesOecologia, 2002, 131(3): 333–342
[17]Michelot A, Simard S, Rathgeber C, et al. Comparing the intra-annual wood formation of three European species (,and) as related to leaf phenology and non-structural carbohydrate dynamicsTree Physiology, 2012, 32(8): 1033–1045
[18]Zhang H, Wang C, Wang X. Spatial variations in non-structural carbohydrates in stems of twelve temperate tree speciesTrees-Structure and Function, 2014, 28(1): 77–89
[19]Richardson A D, Carbone M S, Keenan T F, et al. Seasonal dynamics and age of stemwood nonstruc-tural carbohydrates in temperate forest treesNew Phytologist, 2013, 197(3): 850–861
[20]Schaedel C, Bloechl A, Richter A, et al. Short-term dynamics of nonstructural carbohydrates and hemice-lluloses in young branches of temperate forest trees during bud breakTree Physiology, 2009, 29(7): 901–911
[21]Yin C Y, Pu X Z, Xiao Q Y, et al. Effects of night warming on spruce root around non-growing season vary with branch order and monthPlant and Soil, 2014, 380(1/2): 249–263
[22]Myers J A, Kitajima K. Carbohydrate storage enhances seedling shade and stress tolerance in a neotropical forestJournal of Ecology, 2007, 95(2): 383–395
[23]Hansen J, Beck E. Seasonal changes in the utilization and turnover of assimilation products in 8-year-old scots pine (L.) treesTrees-Structure and Function, 1994, 8(4): 172–182
[24]徐文鐸. 沙地云杉新種的鑒定及其對我國北方生態環境建設意義應用生態學報, 1999(3): 361
[25]羅菊春. 沙地云杉是防沙治沙的優良樹種中國林業, 2000(7): 38
[26]李春紅, 藍登明, 周世權, 等. 內蒙古白音敖包沙地云杉分類學研究干旱區資源與環境, 2008, 22(2): 164–169
[27]徐文鐸. 內蒙古白音敖包自然保護區沙地云杉林的基本特征、存在問題與解決途徑生態學雜志, 1993, 12(5): 39–44
[28]姜聯合. 沙地云杉之源: 白音敖包保護區植物雜志, 2001(4): 6
[29]Mandre M, Tullus H, Kloseiko J. Partitioning of carbohydrates and biomass of needles in Scots pine canopyZeitschrift fur Naturforschung C — a Journal of Biosciences, 2002, 57(3/4): 296–302
[30]Smith A M, Zeeman S C. Quantification of starch in plant tissuesNature Protocols, 2006, 1(3): 1342–1345
[31]Hou W. Seasonal fluctuation of reserve materials in the trunkwood of spruce ((L.) Karst). Journal of Plant Physiology, 1985, 117(4): 355–362
[32]Chen T, Pei H J, Zhang Y F, et al. Seasonal changes in non-structural carbohydrates and sucrose metabolism enzymes in two Sabina speciesActa Physiologiae Plantarum, 2012, 34(1): 173–180
[33]Dietze M C, Sala A, Carbone M S, et al. Nonstructural carbon in woody plantsAnnual Review of Plant Biology, 2014, 65: 667–687
[34]Wong B L, Baggett K L, Rye A H. Seasonal patterns of reserve and soluble carbohydrates in mature sugar maple ()Canadian Journal of Botany-Revue Canadienne de Botanique, 2003, 81(8): 780–788
[35]Levitt J. Response of plants to environmental stresses. Chilling, freezing, and high temperature stresses. New York: Academic Press, 1980
[36]Moraga S P, Escobar R, Valenzuela A S. Resistance to freezing in threeLabill sub-speciesElectronic Journal of Biotechnology, 2006, 9(3): 310–314
[37]Kerepesi I, Banyai-Stefanovits E, Galiba G. Cold acclimation and abscisic acid induced alterations in carbohydrate content in calli of wheat genotypes differing in frost toleranceJournal of Plant Physiology, 2004, 161(1): 131–133
[38]Kozlowski T T, Pallardy S G. Acclimation and adaptive responses of woody plants to environmental stressesBotanical Review, 2002, 68(2): 270–334
[39]Bergh J, McMurtrie R E, Linder S. Climatic factors controlling the productivity of Norway spruce: a model-based analysisForest Ecology and Manage-ment, 1998, 110: 127–139
[40]Horowitz M E, Fahey T J, Yavitt J B, et al. Patterns of late-season photosynthate movement in sugar maple saplingsCanadian Journal of Forest Research-Revue Canadienne de Recherche Forestiere, 2009, 39(12): 2294–2298
[41]Senser M, Schotz F, Beck E. Seasonal-changes in structure and function of spruce chloroplastsPlanta, 1975, 126(1): 1–10
[42]Regier N, Streb S, Zeeman S C, et al. Seasonal changes in starch and sugar content of poplar (×cv. Dorskamp) and the impact of stem girdling on carbohydrate allocation to rootsTree Physiology, 2010, 30(8): 979–987
[43]Aerts R. The advantages of being evergreenTrends in Ecology & Evolution, 1995, 10(10): 402–407
[44]Moore P. The advantages of being evergreenNature, 1980, 285: 535–535
[45]Carbone M S, Czimczik C I, Keenan T F, et al. Age, allocation and availability of nonstructural carbon in mature red maple treesNew Phytologist, 2013, 200(4): 1145–1155
[46]Verdaguer D, Ojeda F. Root starch storage and allocation patterns in seeder and resprouter seedlings of two Cape Erica (Ericaceae) speciesAmerican Journal of Botany, 2002, 89(8): 1189–1196
[47]Sala A, Woodruff D R, Meinzer F C. Carbon dynamics in trees: feast or famine?. Tree Physiology, 2012, 32(6): 764–775
Seasonal Dynamic Changes of Non-structural Carbohydrate in Tissues ofin Baiyinaobao
WANG Yiran, ZHENG Chengyang?, ZENG Faxu
Department of Ecology, College of Urban and Environmental Sciences, Peking University, Beijing 100871; ? Corresponding author, E-mail: zhengcy@pku.edu.cn
To understand seasonal dynamic of non-structural carbohydrate (NSC) in evergreen conifers, the authors analyzed the soluble sugar, starch and NSC content of leaf, branch, bark and root system offrom April to October. The results indicate that starch abundance in different organs ofreach the highest point in May, then decrease gradually and maintain at a low level from August to October. This might be reasoned that germination required starch is accumulated through photosynthesis from April to May. The soluble sugar content is slight low in May, raise gradually and reach the highest point in October. However, starch accumulated during the growth season may not account for soluble sugar increment in winter. No significant correlation is detected betweendifferent organs’ starch, soluble sugar, and NSC content to monthly mean temperature and precipitation.
; non-structural carbohydrate; seasonal dynamic changes; temperature and precipitation
10.13209/j.0479-8023.2016.062
Q948
2015-04-02;
2015-05-29; 網絡出版日期: 2016-09-02
國家自然科學基金(31170452, 31321061)資助

