CD14在強直性脊柱炎患者外周血單個核細胞和血清中的表達研究
陳曦 李秋霞 魏秋靜 古潔若
?
·基礎研究論著·
CD14在強直性脊柱炎患者外周血單個核細胞和血清中的表達研究
陳曦李秋霞魏秋靜古潔若
目的研究CD14基因在強直性脊柱炎(AS)患者外周血單個核細胞中RNA,和血清中蛋白的表達情況,并對CD14基因進行相關性分析。方法采集病情活動期AS患者的靜脈血,分離外周血單個核細胞(PBMC)后提取RNA,同時從靜脈血中離心分離血清于-20℃保存。其中21例AS活動期患者和20名健康志愿者的外周血行Microarray芯片檢測。使用ELISA法檢測另外40例活動期AS患者和40名健康志愿者血清中CD14的含量。對結果基因進行信號通路分析,探討其參與AS發病的相關機制。結果Microarray芯片檢測CD14在AS患者PBMC中mRNA的表達的熒光強度值為6 824±1 449,健康對照組為4 027±923。ELISA法檢測AS患者血清中CD14蛋白含量中位數為2 568 kU/L,健康對照組為 905 kU/L。CD14在AS患者PBMC中mRNA和血清中蛋白的表達水平均高于健康對照組(P均<0.05)。CD14主要參與了Toll樣受體(TLR)信號途徑和固有免疫信號途徑。STRING10在線蛋白質分析提示CD14和MYD88、TLR2、TLR6等基因相關。結論CD14可能通過參與免疫炎癥反應相關的通路參與了AS的發病過程。
強直性脊柱炎;CD14;血清;外周血單個核細胞
強直性脊柱炎(AS)是一種常見的全身性慢性炎癥性疾病,以骶髂關節炎、肌腱端炎和脊柱炎為特點,病情嚴重時可導致患者功能喪失和殘疾。AS的發病與促炎細胞因子表達的上調有關,其中最重要并為多數學者所公認的細胞因子是TNF-α[1-4]。CD14分子在激活固有免疫系統、細菌吞噬作用和清除凋亡細胞等各種免疫反應中起重要作用。CD14/Toll樣受體 4(TLR 4)-核因子-κB(NF-κB)信號通路參與了骨關節炎的發病機制。CD14/TLR 4-NF-κB信號通路過度活化,下游NF-κB p65及基質金屬蛋白酶-13(MMP-13)的表達升高可能導致關節軟骨破壞、降解加速,是誘發骨關節炎發展的重要因素之一[5]。本課題組在2009年用Microarray芯片對未分化脊柱關節病患者及健康志愿者的外周血單個核細胞(PBMC)進行分析,發現了6個差異基因,經過實時定量PCR(RT-PCR)驗證后證實有4個基因與Microarray芯片結果相符[6]。本研究重新對該Microarray芯片進行了分析,使用ELISA法在蛋白質水平進行驗證,并結合AS發病機制的相關信號通路進行分析,現報告如下。
對象與方法
一、研究對象
納入Microarray芯片和ELISA研究的AS患者均來自中山大學附屬第三醫院門診或住院患者,健康對照組血液標本均取自中山大學附屬第三醫院健康體檢者,所有受試對象均知情同意并自愿參與本研究。Microarray芯片研究中,AS患者的男女比為13∶8,年齡(35±9)歲;健康對照者的男女比為10∶10,年齡(37±9)歲。ELISA研究中,AS患者的男女比為33∶7,年齡(31±12)歲;健康對照者的男女比為33∶7,年齡(30±9)歲。AS患者均符合1984年修訂的AS紐約診斷標準,該組患者均處在疾病活動期,Bath AS病情活動指數(BASDAI)>4分,或ESR升高或CRP升高。納入Microarray實驗組AS患者的BASDAI為4.6(2.6,7.8)分;納入ELISA實驗組的患者BASDAI為5.0(2.9,8.2)分。AS組與健康對照組的性別構成、年齡比較差異均無統計學意義(P均>0.05)。排除合并其他自身免疫性疾病、肝腎疾病、感染、惡性腫瘤及血液系統疾病等。本研究已通過醫院倫理委員會審批。
二、主要試劑與儀器
逆轉錄試劑盒采用PrimeScriptRTMaster Mix (Perfect Real Time)(日本Takara公司)。微陣列芯片(Sentrix Human Ref- 8_v2 Beadchips,美國Illumina公司);Human sCD14 Quantikine ELISA Kit(1 KT) DC140(美國R&D公司)試劑盒。人外周血淋巴細胞分離液(TBD,LTS1077-1,天津市灝洋生物制品科技有限責任公司);Trizol(美國Invitrogen公司);Axon GenePix激光掃描儀(美國Axon公司);KEGG、STRING蛋白分析在線數據庫;GenClip 2.0(Human Gene Function And Network Analysis)基因和蛋白在線分析軟件。
三、實驗方法
使用EDTA抗凝管收集入組者外周靜脈血樣本,分離PBMC,使用Trizol法提取總RNA。將提取出的總RNA逆轉錄為模板DNA,并使用包含全基因組20 589個探針的微陣列芯片對21例AS患者和20名健康受試者進行檢測。使用ELISA試劑盒對40例AS患者與40名健康體檢者CD14分子進行檢測,實驗按照說明書步驟操作。
四、Microarray芯片的分析
將芯片數據進行標準化處理,使用芯片分析軟件Array tool 2.0中的微陣列顯著性(SAM)分析法和基因組表達比較法對芯片數據進行分析,隨后挑選出SAM分析法中fold值大于1.5(AS患者組中表達下調)和小于0.66(AS患者組中表達上調)的基因,并選擇基因組表達比較法中P值小于0.0001的基因。通過文獻查閱、京都基因與基因組百科全書(KEGG)數據庫的路徑分析和使用GenClip 2.0在線蛋白質分析軟件的人類基因功能和網絡分析功能對CD14相關的信號通路進行分析[7]。利用STRING10在線蛋白質分析軟件分析CD14的相關基因,并結合已知的CD14/TLR 4-NF-κB-TNF-α信號通路總結可能的CD14-TLR-NF-κB-TNF-α的信號通路[8-11]。
五、統計學處理
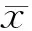
結 果
一、Microarray芯片分析結果
經模板DNA芯片數據比對后,共篩選出63個差異基因(fold<0.66或fold>1.5,P均<0.001)。AS組的熒光強度值為6 824±1 449,是健康對照組(4 027±923)的1.69倍,2組Microarray芯片中CD14熒光強度值比較差異有統計學意義(t=7.330,P<0.001)。
二、ELISA分析結果
AS組和健康對照組PBMC的CD14含量分別為2 568(965,4 490)、905(477,1 269)kU/L,AS組患者PBMC的CD14含量是對照組的2.83倍,2組PBMC的CD14含量比較差異有統計學意義(Z=2.393,P=0.017)。
三、CD14分子參與AS相關信號通路的分析結果
CD14主要參與了Toll樣受體信號途徑和固有免疫信號途徑。STRING10在線蛋白質分析提示CD14和MYD88、TLR2、TLR6等基因相關(圖1),可能的CD14-TLR-NF-κB-TNF-α信號通路見圖2。

圖1 與CD14相關的蛋白分子相互作用示意圖
LBP:脂多糖結合蛋白;MYD88:髓系分化因子88;TLR1:Toll樣受體1;TLR2:Toll樣受體2;TLR4:Toll樣受體4;TLR6:Toll樣受體6;LY96:淋巴細胞抗原96;ITGAM:整合素αM;ITGB2:整合素β2
討 論
AS的典型病理變化是從最初的炎癥階段進展到骨化強直階段,最終發生關節融合,其中最重要的炎癥因子是TNF-α。TNF-α作為炎癥反應的啟動因子,在AS的骨代謝病理過程中起著重要的作用。有研究發現,活動期和非活動期的中國AS患者血清TNF-α水平均明顯高于健康人,活動期者較非活動期者升高得更明顯[12-13]。目前AS具體的炎癥過程仍正在研究中。其中介導固有免疫的TLR家族在AS的發病過程中起著重要作用。本課題組前期研究結果表明,TLR2與TLR4的mRNA和蛋白的表達水平在AS患者中均高于健康人,并且與AS的疾病活動度評分呈線性關系[14]。TLR2、TLR4、TLR6的激活均需要CD14分子的參與, 并繼而激活NF-κB,產生TNF-α等炎癥因子,導致疾病的發生[8-11]。本研究也發現,無論是在AS患者的PMBC還是在血清中,CD14水平均比健康人升高。
CD14是脂多糖受體,可介導脂多糖對單核細胞的刺激并分泌TNF、IL-1等細胞因子,介導一系列生理(增強免疫反應性)和病理(炎癥)反應[15]。

圖2 CD14-TLR-NF-κB-TNF-α信號通路示意圖
Lipoproteins:脂蛋白類;Mannans:甘露聚糖類;Lipopolysaccharides:脂多糖;MYD88:髓系分化因子88;TRAF6:TNF受體相關因子6;IKKα:IκB激酶α;IKKβ:IκB激酶β;IKKγ:IκB激酶γ
CD14 被證實是脂多糖激活內在免疫信號轉導途徑進而激活 NF-κB 所必需的細胞因子,而 CD14的活化是炎癥反應的共同途徑[16]。在風濕性疾病如類風濕關節炎、SLE和干燥綜合征的研究中,已證實無論是單核細胞表面的CD14還是可溶性CD14的水平均和疾病的發生、發展有重要關系[17-20]。CD14和AS相關性的研究目前國內較少,以 “ankylosing spondylitis and CD14”為關鍵詞在Pubmed數據庫內檢索,結果有18篇文獻,其中僅3篇文獻的研究內容是關于AS和CD14的,而且研究也不夠深入,多是關于CD14多態性和其在細胞表面表達情況的觀察[21-23]。聯系到CD14-TLR-NF-κB-TNF-α信號通路,結合AS的發病特點,筆者推測CD14與炎癥和TNF-α的產生相關,參與了AS的發病過程。
Microarray 芯片實驗所產生的數據都是高通量的,對高通量數據的分析大多是采用數據的批量導入,很少對單個基因的數據進行分析,因為所使用的分析軟件及參數不同,分析結果有可能會有大同小異的結果,也可能會遺漏某些有統計學意義的基因。本研究通過高通量數據的批量分析結合單個基因的數據單獨分析,結果發現了CD14在AS患者外周血PBMC的mRNA和血清中蛋白表達水平均有升高,與健康對照者比較差異有統計學意義,彌補了既往數據分析的遺漏,找到了一個有意義的生物標記分子,為日后的進一步研究提供了依據。
[1]Wang NG, Wang DC, Tan BY, Wang F, Yuan ZN. TNF-α and IL10 polymorphisms interaction increases the risk of ankylosing spondylitis in Chinese Hanpopulation.Int J Clin Exp Pathol,2015,8(11):15204-15209.
[2]Dong X, Zheng Y, Shi TY, Liu HY. Effects of tumor necrosis factor-alpha on sexual activity of male patients with ankylosing spondylitis.Clin Rheumatol,2015,34(5):915-920.
[3]Aguillón JC, Cruzat A, Cuenca J, Cuchacovich M. Tumor necrosis factor alpha genetic polymorphism as a risk factor in disease.Rev Med Chil,2002,130(9):1043-1050.
[4]Liu KG, He QH, Tan JW, Liao GJ.Expression of TNF-α, VEGF, and MMP-3 mRNAs in synovial tissues and their roles in fibroblast-mediatedosteogenesis in ankylosing spondylitis.Genet Mol Res,2015,14(2):6852-6858.
[5]王永福, 林劍, 詹宏剛. CD14/TLR-4-NF-κB信號通路參與骨關節炎發病機制的研究. 實用骨科雜志,2013,19(6): 528-530.
[6]Gu J, Wei YL, Wei JC, Huang F, Jan MS, Centola M, Frank MB, Yu D.Identification of RGS1 as a candidate biomarker for undifferentiated spondylarthritis by genome-wideexpression profiling and real-time polymerase chain reaction.Arthritis Rheum,2009,60(11):3269-3279.
[7]李秋霞, 魏秋靜, 廖澤濤. 基因挖掘軟件GenCLip尋找強直性脊柱炎相關基因的研究. 新醫學,2011,42(5): 304-307.
[8]Brenaut P, Lefèvre L, Rau A, Laloё D, Pisoni G, Moroni P, Bevilacqua C, Martin P.Contribution of mammary epithelial cells to the immune response during early stages of a bacterialinfection to Staphylococcus aureus.Vet Res,2014,45:16.
[9]Zoccal KF, Bitencourt Cda S, Paula-Silva FW, Sorgi CA, de Castro Figueiredo Bordon K, Arantes EC, Faccioli LH.TLR2, TLR4 and CD14 recognize venom-associated molecular patterns from Tityus serrulatus to inducemacrophage-derived inflammatory mediators.PLoS One,2014,9(2):e88174.
[10]Park BS, Lee JO.Recognition of lipopolysaccharide pattern by TLR4 complexes.Exp Mol Med,2013,45:e66.
[11]Yew KH, Carpenter C, Duncan RS, Harrison CJ.Human cytomegalovirus induces TLR4 signaling components in monocytes altering TIRAP, TRAM anddownstream interferon-beta and TNF-alpha expression.PLoS One,2012,7(9):e44500.
[12]趙瑞梅, 孫永平. 強直性脊柱炎患者外周血TNF-α、IL-17、IL-23的表達及相關性分析. 實用臨床醫藥雜志,2015, 19(9): 38-40.
[13]張璐, 鄒紅云, 余伍忠, 王錚, 焦敏. 強直性脊柱炎患者 TNF-α表達水平測定分析. 中國實驗診斷學,2014,18(4): 589-592.
[14]毋靜, 于清宏, 曲源, 廖澤濤, 魏秋靜, 古潔若. TLR-2、TLR-4在強直性脊柱炎患者外周血單個核細胞中的表達及其臨床意義. 新醫學,2011,42(3): 166-169.
[15]Zanoni I, Granucci F.Role of CD14 in host protection against infections and in metabolism regulation.Front Cell Infect Microbiol,2013,3:32.
[16]Phan HH, Cho K, Sainz-Lyon KS, Shin S, Greenhalgh DG. CD14-dependent modulation of NF-kappaB alternative splicing in the lung after burn injury.Gene,2006,371(1):121-129.
[17]Coulthard LR, Geiler J, Mathews RJ, Church LD, Dickie LJ, Cooper DL, Wong C, Savic S, Bryer D, Buch MH, Emery P, Morgan AW, McDermott MF.Differential effects of infliximab on absolute circulating blood leucocyte counts of innate immune cells inearly and late rheumatoid arthritis patients.Clin Exp Immunol,2012,170(1):36-46.
[18]Korkosz M, Bukowska-Strakova K, Sadis S, Grodzicki T, Siedlar M.Monoclonal antibodies against macrophage colony-stimulating factor diminish the number of circulatingintermediate and nonclassical [CD14(++)CD16(+)/CD14(+)CD16(++)] monocytes in rheumatoid arthritispatient. Blood, 2012, 119(22):5329-5230.
[19]Shin MS, Kang Y, Lee N, Kim SH, Kang KS, Lazova R, Kang I. U1-small nuclear ribonucleoprotein activates the NLRP3 inflammasome in human monocytes. J Immunol, 2012, 188(10): 4769-4775.
[20]尤海燕, 芮金兵, 焦志軍, 李晶, 裘影影. 類風濕關節炎患者外周血CD14+CD16+單核細胞亞群測定及意義. 江蘇醫藥,2010,36(13): 1489-1491.
[21]Slobodin G, Kessel A, Kuznets I, Peri R, Haj T, Rosner I, Toubi E, Odeh M. CD14brightLAP+mononuclear cells in peripheral blood positively correlate with BASRI scores in patientswith ankylosing spondylitis: a pilot study.Joint Bone Spine,2012,79(6):633-634.
[22]van der Paardt M, Crusius JB, de Koning MH, Morré SA, van de Stadt RJ, Dijkmans BA, Pea AS, van der Horst-Bruinsma IE.No evidence for involvement of the Toll-like receptor 4 (TLR4) A896G and CD14-C260T polymorphisms insusceptibility to ankylosing spondylitis.Ann Rheum Dis,2005,64(2):235-238.
[23]Pointon JJ, Chapman K, Harvey D, Sims AM, Bradbury L, Laiho K, Kauppi M, Kaarela K, Tuomilehto J, Brown MA, Wordsworth BP.Toll-like receptor 4 and CD14 polymorphisms in ankylosing spondylitis: evidence of a weak association in Finns. J Rheumatol,2008,35(8):1609-1612.
Expression of CD14 in peripheral blood mononuclear cells and serum of patients with ankylosing spondylitis
ChenXi,LiQiuxia,WeiQiujing,GuJieruo.
DepartmentofRheumatism,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
Correspondingauthor,GuJieruo
ObjectiveTo measure the expression level of CD14 mRNA in the peripheral blood mononuclear cells (PBMCs) and CD14 protein in the serum of patients with ankylosing spondylitis (AS) and to perform correlation analysis of CD14 gene. MethodsThe venous blood samples were obtained from patients with active AS, PBMCs were isolated and RNA was extracted subsequently. The serum was isolated from the venous blood samples by centrifuge and restored at -20 ℃. The peripheral blood samples collected from 21 patients with active AS and 20 healthy volunteers were detected by the microarray chip. Using an enzyme-linked immunosorbent assay (ELISA), the expression of CD14 protein in the serum of 40 patients with active AS and 40 healthy volunteers was detected for verification. The signaling pathway of the related genes was analyzed to investigate the mechanism underlying the pathogenesis of AS. ResultsMicroarray chip detected that the fluorescent intensity of CD14 mRNA in the PBMC of AS patients was 6 824±1 449, significantly higher compared with 4 027±923 in the healthy controls (P<0.05). ELISA demonstrated that the median level of CD14 protein in the serum of AS patients was calculated as 2 568 kU/L, significantly higher than 905 kU/L in the healthy controls (P<0.05). CD14 mainly participated in the Toll-like receptor and inherent immune signaling pathways. STRING 10 hinted that CD14 was correlated with MYD88, TLR2 and TLR6, etc. ConclusionCD14 is probably involved with the pathogenesis of AS via participating in the signaling pathways related to immune and inflammatory response.
Ankylosing spondylitis; CD14; Serum; Peripheral blood mononuclear cell
10.3969/j.issn.0253-9802.2016.09.004
510630 廣州,中山大學附屬第三醫院風濕免疫科
,古潔若
2016-06-05)(本文編輯:林燕薇)

