豬繁殖與呼吸綜合征病毒微載體培養(yǎng)試驗研究
劉曉航 夏一今/哈藥集團生物疫苗有限公司李一經(jīng)/東北農(nóng)業(yè)大學動物醫(yī)學學院
豬繁殖與呼吸綜合征病毒微載體培養(yǎng)試驗研究
劉曉航 夏一今/哈藥集團生物疫苗有限公司
李一經(jīng)/東北農(nóng)業(yè)大學動物醫(yī)學學院
豬繁殖與呼吸綜合征(Porcine reproductive and respiratory syndrome, PRRS)是由豬繁殖與呼吸綜合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一種以感染豬發(fā)熱、厭食,妊娠母豬晚期流產(chǎn)、早產(chǎn)、產(chǎn)死胎、弱胎和木乃伊胎,各種年齡豬(特別是仔豬)呼吸障礙為特征的高度傳染性疾病。郭寶清等(1996)首次從國內(nèi)疑似PRRS感染豬群中分離出PRRSV,從而證實了本病在我國的存在。此病常為地方流行性,長期危害養(yǎng)豬生產(chǎn),給養(yǎng)豬業(yè)造成巨大的經(jīng)濟損失。
目前,豬繁殖與呼吸綜合征滅活疫苗的生產(chǎn)主要是轉瓶細胞培養(yǎng)的傳統(tǒng)培養(yǎng)方式,進而增殖PRRSV。但轉瓶培養(yǎng)細胞增殖較為緩慢而且生產(chǎn)過程中對細胞和病毒的培養(yǎng)條件,如pH、溶氧、糖耗等難以監(jiān)控和適時補給,無法提供最佳的培養(yǎng)條件,造成該方法自動化程度低,勞動強度大,并因為轉瓶細胞培養(yǎng)環(huán)境的不可控性,導致存在生產(chǎn)的產(chǎn)品質(zhì)量穩(wěn)定性不夠、批間差較大、產(chǎn)量低等問題。
本研究摸索了利用微載體大規(guī)模培養(yǎng)Marc-145細胞增殖PRRSV病毒的條件,根據(jù)試驗結果確定最佳增殖條件,為以哺乳動物細胞為基質(zhì)大規(guī)模增殖病毒及制備藍耳病疫苗提供依據(jù)。
一、材料與方法
1.毒株與細胞。PRRSV Hun4 F112株病毒由中國農(nóng)業(yè)科學院哈爾濱獸醫(yī)研究所豬病分子診斷實驗室惠贈;Marc-145細胞由本單位保存,傳代培養(yǎng)至54代。
2.主要設備與試劑。5 L生物反應器(B5,Sartorius,Germany);Cytodex-1購自GE Healthcare公司;DMEM購自Life technology;其他試劑均為進口或國產(chǎn)分析純產(chǎn)品。
3.靜置培養(yǎng)。Marc-145細胞生長至3 d~4 d后,細胞基本鋪滿方瓶時,先用PBS清洗2次,再加入0.25%胰酶(含0.02% EDTA)溶液消化,傾去胰酶,加含10%血清的DMEM培養(yǎng)基,吹打,T75方瓶以1∶3~1∶4的比率傳代。
4.微載體培養(yǎng)。
(1)微載體處理。用無Ca2+、Mg2+離子的磷酸緩沖液清洗并浸泡至少3 h后,經(jīng)121℃高壓蒸汽滅菌25 min,冷卻后儲于4℃密封待用。使用前用37℃的細胞培養(yǎng)液清洗2遍。
(2)Marc-145細胞的反應器培養(yǎng)優(yōu)化。
①不同初始密度細胞對細胞生長的影響。不同初始密度1.5×105個細胞/ml、3.0×105個細胞/ml、4.5×105個細胞/ml的Marc-145細胞分別接種于5 L反應器中,微載體用量為3 g/L,觀察不同初始密度對細胞生長的影響,確定最佳接種細胞密度。
②攪拌速度對細胞生長的影響。本實驗分別考察了攪拌速度為50/min、75 r/min和100 r/min時Marc-145細胞在DMEM培養(yǎng)基中的生長情況,微載體濃度為3 g/L。以3.0×105cells/ml細胞密度接種于5 L反應器中,工作體積為2 L,每隔8 h進行監(jiān)測,取樣計數(shù)細胞。
③不同微載體濃度對細胞生長的影響。微載體供應商GE公司推薦的微載體濃度為2~3 g/L,分批培養(yǎng)細胞時一般不超過5 g/L。本實驗考察了微載體濃度為1 g/L、3 g/L和5 g/L時細胞的生長情況。
④代謝產(chǎn)物對細胞生長的影響。Marc-145細胞培養(yǎng)過程中,乳酸和葡萄糖的代謝情況是細胞生長的主要指標。因此,本研究檢測細胞生長過程中葡萄糖、乳酸代謝情況,并對灌注策略進行分析。
5.微載體培養(yǎng)PRRSV病毒條件優(yōu)化。
(1)病毒感染量(MOI)的確定。細胞培養(yǎng)48 h后,分別以MOI=0.01、0.1、0.5、1和5接種病毒,檢測病毒滴度。
(2)病毒感染時間(TOI)的確定。細胞分別培養(yǎng)24、48、72和96 h后,以1.3.1中優(yōu)化的MOI接種病毒,檢測病毒滴度。
(3)病毒測定。樣品TCID50測定:將在含血清培養(yǎng)基中培養(yǎng)好的Marc-145細胞消化,稀釋至所需的細胞密度(0.8~1.0×105cells/ml,即每孔8 000~10 000個細胞),向96孔板中每孔加100μl細胞懸液;置培養(yǎng)箱中37℃孵育24 h至細胞鋪成單層約60%豐度;取出孔板,吸去培養(yǎng)液,每孔添加約100μl PBS搖晃洗滌2遍以除去血清;將10倍比系列稀釋好的病毒液加到96孔板上,每孔100μl,從1到11作11個梯度,從A到H作8個重復,最后一列(A12-H12)做陰性對照(各加100μl病毒稀釋液),置培養(yǎng)箱37℃孵育1 h;吸除病毒液,加入100μl細胞維持液;置培養(yǎng)箱37℃培養(yǎng),逐日觀察細胞病變和對照,共觀察2~5日,并記錄細胞病變的孔數(shù),按照Reed-Muench法計算病毒的TCID50。同時以相同的方法對用轉瓶培養(yǎng)的PRRS病毒液進行TCID50測定。以此作為對照組。
6.高致病性豬繁殖與呼吸綜合征活疫苗免疫原性實驗。免疫攻毒測定:用5~6周齡健康易感仔豬15頭,隨機分為3組,每組5頭。一組用供試疫苗進行免疫保護,另一組用轉瓶苗進行保護;兩組試驗豬各頸部肌肉注射疫苗1頭份。第三組不接種疫苗,作為對照,在相同條件下隔離飼養(yǎng)。28日后,所有豬各肌肉注射檢驗用強毒HuN4株的病毒培養(yǎng)液(104.0TCID50/ml)1 ml,每頭滴鼻2 ml,每日測溫并觀察21日。
二、結果
1.初始細胞密度的確定。當微載體用量為3 g/L時,初始細胞密度1.5×105個細胞/ml、3.0×105個細胞/ml和4.5×105個細胞/ml使得Marc-145細胞在微載體上生長曲線有所差異(圖1)。低初始密度 (1.5×105個細胞/ml)使Marc-145細胞的延遲期延長,這是由于單個微載體上分布的細胞過少,同時微載體的空球率較高 (圖2A),細胞生長缺乏初始密度效應而造成生長相對緩慢,最大細胞密度也最低,但細胞存活率始終維持在較高水平。4.5×105個細胞/ml的初始密度可以使Marc-145細胞快速進入生長期,但細胞存活率相對較低,這是由于接種后細胞存在聚團和游離細胞不黏附的現(xiàn)象,雖然單個微載體上分配的細胞個數(shù)很多,但不能提供有效的黏附生長表面,不利于細胞生長(圖2C)。所以細胞接種于微載體上培養(yǎng)時,合適的細胞初始密度(3×105個細胞/ml)既能均勻分布細胞于每個微載體表面,促使細胞快速生長,同時也為細胞的生長預留了充裕的生長表面,最終獲得較好的培養(yǎng)效果,維持較高的細胞存活率(圖2B)。細胞不同密度接種對細胞的增殖會有較明顯的影響,初始密度過小和過大均不利于細胞的增殖,中密度接種較為適合。

圖1 不同初始密度的Marc-145細胞在3g/L微載體上生長曲線

圖2 不同初始密度的Marc-145細胞在3g/L微載體上培養(yǎng)6 h時的黏附效率比較
2.攪拌速度對細胞生長的影響。微載體培養(yǎng)過程中為了使微載體充分懸浮,必須要有足夠高的攪拌速度;但過度的攪拌會延長細胞貼壁時間,嚴重損傷已貼壁細胞,尤其對有絲分裂周期細胞的傷害更大,導致細胞密度降低。因此本實驗分別考察了攪拌速度為80/min、100 r/min和120 r/min時Marc-145細胞在DMEM培養(yǎng)基中的生長情況。結果如圖3所示,當攪拌速度為80 r/min時,細胞密度緩慢上升,最高細胞密度僅為8.3×105cell/ml,這可能是因為攪拌速度過低,轉瓶中氧傳質(zhì)速度不能滿足細胞消耗,因此細胞生長不出現(xiàn)對數(shù)生長期;攪拌速度為120 r/min時,最高密度大于前者,但也明顯小于當攪拌速度為100 r/min時的最高細胞密度,說明這時攪拌過度,對細胞產(chǎn)生了嚴重的剪切傷害。攪拌速度為100 r/min時,細胞快速進入對數(shù)生長期,56 h時細胞最高密度為1.8×106cell/ml,因此我們確定100 r/min為最佳攪拌速度。

圖3 攪拌速度對微載體培養(yǎng)MDCK細胞生長的影響
3.微載體濃度的確定。微載體濃度影響種子細胞的準備量、最高細胞密度、細胞代數(shù)、換液頻率和策略,又因為微載體價格昂貴,對培養(yǎng)成本也有很大影響,所以選擇合適的微載體濃度對大規(guī)模工業(yè)化細胞培養(yǎng)有重要意義。微載體供應商GE公司推薦的微載體濃度為2~3 g/L。本實驗考察了微載體濃度為1 g/L、3 g/L和5 g/L時細胞的生長情況,實驗結果如圖4所示,微載體濃度為1g/L時,不能提供足夠的表面積供細胞生長,細胞受到較嚴重的接觸抑制,56 h時細胞密度只有5.0×105cell/ml;而微載體濃度為3 g/L和5 g/L時,36 h前細胞密度無明顯差別,36~60 h前者細胞密度略高于后者,最高細胞密度分別為1.5×106cell/ml和1.3×106cell/ml。考慮到使用成本,選擇3 g/L作為微載體的使用重量。

圖4 微載體濃度對微載體培養(yǎng)Marc-145細胞生長的影響
4.生物反應器細胞培養(yǎng)代謝分析和灌注策略。在Marc-145細胞進入對數(shù)生長期過程中葡萄糖含量迅速下降到最低值5 mmol/L,代謝乳酸由0 mmol/L快速升高到20 mmol/L,隨著細胞總數(shù)接近最大值,細胞的葡萄糖消耗逐漸趨于穩(wěn)定,同時乳酸含量也下降到一個較低的水平(圖5)。由于1分子葡萄糖完全代謝為乳酸的情況下,可以生成2分子乳酸。在細胞生長期,葡萄糖消耗量略低于乳酸生成量,說明葡萄糖不是完全代謝生成乳酸,低于50%的葡萄糖完全氧化供給細胞能量。因此,在細胞放大培養(yǎng)過程中,早期細胞以葡萄糖代謝產(chǎn)生大量乳酸為特征,灌注培養(yǎng)基以控制乳酸濃度在較低水平為目的,灌注量3~4體積;中后期以細胞維持生存為灌注目的,灌注量1~2體積,逐步減少以達到較高培養(yǎng)基利用率。

圖5 5L生物反應器MDCK細胞葡萄糖、乳酸含量曲線
5.反應器參數(shù)控制。激流式生物反應器的使用方法,按產(chǎn)品使用和操作方法說明進行。反應器運行過程中主要參考設置如表1所示。
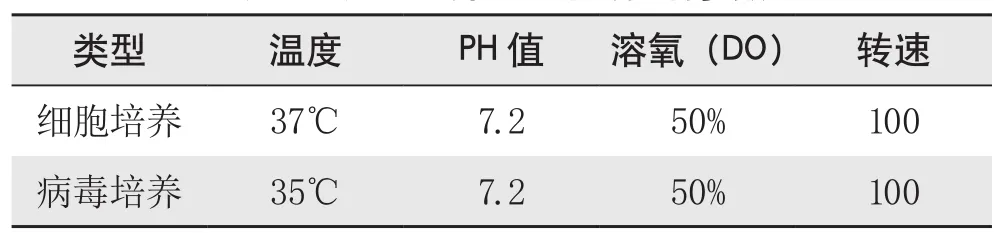
表1 反應器培養(yǎng)過程中的控制參數(shù)
(1)PRRSV病毒感染Marc145細胞的條件優(yōu)化。
①病毒感染量(MOI)及收毒時間的確定。不同的感染復數(shù)對PRRSV增殖效價的影響結果如表2所示。過高或過低的感染復數(shù)(5和0.01)均導致較低的PRRSV增殖效價,說明接毒劑量直接影響病毒的增殖效率。感染復數(shù)為0.10時可以獲得最高的PRRSV增殖效價,達到108.0TCID50/ml。此外各組試驗結果均顯示,接毒后48h的病毒效價均高于接毒后72 h的病毒效價,說明接毒后48h可以作為收獲病毒的最適時間。對上述工藝共進行3次驗證,在5L反應器中獲得比較穩(wěn)定的細胞生長及病毒增殖效果,病毒增殖效價均高于108.0TCID50/ml,優(yōu)于傳統(tǒng)的轉瓶生產(chǎn)效價。
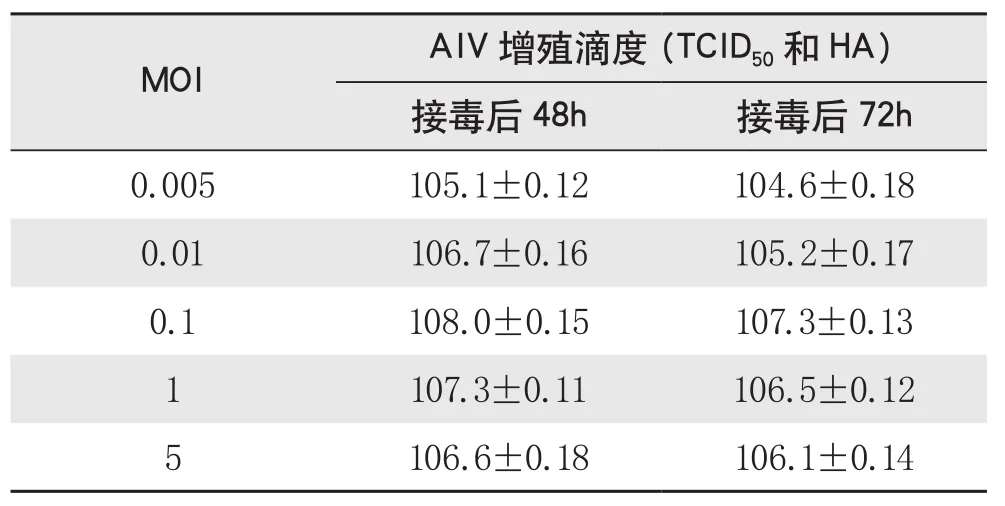
表2 不同感染復數(shù)(MOI)對PRRSV增殖效價的影響
②病毒維持液血清濃度的確定。分別選擇1.5%、2%、2.5%血清濃度維持液,培養(yǎng)結束后,分別對含毒細胞培養(yǎng)液的病毒含量進行測定,以確定最佳血清濃度的維持液。
實驗結果見表3,從表3可以看出,血清濃度對病毒的增值有一定的影響,當血清濃度為2%時,病毒含量為107.6TCID50/0.1ml,明顯高于血清濃度為1.5%時的病毒含量。但與2.5%和3.0%比較時,結果差異不顯著,因此選擇血清濃度為2%的維持液培養(yǎng)病毒。

表3 不同血清濃度維持液對病毒增殖的影響
6.高致病性豬繁殖與呼吸綜合征活疫苗的效力試驗。由表4的結果可以看出,本生產(chǎn)的活疫苗保護率在90%,而轉瓶生產(chǎn)的疫苗保護率為70%,實驗證明病毒懸浮培養(yǎng)生產(chǎn)的活疫苗比轉瓶生產(chǎn)的疫苗有更好的保護效果。
表4 活疫苗對PRRSV強毒攻擊的保護力
三、結論
實驗得出,用懸浮培養(yǎng)制備的活疫苗病毒含量高且免疫保護效果好,通過與傳統(tǒng)轉瓶培養(yǎng)病毒制備的疫苗免疫效果對比,免疫保護效力要顯著優(yōu)于傳統(tǒng)轉瓶制備的活疫苗對豬的免疫保護效力。懸浮培養(yǎng)PRRSV生產(chǎn)方法,體現(xiàn)了連續(xù)培養(yǎng)和規(guī)模化生產(chǎn)動物細胞和病毒的趨勢,與傳統(tǒng)的轉瓶培養(yǎng)工藝相比,具有病毒含量高、抗原效價提高顯著的優(yōu)點,且產(chǎn)品質(zhì)量均一;生產(chǎn)工藝簡化,產(chǎn)量大,提高生產(chǎn)效率,降低生產(chǎn)成本。
(略)

