miRNA211在人皮膚黑素瘤的表達及功能研究
徐妍 董達科 華海康 朱小紅
214002 江蘇,無錫市第二人民醫院腫瘤科(徐妍),皮膚科(董達科、華海康、朱小紅)
miRNA211在人皮膚黑素瘤的表達及功能研究
徐妍 董達科 華海康 朱小紅
214002 江蘇,無錫市第二人民醫院腫瘤科(徐妍),皮膚科(董達科、華海康、朱小紅)
目的探討miRNA211(miR?211)在惡性黑素瘤進展過程中的表達以及靶分子MMP?16與miR?211表達的相關關系。方法實驗分陰性對照組、空載體對照組、miR?211過表達組。TaqMan熒光定量PCR檢測miR?211在黑素細胞、黑素瘤細胞的表達,以及在痣、黑素瘤組織中的表達。SRB試驗和流式細胞儀分別檢測細胞增殖和細胞周期分布。甲基纖維素克隆形成試驗和Transwell遷移試驗研究細胞克隆形成和細胞遷移。用集落大小衡量克隆形成力,而同一遷移距離下的相對細胞數用來衡量細胞遷移能力。TaqMan熒光定量PCR檢測比較miR?211表達增加前后MMP?16 mRNA表達的變化。結果miR?211在黑素瘤細胞G361、C32和A375表達量分別是0.09± 0.02,0.000 52±0.000 20,0.000 03±0.000 01(F=10410,P<0.01)。miR?211在黑素瘤標本的表達量(0.17±0.03)顯著低于痣的表達量(0.87±0.08),t=9.118,P<0.01。在體外,miR?211表達上調的黑素瘤細胞miR?211過表達組與陰性對照組及空載體對照組比較,細胞增殖與細胞周期分布,差異無統計學意義。miR?211過表達組、空載體對照組的克隆形成力分別是0.49±0.05、0.85±0.09,兩組比較,差異有統計學意義(t=2.19,P<0.05)。miR?211過表達組、空載體對照組的克隆形成力分別是0.49±0.06、0.82±0.09,兩組比較,差異有統計學意義(t=3.15,P<0.05)。而空載體對照組與陰性對照組比較,差異無統計學意義。轉染miR?211 mimics后24 h,在miR?211過表達組和空載體對照組的MMP?16 mRNA水平比較分別是0.33±0.02和0.91±0.03,兩組比較,t=11.30,P<0.01;48 h分別是0.52±0.01和0.96±0.02,兩組比較,t=5.02,P<0.05;72 h分別是0.71±0.01和0.97±0.03,兩組比較,t=3.85,P<0.05。空載體對照組與陰性對照組在3個時間點的比較,差異均無統計學意義。結論miR?211在惡性黑素瘤的細胞水平和組織水平低表達。miR?211抑制黑素瘤細胞的錨著非依賴性生長及細胞的遷移。miR?211表達上調后,MMP?16 mRNA表達下調,可能是miR?211下游的靶分子從而影響黑素瘤的侵襲轉移。
黑色素瘤;微小RNAs;腫瘤轉移;基質金屬蛋白酶16;miRNA211
惡性黑素瘤是一種皮膚黏膜的惡性腫瘤。在世界范圍內,皮膚惡性黑素瘤發病率的年增長率3%~5%[1]。在我國每年新發病例約2萬[2]。2007年,國外兩個微小RNA(miRNA)芯片研究發現黑素瘤特異表達的 miRNA(miR)[3?4]。后續的基因芯片的實驗結果發現,miR?200家族、miR?211、miR?141、miR?182、miR?183等在皮膚黑素瘤組織、細胞水平特異性表達[5?6]。王震英等[7?8]發現,let?7a在黑素瘤中表達下降,且let?7a可抑制A375細胞增殖并促進A375細胞凋亡,同時下調caspase3蛋白表達。實驗證明,基質金屬蛋白酶(MMP)1、2、3、9、14、15、16在體內外均高表達,并表現出侵襲的表型[9]。通過Diana Tool(http://diana.imis.athena ?innovation.gr/DianaTools/index.php)篩選 miRNA211(miR?211)的靶基因時,我們發現在357個預測靶分子MMP?16排在17位,尚無實驗相關數據。因此,我們初步探討了miR?211新的靶分子MMP?16與miR?211表達的相關關系。
資料與方法
一、臨床資料
收集2010—2012年經組織病理學確診18例痣中,男10例,女8例;年齡23~71歲,中位年齡50.5歲。2002—2012年經病理組織學確診41例黑素瘤石蠟切片。41例黑素瘤患者中男23例,女18例。年齡31~74歲,中位年齡53.3歲。
二、主要材料
原代黑素細胞HER1及惡性皮膚黑素瘤細胞A375、C32、G361、MelM培養基及補充物(美國ATCC公司)。MEM、DMEM培養基、胎牛血清、OPTI?MEM無血清培養基和胰蛋白酶細胞培養所需試劑(美國Gibco公司)。細胞總RNA(Trizol,美國Invitrogen公司)和組織總RNA(Recover AllTM,美國Ambion公司)抽提試劑。轉染試劑(siPORTNeoFX Transfection Agent)、miRNATaqMANqPCR 試 劑、MMP?16 Taq Man Assay、miR?211類似物、miR?Scramble空載體對照試劑(美國Applied Biosystems公司)。Matrigel?基底膜基質(美國BD Biosciences公司)。甲基纖維素(美國RD System公司)。
三、方法
1.細胞培養、轉染及轉染效率檢測:將人黑素細胞系接種于MelM培養基,人黑素瘤細胞系接種于DMEM培養基,隨后置于37℃、5%CO2的恒溫箱中培養,隔日換液或傳代培養。選擇A375細胞進行下游功能實驗。按說明書要求以等量OPTI?MEM無血清培養基對miR?211類似物或空載體對照進行稀釋。后將轉染試劑與上述稀釋的小RNA按要求混勻、靜置后加入待用培養板。最后將對數生長期的A375細胞接種于含有上述小RNA和轉染試劑混液的培養板中。接種濃度參考12孔板1×105/孔,6孔板2×105/孔濃度。培養基每天更換。轉染效率的檢測使用FAM?labelled Pre?miR的陰性對照,通過流式細胞儀檢測熒光吸收率來確定轉染效率。
2.各細胞及組織的RNA抽提及cDNA合成:按照Trizol和RecoverAllTM說明書步驟抽提各株細胞總RNA和組織中的總RNA,取RNA于紫外分光度計下檢測260 nm和280 nm的吸光度(A值),A260/280為1.8~2.1時,符合純度要求。按照miRNA反轉錄試劑盒說明書合成cDNA。
3.實時定量PCR檢測miR?211和MMP?16的表達:miR?92在黑素瘤及黑素細胞表達穩定性高于其他內參照,因此選擇miR?92作為miRNAqPCR的內參照,β肌動蛋白作為mRNA表達檢測的內參照。將合成的cDNA稀釋10倍,再按qPCR說明書配制反應體系,通用引物由試劑盒提供,每個樣本設置3個復孔取均值。PCR反應步驟:95℃10 min,95 ℃ 15 s,60 ℃ 1 min,40個循環。miR?211序列:UUCCCUUUGUCAUCCUUCGCCU。記錄各實驗孔的 Ct值,目的基因的相對表達量 F=2?ΔΔCt,其中ΔCT=CT目的基因?CT內參基因,ΔΔCT= ΔCT實驗組-ΔCT對照組,2-ΔΔCt表示目的基因相對于對照組的表達倍數。
4.細胞增殖、細胞周期檢測:實驗設陰性對照組、空載體對照組、miR?211過表達組。每組重復16孔,重復3次實驗。以1 000~1 500個細胞/孔濃度接種于96孔板,每組有16個復孔。實驗檢測24、48、72、96 h。磺酰羅丹明B(SRB)實驗步驟如下:每孔加入50 μl 25%(V/V)TCA,4℃孵育不少于1 h。用水清洗96孔板10 min,自然干。加入50 μl的0.057%(W/V)SRB溶液,室溫孵育30 min。用1%(V/V)150 μl乙酸洗板4次,自然干。最后每孔加入150 μl 10 mmol/L Tris溶液(pH 10.5)振蕩孵育1 h,在A510 nm讀板獲取數據。
碘化丙錠檢測細胞周期:上述3個組每組2管重復3次取均值。用胰酶消化轉染后的A375細胞。隨后用PBS沖洗、離心細胞各2次。新細胞團重懸于檸檬酸緩沖液并保存在-20℃。在FACS檢測前將細胞檸檬酸緩沖液中先后加入一定量的A溶液混合2 min、B溶液10 min及C溶液10 min后,此時的細胞混合液即可行FACS細胞周期檢測。該實驗分別檢測了轉染后24、48、72 h的細胞周期分布情況。
5.克隆形成實驗:克隆的大小用來衡量克隆形成力。上述3個組每組2孔重復3次取均值。分別檢測轉染后第1、3、6、9、12天的克隆大小。具體步驟:將1.8%(W/V)瓊脂糖膠溶液加熱至沸,液態的瓊脂糖膠與2×MEM培養基按1∶1比例混合,在6孔板中每孔加入2 ml的上述混合液,室溫放置使其凝固。將甲基纖維素溶液與2×MEM按說明書要求的比例混合。隨后將轉染后16~18 h的細胞與甲基纖維素培養基按比例混合。以每孔2 ml甲基纖維素細胞混合液加入到準備好的瓊脂糖膠6孔板,每孔細胞量為5 × 103~ 104個。第1、3、6、9、12天在顯微鏡下觀察攝片。每實驗孔計算30個克隆大小的均值。Image J軟件計算克隆大小,Gel Doc計算每孔的克隆數量。
6.Transwell細胞遷移實驗:上述3個組每組2孔重復3次取均值。先將Matrigel在冰上慢慢溶解,PBS和Matrigel按1∶1比例混勻。在插有Transwell的24孔板中每孔加入100 μl上述混合液。24孔板在37℃孵育箱孵育30 min使得Matrigel在Transwell底部凝固。將轉染后16~18 h的細胞按(1~4)×105/ml濃度與培養基混合制成細胞混懸液。當Matrigel凝固后將Transwell倒置。再將每孔100 μl的細胞混懸液加到Transwell的底部過濾膜上,然后將倒置的板放入細胞培養箱2~4 h。此時細胞粘附在細胞板,將細胞板正置。隨后用無血清培養基浸洗每個Transwell孔3次。最后在Transwell每孔里加入100 μl含血清的常規培養基。上述含有Transwell的24孔板放入孵育箱培養5 d。每日更換常規培養基。觀察攝片前對細胞進行固定和染色。共聚焦顯微鏡成像系統按每10 μm間隔進行掃描攝片,Image J軟件處理后續的圖像數據。使用相對細胞數對3組進行細胞遷移力的比較。相對細胞數是指將進行細胞計數的40 μm處細胞數/0 μm處細胞數,這樣可以排除因初始加細胞人為造成的細胞數量不同的誤差。
7.統計分析:用GraphPad Prism Version 5.0軟件進行數據分析。計量資料以±s表示。計量資料的的兩兩比較采用Studentt檢驗,多組比較采用單因素方差分析。以P<0.05為差異有統計學意義。
結 果
一、miR?211在黑素細胞和黑素瘤細胞的表達
miR?211在3株黑素瘤細胞G361、C32、A375的表達量相比黑素瘤細胞HER1分別是0.09±0.02、0.000 52±0.000 2、0.000 03±0.000 01(F=10 410,P<0.01)。miR?211在3株黑素瘤細胞的表達量相比黑素細胞顯著下降,尤其是在A375細胞中,miR?211的表達量僅是黑素細胞的萬分之一。
二、miR?211在痣與黑素瘤組織標本的表達
miR?211在痣的表達量0.87±0.08(n=18),在黑素瘤的表達量0.17±0.03(n=41),兩者比較差異有統計學意義(t=9.118,P<0.01)。同樣的,miR?211在黑素瘤組織中的表達量比痣組織的表達量減少了80%。
三、miR?211類似物轉染A375細胞的轉染效率及轉染后miR?211的表達
用含有熒光蛋白的空載體小RNA轉染人黑素瘤A375細胞24、48、72 h后,用FACS檢測轉染效率,轉染效率超過80%。體外轉染miR?211類似物至A375細胞后通過熒光qPCR方法測得miR?211表達上調百萬倍。
四、miR?211過表達后細胞增殖、細胞周期分布
miR?211過表達組與陰性對照組、空載體對照組在細胞增殖和細胞周期的比較,差異均無統計學意義,見表1,2。在本實驗中沒有發現miR?211的上調能夠影響A375細胞的增殖及凋亡。
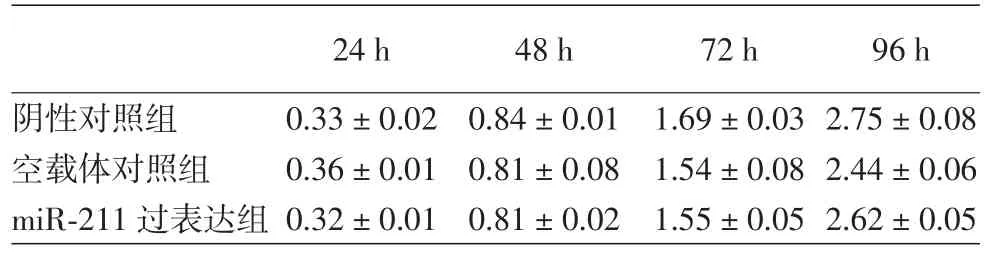
表1 3個組A375瘤細胞細胞增殖的情況
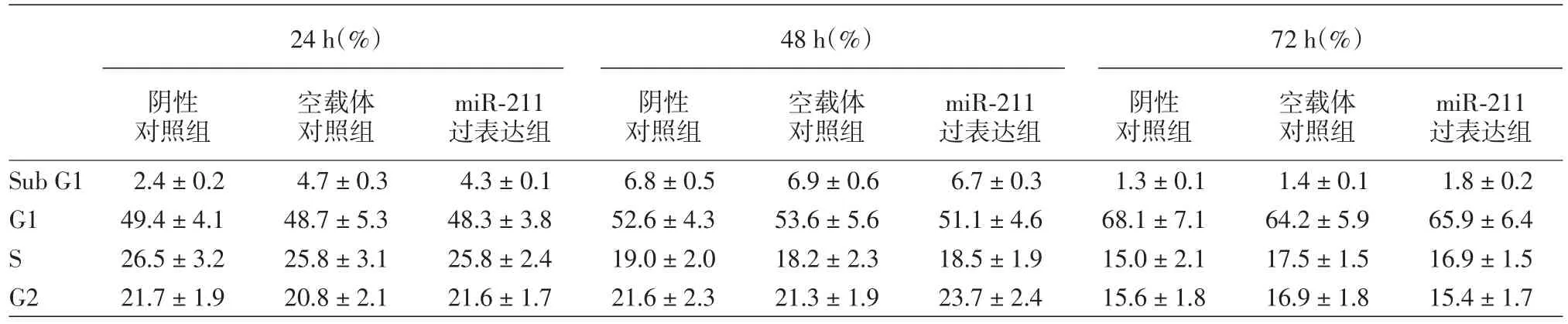
表2 3個組A375瘤細胞細胞周期的情況
五、miR?211過表達后細胞克隆形成力及侵襲力
1.克隆形成試驗:第6天,miR?211過表達組、空載體對照組的克隆形成力分別是0.49±0.05、0.85±0.09,兩組比較,差異有統計學意義(t=2.19,P<0.05,圖1A~1C);陰性對照組和空載體對照組的差異無統計學意義(t=1.83,P>0.05)。在A375細胞中,miR?211的過表達使得腫瘤細胞克隆較miR?211未過表達瘤細胞的克隆縮小了43%。第12天,可見miR?211過表達組克隆個數(305)明顯少于陰性對照組(770)、空載體對照組的克隆數量(547)(圖1D~1F)。
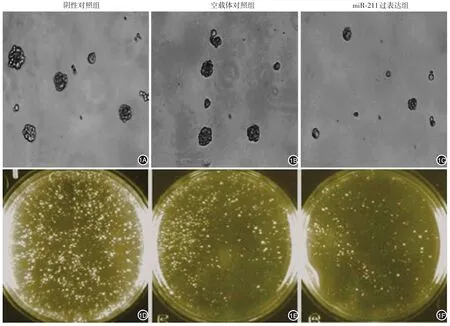
圖1 甲基纖維素實驗比較轉染后第6天陰性對照組、空載體對照組和miR?211過表達組A375細胞的致瘤能力 1A~1C:每組隨機選取30個克隆,并計算出每個克隆大小的±s(×100);1D~1F:GelDoc拍攝了1組實驗在觀察至轉染后第12天,3個組細胞克隆的數量大體觀
2.Transwell細胞遷移試驗:實驗發現,轉染后第5天miR?211過表達組、空載體對照組的細胞遷移力分別是0.49±0.06、0.82±0.09,兩組比較差異有統計學意義(t=3.153,P<0.05)。陰性對照組和空載體對照組的差異無統計學意義(t=1.046,P>0.05,圖2)。在A375細胞中,miR?211的過表達使得細胞遷移的距離顯著小于miR?211未過表達的瘤細胞,腫瘤細胞遷移距離縮短了41%。
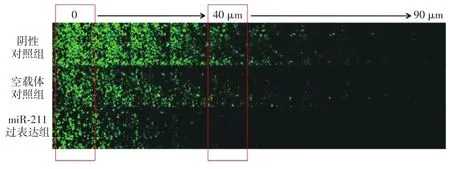
圖2 Transwell細胞遷移實驗比較陰性對照組、空載體對照組和miR?211過表達組3個組A375細胞的侵襲轉移能力。轉染后第5天,3個組從40 μm的這層開始miR?211過表達組的相對細胞數量與陰性對照組和空載體對照組比較,差異有統計學意義(相對細胞數是將進行細胞計數的40 μm處細胞數/0 μm處細胞數)。每組均隨機選6個視野中細胞數的±s。共聚焦顯微鏡拍攝0~90 μm共100 μm長的距離。每層厚度10 μm
六、miR?211過表達后MMP?16 mRNA的表達
24 h后,空載體對照組和miR?211過表達組相對表達量分別是0.91±0.03、0.33±0.02,兩組比較,t=11.3,P<0.01。48 h后的相對表達量分別是0.96±0.02、0.52±0.01,兩組比較,t=5.02,P<0.05。72 h后的相對表達量分別是0.97±0.03,0.71±0.01,兩組比較,t=3.85,P< 0.05。陰性對照組和空載體對照組的MMP?16 mRNA表達差異無統計學意義。miR?211過表達組的MMP?16的表達量在轉染后3 d內均顯著減少。在A375瘤細胞,MMP?16在miR?211過表達后24 h表達量減少了近60%。上述結果提示miR?211與MMP?16表達呈負相關。
討 論
研究發現,miRNA除了能夠精確地確定單一腫瘤的類型[10],還能夠發揮重要的抑癌基因和(或)原癌基因的作用。因此,miRNA不僅可以成為新型的生物標志物,進一步研究特異表達的miRNA可以為腫瘤的臨床治療提供新的方向。
通過已發表的miRNA基因芯片的研究結果,我們挑選了一些特異表達的miRNA進行表達的檢測及功能的研究。我們發現miR?211在惡性黑素瘤細胞和黑素瘤組織中均顯著低表達。而有些miRNA,比如miR?205、23b它們在黑素瘤組織和黑素瘤細胞中表達情況并不一致[5]。在功能實驗中,我們進一步發現增加miR?211在黑素瘤中的表達顯著降低了黑素瘤細胞的克隆形成力和腫瘤侵襲力,但并未影響腫瘤細胞的增殖及細胞周期分布,這與Boyle實驗組的結果一致[11]。而Mazar等[12]實驗發現miR?211同時影響腫瘤細胞增殖和侵襲轉移。我們的實驗結果雖然沒有發現miR?211的上調能夠影響A375細胞的增殖及凋亡,但細胞克隆的形成除了表現在細胞增殖外,還表現在細胞錨著非依賴性生長能力方面。我們實驗的陽性結果說明miR?211在抑制腫瘤發生發展中的作用主要表現在抑制細胞錨著非依賴性生長的特性上。
國外研究發現,miR?211的直接靶基因,如IGF2R、TGFBR2、NFAT5和NUAK1與細胞周期、免疫調節及侵襲轉移息息相關[13?14]。在尋找miR?211新的靶基因的過程中我們選擇了MMP?16。除了在篩選miR?211的預測靶基因MMP?16排位較高以外還結合MMP?16本身在腫瘤的作用。MMP?16與在多種侵襲性強的惡性腫瘤高表達的MMP?14不同,它僅在部分侵襲性高的結節型惡性腫瘤如膠質瘤、肝癌、胃癌及黑素瘤高表達[15]。研究發現,MMP?16在黑素瘤作為一種基質依賴的調節因子影響黑素瘤的侵襲轉移。它的表達與快速纖維蛋白侵襲有關,從而限制膠原的侵襲,且必須依賴MMP?14來促進結節型細胞的增殖[15]。MMP?16還被認為是黑素瘤的不良預后因子。本研究初次探討了MMP?16與miR?211在黑素瘤表達的相關關系,發現MMP?16在miR?211的表達呈負相關。miR?211與MMP?16的相關關系是如何進一步影響黑素瘤的發生發展尚待進一步研究。
[1]Lens M.Current clinical overview of cutaneous melanoma[J].Br J Nurs,2008,17(5):300 ?305.DOI:10.12968/bjon.2008.17.5.28825.
[2]CSCO黑素瘤專家委員會.中國黑素瘤診治指南(2011版)[J].臨床腫瘤學雜志,2012,17(2):159?171.DOI:10.3969/j.issn.1009?0460.2012.02.015.Melanoma Committee of CSCO.Guidelines for the diagnosis and treatment of melanoma(2011)[J].Chin Clin Oncol,2012,17(2):159?171.DOI:10.3969/j.issn.1009?0460.2012.02.015.
[3]Gaur A,Jewell DA,Liang Y,et al.Characterization of microRNA expression levels and their biological correlates in human cancer cell lines[J].Cancer Res,2007,67(6):2456 ?2468.DOI:10.1158/0008?5472.CAN?06?2698.
[4]Blower PE,Verducci JS,Lin S,et al.MicroRNA expression profiles for the NCI?60 cancer cell panel[J].Mol Cancer Ther,2007,6(5):1483?1491.DOI:10.1158/1535?7163.MCT?07?0009.
[5]Philippidou D,Schmitt M,Moser D,et al.Signatures of microRNAs and selected microRNA target genes in human melanoma[J].Cancer Res,2010,70(10):4163?4173.DOI:10.1158/0008?5472.CAN?09?4512.
[6]Mueller DW,Rehli M,Bosserhoff AK.miRNA expression profiling in melanocytes and melanoma cell lines reveals miRNAs associated with formation and progression of malignant melanoma[J].J Invest Dermatol,2009,129(7):1740?1751.DOI:10.1038/jid.2008.452.
[7]王震英,張捷,王焱,等.微小RNA?let?7a對黑素瘤細胞系A375細胞凋亡的影響[J].中華皮膚科雜志,2010,43(8):575?578.DOI:10.3760/cma.j.issn.0412?4030.2010.08.020.Wang ZY,Zhang J,Wang Y,et al.Effect of microRNA?let?7a on apoptosis in melanoma cell line A375[J].Chin J Dermatol,2010,43(8):575?578.DOI:10.3760/cma.j.issn.0412?4030.2010.08.020.
[8]王震英,王焱,薛燕寧,等.let?7a微小RNA在黑素瘤中的表達及其對A375細胞增殖的影響[J].中華皮膚科雜志,2010,43(5):358?361.DOI:10.3760/cma.j.issn.0412?4030.2010.05.021.Wang ZY,Wang Y,Xue YN,et al.Expression of microRNA let?7a in melanoma and its effect on the proliferation of A375 human melanoma cell line[J].Chin J Dermatol,2010,43(5):358?361.DOI:10.3760/cma.j.issn.0412?4030.2010.05.021.
[9]Ntayi C,Hornebeck W,Bernard P.Involvement of matrix metallo?proteinases(MMPs) in cutaneous melanoma progression[J].PatholBiol(Paris),2004,52(3):154?159.DOI:10.1016/j.patbio.2004.02.002.
[10]Zhang B,Pan X,Cobb GP,et al.microRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1 ?12.DOI:10.1016/j.ydbio.2006.08.028.
[11]Boyle GM,Woods SL,Bonazzi VF,et al.Melanoma cell invasi?veness is regulated by miR?211 suppression of the BRN2 transcription factor[J].Pigment Cell Melanoma Res,2011,24(3):525?537.DOI:10.1111/j.1755?148X.2011.00849.x.
[12]Mazar J,DeYoung K,Khaitan D,et al.The regulation of miRNA?211 expression and its role in melanoma cell invasiveness[J].PLoS One,2010,5(11):e13779.DOI:10.1371/journal.pone.0013779.
[13]Levy C,Khaled M,Iliopoulos D,et al.Intronic miR?211 assumes the tumor suppressive function of its host gene in melanoma[J].Mol Cell,2010,40(5):841 ?849.DOI:10.1016/j.molcel.2010.11.020.
[14]BellRE,KhaledM,NetanelyD,etal.Transcription factor/microRNA axis blocks melanoma invasion program by miR?211 targeting NUAK1[J].J Invest Dermatol,2014,134(2):441 ?451.DOI:10.1038/jid.2013.340.
[15]Tatti O,Arjama M,Ranki A,et al.Membrane?type?3 matrix metalloproteinase(MT3?MMP)functions as a matrix composition?dependent effector of melanoma cell invasion[J].PLoS One,2011,6(12):e28325.DOI:10.1371/journal.pone.0028325.
Expression and function of miRNA211 in human cutaneous melanoma
Xu Yan,Dong Dake,Hua Haikang,Zhu Xiaohong
Department of Oncology,Wuxi No.2 People′s Hospital,Wuxi 214002,China(Xu Y);Department of Dermatology,Wuxi No.2 People′s Hospital,Wuxi 214002,China(Dong DK,Hua HK,Zhu XH)
ObjectiveTo determine the expression of miRNA211(miR?211)in the development of malignant melanoma,and to investigate the correlation between miR?211 and its target molecule,matrix metalloproteinase 16(MMP?16).MethodsCultured A375 melanoma cells were divided into 3 groups:miR?211 overexpression group and mock?vehicle group transfected with miR?211 mimics and empty vehicle respectively,and negative control group receiving no treatment.TaqMan fluorescence?based quantitative PCR was performed to determine the expression of miR?211 in HER1 primary melanocytes,A375,C32 and G361malignant melanoma cell lines,as well as in nevus tissues(n=18)and melanoma tissues(n=41),and to evaluate changes of MMP?16 mRNA expression in A375 cells before and after the overexpression of miR?211.Sulforhodamine B(SRB)assay and flow cytometry were conducted to evaluate cellular proliferative activity and determine cell cycle distribution respectively,and methylcellulose assay and Transwell assay to evaluate colony formation and cell migration abilities respectively.The size of selected colonies was used to represent colony formation ability,while the ratio of the number of migrating cells to that of non?migrating cells to represent cell migration ability.ResultsThere were significant differences in the expression level of miR?211 among the G361,C32 and A375 cells(0.09±0.02vs.0.000 52±0.000 20vs.0.000 03±0.000 01,F=10 410,P<0.01).The expression of miR?211 was significantly decreased in melanoma tissues compared with nevus tissues(0.17±0.03vs.0.87±0.08,t=9.118,P<0.01).No significant differences were observed in cellular proliferative activity or cell cycle distribution among the miR?211 overexpression group,mock?vehicle group and negative control group.Compared with the mock?vehicle group,the miR?211 overexpression group showed significantly suppressed colony formation(0.49±0.05vs.0.85±0.09,t=2.19,P<0.05)and cell migration(0.49±0.06vs.0.82±0.09,t=3.15,P<0.05)abilities,while no significant difference was observed between the mock?vehicle group and negative control group.Additionally,the mRNA expression of MMP?16 significantly decreased in the miR?211 overexpression group compared with the mock?vehicle group after transfection(24 hours:0.33±0.02vs.0.91±0.03,t=11.30,P<0.01;48 hours:0.52±0.01vs.0.96±0.02,t=5.02,P<0.05;72 hours:0.71±0.01vs.0.97±0.03,t=3.85,P<0.05),with no significant difference between the mock?vehicle group and negative control group at the above time points.Conclusions miR?211 was lowly expressed in both malignant melanoma cells and tissues,and it could inhibit both anchorage?independent growth and migration of melanoma cells.After up?regulation of miR?211 expression,the mRNA expression of MMP?16 decreased in A375 cells,suggesting that MMP?16 may be a downstream target of miR?211,and can influence melanoma metastasis.
Melanoma;MicroRNAs;Neoplasm metastasis;Matrix metalloproteinase 16;miRNA211
Zhu Xiaohong,Email:zxh6801@126.com
2015?11?30)
(本文編輯:吳曉初)
朱小紅,Email:zxh6801@126.com
10.3760/cma.j.issn.0412?4030.2016.09.006
南京醫科大學重點項目(2013NJMU193)
Fund program:Major Project of Nanjing Medical University(2013NJMU193)

