自噬:細胞的“清道夫”——2016年諾貝爾生理學或醫學獎簡介
劉 佳 楊 慧
(首都醫科大學基礎醫學院神經生物學系 北京腦重大疾病研究院,北京 100069)
?
· 諾貝爾獎 ·
自噬:細胞的“清道夫”
——2016年諾貝爾生理學或醫學獎簡介
劉佳楊慧*
(首都醫科大學基礎醫學院神經生物學系北京腦重大疾病研究院,北京 100069)
2016 年諾貝爾生理學或醫學獎頒發給日本國籍科學家大隅良典(Yoshinori Ohsumi),以表彰他在自噬分子機制研究中所做出的卓越貢獻。
自噬;諾貝爾生理學或醫學獎; 大隅良典
2016年10月3日,瑞典卡羅林斯卡醫學院宣布,將本年度諾貝爾生理學或醫學獎授予日本東京工業大學的大隅良典(Yoshinori Ohsumi)教授,以表彰他在自噬反應領域中所做出的卓越貢獻。他的工作不但揭示了一種基本的細胞機能,同時更為多種疾病的分子機制研究鋪平了道路,包括癌癥、神經退行性疾病、糖尿病、心肌病等。
自噬,是一種細胞對自身成分進行降解并回收利用的基本過程。通俗地說,細胞可以既通過降解自身的非必需成分來回收利用營養和能量,同時也可以通過降解一些毒性成分以阻止細胞損傷,從而維持細胞穩態。由此可知,自噬并不只發生于病變的細胞里,而是廣泛發生于所有細胞中。它好比一個清潔工,隨時都要工作,把細胞內不需要的或有毒性的蛋白質聚集體、耗竭的細胞器及時清除,從而保持細胞的清潔并維持細胞內的穩態。然而,自噬的活性會隨著衰老的過程而逐漸減弱,因此衰老的細胞中通常會堆積一系列受損的細胞器、蛋白聚集體等,從而影響細胞的正常功能。這也將自噬和癌癥、神經退行性疾病等密切的聯系了起來。那么,提高自噬水平就可以抵抗衰老嗎?事實并非如此,自噬是一把“雙刃劍”,適度的自噬是細胞的清道夫,可以維持細胞的正常功能,然而過度的自噬卻可以加速細胞的死亡。因此,為了能夠更好地使用這把“雙刃劍”,科學家們開始有了一系列的疑惑:自噬的分子機制是什么?自噬如何被調節?是否可以通過調節自噬而干預疾病的進展?大隅良典教授對自噬分子機制的研究打開了自噬這個未知領域的大門,諾貝爾生理學或醫學獎評委會主席朱琳·吉拉斯這樣評價大隅良典的研究成果:曾經,人們一直認為溶酶體是細胞內的垃圾場,但直到大隅良典的研究問世后,才讓人們意識到這并不是一個簡單的垃圾場,而是一個擁有著復雜巧妙工作機制的回收站。
1 獲獎者簡介
大隅良典(圖1)于1945年2月9日出生于日本福岡,現任日本東京工業大學前沿科學研究中心教授,是日本著名的分子細胞生物學家,多年來致力于細胞自噬機制的研究。大隅良典分別于1967年和1974年在東京大學獲得學士和博士學位,1974至1977年在紐約洛克菲勒大學進行博士后研究工作。1977年,大隅良典返回日本東京大學任職。1996年,大隅良典到日本國家生物學研究所任教授。自2009年開始,大隅良典開始任日本東京工業大學前沿科學研究中心教授,2014年被評為該校榮譽教授。大隅良典教授是自噬分子機制和生理學功能研究的先驅者和奠基人,他的研究團隊主要以酵母為模式生物,發現多個自噬相關基因(autophagy related gene),并闡明了其功能,為自噬的研究發展做出了杰出的貢獻。大隅良典教授團隊發表高水平科研論文200余篇,曾獲得“Fujihara Award”、“Japan Academy Prize”、“Kyoto Prize”、“Gairdner Foundation International Award”“International Prize for Biology”“Wiley Prize in Biomedical Sciences”等重要獎項。大隅良典教授現為歐洲分子生物學組織(European Molecular Biology Laboratory, EMBO)、日本分子生物學學會、美國細胞學學會等成員,并擔任多個國際知名學術期刊的編委。

圖1 大隅良典教授
2 主要科學貢獻
20世紀中期, 比利時生物學家Christian de Duve在細胞內發現了溶酶體結構,這個結構好比細胞內的回收站,專門負責回收細胞內多余或耗竭的組分。正是因為發現了溶酶體,Christian de Duve教授于1974年獲得了諾貝爾生理學或醫學獎。1963年,自噬一詞也是被Christian de Duve教授第一次所定義,該詞的詞源是auto(自)和phagein(吃)。顧名思義,自噬是指細胞自我消化的方式。這是一種十分奇妙的現象,即當細胞處于特定條件(如饑餓)中,會通過細胞內一些膜性結構發生的微妙的變化,形成一個布袋樣結構,將細胞內的某些胞質、蛋白質或細胞器包裹起來并降解掉,從而滿足細胞所需要的能量并維持細胞穩態(圖2)。

圖2 自噬溶酶體降解通路[1]
由內質網、高爾基體、線粒體等脫落的雙層膜包裹部分細胞質和胞內待降解的細胞器、蛋白質成分形成自噬小體(autophagosome),后者與溶酶體融合形成自噬溶酶體(autolysosome),從而降解其所包裹的內容物,以滿足細胞本身的能量代謝需要及細胞器的更新。
1)主要成就:盡管自噬早在1963年便被定義,但這個領域卻沒有被科學家們廣泛關注,因為當時絕大多數的研究者們將重點集中在了另一種蛋白降解途徑上,即泛素蛋白酶體系統(ubiquitin proteasome system, UPS)。然而,隨著UPS研究的深入,研究者們逐漸發現這種過程雖然可以有效的降解細胞內小分子的可溶性蛋白,但是卻不能清除大分子的蛋白復合體或耗盡的細胞器。因此便引出了科學家們的疑惑,即這些大分子蛋白或細胞器是不是可以通過自噬清除呢?如果可以,那么自噬的機制是什么? 基于這些問題,研究者們逐漸開始關注并探索自噬的分子機制,但是在這一研究的道路上困難重重,以至于在很長一段時間內,有關自噬過程的分子機制始終是一個謎。直到20世紀90年代初期,大隅良典通過一系列精妙的實驗闡述了酵母細胞中自噬的分子機制,從而開啟了自噬分子機制研究的大門(圖3)。
自1988年大隅良典教授留學回國并創立了自己的實驗室后,他便把研究方向集中到了蛋白質在液泡中的降解過程上,液泡是酵母細胞中的一種功能類似于溶酶體的細胞器。然而在大隅良典的研究的開始階段,他便遇到了一個科學難題:酵母細胞非常小,現有的顯微技術很難清楚地觀察到其內部結構,因此便無法確定在酵母細胞中是否同樣存在自噬現象。為了解決這個難題,他試圖破壞自噬過程中最后一步的降解過程,即阻斷液泡對蛋白質的分解,這樣如果自噬小體可以形成但又不會被降解,就會大量堆積在細胞內,從而便容易被觀察到了。直到1992年,大隅良典教授找到了一種因突變而缺乏液泡降解酶的酵母細胞株,并且發現在饑餓的情況下,短短幾個小時內,這種突變的酵母細胞內便出現大量囊泡樣結構,這些結構正是自噬體(圖4)。大隅良典的實驗第一次證明了在酵母細胞中同樣存在自噬現象,這也成為了自噬領域的一個突破性發現,相關實驗結果發表在了JCellBiol雜志上[3]。隨后,大隅良典大膽猜想在細胞自噬過程中是否存在某個或某幾個關鍵基因,如果突變了這些基因,自噬是不是就會被阻斷了呢?基于這個想法,大隅良典決定進行突變株篩選,并在1993年成功找到了一批與自噬相關的酵母突變體[4]。4年后,大隅良典教授的研究團隊成功克隆出了ATG1基因[5]。2000年,大隅良典教授在EMBOJ上發表論文,闡述了微管相關蛋白LC3(ATG8)在自噬體膜表面的定位及其相關功能,這篇論文至今共被引用4 200余次,成為了自噬研究領域的另一里程碑[6]。之后,30余個ATG基因陸續被發現,隨之,與自噬相關的信號通路也漸漸被闡明。近年來,當絕大部分科學家不斷探索自噬產生的后果以及與疾病的關系時,大隅良典的團隊另辟蹊徑,仍將目光集中于自噬的發生層面。他們通過對酵母的研究發現,促進自噬過程的ATG13蛋白會與其他4種蛋白質通過網狀結構進行連接形成一個巨大的細胞自噬啟動裝置。這個裝置能通過創造出雙層膜結構,招募待分解物質。這個研究成果對于預防和治療與自噬紊亂相關的癌癥或神經退行性疾病都有著重要意義[7]。
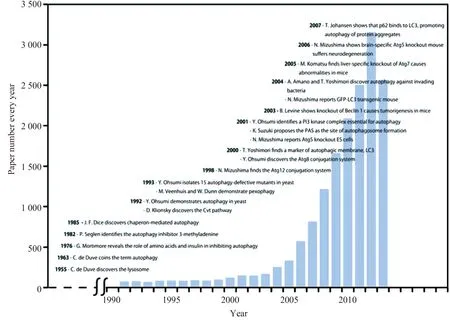
圖3 自噬研究論文數量[2]

圖4 饑餓狀態下酵母細胞體內自噬小體[3]
氮缺乏培養基處理BJ3505細胞2h后細胞形態學改變。A.低倍鏡下; B. 高倍鏡下。AB:自噬小體,V:液泡。
2)科學意義:(1)該研究開啟了自噬分子機制研究的大門。自1963年自噬被定義以來,至今已經50余年。但在早期,這個未知的領域并沒有被科學家們過多的關注,直到20世紀90年代初,大隅良典的開拓性研究問世后,自噬機制在生理及醫學研究中的核心重要性才廣泛被人們意識到。同時,大隅良典對于Atg1和LC3的克隆及功能學研究也為后續自噬相關基因的發現、自噬通路的分子機制研究以及干預奠定了基礎。(2)該研究有助于探究癌癥、神經退行性疾病等病理機制,并為這些疾病的治療提供了新的思路。在大隅良典以及其他研究者的努力下,細胞自噬的分子機制及其功能也漸漸被闡明。細胞可以通過自噬為自身提供能量、更新組件,然而自噬的紊亂也在一系列疾病的致病機制中起著舉足輕重的作用,尤其是癌癥和神經退行性疾病。
自噬與癌癥:對于癌癥來說,自噬是一把雙刃劍。在腫瘤產生過程中,細胞內的氧化損傷會導致蛋白損傷及堆積,而后者又會進一步造成DNA損傷,DNA損傷無法修復便會導致癌變,這種情況下,良好的自噬系統可以抑制正常細胞的惡性轉化以及腫瘤的發生。然而當癌癥患者接受了放射治療或化學藥物治療后,奄奄一息的癌細胞又可能通過自噬系統而存活下來,從而使癌癥無法根治,這又使得自噬促進了癌細胞的生存以及疾病的發展。因此適時適當的調節自噬成為了攻破癌癥的一個可行的方向[8]。
自噬與神經退行性疾病:由于自噬能夠清除細胞中的大量殘渣和受損的細胞器,因此對于神經元這種長壽細胞,自噬的作用便顯得尤為重要。伴隨著衰老的進程,神經退行性疾病的發病率逐漸升高,包括阿爾茨海默病(Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease, PD)等。然而,這些疾病典型的病理改變與蛋白質的堆積密切相關,包括β-淀粉樣蛋白(Aβ)、tau蛋白、α-突觸核蛋白(α-synuclein, α-syn)等。因此,研究人員普遍認為自噬功能的紊亂與神經退行性疾病的發生發展密切相關,調節細胞內的自噬水平也可能成為一種有效的疾病干預手段[9]。
3)諸多相關問題有待揭示:大隅良典在接受諾貝爾媒體采訪時對其首席科學官 Adam Smith說道:自噬仍是一個未知的領域,現在這個領域需要解決的問題看上去比我開始研究時還要多!因此,盡管大隅良典為自噬分子機制的研究奠定了堅實的基礎,但人們對自噬的了解仍然只是冰山一角。在這個領域中仍有許多問題有待澄清?如自噬體膜的來源、降解底物的識別性、特殊細胞器如線粒體自噬的分子機制等。因此,細胞自噬的大門才剛剛打開,一個龐大的未知世界等著我們去探索。
總之,大隅良典在自噬領域做出的杰出貢獻開啟了科學家們揭示細胞循環自身內容物的新紀元,為理解機體內許多生理學過程鋪平了道路,為癌癥、神經退行性疾病的治療迎來了曙光。
[1]Lamb C A, Yoshimori T, Tooze S A. The autophagosome: origins unknown, biogenesis complex[J]. Nat Rev Mol Cell Biol, 2013, 14(12): 759-774.
[2]Ohsumi Y. Historical landmarks of autophagy research[J]. Cell Res, 2014, 24(1): 9-23.
[3]Takeshige K, Baba M, Tsuboi S, et al. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction[J]. J Cell Biol, 1992, 119(2): 301-311.
[4]Tsukada M, Ohsumi Y. Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae[J]. FEBS Lett, 1993, 333(1-2): 169-174.
[5]Matsuura A, Tsukada M, Wada Y, et al. Apg1p, a novel protein kinase required for the autophagic process in Saccharomyces cerevisiae[J]. Gene, 1997, 192(2): 245-250.
[6]Kabeya Y,Mizushima N, Ueno T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21): 5720-5728.
[7]Yamamoto H, Fujioka Y, Suzuki S W, et al. The Intrinsically Disordered Protein Atg13 Mediates Supramolecular Assembly of Autophagy Initiation Complexes[J]. Dev Cell, 2016, 38(1): 86-99.
[8]Mowers E E, Sharifi M N, Macleod K F. Autophagy in cancer metastasis[J]. Oncogene, 2016.doi: 10.1038/onc.2016.333. [Epub ahead of print].
[9]Menzies F M, Fleming A, Rubinsztein D C. Compromised autophagy and neurodegenerative diseases[J]. Nat Rev Neurosci, 2015, 16(6): 345-357.
編輯陳瑞芳
, E-mail:huiyang@ccmu.edu.cn
Autophagy:intracellular “scavenger”—— introduction of Nobel Prize in Physiology or Medicine 2016
Liu Jia, Yang Hui*
(DepartmentofNeurobiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity;BeijingInstituteforBrainDisorders,Beijing100069,China)
The Nobel Prize in Physiology or Medicine 2016 was awarded to Yoshinori Ohsumi for his discoveries of mechanisms for autophagy.
autophagy; The Nobel Prize in Physiology or Medicine; Yoshinori Ohsumi
時間:2016-07-0010∶55
http://www.cnki.net/kcms/detail/11.3662.R.20161016.1055.002.html
10.3969/j.issn.1006-7795.2016.05.027]
2016-10-10)

