PD-1/PD-L1抑制劑在晚期非小細(xì)胞肺癌中的臨床進(jìn)展與治療策略
唐宛豫 張國(guó)偉 王慧娟 馬智勇
(河南省腫瘤醫(yī)院,鄭州450000)
?
PD-1/PD-L1抑制劑在晚期非小細(xì)胞肺癌中的臨床進(jìn)展與治療策略
唐宛豫張國(guó)偉王慧娟馬智勇
(河南省腫瘤醫(yī)院,鄭州450000)
肺癌是世界范圍內(nèi)發(fā)病率與致死率最高的腫瘤[1],而非小細(xì)胞肺癌占肺癌的85%。絕大多數(shù)患者就診時(shí)已經(jīng)屬于晚期,經(jīng)過(guò)化療、放療等傳統(tǒng)治療后,5年生存率不超過(guò)15%。由于GVAX瘤苗、黑素瘤相關(guān)抗原-3(MAGE-A3)疫苗、BLP疫苗、MUC-1疫苗等腫瘤疫苗在肺癌的臨床研究中失敗,既往認(rèn)為免疫治療對(duì)腫瘤無(wú)效,腫瘤細(xì)胞可以通過(guò)“免疫逃逸”機(jī)制而避免免疫系統(tǒng)的攻擊。近年來(lái)腫瘤免疫治療研究發(fā)現(xiàn)了一些與腫瘤免疫逃逸相關(guān)的監(jiān)測(cè)點(diǎn),針對(duì)這些監(jiān)測(cè)點(diǎn)設(shè)計(jì)的免疫監(jiān)測(cè)點(diǎn)抑制劑,如CTLA-4和PD-1/PD-L1抑制劑在臨床中觀察到了抗腫瘤的效果,也為治療NSCLC提供了一種新的方法。
晚期肺癌的主要治療手段包括:化療、放療以及近年來(lái)興起的靶向治療。通過(guò)這些治療,晚期肺癌患者的5年生存率有很大提高,尤其是EGFR和EML4-ALK驅(qū)動(dòng)基因陽(yáng)性的患者,中位生存時(shí)間提高了2~3倍。然而臨床上肺鱗癌的患者大多數(shù)不能檢測(cè)到驅(qū)動(dòng)基因,肺腺癌患者也僅有40%能檢測(cè)到驅(qū)動(dòng)基因,因此對(duì)于這些患者,必須開(kāi)辟新的治療方法。而免疫檢測(cè)點(diǎn)抑制劑,給這些患者帶來(lái)了生存的希望。針對(duì)負(fù)性調(diào)節(jié)因子的免疫檢測(cè)點(diǎn)抑制劑可以克服由腫瘤上調(diào)負(fù)性調(diào)節(jié)蛋白所導(dǎo)致的腫瘤免疫逃逸,從而增強(qiáng)機(jī)體的免疫系統(tǒng)對(duì)腫瘤細(xì)胞的殺傷作用。目前PD-1/PD-L1抑制劑已經(jīng)完成了Ⅲ期臨床研究,且Nivolumab及Pembrolizumab已經(jīng)被FDA批準(zhǔn)用于NSCLC的治療。下面本文就PD-1/PD-L1抑制劑在臨床上取得的成就進(jìn)行綜述。
1 免疫檢測(cè)點(diǎn)抑制劑在NSCLC中的進(jìn)展
腫瘤生長(zhǎng)初期,先天免疫系統(tǒng)和適應(yīng)性免疫系統(tǒng)會(huì)對(duì)腫瘤細(xì)胞識(shí)別并清除,如清除不完全,免疫系統(tǒng)便會(huì)與腫瘤細(xì)胞進(jìn)入一種平衡狀態(tài)。若腫瘤細(xì)胞的免疫原性減弱,將會(huì)導(dǎo)致腫瘤細(xì)胞生長(zhǎng)增殖的微環(huán)境得以建造。對(duì)比NSCLC患者與健康志愿者的循環(huán)血,發(fā)現(xiàn)雖然CD8+T淋巴細(xì)胞明顯增多[2],但是由于T細(xì)胞表面的免疫抑制分子的表達(dá)水平升高[3]、調(diào)節(jié)性T細(xì)細(xì)胞增多[4]、主要組織相容性分子表達(dá)減少以及促使免疫細(xì)胞抗原遞呈能力降低的細(xì)胞因子分泌增多[5]等因素,導(dǎo)致機(jī)體對(duì)腫瘤細(xì)胞的殺傷力降低。
最初的研究希望通過(guò)機(jī)體注射腫瘤相關(guān)抗原,以提高T淋巴細(xì)胞對(duì)腫瘤細(xì)胞的殺傷作用。然而,MAGE-A3[6,7]、MUC-1[8,9]等疫苗的失敗逐漸使人們了解到NSCLC中增殖的T細(xì)胞處于抑制狀態(tài)。而CTLA-4、PD-1/PD-L1、LAG-3、TIM-3等T細(xì)胞表面的免疫抑制分子的表達(dá)水平升高正是導(dǎo)致T細(xì)胞無(wú)能的主要原因[10]。
1999年Dong等[11]首次發(fā)現(xiàn)B7家族中的B7-H1分子(之后被命名為PD-L1),阻滯這個(gè)分子可以導(dǎo)致IL-10等分子的分泌,因此他們考慮B7-H1可能是一個(gè)細(xì)胞介導(dǎo)的免疫反應(yīng)的負(fù)性調(diào)節(jié)共刺激分子。PD-1/PD-L1通路于2000年被Freeman發(fā)現(xiàn)[12],PD-1與B7-1/B7-2結(jié)構(gòu)相似,與PD-L1結(jié)合可以抑制T細(xì)胞內(nèi)NF-κB的轉(zhuǎn)錄,從而使T細(xì)胞無(wú)能。隨后研究發(fā)現(xiàn)PD-1缺陷的小鼠易患淋巴細(xì)胞增殖性疾病、自身免疫性擴(kuò)張型心肌病等疾病[13],這些研究證實(shí)了在機(jī)體內(nèi)PD-1/PD-L1通路可以負(fù)性調(diào)節(jié)自身免疫系統(tǒng),導(dǎo)致機(jī)體活化的T淋巴細(xì)胞減少,細(xì)胞因子分泌減少。2005年Hirano等[14]在腫瘤模型小鼠中發(fā)現(xiàn),對(duì)CD137單克隆抗體耐藥的小鼠腫瘤細(xì)胞表面高表達(dá)PD-L1,而阻滯PD-1/PD-L1通路的特異性抗體可以反轉(zhuǎn)這種耐藥并增強(qiáng)治療效果。之后人們?cè)噲D將抗PD-1單抗用于臨床。
2010年,MDX-1106[15]的Ⅰ期臨床試驗(yàn)首次證實(shí)了抗PD-(L)1抗體在人體內(nèi)的抗腫瘤作用,在治療的39例患者中(其中6例NSCLC),1例黑色素瘤患者獲得了持續(xù)的完全緩解,1例黑色素瘤和1例腎細(xì)胞癌患者獲得了部分緩解。其中1名NSCLC患者根據(jù)RECIST1.1標(biāo)準(zhǔn),療效評(píng)價(jià)為病情穩(wěn)定。第一次證實(shí)了抗PD-1/PD-L1抗體在人機(jī)體內(nèi)的抗腫瘤作用。之后多個(gè)公司研制的PD-1/PD-L1抑制劑逐步進(jìn)入臨床研究,其中由施貴寶公司研發(fā)的抗PD-1抑制劑Nivolumab已在NSCLC的Ⅲ期臨床試驗(yàn)顯示出良好的療效。CheckMate 017與057研究結(jié)果顯示[16,17],Nivolumab對(duì)比多西他賽二線治療獲得大約3個(gè)月的額外生存獲益,因此2015年經(jīng)FDA批準(zhǔn)用于晚期非小細(xì)胞肺癌含鉑方案化療后的二線治療[18]。至此,腫瘤免疫治療成為繼手術(shù)、放療、化療、靶向治療之后,已被證明具有顯著臨床療效及優(yōu)勢(shì)的第五種抗腫瘤治療方法。此后,這些藥物進(jìn)行了大量的臨床試驗(yàn)(見(jiàn)表1),證實(shí)了腫瘤免疫治療的顯著療效。
2 免疫治療療效的預(yù)測(cè)因素
隨著免疫檢測(cè)點(diǎn)抑制劑類藥物臨床研究的深入,人們發(fā)現(xiàn)抗PD-1抑制劑僅在部分患者中獲得良好的療效。尋找可靠的生物標(biāo)記以區(qū)別出可獲益的人群是免疫治療能否更好應(yīng)用于臨床的關(guān)鍵。
2.1PD-L1是否有可能成為預(yù)測(cè)因子研究顯示PD-L1大約在45%~50%的肺癌患者中(各種組織類型的肺癌)表達(dá)。且目前已有大量臨床研究已經(jīng)證實(shí)了PD-1及PD-L1的表達(dá)與患者的淋巴結(jié)轉(zhuǎn)移狀態(tài)[23]、分期[24]、機(jī)體淋巴細(xì)胞水平[25]及患者的預(yù)后[26]有直接的關(guān)系。因此在臨床試驗(yàn)中,PD-L1第一個(gè)被考慮是可能的預(yù)測(cè)因子,且已有部分臨床試驗(yàn)探究了PD-L1陽(yáng)性與PD-1通路抑制劑的療效之間的關(guān)系。
(1)支持PD-L1是預(yù)測(cè)因子的臨床試驗(yàn):Ⅲ期臨床試驗(yàn)CheckMate 057[16,17]的結(jié)果顯示, PD-L1表達(dá)≥10%的腺癌患者中,接受Nivolumab治療(n=86)與接受多西他賽治療(n=79)的患者中位OS分別為19.4與8.0個(gè)月,風(fēng)險(xiǎn)比為0.4。而在PD-L1表達(dá)低于10%的患者中,患者OS分別為9.9和10.3個(gè)月(無(wú)統(tǒng)計(jì)學(xué)差異)。
同樣在Pembrolizumab[19]的臨床研究中,我們發(fā)現(xiàn)PD-L1的表達(dá)對(duì)療效有一定的預(yù)測(cè)作用。101名NSCLC患者中,超過(guò)50%的腫瘤細(xì)胞表達(dá)PD-L1的患者的ORR為47%,而少于50%的腫瘤細(xì)胞表達(dá)PD-L1的患者ORR僅為19%。
MPDL3280的臨床試驗(yàn)并未區(qū)分病理類型,均為ⅢB-Ⅳ期的NSCLC患者。該研究用免疫組化的方法檢測(cè)腫瘤浸潤(rùn)免疫細(xì)胞和腫瘤細(xì)胞的PD-L1的表達(dá),然后對(duì)腫瘤細(xì)胞和免疫細(xì)胞進(jìn)行評(píng)分(其中高表達(dá)評(píng)分為3分)。最后將患者分為T(mén)C3或者IC3組,TC2/3或者IC2/3組,TC1/2/3或者IC1/2/3組,TC0且IC0組,結(jié)果顯示高表達(dá)PD-L1蛋白的亞組(TC3或者IC3組)達(dá)到了最長(zhǎng)的PFS為9.7個(gè)月,而在不表達(dá)PD-L1的亞組中(TC0且IC0組),患者PFS僅為2.8個(gè)月,對(duì)比多西他賽組的3.4個(gè)月,無(wú)明顯的生存獲益[20]。
表1免疫檢測(cè)點(diǎn)抑制劑在晚期NSCLC的臨床試驗(yàn)結(jié)果
Tab.1Clinical trials of immune checkpoint inhibitors in advanced NSCLC
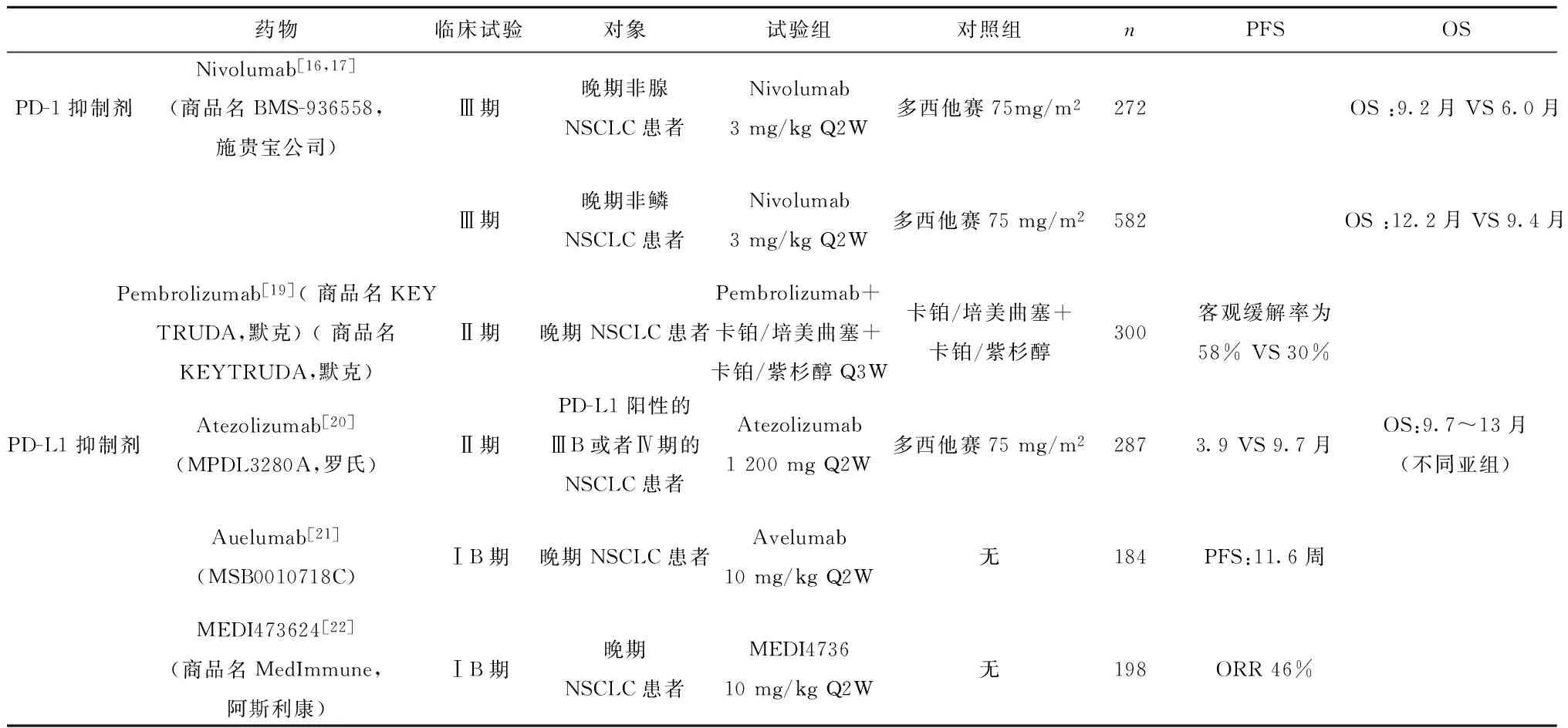
藥物臨床試驗(yàn)對(duì)象試驗(yàn)組對(duì)照組nPFSOSPD-1抑制劑Nivolumab[16,17](商品名BMS-936558,施貴寶公司)Ⅲ期晚期非腺NSCLC患者Nivolumab3mg/kgQ2W多西他賽75mg/m2272OS:9.2月VS6.0月Ⅲ期晚期非鱗NSCLC患者Nivolumab3mg/kgQ2W多西他賽75mg/m2582OS:12.2月VS9.4月Pembrolizumab[19](商品名KEYTRUDA,默克)(商品名KEYTRUDA,默克)Ⅱ期晚期NSCLC患者Pembrolizumab+卡鉑/培美曲塞+卡鉑/紫杉醇Q3W卡鉑/培美曲塞+卡鉑/紫杉醇300客觀緩解率為58%VS30%PD-L1抑制劑Atezolizumab[20](MPDL3280A,羅氏)Ⅱ期PD-L1陽(yáng)性的ⅢB或者Ⅳ期的NSCLC患者Atezolizumab1200mgQ2W多西他賽75mg/m22873.9VS9.7月OS:9.7~13月(不同亞組)Auelumab[21](MSB0010718C)ⅠB期晚期NSCLC患者Avelumab10mg/kgQ2W無(wú)184PFS:11.6周MEDI473624[22](商品名MedImmune,阿斯利康)ⅠB期晚期NSCLC患者M(jìn)EDI473610mg/kgQ2W無(wú)198ORR46%
(2)但是在CheckMate 017[16,17]中,鱗癌患者的PD-L1表達(dá)狀況對(duì)于療效終點(diǎn)既不是預(yù)后性的也不是預(yù)測(cè)性的指標(biāo)。且研究證明機(jī)體PD-L1表達(dá)水平并不是一直不變的,隨著治療線數(shù)的增加、疾病的進(jìn)展,PD-L1的表達(dá)水平也會(huì)有所變化[26]。PD-L1的表達(dá)也存在異質(zhì)性,例如一名接受Nivolumab治療獲得完全緩解,其原發(fā)灶組織標(biāo)本的PD-L1表達(dá)為陽(yáng)性,但是淋巴結(jié)轉(zhuǎn)移灶和皮膚轉(zhuǎn)移灶的PD-L1表達(dá)均為陰性[27]。
綜合目前的臨床試驗(yàn)結(jié)果,考慮到PD-L1對(duì)療效的預(yù)測(cè)并非完全準(zhǔn)確,有可能與組織類型及所檢測(cè)的組織標(biāo)本有關(guān),尚需進(jìn)一步的研究。現(xiàn)在有許多研究試圖找出更為精確的預(yù)測(cè)因子。
2.2吸煙患者接受免疫檢測(cè)點(diǎn)抑制劑的療效較無(wú)吸煙史的患者好經(jīng)統(tǒng)計(jì)在Nivolumab、Pembroli-zumab和MPDL3280a的臨床試驗(yàn)中,吸煙與不吸煙患者的ORR有差異(分別為27%vs 0%、27%vs 9%與26%vs 10%),同時(shí)Calles[28]發(fā)現(xiàn)吸煙患者的PD-L1表達(dá)高于不吸煙患者。Calles認(rèn)為是煙草中的尼古丁誘導(dǎo)體細(xì)胞高頻率突變,導(dǎo)致吸煙患者免疫原性高于無(wú)吸煙史患者[29],因此對(duì)免疫檢測(cè)點(diǎn)抑制劑的敏感性增加[30]。一直以來(lái),吸煙史意味著肺癌患者接受化療及靶向治療的預(yù)后較差[31],而PD-(L)1抑制劑對(duì)吸煙患者的療效良好,這可能會(huì)在肺癌患者選擇治療方案時(shí)提供幫助。
2.3錯(cuò)配修復(fù)基因MMR的預(yù)測(cè)作用是否適用于NSCLC2015年ASCO報(bào)道了錯(cuò)配修復(fù)基因MMR缺失可以預(yù)測(cè)Pembrolizumab在直腸癌中的療效。在伴MMR缺失的結(jié)直腸癌的患者中有效率可達(dá)62%,且疾病控制率高達(dá)92%,而MMR正常的患者分別為0%和16%。MMR系統(tǒng)廣泛存在于生物體中,是細(xì)胞復(fù)制后的一種修復(fù)機(jī)制,可以矯正DNA重組和復(fù)制過(guò)程中產(chǎn)生的堿基錯(cuò)配而保持基因組的穩(wěn)定性。一旦該基因發(fā)生突變,就會(huì)導(dǎo)致細(xì)胞錯(cuò)配修復(fù)功能缺陷,結(jié)果產(chǎn)生遺傳不穩(wěn)定,表現(xiàn)為復(fù)制錯(cuò)誤或微衛(wèi)星不穩(wěn)定,進(jìn)而導(dǎo)致體細(xì)胞突變頻率升高,因而容易發(fā)生腫瘤。由于突變頻率增高會(huì)導(dǎo)致腫瘤的免疫原性增強(qiáng),所以MMR缺失的患者對(duì)免疫治療有較高的敏感性。雖然MMR缺失首先在結(jié)直腸癌中發(fā)現(xiàn),但是之前相關(guān)研究曾報(bào)道錯(cuò)配修復(fù)基因在肺癌組織的缺失表達(dá)率可高達(dá)74%,因此研究NSCLC患者M(jìn)MR缺失與免疫治療的療效關(guān)系是極其有必要的。
2.4其他可能的預(yù)測(cè)方法目前其他的預(yù)測(cè)因素大都尚未進(jìn)行臨床試驗(yàn),處于研究階段。目前可能的預(yù)測(cè)方法有CT、LA-4及PD-1/PD-L1基因、癌癥基因組(Cancer gene panels,CGPs)及在結(jié)直腸癌中發(fā)現(xiàn)的錯(cuò)配修復(fù)基因MMR。
(1)Ma等[32]人分析了中國(guó)528名NSCLC患者和600名健康患者,發(fā)現(xiàn)CTLA-4和PD-1基因分布的多態(tài)性在NSCLC患者與健康對(duì)照組的分布相似,除了PD-L1 8923 A/C等位基因,其中AC基因型與C等位基因在NSCLC患者中的頻率明顯高于健康志愿者(P分別為0.006與0.004)。Cheng等[33]也分析了288名NSCLC患者和300名健康對(duì)照組,同樣發(fā)現(xiàn)了PD-L1 8923A/C基因在NSCLC患者中的頻率明顯高于健康患者。比起檢測(cè)組織中的CTLA-4和PD-L1表達(dá)水平,CTLA-4和PD-1基因在NSCLC中表達(dá)穩(wěn)定,也使其有希望成為免疫檢測(cè)點(diǎn)療效的預(yù)測(cè)因子。
(2)Campesato等[34]試圖用CGPs來(lái)預(yù)測(cè)患者對(duì)PD-1和CTLA-4抑制劑的療效。他們?cè)谘芯恐邪l(fā)現(xiàn)有高CGPs突變負(fù)荷的NSCLC患者對(duì)PD-1抑制劑有更持久的臨床獲益(P=0.01)。該預(yù)測(cè)因子的機(jī)制也與突變負(fù)荷高導(dǎo)致的免疫原性增強(qiáng)有關(guān)。
目前患者PD-L1的表達(dá)水平及吸煙史可能對(duì)PD-(L)1抑制劑的療效有一定的預(yù)測(cè)作用,然而對(duì)于優(yōu)勢(shì)人群選擇的精確度是遠(yuǎn)遠(yuǎn)不夠的,錯(cuò)配修復(fù)基因MMR對(duì)PD-L1抑制劑的預(yù)測(cè)作用是否能在NSCLC中重現(xiàn)尚需大樣本數(shù)據(jù)來(lái)證實(shí)。其他可能的預(yù)測(cè)因子尚無(wú)明確的研究結(jié)果來(lái)證實(shí)在肺癌中的預(yù)測(cè)作用。然而對(duì)于精準(zhǔn)醫(yī)學(xué)的實(shí)現(xiàn)來(lái)說(shuō),生物標(biāo)記的探索是目前PD-(L)1抑制劑最有可能的出路之一,因此對(duì)生物學(xué)標(biāo)記的探索仍需進(jìn)一步努力。
3 小結(jié)
由于腫瘤的發(fā)生和發(fā)展是多種因素導(dǎo)致的,因此任何一種治療手段都不可能適合所有的肺癌患者,然而隨著治療手段的多樣化,精準(zhǔn)醫(yī)療、個(gè)體化治療必將成為趨勢(shì),免疫治療也必將面對(duì)該挑戰(zhàn)。因此對(duì)聯(lián)合用藥副作用的管理、對(duì)預(yù)測(cè)因子的尋找仍然是擺在我們面前的重要課題。
[1]Edwards BK,Noone AM,Mariotto AB,etal.Annual Report to the Nation on the status of cancer,19a75-2010,featuring prevalence of comorbidity and impact on survival among persons with lung,colorectal,breast,or prostate cancer[J].Cancer,2014,120(9):1290-1314.
[2]胥萍,陳慧 陳永井,等.肺癌患者外周血中單個(gè)核細(xì)胞表面程序性死亡蛋白1及其受體的表達(dá)和生物學(xué)意義[J].中華腫瘤雜志,2013,35(12):910-913.
[3]Yuan J,Page DB,Ku GY,etal.Correlation of clinical and immunological data in a metastatic melanoma patient with heterogeneous tumor responses to ipilimumab therapy[J].Cancer Immun,2010,10(1):1-7.
[4]Woo EY,Yeh H,Chu CS,etal.Cutting edge:Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation[J].J Immunol,2002,168(9):4272-4276.
[5]Grosso JF,Jure-Kunkel MN.CTLA-4 blockade in tumor models:an overview of preclinical and translational research[J].Cancer Immunity Archive,2013,13(5):1-14.
[6]Ramlogan-Steel CA,Steel JC,Morris JC.Lung cancer vaccines:current status and future prospects[J].Transl Lung Cancer Res,2014,3(1):46-52.
[7]Sienel W,Varwerk C,Linder A,etal.Melanoma associated antigen (MAGE)-A3 expression in Stages I and II non-small cell lung cancer:results of a multi-center study[J].Eur J Cardiothorac Surg,2004,25(1):131-134.
[8]Palmer M,Parker J,Modi S,etal.Phase I study of the BLP25 (MUC1 Peptide) liposomal vaccine for active specific immunotherapy in stage IIIB/IV non-small-cell lung cancer[J].Clin Lung Cancer,2001,3(1):49-57.
[9]Sangha R,Butts C.L-BLP25:a peptide vaccine strategy in non small cell lung cancer [J].Clin Lung Cancer,2007,13(15):4652-4654.
[10]Li X,Hu W,Zheng X,etal.Emerging immune checkpoints for cancer therapy[J].Acta Oncol,2015,54(10):1706-1713.
[11]Dong H,Zhu G,Tamada K,etal.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin-10 secretion[J].Nat Med,1999,5(12):1365-1369.
[12]Dong H,Zhu G,Tamada K,etal.Engagement of the Pd-1 immunoinhibitory receptor by a Novel B7 family member leads to negative regulation of lymphocyte activation[J].J Exp Med,2000,192(7):1027-1034.
[13]Nishimura H,Okazaki T,Tanaka Y,etal.Autoimmune dilated cardiomyopathy in PD-1 receptor-deficient mice[J].Science,2001,291(5502):319-322.
[14]Hirano F,Kaneko K,Tamura H,etal.Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity[J].Cancer Res,2005,65(3):1089-1096.
[15]Brahmer JR,Drake CG,Wollner I,etal.Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors:safety,clinical activity,pharmacodynamics,and immunologic correlates [J].JCO,2010,28(19):3167-3175.
[16]Spige DR,Reckamp KL,Rizvi NA,etal.A phase III study (CheckMate 017) of nivolumab (NIVO;anti-programmed death-1 [PD-1]) vs docetaxel (DOC) in previously treated advanced or metastatic squamous (SQ) cell non-small cell lung cancer (NSCLC)[R].ASCO,2015 .
[17]Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J].N Engl J Med,2015,373(2):123-135.
[18]Times O.FDA expands approved use of opdivo (Nivolumab) for lung cancer[J].Oncology Times,2015,37(7):3.
[19]Brahmer JR,Kim ES,Zhang J,etal.KEYNOTE-024:Phase III trial of pembrolizumab (MK-3475) vs platinum-based chemotherapy as first-line therapy for patients with metastatic non-small cell lung cancer (NSCLC) that expresses programmed cell death ligand 1 (PD-L1)[R].ASCO,2015.
[20]Rittmeyer A,Spira A,Park K.Efficacy,safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC[R].ASCO,2015 .
[21]Heery CR,Coyne GH,Marte JL,etal.Pharmacokinetic profile and receptor occupancy of avelumab (MSB0010718C),an anti-PD-L1 monoclonal antibody,in a phase I,open-label,dose escalation trial in patients with advanced solid tumors[R].ASCO,2015.
[22]Antonia S,Rizvi N,Brahmer J,etal.Safety and clinical activity of MEDI4736,an anti-programmed cell death-ligand 1 (PD-L1) antibody,in patients with NSCLC[R].ASCO,2015.
[23]Schmidt LH,Kummel A,Gorlich D,etal.PD-1 and PD-L1 Expression in NSCLC Indicate a Favorable Prognosis in Defined Subgroups[J].PLoS One,2015,10(8):e0136023.
[24]韋騰飛,張軍,吳豫,等.CD4+T細(xì)胞表面共抑制分子的表達(dá)水平與非小細(xì)胞肺癌疾病進(jìn)展的關(guān)系[J].中華腫瘤雜志,2014,36(6):424-429.
[25]Zhang Y,Huang S,Gong D,etal.Programmed death-1 upregulation is correlated with dysfunction of tumor-infiltrating CD8+T lymphocytes in human non-small cell lung cancer[J].Cell Mol Immunol,2010,7(5):389-395.
[26]Zhang J,Gao J,Li Y,etal.Circulating PD-L1 in NSCLC patients and the correlation between the level of PD-L1 expression and the clinical characteristics[J].Thorac Cancer,2015,6(4):534-538.
[27]Han JJ,Kim DW,Koh J,etal.Change in PD-L1 expression after acquiring resistance to gefitinib in EGFR-mutant non-small-cell lung cancer[J].Clin Lung Cancer,2016,17(4):263-270.
[28]Calles A,Liao X,Sholl LM,etal.Expression of PD-1 and its ligands,PD-L1 and PD-L2,in smokers and never smokers with KRAS-mutant lung cancer[J].J Thorac Oncol,2015,10(12):1726-1735.
[29]Chen DS,Irving BA,Hodi FS ,etal.Molecular pathways:next-generation immunotherapy-inhibiting programmed death-ligand 1 and programmed death-1[J].Clin Cancer,2012,18(4):6580-6587.
[30]Soria J,Gettinger S,Gordon M,etal.Clinical activity,safety and biomarkers of PD-L1 blockade in non-small cell lung cancer (NSCLC):additional analyses from a clinical study of the engineered antibody MPDL3280A (anti-PDL1)[J].Eur J Cancer,2014,25(4):465.
[31]Lee JY,Na II,Jang SH,etal.Differences in clinical presentation of non- small cell lung cancer in never- smokers versus smokers[J].J Thorac Dis,2013,5(6):758- 763.
[32]Ma Y,Liu X,Zhu J,etal.Polymorphisms of co-inhibitory molecules (CTLA-4/PD-1/PD-L1) and the risk of non-small cell lung cancer in a Chinese population[J].Int J Clin Exp Med,2015,8(9):16585-16591.
[33]Cheng S,Zheng J,Zhu J,etal.PD-L1 gene polymorphism and high level of plasma soluble PD-L1 protein may be associated with non-small cell lung cancer[J].Int J Biol Markers,2015,30(4):364-368.
[34]Campesato LF,Barroso-Sousa R,Jimenez L,etal.Comprehensive cancer-gene panels can be used to estimate mutational load and predict clinical benefit to PD-1 blockade in clinical practice[J].Oncotarget,2015,27(6):33.
[收稿2016-02-19修回2016-03-28]
(編輯倪鵬)
10.3969/j.issn.1000-484X.2016.10.033
唐宛豫(1992年-),女,碩士,醫(yī)師,主要從事晚期肺癌綜合治療方面的研究,E-mail:tangwanyu3940@sina.com。
及指導(dǎo)教師:馬智勇(1952年-),男,主任醫(yī)師,碩士生導(dǎo)師,主要從事晚期肺癌的綜合治療方面研究,E-mail:mazhiyong@csco.org.cn。
R392
A
1000-484X(2016)10-1558-04
- 中國(guó)免疫學(xué)雜志的其它文章
- 橋本氏甲狀腺炎患者外周血中CD4+CD45RO+記憶性T細(xì)胞的表達(dá)及意義
- 類風(fēng)濕關(guān)節(jié)炎患者外周血單核細(xì)胞亞群的變化及其意義①
- 人Cosmc胞外段蛋白在昆蟲(chóng)細(xì)胞Sf-9中的表達(dá)與純化研究①
- 單核巨噬細(xì)胞極化在慢性活動(dòng)性乙型肝炎中的表達(dá)及意義①
- Smad7基因質(zhì)粒轉(zhuǎn)染骨髓間充質(zhì)干細(xì)胞在體外對(duì)肝星狀細(xì)胞TGF-β1信號(hào)傳導(dǎo)的影響①
- 良惡性乳腺腫瘤外周血基因差異表達(dá)研究①