以殼聚糖納米微球?yàn)檩d體的Crisp1-DNA避孕疫苗的制備及體外表達(dá)
羅金,楊菁,程琰,張怡,徐望明
(武漢大學(xué)人民醫(yī)院生殖醫(yī)學(xué)中心,武漢 430060)
?
·實(shí)驗(yàn)研究·
以殼聚糖納米微球?yàn)檩d體的Crisp1-DNA避孕疫苗的制備及體外表達(dá)
羅金,楊菁*,程琰,張怡,徐望明
(武漢大學(xué)人民醫(yī)院生殖醫(yī)學(xué)中心,武漢430060)
目的構(gòu)建以殼聚糖納米微球?yàn)檩d體的Crisp1 DNA疫苗,對(duì)其物理學(xué)、生物學(xué)活性進(jìn)行測(cè)定,并評(píng)估其在COS-7細(xì)胞中的表達(dá)情況及細(xì)胞毒性。方法采用本實(shí)驗(yàn)室前期構(gòu)建的真核表達(dá)質(zhì)粒pcDNA3.1-Crisp1,以復(fù)凝法制備載Crisp1 DNA疫苗的殼聚糖納米粒(CS/DNA NPs),用透射電鏡以及凝膠阻滯分析對(duì)其相關(guān)物理學(xué)、生物學(xué)活性進(jìn)行測(cè)定,然后將載Crisp1 DNA疫苗的殼聚糖納米粒轉(zhuǎn)染至COS-7細(xì)胞,檢測(cè)其細(xì)胞毒性,并用間接免疫熒光法鑒定其在細(xì)胞內(nèi)的表達(dá)情況。結(jié)果透射電鏡結(jié)果顯示納米粒形態(tài)較均一,平均粒徑為189.3 nm,Zeta電位約為+0.2 mV。凝膠阻滯分析顯示殼聚糖微粒可將DNA疫苗完全阻滯于加樣孔中并保護(hù)DNA質(zhì)粒不降解。MTT試驗(yàn)顯示殼聚糖組細(xì)胞存活率顯著高于脂質(zhì)體組(P<0.01)。間接免疫熒光實(shí)驗(yàn)結(jié)果顯示CS/DNA NPs能在COS-7細(xì)胞中有效表達(dá)Crisp 1抗原蛋白。結(jié)論由殼聚糖納米微球介導(dǎo)的Crisp1 DNA疫苗,可在真核細(xì)胞中有效地表達(dá),且具有較小的細(xì)胞毒性,為進(jìn)一步發(fā)展安全有效的DNA避孕疫苗打下了基礎(chǔ)。
Crisp-1;避孕;DNA疫苗;殼聚糖;納米微球
Methods:The eukaryotic expression plasmid pcDNA3.1-Crisp1 was constructed previously and encapsulated in nanoparticles with chitosan by complex coacervation process. Transmission electron microscope (TEM) and Gel retardation assay were used to observe the physical and biological characteristics of the chitosan/pcDNA3.1-Crisp1 nanoparticles. Then,the chitosan/pcDNA3.1-Crisp1 nanoparticles (CS/DNA NPs) were transfected to COS-7 cells,detecting its cytotoxicity and evaluating its expression by indirect immunoflurescence.
Results:TEM showed that chitosan/pcDNA3.1-Crisp1 nanoparticleshad symmetrical shape,with a diameter about 189.3 nm,and zeta potential was+0.2 mV. Gel retardation assay showed that pcDNA3.1-Crisp1 contained in chitosan nanoparticles could be completely retarded and remained intact after DNase I treatment. MTT assay showed that the viability of cells incubated with chitosan-DNA was significantly higher than that of the control Lipofect 2 000 group (P<0.01). Indirect immunouorescence showed that pcDNA3.1-Crisp1 could expressed effectively in COS-7 cells.
Conclusions:Chitosan nanoparticles containing Crisp1-DNA contraceptive vaccine can express effectively in eukaryotic cells and have less cytotoxicity. Chitosan can be used as an effective non-virus DAN vaccine carrier.
(JReprodMed2016,25(10):947-952)
富含半胱氨酸分泌蛋白-1(cysteine-rich secretory protein-1,Crisp1)是由附睪頭部的上皮細(xì)胞合成分泌的一種雄激素依賴型糖蛋白。由于在生殖過(guò)程中的多個(gè)環(huán)節(jié)起著重要作用,如調(diào)控精子的獲能、參與精卵融合等,Crisp1被認(rèn)為是一種極具前景的候選避孕疫苗[1-3]。在前期的研究中,本實(shí)驗(yàn)室成功的構(gòu)建了真核表達(dá)載體pcDNA3.1-Crisp1[4],并證實(shí)該疫苗可在小鼠體內(nèi)誘導(dǎo)特異性免疫反應(yīng),但避孕效果不盡理想[5-6]。其原因可能是:(1)由于裸DNA帶負(fù)電荷,難以通過(guò)脂質(zhì)的細(xì)胞膜;(2)在體內(nèi)易被核酸酶降解而迅速清除[7];(3)質(zhì)粒DNA轉(zhuǎn)運(yùn)到組織細(xì)胞尤其是抗原遞呈細(xì)胞(APc)的效率較低,從而導(dǎo)致抗原表達(dá)水平低下[8]。因此,要成功將基因免疫用于開(kāi)發(fā)避孕疫苗,還需要選擇一個(gè)合適的基因給藥載體,以提高 DNA疫苗在體內(nèi)主動(dòng)免疫效果。目前,非病毒載體由于具有較好的生物安全性已越來(lái)越多地運(yùn)用于基因治療研究中。殼聚糖是一種帶正電荷的天然聚合物,無(wú)細(xì)胞毒性,且具有很好的生物相容性和生物降解性[9],近年來(lái)作為一種新開(kāi)發(fā)的載體系統(tǒng)得到了廣泛而深入的研究。本研究采用復(fù)凝法構(gòu)建了載Crisp1 DNA疫苗的殼聚糖納米粒,并對(duì)其相關(guān)物理學(xué)、生物學(xué)活性進(jìn)行測(cè)定,最后通過(guò)與脂質(zhì)體進(jìn)行比較評(píng)估其在COS-7細(xì)胞中的表達(dá)情況,望能為后續(xù)研究其生物學(xué)活性及免疫避孕效應(yīng)提供基礎(chǔ)依據(jù)。
材料和方法
一、材料
1. 主要試劑:殼聚糖購(gòu)自sigma公司;Lipofectamne 2000TM試劑盒和Opti-MEM培養(yǎng)基為Invitrogen公司產(chǎn)品;其余試劑均為國(guó)產(chǎn)或進(jìn)口分析純。
2. 細(xì)菌、細(xì)胞和質(zhì)粒:pcDNA3.1-Crisp1真核表達(dá)質(zhì)粒由本實(shí)驗(yàn)室前期構(gòu)建[4];載體pcDNA3.1 為Novagen 公司產(chǎn)品;COS-7 細(xì)胞購(gòu)自中國(guó)科學(xué)院上海細(xì)胞生物與生物化學(xué)所。
二、研究方法
1. 載Crisp-1DNA疫苗殼聚糖納米粒的制備(復(fù)凝法):根據(jù)前期文獻(xiàn)報(bào)道,采用復(fù)凝法制備殼聚糖納米粒[10]。稱取純化的殼聚糖10.0 mg,溶解于l%冰乙酸溶液中,用NaOH調(diào)節(jié)pH至5.5,稀釋溶液使殼聚耱濃度為0.02%(W/V),0.22 μm針式濾器過(guò)濾除菌。取適量pcDNA3.1-Crisp1加入25 mmol/L Na2S04溶液中,調(diào)節(jié)其濃度分別為50 μg/ml、100 μg/ml、200 μg/ml,分別記為CS/DNA 50、CS/DNA 100、CS/DNA 200。將0.02%殼聚糖溶液和3種不同濃度的pcDNA3.1-Crisp1/Na2S04(25 mmol/L)溶液均預(yù)熱至55℃,分別取等體積的殼聚糖溶液與pcDNA3.1-Crisp1溶液迅速混勻,渦旋30 s,室溫靜置30 min,所得pcDNA3.1-Crisp1-殼聚糖納米粒懸液即可用于生物學(xué)鑒定和細(xì)胞轉(zhuǎn)染。取不同質(zhì)粒濃度的納米粒懸液200 μl,高速離心機(jī)離心(14 000g×30 min),收集上清液,紫外分光光度法(OD260)檢測(cè)上清液中質(zhì)粒DNA的含量,并計(jì)算不同質(zhì)粒濃度下的包埋率。
基因含量(包埋量,μg)=OD260×稀釋倍數(shù)×體積×50/1 000;
包埋率G(%)=[(Wo-wo)/Wo]×100%(Wo為加入的DNA的總量;wo為上清液中剩余的DNA的量)。
2. 納米粒形態(tài)、粒徑分布及zeta電位的測(cè)定:取少量納米粒混懸液滴至鋪有碳膜的銅網(wǎng)上,靜置2 min,用濾紙吸干混懸液,再滴加2%磷鎢酸負(fù)染2 min,于透射電子顯微鏡(TEM)下觀察納米粒形態(tài),并選取有代表性的視野拍照,進(jìn)行形態(tài)測(cè)定。另取納米粒混懸液適量,加雙蒸水稀釋后用納米粒度分析儀測(cè)定平均粒徑、多分散度和zeta電位。
3. 凝膠阻滯分析和DNase I保護(hù)試驗(yàn):分別取裸質(zhì)粒和殼聚糖納米質(zhì)粒復(fù)合物,行含0.5 μg/ml溴化乙錠的1%瓊脂糖凝膠電泳(100 V,30 min),紫外凝膠成像儀觀察并照相,分析殼聚糖納米粒與質(zhì)粒的結(jié)合力。由于裸質(zhì)粒DNA在體內(nèi)易被降解,為驗(yàn)證納米粒對(duì)質(zhì)粒DAN的保護(hù)作用,選用核酸酶(DNase I)作為酶原進(jìn)行抗核酸試驗(yàn)。取樣本和裸質(zhì)粒DNA 溶液各20 μl (含質(zhì)粒DNA 1 μg),分別加入0.2 μl DNaseI,37℃反應(yīng)30 min,0℃冰浴15 mim終止反應(yīng),以含0.5 μg/ml溴化乙錠的1%瓊脂糖凝膠進(jìn)行電泳分析(100 V,30 min),同時(shí)與未加酶的殼聚糖納米質(zhì)粒復(fù)合物樣品和裸質(zhì)粒溶液對(duì)照。
4. 細(xì)胞毒性檢測(cè)(MTT):COS-7 細(xì)胞用含有10%胎牛血清的杜爾伯科極限必需培養(yǎng)基(DMEM),37℃、5% CO2恒溫培養(yǎng)。用0.25%胰酶消化單層培養(yǎng)的COS-7細(xì)胞,以每孔內(nèi)1×104個(gè)細(xì)胞接種于96孔板,培養(yǎng)至細(xì)胞貼壁后,將裸DNA、脂質(zhì)體-質(zhì)粒DNA、及殼聚糖-質(zhì)粒DNA分別加入細(xì)胞孔中,只加培養(yǎng)液的空白孔調(diào)零,非處理細(xì)胞為對(duì)照。溫箱中培養(yǎng)48 h后取出96孔板,加入MTT 20 μl,繼續(xù)培養(yǎng)4 h。吸棄全部上清液,每孔加入150 μl 二甲基亞砜(DMSO),震蕩10 min,選擇570 nm波長(zhǎng),以空白孔調(diào)零,酶標(biāo)儀測(cè)其吸光度值并計(jì)算各組細(xì)胞存活率。細(xì)胞存活率=[OD570(實(shí)驗(yàn)組)/OD570(對(duì)照組)] × 100%。
5. 間接免疫熒光細(xì)胞化學(xué)檢測(cè)Crisp1蛋白在真核細(xì)胞中的表達(dá)與定位:轉(zhuǎn)染48 h后,吸棄培養(yǎng)基,PBS洗3次,用4%多聚甲醛-PBS固定液室溫固定15 min,吸出固定液,PBS洗3次,0.5 ml 0.2%的Triton-X 100溶液破膜8 min,PBS洗3次,正常山羊血清室溫(37℃)下封閉20 min,PBS洗3次,滴加一抗(山羊抗鼠CRISP-1單抗,1∶100稀釋) 4℃過(guò)夜,PBS洗3次,滴加二抗(FITC標(biāo)記的兔抗山羊IgG,1∶100稀釋),37℃避光孵育90 min,PBS洗3次,緩沖甘油封片,熒光顯微鏡下觀察。
三、統(tǒng)計(jì)學(xué)分析
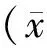
結(jié) 果
一、不同質(zhì)粒濃度下殼聚糖對(duì)pcDNA3.1-Crisp1的包埋率
采用紫外分光光度儀檢測(cè)殼聚糖對(duì)不同濃度的質(zhì)粒DNA的包埋率,結(jié)果顯示,質(zhì)粒濃度為100 μg/ml時(shí),殼聚糖對(duì)質(zhì)粒DNA的包埋率最高(表1)。

表1 不同質(zhì)粒濃度下殼聚糖對(duì)pcDNA3.1-Crisp1的包埋率
注:分別與低、高濃度組相比,*P<0.05
二、殼聚糖/pcDNA3.1-Crisp1納米粒的物理學(xué)特征
透射電子顯微鏡觀察結(jié)果顯示,載基因殼聚糖納米粒形態(tài)較為規(guī)則,近球形,大小較均一,散在分布,分散性好(圖1)。激光粒度分析儀測(cè)定結(jié)果表明,納米粒直徑約189.3 nm,多分散指數(shù)為0.459,粒徑分布范圍較窄。Zeta電位約為+0.2 mV。
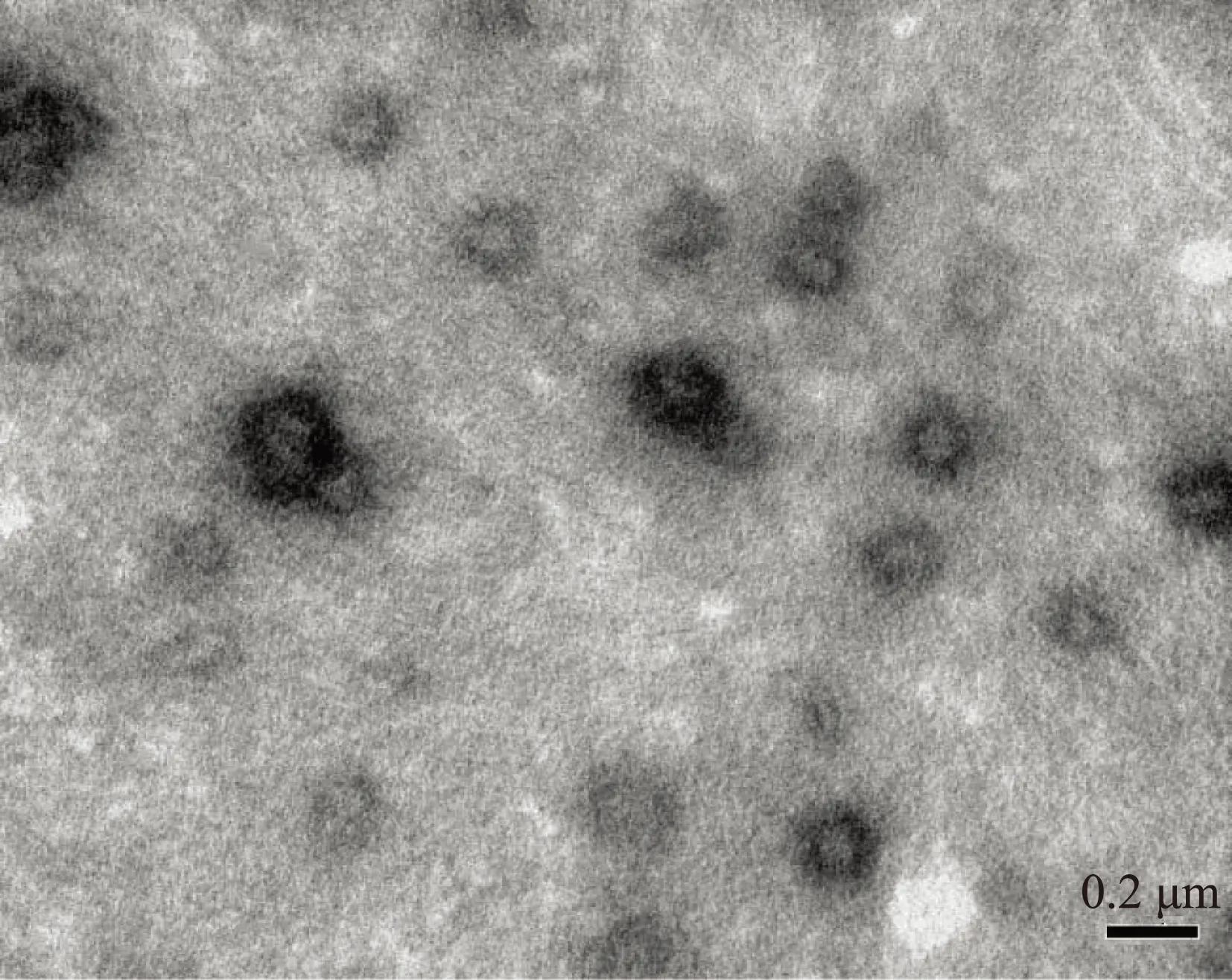
圖1 殼聚糖/pcDNA3.1-Crisp-1納米粒透射電鏡成像
三、凝膠阻滯分析和DNase I保護(hù)試驗(yàn)
1%瓊脂糖凝膠電泳結(jié)果顯示,殼聚糖與DNA疫苗后結(jié)合使質(zhì)粒DNA阻滯于加樣孔中,未觀察到質(zhì)粒跑出,說(shuō)明殼聚糖能有效地包裹質(zhì)粒DNA(圖2A)。但是,向各組樣品加入DNase I后,電泳結(jié)果顯示裸質(zhì)粒DNA被DNase I消化;而殼聚糖納米微粒中的質(zhì)粒DNA并未受影響,說(shuō)明殼聚糖能保護(hù)質(zhì)粒DNA不受核酸酶降解(圖2B)。
A:殼聚糖納米粒與質(zhì)粒DNA結(jié)合試驗(yàn)電泳圖,1:Marker;2:質(zhì)粒DNA組;3-5:pcDNA3.1-Crisp-1殼聚糖微粒組。B:殼聚糖納米粒對(duì)質(zhì)粒DNA保護(hù)試驗(yàn)電泳圖,1:Marker;2:質(zhì)粒DNA組;3-5:pcDNA3.1-Crisp-1殼聚糖微粒組圖2 殼聚糖納米粒與質(zhì)粒DNA凝膠電泳圖譜
四、細(xì)胞毒性檢測(cè)(MTT)
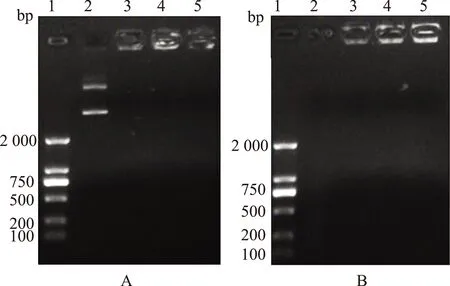
MTT試驗(yàn)結(jié)果顯示裸 DNA、脂質(zhì)體-質(zhì)粒DNA、CS/DNA NPs三組的細(xì)胞存活率分別為(86.74±3.26)%、(29.13±4.02)%、(80.32±6.23)%。殼聚糖組與裸質(zhì)粒組細(xì)胞存活率差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但顯著高于脂質(zhì)體-DNA組,差異有統(tǒng)計(jì)學(xué)意義(P<0.01) (圖3)。
五、間接免疫熒光細(xì)胞化學(xué)檢測(cè)Crisp-1在真核細(xì)胞中的表達(dá)
將正常COS-7細(xì)胞和經(jīng)不同方式轉(zhuǎn)染pcDNA3.1-Crisp1的COS-7細(xì)胞用4%多聚甲醛-PBS固定液固定后,分別做間接免疫熒光(IIF)檢測(cè)。如圖4所示,經(jīng)過(guò)相同處理后,無(wú)論是用脂質(zhì)體介導(dǎo)轉(zhuǎn)染的COS-7細(xì)胞中還是載DNA殼聚糖納米微球直接轉(zhuǎn)染的COS-7細(xì)胞中均可看到明亮的綠色熒光,表明殼聚糖可有效的介導(dǎo)Crisp1 DNA疫苗在真核細(xì)胞中表達(dá)。
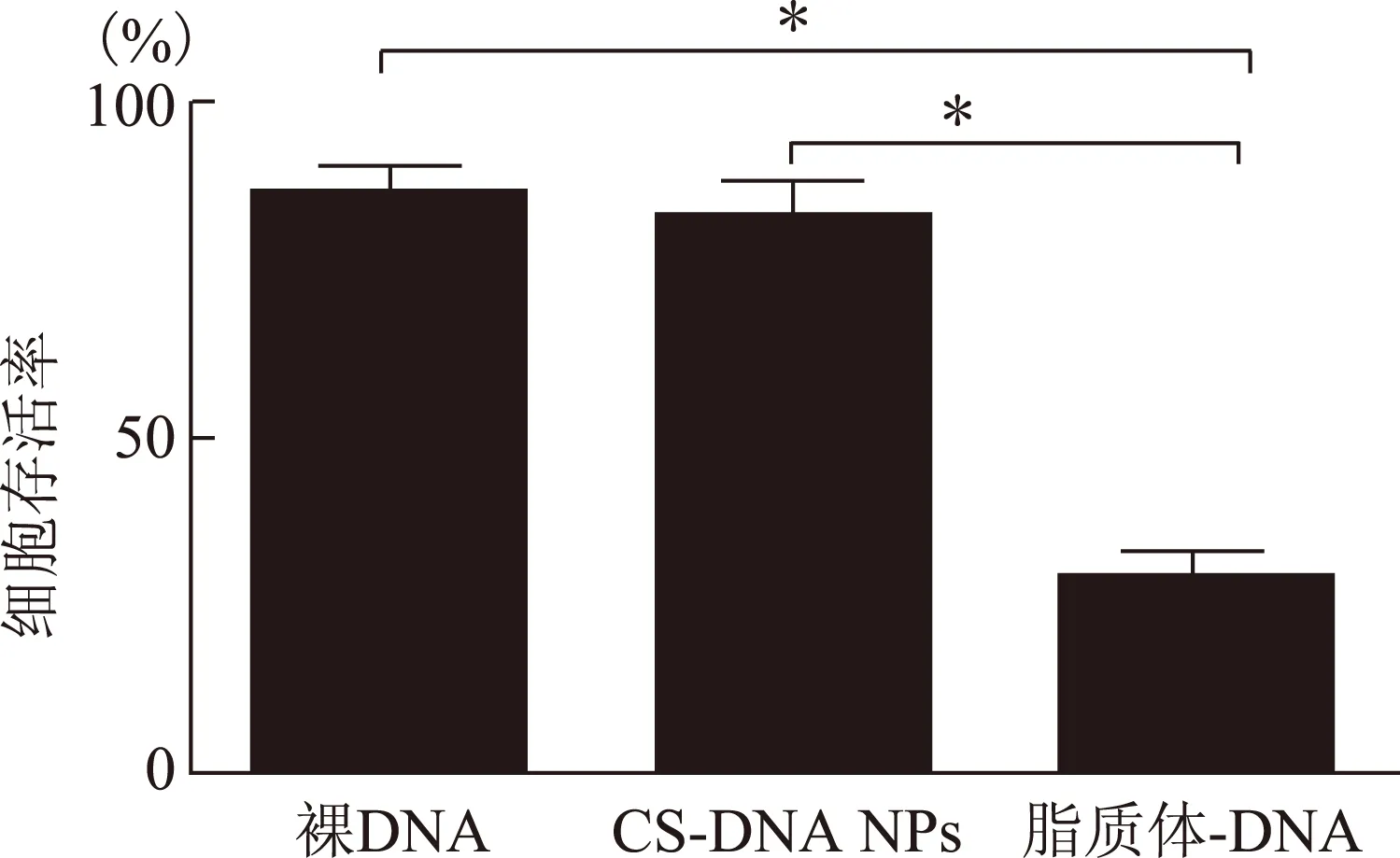
組間兩兩分別比較,*P<0.01圖3 各組細(xì)胞毒性檢測(cè)后細(xì)胞存活率
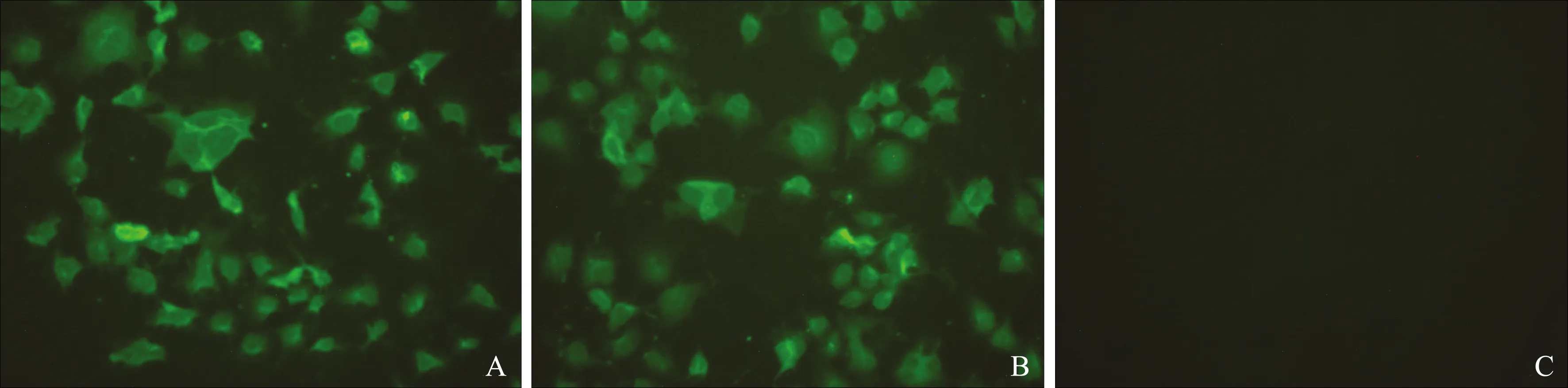
A:以殼聚糖納米粒介導(dǎo)的pcDNA3.1-Crisp1質(zhì)粒轉(zhuǎn)染的COS-7細(xì)胞;B:經(jīng)脂質(zhì)體介導(dǎo)的pcDNA3.1-Crisp1質(zhì)粒轉(zhuǎn)染的COS-7細(xì)胞;C:未經(jīng)質(zhì)粒轉(zhuǎn)染的正常COS-7細(xì)胞圖4 pcDNA3.1-Crisp1質(zhì)粒經(jīng)不同方法轉(zhuǎn)染COS-7細(xì)胞后Crisp1的熒光表達(dá)
討 論
近年來(lái),隨著基因組學(xué)和蛋白質(zhì)組學(xué)技術(shù)的應(yīng)用和發(fā)展,采用重組DNA技術(shù),以精子相關(guān)蛋白為基礎(chǔ)研究,在多個(gè)動(dòng)物模型上已證實(shí)可產(chǎn)生抗體反應(yīng)并顯示出一定的抗生育效果。Crisp1是一種雄激素依賴性的分泌性糖蛋白,由附睪頭部的上皮細(xì)胞合成并分泌。有研究表明Crisp1不僅參與了精卵融合[1-2],還參與了精子與透明帶的相互作用階段[8],并可調(diào)節(jié)精子在附睪中獲能[3]。最近,Maldera等[11]研究進(jìn)一步發(fā)現(xiàn),人類附睪Crisp1主要是通過(guò)與透明帶3(ZP3)的相互作用介導(dǎo)精子-透明帶結(jié)合,參與受精過(guò)程。在前期的研究中,本課題組成功的構(gòu)建了以Crisp1為基礎(chǔ)的DNA避孕疫苗[4],并對(duì)雌雄性小鼠進(jìn)行主動(dòng)免疫,結(jié)果顯示免疫后雌雄性小鼠血清內(nèi)均可檢測(cè)到特異性抗Crisp1的IgG抗體,且抗體滴度隨著免疫時(shí)間延長(zhǎng)而逐漸升高,停止免疫后4周抗體滴度開(kāi)始緩慢下降[5-6],并進(jìn)一步證實(shí)了mCrisp1抗體特異性作用于精卵融合階段,而對(duì)正常小鼠附睪精子的活動(dòng)率、存活率、自發(fā)或誘發(fā)頂體反應(yīng)率及精子粘附卵的能力均無(wú)影響[12],但是該疫苗對(duì)小鼠的抗生育作用并不十分理想,免疫后僅能使小鼠的生育力降低30%左右,且與重組Crisp1蛋白相比,其免疫原性較低[5-6],因此要提高DNA疫苗的免疫原性,選擇一種合適的載體非常重要。
殼聚糖是一種天然的陽(yáng)離子聚合物,來(lái)源廣泛,價(jià)格低廉,具有較高的生物相容性和生物降解性,并且易與DNA結(jié)合形成納米微粒[13]。有文獻(xiàn)報(bào)導(dǎo)殼聚糖還具有免疫佐劑的功能,能優(yōu)化DNA疫苗接種的效果[14-15]。本實(shí)驗(yàn)采用經(jīng)典的復(fù)凝法制備殼聚糖/pcDNA3.1-Crisp1納米微粒,主要是利用殼聚糖與DNA疫苗之間的靜電作用和硫酸鈉對(duì)殼聚糖的鹽析作用,使殼聚糖分子和質(zhì)粒DNA分子復(fù)合壓縮并包裹纏繞,形成納米顆粒,然后從體系中析出形成殼聚糖-DNA疫苗納米粒膠體混懸液。采用這種方法制備的殼聚糖納米粒,在制備過(guò)程中未加入任何有機(jī)溶劑,制備條件溫和,從而保護(hù)了質(zhì)粒基因的結(jié)構(gòu)和功能。用紫外分光光度法檢測(cè)殼聚糖-DNA疫苗納米粒對(duì)質(zhì)粒DNA的包埋率,結(jié)果顯示在質(zhì)粒DNA濃度為100 μg/ml時(shí),殼聚糖對(duì)質(zhì)粒DNA的包埋率高達(dá)94%,而凝膠阻滯分析實(shí)驗(yàn)中,殼聚糖-DNA疫苗納米粒組質(zhì)粒DNA全部被阻滯在加樣孔中,證明質(zhì)粒DNA幾乎全部被殼聚糖包裹,與包埋率檢測(cè)結(jié)果一致。說(shuō)明采用該方法制備 CS/DNA納米粒切實(shí)可行。導(dǎo)致裸質(zhì)粒DNA免疫效應(yīng)低下的原因之一是其在體內(nèi)易被核酸酶降解,本實(shí)驗(yàn)中,采用DNase I消化實(shí)驗(yàn)檢測(cè)CS-pcDNA3.1-Crisp1納米復(fù)合物的抗核酸酶能力,結(jié)果發(fā)現(xiàn)當(dāng)DNase I濃度為25 U/ml,遠(yuǎn)超過(guò)生理劑量時(shí),CS-pcDNA3.1-Crisp1納米復(fù)合物能有效保護(hù)DNA不被降解。
納米粒能否被細(xì)胞有效吸收的兩個(gè)重要影響因素為納米粒的表面電荷和粒徑大小,帶正電的納米粒可以與帶負(fù)電的細(xì)胞膜進(jìn)行靜電作用,而殼聚糖-DNA基因傳遞系統(tǒng)主要通過(guò)內(nèi)吞或胞飲進(jìn)入細(xì)胞,因此納米粒徑的大小直接影響細(xì)胞對(duì)納米粒的吸收[16]。本實(shí)驗(yàn)所獲得的納米粒形態(tài)規(guī)則,大小均一,分散性好,且經(jīng)納米粒度分析儀檢測(cè)顯示納米粒Zeta電位為+0.2 mV,改變了DNA疫苗本身帶負(fù)電荷的性質(zhì),使其更容易通過(guò)細(xì)胞膜被機(jī)體吸收。
殼聚糖能否介導(dǎo)質(zhì)粒成功轉(zhuǎn)染至真核細(xì)胞中并獲得表達(dá)是實(shí)驗(yàn)關(guān)鍵點(diǎn)所在。本實(shí)驗(yàn)采用兩種不同的方法轉(zhuǎn)染COS-7細(xì)胞,結(jié)果顯示以殼聚糖納米粒為載體的pcDNA3.1-Crisp-1可在COS-7細(xì)胞中有效表達(dá),且與脂質(zhì)體轉(zhuǎn)染后表達(dá)部位一致。由于脂質(zhì)體可以改變所包裹藥物在體內(nèi)的分布,特異性地靶向腫瘤組織,提高藥物療效,降低藥物毒性,因此,近年來(lái),脂質(zhì)體作為藥物傳輸系統(tǒng)在抗癌藥物的制備中應(yīng)用廣泛[17],但其潛在的細(xì)胞毒性給脂質(zhì)體的應(yīng)用帶來(lái)了局限性。雖然有報(bào)道稱陽(yáng)離子脂質(zhì)體在細(xì)胞內(nèi)釋放核酸后會(huì)自我降解,但如果細(xì)胞攝入大量的陽(yáng)離子脂質(zhì)體,將對(duì)細(xì)胞產(chǎn)生較大的毒性作用,引起細(xì)胞凋亡或壞死[18]。在本實(shí)驗(yàn)中,采用MTT試驗(yàn)對(duì)兩種方法轉(zhuǎn)染后COS-7細(xì)胞的存活率進(jìn)行檢測(cè),結(jié)果顯示:與脂質(zhì)體Lipofectamine 2000TM轉(zhuǎn)染方法相比,殼聚糖組細(xì)胞存活率顯著高于脂質(zhì)體組(P<0.01),說(shuō)明殼聚糖微粒具有較小的細(xì)胞毒性和較高的安全性。
綜上所述,本實(shí)驗(yàn)成功地構(gòu)建了以殼聚糖納米微粒為載體的CRISP1-DNA避孕疫苗,并證實(shí)殼聚糖可作為有效地DNA避孕疫苗給藥載體,且安全無(wú)毒性。
致謝
感謝武漢大學(xué)物理學(xué)院納米中心周張凱博士和中國(guó)科學(xué)院水生所電鏡中心袁秀云老師在實(shí)驗(yàn)過(guò)程中給予的幫助與指導(dǎo)。
[1]Cohen DJ,Ellerman DA,Cuasnicú PS. Mammalian sperm-egg fusion:evidence that epididymal protein DE plays a role in mouse gamete fusion[J]. Biol Reprod,2000,63:462-468.
[2]Roberts KP,Wamstad JA,Ensrud KM,et al. Inhibition of capacitation-associated tyrosine phosphorylation signaling in rat sperm by epididymal protein Crisp-1[J]. Biol Reprod,2003,69:572-581.
[3]Visconti PE,Westbrook VA,Chertihin O,et al. Novel signaling pathways involved in sperm acquisition of fertilizing capacity[J]. J Reprod Immunol,2002,53:133-150.
[4]羅金,楊菁,徐望明,等. 小鼠富含半胱氨酸分泌蛋白-1真核表達(dá)載體的構(gòu)建及其在COS-7細(xì)胞中的表達(dá)[J]. 生殖與避孕,2010,30:509-513.
[5]羅金,楊菁,程琰,等. 小鼠富含半胱氨酸分泌蛋白-1DNA疫苗免疫避孕效果的評(píng)價(jià)[J]. 生殖與避孕,2013,33:145-148.
[6]Luo J,Yang J,Cheng Y,et al. Immunogenicity study of plasmid DNA encoding mouse cysteine-rich secretory protein-1 (mCRISP1) as a contraceptive vaccine[J]. Am J Reprod Immunol,2012,68:47-55.
[7]Wolff JA,Malone RW,Williams P,et a1. Direct gene transfer into mouse muscle in vivo[J]. Scienc,1990,247:1465-1468.
[8]Mansouri S,Cuie Y,Winnik F,et al. Characterization of folate-chitosan-DNA nanoparticles for gene therapy[J]. Biomaterials,2006,27:2060-2065.
[9]Guliyeva U,Oner F,Ozsoy S,et al. Chitosan microparticles containing plasmid DNA as potential oral gene delivery system[J]. Eur J Pharm Biopharm,2006,62:17-25.
[10]Busso D,Cohen DJ,Maldera JA,et al. A novel function for CRISP1 in rodent fertilization:involvement in sperm-zona pellucida interaction[J]. Biol Reprod,2007,77:848-854.
[11]Maldera JA,Weigel Muoz M,Chirinos M,et al. Human fertilization:epididymal hCRISP1 mediates sperm-zona pellucida binding through its interaction with ZP3[J]. Mol Hum Reprod,2014,20:341-349.
[12]羅金,劉雪麗,楊菁,等. 小鼠富含半胱氨酸分泌蛋白-1特異性抗體的抗生育作用機(jī)制[J]. 武漢大學(xué)學(xué)報(bào)(醫(yī)學(xué)版),2016,37:249-253.
[13]Aiba S. Solution stability and reactivity of partially N-acetylated chitosan derivatives in aqueous media[J]. Int J Biol Macromol,1989,11:249-252.
[14]Xu J,Dai W,Wang Z,et al. Intranasal vaccination with chitosan-DNA nanoparticles expressing pneumococcal surface antigen a protects mice against nasopharyngeal colonization by Streptococcus pneumoniae[J]. Clin Vaccine Immunol,2011,18:75-81.
[15]Sui Z,Chen Q,F(xiàn)ang F,et al. Cross-protection against influenza virus infection by intranasal administration of M1-based vaccine with chitosan as an adjuvant[J]. Vaccine,2010,28:7690-7698.
[16]Erbacher P,Zou S,Bettinger T,et al. Chitosan-based vector/DNA complexes for gene delivery:biophysical characteristics and transfection ability[J]. Pharm Res,1998,15:1332-1339.
[17]盛竹君,徐維平,徐婷娟,等. 脂質(zhì)體藥物傳輸系統(tǒng)的研究新進(jìn)展[J]. 中國(guó)藥業(yè),2015,24:6-8.
[18]林梟,崔韶暉,趙軼男,等. 陽(yáng)離子脂質(zhì)體的細(xì)胞毒性[J]. 生命的化學(xué),2016,36:50-56.
[編輯:侯麗]
Preparation of chitosan nanoparticles containing Crisp1-DNA contraceptive vaccine and its expression in vitro
LUO Jin,YANG Jing*,CHEN Yan,ZHANG Yi,XU Wang-ming
ReproductiveMedicalCenter,RenminHospitalofWuhanUniversity,Wuhan430060
Objective:To construct chitosan nanoparticles containing Crisp1 DNA contraceptive vaccine,determine its physical and biological characteristics,and evaluate its expression in COS-7 cells.
Cysteine-rich secretory protein-1(Crisp1);Chitosan;DNA vaccine;Immunocontraception;Nanoparticles
10.3969/j.issn.1004-3845.2016.10.018
2016-04-04;
2016-04-23
國(guó)家自然科學(xué)基金資助項(xiàng)目(81501306)
羅金,女,湖北天門人,博士,生殖醫(yī)學(xué)專業(yè).(*

