抑癌基因ST7L對卵巢癌細胞增殖、細胞周期和裸鼠移植瘤的影響
周聞,楊臻,劉民,湯華
(1.天津醫(yī)科大學基礎醫(yī)學院病原生物學系生命科學中心實驗室,天津300070;2.天津市天津醫(yī)院檢驗科,天津300211)
抑癌基因ST7L對卵巢癌細胞增殖、細胞周期和裸鼠移植瘤的影響
周聞1,2,楊臻1,劉民1,湯華1
(1.天津醫(yī)科大學基礎醫(yī)學院病原生物學系生命科學中心實驗室,天津300070;2.天津市天津醫(yī)院檢驗科,天津300211)
目的:研究ST7L基因?qū)θ祟惵殉舶┘毎礝VCAR3和SKOV3細胞增殖、細胞周期和體內(nèi)裸鼠成瘤模型的影響。方法:PCR擴增ST7L過表達質(zhì)粒(pcDNA3/ST7L),生物合成ST7L的敲降質(zhì)粒(pSilencer/ST7L);利用脂質(zhì)體轉(zhuǎn)染技術在卵巢癌細胞中過表達或者敲降ST7L基因,用熒光定量PCR、Western blot驗證質(zhì)粒的有效性;MTT、克隆形成實驗、流式細胞術檢測ST7L對OVCAR3和SKOV3細胞增殖能力、周期的影響;并通過裸鼠移植瘤實驗研究ST7L在體內(nèi)成瘤能力。結果:過表達和敲降ST7L質(zhì)粒是有效的;過表達ST7L后抑制了卵巢癌細胞生長,抑制了細胞G1/S期的轉(zhuǎn)化;過表達ST7L在體內(nèi)能夠有效抑制裸鼠的成瘤能力。結論:ST7L抑制OVCAR3和SKOV3細胞的增殖能力,抑制細胞周期進程,抑制體內(nèi)裸鼠成瘤能力。
抑癌基因ST7L;卵巢癌;移植瘤;細胞增殖;細胞周期;裸鼠
卵巢癌在女性腫瘤中是第二大常見腫瘤,但致死率卻是最高的;上皮細胞性卵巢癌約占卵巢癌的90%,因此,研究上皮細胞性卵巢癌對于了解卵巢癌的發(fā)生發(fā)展和治療具有重大意義[1-2]。據(jù)文獻報道,上皮細胞性卵巢癌的發(fā)生發(fā)展主要是由癌基因或者抑癌基因的異常表達所引起,抑癌基因的失活會導致腫瘤的形成和惡性轉(zhuǎn)化[3]。ST7L作為抑癌基因ST7的同源物被發(fā)現(xiàn)[4],但是其在卵巢癌中的功能及其分子機制目前還不清楚。本研究主要是在卵巢癌細胞系中通過MTT實驗、克隆形成實驗、細胞周期實驗對ST7L的功能進行探究并在裸鼠移植瘤中分析成瘤能力,確定ST7L在卵巢癌中的抑癌作用,為進一步研究其具體的分子機制奠定理論基礎。
1 材料和方法
1.1細胞系人卵巢癌細胞系OVCAR3和SKOV3為本實驗室保存,其培養(yǎng)條件為含有10%胎牛血清、100 μg/mL鏈霉素、100 IU/mL青霉素的RPMI-1640培養(yǎng)液,細胞置于37℃含5%CO2的細胞孵箱中培養(yǎng),每隔48~72 h用0.1%胰蛋白酶消化液消化細胞,進行傳代培養(yǎng)。
1.2質(zhì)粒構建
1.2.1過表達ST7L的質(zhì)粒構建(1)PCR制備插入的外源片段:循環(huán)溫度為:94℃5 min(預變性),94℃30 s(變性)、56℃30 s(退火)、72℃120 s(延伸)、33個循環(huán),72℃10 min(延伸),產(chǎn)物大小約為1 700 bp的片段,酶切位點為Kpn I和Eco RI。
上游引物ST7L-S序列為5′CAGGGGTACCGCC ACCATGGCGGACCGTGGCGGCGTG3′;下游引物ST7L-AS序列為5′CCGGAATTCGCCAGAACTCAAA CCTAGGTCTTC3′。(2)將回收PCR產(chǎn)物連接至已切好的pcDNA3載體上。
1.2.2生物合成ST7L的敲降質(zhì)粒上游引物為shR-ST7L-Top 5′GATCCAGTCCTCAGCATGAAGC TCAACTCGAGTTGAGCTTCATGCTGAGGACTTTTTT GA3′;下游引物為shR-ST7L-Bot 5′AGCTTCAAAA AAGTCCTCAGCATGAAGCTAACTCGAGTTGAGCTT CATGCTGAGGACTG3′。
1.3熒光定量PCR按照RNA提取試劑盒說明書步驟提取細胞總RNA。然后使用逆轉(zhuǎn)錄試劑盒將其逆轉(zhuǎn)錄為cDNA,使用CWBIO公司的SYBR Green MasterMix進行熒光定量PCR。PCR進行40個循環(huán),循環(huán)參數(shù)為(94℃30 s,58℃30 s,72℃30 s)。引物如下:ST7L上游引物序列,5′CGCGGATCCCCTCTG TGTGTGTGTGTGTAAC3′,下游引物序列,5′CCGGA ATTCGCATTCCTGGGCAGGTCGGT3′;β-actin上游引物序列,5′CGTGACATTAAGGAGAAGCTG3′,下游引物序列,5′CTAGAAGCATTTGCGGTGGAC3′。ST7L基因轉(zhuǎn)錄水平按照2-ΔΔCt法通過管家基因βactin進行校正。
1.4 Western blot用細胞裂解液RIPA從各組細胞中提取細胞全蛋白。蛋白樣品用10%SDS-PAGE跑膠后用濕法轉(zhuǎn)膜至PVDF膜上。5%脫脂牛奶室溫封閉2 h,4℃孵育ST7L(1∶2 000稀釋)和GAPDH(1∶5 000稀釋)一抗過夜。兔抗人多克隆抗ST7L抗體購自天津賽爾生物技術有限公司。充分洗膜后室溫孵育二抗1 h。羊抗兔二抗購自天津賽爾生物技術有限公司。再次洗膜后于暗室中顯影、定影,得到最終結果。
1.5 MTT 96孔板中分別轉(zhuǎn)染4組細胞,分別在轉(zhuǎn)染后48 h、72 h加入10 μL/孔5 mg/mL的MTT溶液;繼續(xù)37℃溫箱培養(yǎng)4~6 h,小心吸盡培養(yǎng)液,每孔加入100μL DMSO;避光振蕩溶解結晶后用酶標儀于570 nm處檢測吸光度OD值。每組實驗重復3次。
1.6細胞周期流式細胞術收集轉(zhuǎn)染后48 h的4組細胞,計數(shù)細胞,每管取6×105個細胞,然后嚴格按照周期檢測試劑盒說明書進行操作,后經(jīng)流式細胞儀檢測。該試劑盒購自凱基生物有限公司。
1.7裸鼠移植瘤模型由中國科學院動物中心購買6周大的BALB/c免疫缺陷的裸鼠,轉(zhuǎn)染過表達pcDNA3/ST7L質(zhì)粒和pcDNA3對照質(zhì)粒至OVCAR3細胞48 h后,計數(shù)1×106個細胞注射入裸鼠腋窩皮下。每組含5只裸鼠。剝離腫瘤觀察其大小。
2 結果
2.1過表達質(zhì)粒pcDNA3/ST7L和敲降質(zhì)粒pSilencer/ST7L有效我們擴增了ST7L的過表達片段并連接至pcDNA3載體,命名為pcDNA3/ST7L;生物合成的敲降質(zhì)粒命名為pSilencer/ST7L。圖1示,過表達ST7L后能夠明顯升高ST7L的mRNA和蛋白水平;敲降ST7L后能夠顯著降低ST7L的mRNA和蛋白水平。該結果表明所構建的質(zhì)粒是有效的。
2.2 ST7L抑制OVCAR3和SKOV3細胞的細胞活性圖2示,過表達ST7L后,48 h、72 h后的細胞活性明顯受到抑制;敲降ST7L后明顯促進幾個時間點的細胞活性。
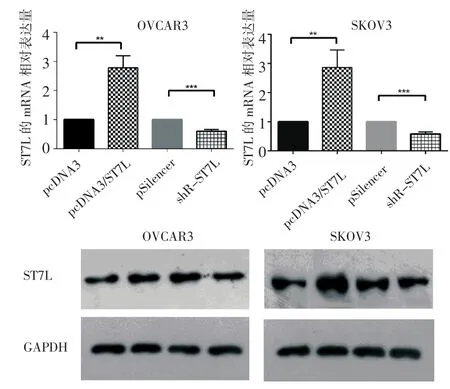
圖1 熒光定量PCR實驗和western b lot實驗驗證質(zhì)粒是有效的Fig 1 The plasm idsproved to be effective by RT-qPCR and western blot assay
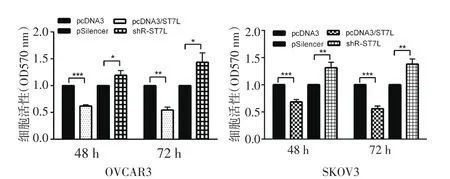
圖2 MTT實驗分析過表達ST7L抑制OVCAR3和SKOV3的細胞活性Fig 2 Overexpression of ST7L supressed cell viability of OVCAR3 and SKOV3 by MTT assay
2.3ST7L抑制OVCAR3和SKOV3細胞的集落形成能力集落形成實驗表明,在卵巢癌細胞中過表達ST7L后集落形成率較對照組明顯受到抑制,抑制率大約為30%;敲降后的集落形成能力明顯增強,增強了約1.4倍(圖3)。
2.4 ST7L抑制OVCAR3細胞G1/S期轉(zhuǎn)化流式細胞術檢測分析結果發(fā)現(xiàn),過表達ST7L能夠明顯抑制OVCAR3細胞G1/S的轉(zhuǎn)化,敲降ST7L后能夠有效地促進OVCAR3細胞G1/S期的轉(zhuǎn)化(圖4)。
2.5 ST7L抑制裸鼠成瘤的能力裸鼠移植成瘤模型實驗結果表明,過表達ST7L的裸鼠組裸鼠的成瘤能力明顯低于對照組,而且這種差異是有意義的(圖5)。
3 討論
2015年約有21 980例新增卵巢癌患者,14 270例患者死于該癌癥[5]。目前的治療手段主要為擴大性的手術治療以及鉑依賴的化療[6-7],70%~80%的癌癥病人可以獲得緩解性的手術治療,但是絕大部分患者是難以治愈的[8]。卵巢癌高致死率的原因部分是因為早期難以診斷,75%的患者診斷出來已經(jīng)到三期或是四期[9]。這些不斷增加的病例很難治療,導致5年的生存率低于30%[10],因此研究卵巢癌的分子機制、提高早期診斷率對于治療卵巢癌是有意義的。
ST7作為抑癌基因與wnt2基因成簇定位于7號染色體。Katoh等[4,11]通過生物信息學預測和cDNA-PCR確定了ST7的一個相關基因,并命名為ST7L,其包括有575個氨基酸。在乳腺癌、頭頸部鱗狀細胞癌、非小細胞性肺癌、腦膜瘤、黑色素瘤、急性淋巴癌等一系列癌癥中,由于等位基因的缺失或者人類染色體區(qū)域的重組,ST7L可能作為新的抑癌基因發(fā)揮作用。Chen等[12]報道,在神經(jīng)膠質(zhì)瘤細胞中,ST7L抑制細胞的增殖能力和侵襲能力,并且可以誘導細胞凋亡。我們查閱大量文獻[13-15]發(fā)現(xiàn),ST7L在卵巢癌中作用及其分子機制到目前為止鮮有報道。我們構建了ST7L的過表達和敲降質(zhì)粒,通過脂質(zhì)體轉(zhuǎn)染法轉(zhuǎn)染質(zhì)粒進入卵巢癌的OVCAR3和SKOV3兩種細胞系,并且驗證了質(zhì)粒有效性。MTT和克隆形成實驗表明,ST7L能夠抑制卵巢癌細胞的增殖能力;流式細胞術檢測細胞周期發(fā)現(xiàn),ST7L能夠阻滯細胞由G1期向S的轉(zhuǎn)化;裸鼠的移植瘤模型發(fā)現(xiàn),ST7L能夠抑制移植瘤的生長。
綜上所述,本研究可以確定ST7L在卵巢癌中作為抑癌基因影響著細胞的生長增殖能力以及細胞的周期轉(zhuǎn)化。這為進一步研究ST7L在卵巢癌中具體分子機制及其相關通路奠定了工作基礎,也為早期診斷卵巢癌找尋新的靶標分子提供了一定的參考價值。
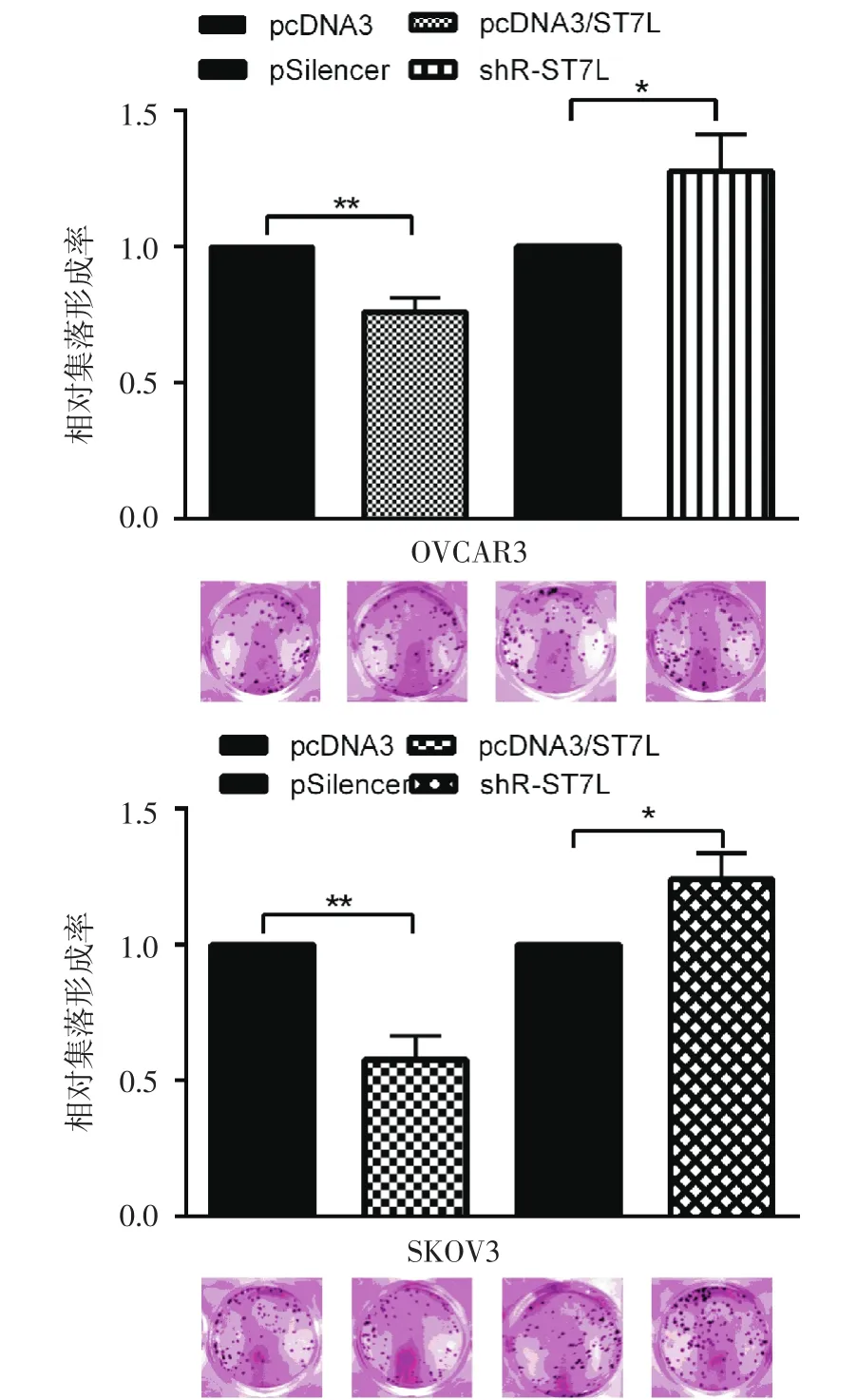
圖3 克隆形成實驗檢測ST7L對克隆形成能力的影響Fig 3 The effects of ST7L on colony formation rate by colony form ation assay
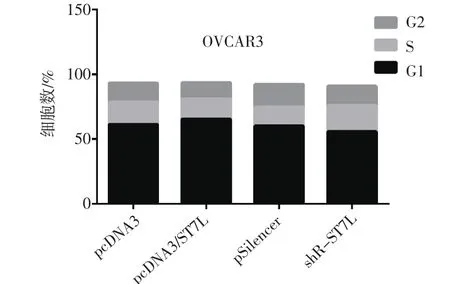
圖4 過表達ST7L阻滯OVCAR3細胞由G1期向S期轉(zhuǎn)化Fig 4 ST7L overexpressed inhibited G1/S progess of OVCAR3

圖5 裸鼠移植瘤模型分析ST7L對體內(nèi)成瘤能力的影響Fig 5 The effects of ST7L on grow th ability by tum or xenograft model in vivo
[1]Clarke-Pearson D L.Clinical practice.Screening for ovarian cancer[J].N Engl J Med,2009,361(2):170
[2]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
[3]Li S D,Zhang J R,Wang Y Q,et al.The role of microRNAs in ovarian cancer initiation and progression[J].J Cell Mol Med,2010,14(9):2240
[4]Kirikoshi H,Katoh M.Expression of ST7R(ST7-like,ST7L)in normal tissues and cancer[J].Int J Oncol,2002,21(1):193
[5]Siegel R L,Miller K D,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5
[6]Ozols R F,Bundy B N,Greer B E,et al.Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer:a Gynecologic Oncology Group study[J].J Clin Oncol,2003,21(17):3194
[7]Mcguire W P,Hoskins W J,Brady M F,et al.Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage IIIand stage IV ovarian cancer[J].NEngl JMed,1996,334(1):1
[8]Bristow R E,Tomacruz R S,Armstrong D K,et al.Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the Platinum era:a meta-analysis[J].J Clin Oncol,2002,20(5):1248
[9]Chester C,Dorigo O,Berek J S,et al.Immunotherapeutic approaches to ovarian cancer treatment[J].Immunother Cancer,2015,3:7
[10]Robertson D M.Screening for the early detection of ovarian cancer[J].Womens Health(Lond Engl),2009,5(4):347
[11]Saitoh T,Katoh M.Molecular cloning and characterization of mouse St7r(St7-like,St7l)[J].Int J Mol Med,2002,10(1):119
[12]Chen L,Zhang A,Li Y,et al.MiR-24 regulates the proliferation and invasion of glioma by ST7L via β-catenin/Tcf-4 signaling[J]. Cancer Lett,2013,329(2):174
[13]Kwak S Y,Yang J S,Kim B Y,et al.Ionizing radiation-inducible miR-494 promotes glioma cell invasion through EGFR stabilization by targeting p190B rhoGAP[J].Biochim Biophys Acta,2014,1843(3):508
[14]Katoh M.Cardio-miRNAs and onco-miRNAs:circulating miRNA-based diagnostics for non-cancerous and cancerous diseases[J]. Front Cell Dev Biol,2014,2:61
[15]Heo H S,Kim J H,Lee Y J,et al.Microarray profiling of genes different expressed during erythroid differentiation of murine erythroleukemia cells[J].Mol Cells,2005,20(1):57
(2016-03-11收稿)
Effects of ST7L on cell proliferation,cell cycle in ovarian cancer and tumour xenografts in nude m ice
ZHOU Wen1,2,YANG Zhen1,LIU Min1,TANG Hua1
(1.Life Science Research Center,Department of Pathogen Biology,Basic Medical School,Tianjin Medical University,Tianjin 300070,China;2.Department of Clinical Laboratory,Tianjin Hospital,Tianjin 300211,China)
Objective:To investigate the effects of ST7L on the proliferation,cell cycle in ovarian cancer and tumor xenograft in nude mice.M ethods:Ectopic expression plasmid of ST7L by PCR and compounded the knockdown plasmid were established.ST7L was overexpressed and knocked down in OVCAR3 and SKOV3 cells via lipidosome 2000 transfection.Fluorescence based quantitative polymerase chain reaction and western blot assay were used to analyze the expression of ST7L.MTT,colony formation assay and flow cytometry were applied to detect the effects of ST7L on the proliferation and cell cycle of OVCAR3 and SKOV3 cells after transfection.Tumor xenograft studies were used to observe the tumor growth in vivo.Results:The used plasmids were effective;the ectopic expression of ST7L suppressed the proliferation and cell cycle of OVCAR3 and SKOV3 cells,and the tumor growth was inhibited by over-expression of ST7L in vivo. Conclusion:ST7L could inhibit the proliferation and cell cycle of ovarian cells and tumor growth in nude mice.
ST7L;ovarian cancer;tumor xenograft;cell proliferation;cell cycle;nude mice
國家自然科學基金資助項目(91029714; 31270818;81572790);天津市自然科學基金資助項目(12JCZDJC25100)
周聞(1982-),女,碩士在讀,研究方向:病原生物學;通信作者:湯華,E-mail:htang2002@yahoo.com。
R737.31
A
1006-8147(2016)05-0373-04

