β片層阻斷肽H102對(duì)雙轉(zhuǎn)基因AD模型小鼠腦內(nèi)LPL和PPAR-γ表達(dá)的影響
李靖,付雪斐,孫鳳仙,袁小涌,王超,徐淑梅
(天津醫(yī)科大學(xué)生理學(xué)教研室,天津300070)
論著
β片層阻斷肽H102對(duì)雙轉(zhuǎn)基因AD模型小鼠腦內(nèi)LPL和PPAR-γ表達(dá)的影響
李靖,付雪斐,孫鳳仙,袁小涌,王超,徐淑梅
(天津醫(yī)科大學(xué)生理學(xué)教研室,天津300070)
目的:通過(guò)觀察β片層阻斷肽H102對(duì)PS1/APP雙轉(zhuǎn)基因阿爾茨海默病(AD)模型小鼠學(xué)習(xí)記憶能力以及腦中脂蛋白脂酶(LPL)及PPAR表達(dá)的影響,探究H102對(duì)AD治療作用的可能機(jī)制。方法:將AD模型小鼠隨機(jī)分為模型組和H102治療組,并將同月齡同背景C57BL/6J小鼠設(shè)為正常對(duì)照組,H102治療組小鼠鼻腔給予H102藥液,5 μL/d;模型組及正常組小鼠鼻腔給予輔料溶液,5 μL/d。連續(xù)給藥4周后進(jìn)行Morris水迷宮測(cè)試,檢測(cè)小鼠學(xué)習(xí)記憶能力,并應(yīng)用實(shí)時(shí)定量熒光PCR(real-time PCR)技術(shù)、Western Blot技術(shù)以及免疫組化法,觀察小鼠腦內(nèi)LPL和PPAR-γ表達(dá)的改變。結(jié)果:Real-time PCR技術(shù)、Western Blot技術(shù)以及免疫組化法均顯示,與模型組小鼠相比,H102治療組小鼠腦內(nèi)LPL和PPAR-γ的表達(dá)顯著增加(P<0.05)。
結(jié)論:β片層阻斷肽H102能夠增加AD小鼠腦內(nèi)LPL的表達(dá),從而進(jìn)一步促進(jìn)Aβ的細(xì)胞內(nèi)吞與降解,PPAR-γ可能參與其中。
β片層阻斷肽;阿爾茨海默癥;脂蛋白脂酶;PPAR-γ;PS1/APP雙轉(zhuǎn)基因小鼠
阿爾茨海默病(Alzheimer's disease,AD)是一種進(jìn)行性中樞神經(jīng)系統(tǒng)退行性疾病,其特征為記憶喪失和其他認(rèn)知惡化等[1]。臨床早期表現(xiàn)主要為患者記憶力的減退和生活自理能力的下降,最終導(dǎo)致發(fā)生進(jìn)行的認(rèn)知功能障礙和缺失、神經(jīng)行為異常,出現(xiàn)精神狀況及生活自理能力的完全喪失[2]。AD典型的病理改變是老年斑(senile plaque,SP)的形成以及神經(jīng)元纖維纏結(jié)(neurofibrillary tangle,NFT)[3]。AD的病因及發(fā)病機(jī)制非常復(fù)雜,有多種假說(shuō)被提出,但尚無(wú)肯定的假說(shuō)來(lái)完整地解釋AD的病因及其發(fā)病機(jī)制。SP沉積中的主要成分是β-淀粉樣肽(β-amyloidpeptide,Aβ),并且越來(lái)越多的證據(jù)表明,Aβ是AD形成和發(fā)展的關(guān)鍵因素[4-5]。Aβ的神經(jīng)毒性涉及復(fù)雜的分子機(jī)制,主要包括促進(jìn)自由基的形成,破壞細(xì)胞內(nèi)的Ca2+穩(wěn)態(tài),降低K+通道的功能以及增強(qiáng)致炎細(xì)胞因子引起炎癥反應(yīng)[6-13]。抑制Aβ的聚集或促進(jìn)Aβ的清除也是治療AD的一個(gè)重要手段。脂蛋白脂酶(LPL)主要表達(dá)在脂肪和肌肉,也高度表達(dá)在腦中,但其具體作用是未知的。然而,考慮到脂蛋白在大腦中的主要部分是高密度脂蛋白,它包含可忽略的或無(wú)三酰基甘油,而且大腦缺乏其重要輔助因子--apoCII,推測(cè)LPL在大腦中具有與催化三酰基甘油水解所不同的功能。在小鼠以及成人大腦的突觸重塑提示LPL具有一個(gè)潛在的新功能,即LPL結(jié)合Aβ,并促進(jìn)了細(xì)胞表面對(duì)Aβ的內(nèi)吞和吸收[14]。H102是由10個(gè)氨基酸組成的β片層阻斷肽,能夠預(yù)防或逆轉(zhuǎn)Aβ的錯(cuò)誤折疊和聚集[6-7,13],能夠減少AD模型小鼠腦內(nèi)Aβ的含量。然而,H102對(duì)于AD腦內(nèi)LPL基因的表達(dá)是否具有調(diào)控作用,是否通過(guò)LPL調(diào)節(jié)Aβ的內(nèi)化,進(jìn)而使Aβ含量減少、學(xué)習(xí)記憶能力提高尚不清楚。在本研究中我們對(duì)此進(jìn)行了探討。
1 材料和方法
1.1材料
1.1.1實(shí)驗(yàn)動(dòng)物6月齡PS1/APP雙轉(zhuǎn)基因小鼠30只,同背景同月齡C57BL/6J小鼠15只,重25.5~30.5 g,購(gòu)自中國(guó)醫(yī)學(xué)科學(xué)院醫(yī)學(xué)實(shí)驗(yàn)動(dòng)物研究所(雌雄由該研究所隨機(jī)提供),飼養(yǎng)于天津醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心SPF級(jí)實(shí)驗(yàn)室。
1.1.2藥品與試劑β片層阻斷肽H102由上海吉爾生物公司合成。LPL抗體和PPAR-γ抗體購(gòu)自美國(guó)ABCAM公司,即用型SABC免疫組化試劑盒和DAB顯色試劑盒購(gòu)自武漢博士德生物公司,Trans Start Top Green qPCR Super Mix試劑盒購(gòu)自北京全式金生物技術(shù)有限公司。
1.2方法
1.2.1動(dòng)物分組與給藥PS1/APP雙轉(zhuǎn)基因AD小鼠隨機(jī)分為2組:模型組和H102治療組,同背景同月齡C57BL/6J小鼠設(shè)為正常對(duì)照組,每組15只。動(dòng)物適應(yīng)性喂養(yǎng)1周后,采用鼻腔給藥方法,H102治療組用自制給藥器給予33 mg/mL藥液5 μL/d;正常對(duì)照組和模型組鼻腔給予等體積輔料溶液(稱(chēng)取0.5 g殼聚糖及0.1 g BSA溶于100 mL雙蒸水中,搖勻,即為輔料溶液),連續(xù)5周。之后進(jìn)行Morris水迷宮測(cè)試[6],取腦,一側(cè)腦組織放于-80℃凍存?zhèn)溆茫硪粋?cè)腦組織固定后進(jìn)行包埋切片。
1.2.2免疫組化組織石蠟切片常規(guī)脫蠟,蒸餾水沖洗;3%H2O2室溫避光孵育10 min,蒸餾水浸泡,2 min×3次;加0.01 mol/L枸櫞酸緩沖液中微波沸騰,沸騰后間隔10 min,再沸騰,取出冷卻至室溫,PBS浸泡,2 min×3次;滴加5%BSA封閉,室溫避光孵育15 min,傾去,勿洗;滴加稀釋好的一抗:LPL(1∶200),PPAR-γ(1∶200),4℃過(guò)夜,PBS沖洗,2 min×3次;滴加生物素標(biāo)記的羊抗鼠通用二抗,室溫孵育20 min,PBS沖洗,3 min×3次;滴加SABC液,避光室溫孵育20 min,PBS沖洗,5 min×3次;DAB顯色劑顯色:EP管中加入1 mL雙蒸水,A、B、C液各滴1滴,混勻,去離子水終止顯色反應(yīng)后充分沖洗;蘇木素復(fù)染,雙蒸水充分沖洗,鹽酸酒精分化,溫水反藍(lán),梯度酒精常規(guī)脫水,二甲苯透明,中性樹(shù)膠封片,于顯微鏡下觀察。陰性對(duì)照用0.01 mol/L PBS溶液代替一抗進(jìn)行實(shí)驗(yàn),其余步驟同上。
1.2.3 Western Blot根據(jù)組織質(zhì)量加入1∶10(m:v)的蛋白裂解液勻漿,提取蛋白。BCA法測(cè)定各組織的蛋白濃度,并用裂解液將各組織的蛋白濃度調(diào)至等濃度,充分混勻后按4∶1加入5×上樣緩沖液,混勻,煮沸5 min,即可直接上樣。配膠,上樣,電泳,轉(zhuǎn)膜,封閉,孵育,曝光顯色。LPL一抗?jié)舛葹?∶800;二抗?jié)舛葹?∶5 000。
1.2.4 Real-time PCR反應(yīng)體系為20 μL,反應(yīng)條件:預(yù)熱變性,95℃,5 min;變性,95℃,30 s;退火,59℃,30 s;延伸,72℃,30 s;共進(jìn)行40個(gè)循環(huán)的擴(kuò)增,72℃延伸8 min。每批實(shí)驗(yàn)均做標(biāo)準(zhǔn)曲線,實(shí)驗(yàn)中同步進(jìn)行內(nèi)參基因β-actin的定量檢測(cè),以目的基因與內(nèi)參基因相對(duì)濃度比作為目的基因的相對(duì)表達(dá)量。
2 結(jié)果
2.1 Morris 水迷宮結(jié)果顯示,給予H102治療組的小鼠逃避潛伏期比模型組要短的多,且H102組小鼠入水朝向角與模型組小鼠相比明顯減小,而跨越隱性平臺(tái)次數(shù)增多,證明β片層阻斷肽H102可以明顯改善PS1/APP雙轉(zhuǎn)基因AD小鼠的學(xué)習(xí)記憶能力。
2.2免疫組化染色
2.2.1 LPL免疫組化染色結(jié)果正常對(duì)照組海馬及大腦皮層著色明顯,LPL有明顯表達(dá);與正常對(duì)照組相比,模型組著色較淺,LPL表達(dá)降低,其差異有統(tǒng)計(jì)學(xué)意義(P<0.01);H102治療組與模型組相比,著色較深,LPL表達(dá)增加,其差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。H102治療組與正常對(duì)照組相比,無(wú)顯著性差異(P>0.05)。見(jiàn)圖1及圖2。

圖1 H102對(duì)PS1/APP雙轉(zhuǎn)基因小鼠大腦皮層及海馬LPL表達(dá)的影響(×400)Fig 1 The expression of LPL p rotein in m ouse brain detected byimmunohistochem istry(×400)
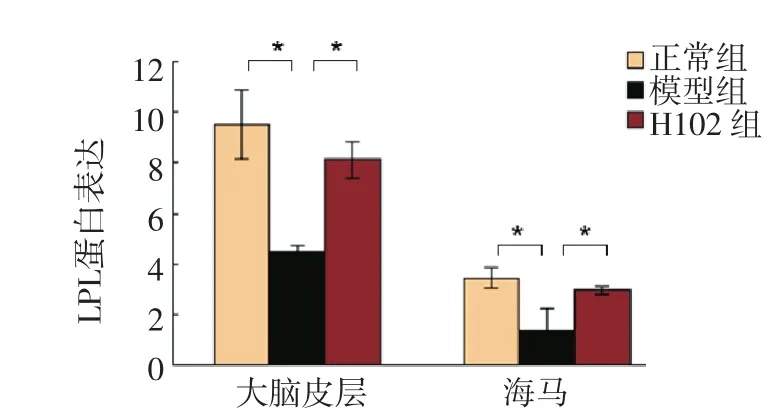
圖2 各組小鼠大腦皮層及海馬中LPL的表達(dá)Fig 2 The expression of LPL protein in mouse brain
2.2.2 PPAR-γ免疫組化染色結(jié)果正常對(duì)照組大腦皮層著色明顯,PPAR-γ有明顯表達(dá);與正常對(duì)照組相比,模型組著色較淺,PPAR-γ表達(dá)降低,其差異有統(tǒng)計(jì)學(xué)意義(P<0.01);H102治療組與模型組相比,著色較深,陽(yáng)性細(xì)胞增多,PPAR-γ表達(dá)增加,其差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。H102治療組與正常對(duì)照組相比,無(wú)顯著性差異(P>0.05)。見(jiàn)圖3及圖4。
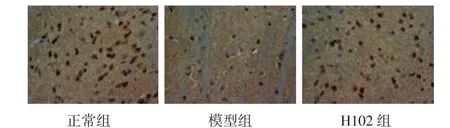
圖3 H 102對(duì)PS1/APP雙轉(zhuǎn)基因小鼠大腦皮層PPAR-γ表達(dá)的影響(×400)Fig 3 The expression of PPAR-γ protein in m ouse brain detected by immunohistochem istry(×400)
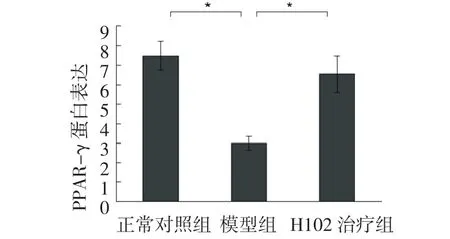
圖4 各組小鼠大腦皮層PPAR-γ的表達(dá)Fig 4 The expression of PPAR-γ protein in mouse brain
2.3 Western blot實(shí)驗(yàn)結(jié)果取小鼠海馬及皮層進(jìn)行勻漿提取蛋白質(zhì)。Westrn blot檢測(cè)結(jié)果顯示,LPL能夠出現(xiàn)明顯條帶。與正常對(duì)照組相比較,模型組小鼠蛋白條帶明顯變窄,LPL蛋白的表達(dá)量顯著減少,其差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與模型組相比,H102治療組的LPL蛋白表達(dá)量明顯升高,蛋白條帶明顯變粗,其差異有統(tǒng)計(jì)學(xué)意義(P<0.05);H102治療組與正常對(duì)照組相比較無(wú)顯著性差異(P>0.05)。見(jiàn)圖5。
2.4 Real time PCR實(shí)驗(yàn)結(jié)果
2.4.1 LPL與正常對(duì)照組比較,模型組LPL mRNA水平顯著降低(P<0.01);H102治療組LPL mRNA水平比模型組顯著性升高(P<0.01)。見(jiàn)圖6。

圖5 各組小鼠腦內(nèi)LPL蛋白的表達(dá)Fig 5 The expression of LPL protein in mouse brain by Western blot assay

圖6 各組小鼠腦內(nèi)LPL m RNA的相對(duì)表達(dá)Fig 6 The expression of LPL m RNA detected by real-tim e PCR
2.4.2 PPAR-γ與正常對(duì)照組比較,模型組小鼠腦內(nèi)PPAR-γ mRNA水平顯著降低(P<0.01);H102治療組小鼠腦內(nèi)PPAR-γ mRNA水平比模型組顯著性升高(P<0.01);H102治療組與正常對(duì)照組相比無(wú)顯著性差異(P>0.05)。見(jiàn)圖7。

圖7 各組小鼠腦內(nèi)PPAR-γ m RNA的相對(duì)表達(dá)Fig7 Theexpression ofPPAR-γmRNA detected by real-tim e PCR
3 討論
Aβ是AD形成和發(fā)展的關(guān)鍵因素。如果能抑制病理變化的起始階段或使已形成的斑塊溶解,將有助于疾病的根治。以Aβ為靶點(diǎn)開(kāi)發(fā)的藥物可通過(guò)抑制Aβ聚集,促進(jìn)Aβ降解和清除,從而達(dá)到減少Aβ毒性的作用[15]。前期研究發(fā)現(xiàn),β片層阻斷肽能夠與Aβ直接作用,從而預(yù)防或逆轉(zhuǎn)Aβ的錯(cuò)誤折疊和聚集[16]。在本研究中,我們應(yīng)用Morris水迷宮法測(cè)量PS1/APP雙轉(zhuǎn)基因AD小鼠空間學(xué)習(xí)和記憶的能力,結(jié)果表明,給予H102治療組的逃避潛伏期比模型組短,證明β片層阻斷肽H102可以明顯改善PS1/APP雙轉(zhuǎn)基因AD小鼠的學(xué)習(xí)記憶能力。
在前期工作中我們應(yīng)用基因芯片技術(shù)對(duì)PS1/ APP雙轉(zhuǎn)基因AD小鼠基因表達(dá)進(jìn)行了檢測(cè),結(jié)果發(fā)現(xiàn)多個(gè)基因表達(dá)的差異,其中就包括LPL。有研究發(fā)現(xiàn),LPL可以與Aβ結(jié)合,增加Aβ與細(xì)胞的親和力,從而促進(jìn)Aβ的細(xì)胞攝取以及進(jìn)一步的降解。此外,LPL減少可能促進(jìn)軸突病變[17-18]。LPL也可以是AD的保護(hù)因素,在腦內(nèi)可能通過(guò)脂類(lèi)的清除和回收,粘結(jié)功能和其它未識(shí)別的機(jī)制從而具有抗氧化應(yīng)激的作用[19-20]。在本研究中,我們發(fā)現(xiàn)LPL在AD模型組小鼠的大腦中表達(dá)減少,影響了Aβ的內(nèi)吞和降解效率,使得Aβ的聚集增加。而H102能夠影響腦內(nèi)LPL的表達(dá),H102治療組LPLmRNA水平和蛋白質(zhì)水平均較模型組上調(diào),這提示H102改善PS1/APP雙轉(zhuǎn)基因AD小鼠學(xué)習(xí)記憶能力的作用可能與通過(guò)增加LPL的表達(dá),促進(jìn)Aβ的攝取和降解,最終減少腦內(nèi)Aβ的形成和沉積有關(guān),也證明了LPL的確與AD的病理機(jī)制密切相關(guān)。
過(guò)氧化物酶體增殖物激活受體(peroxisome proliferator-activated receptor,PPAR)是調(diào)節(jié)目標(biāo)基因表達(dá)的核內(nèi)受體轉(zhuǎn)錄因子超家族成員[21]。根據(jù)結(jié)構(gòu)的不同,PPAR可分為α、β(或δ)和γ 3種類(lèi)型,其中PPAR-γ主要表達(dá)于脂肪組織及免疫系統(tǒng),其與胰島素抵抗、機(jī)體免疫反應(yīng)和脂肪細(xì)胞分化有不可分割的關(guān)聯(lián)[22]。PPAR-γ通過(guò)與其相應(yīng)的配體結(jié)合達(dá)到激活狀態(tài),激活后的PPAR-γ能夠進(jìn)一步與視黃醛X受體α(retinoid X receptor α,RXRα)相互作用而形成異二聚體,之后與特異性DNA序列相結(jié)合而活化靶基因,這個(gè)序列被稱(chēng)為PPAR特異性反應(yīng)元件(peroxisome proliferator responsive element,PPRE)。含有PPRE結(jié)構(gòu)的基因中就包括LPL[23]。PPAR-γ通過(guò)其調(diào)節(jié)相關(guān)基因表達(dá)的作用,在脂肪形成、糖脂代謝以及免疫系統(tǒng)中發(fā)揮著重要的作用,并且與多種疾病發(fā)生、發(fā)展相關(guān),例如糖尿病、肥胖、高血壓、癌癥等[24-25]。此外,PPARγ還能影響NFκB、信號(hào)轉(zhuǎn)錄子、激活蛋白-1介導(dǎo)的信號(hào)通路,通過(guò)抑制這些信號(hào)通路途徑的激活從而對(duì)靶基因啟動(dòng)子的激活和轉(zhuǎn)錄起到抑制作用[26-27]。因此,我們通過(guò)Real-time PCR技術(shù)發(fā)現(xiàn)腦內(nèi)有PPAR-γ的存在,同時(shí)檢測(cè)了給予H102后小鼠腦內(nèi)PPAR-γ表達(dá)的變化,H102治療組小鼠腦內(nèi)PPAR-γ表達(dá)水平較模型組上調(diào),免疫組化染色結(jié)果與之相符,均與LPL的表達(dá)變化趨勢(shì)相同。這些結(jié)果表明,β片層阻斷肽H102在腦內(nèi)可能通過(guò)影響PPAR-γ的活性從而調(diào)節(jié)LPL基因的表達(dá),進(jìn)一步促進(jìn)Aβ的內(nèi)吞和降解。
總之,在此項(xiàng)研究中,我們發(fā)現(xiàn)β片層阻斷肽H102能夠改善PS1/APP雙轉(zhuǎn)基因AD小鼠的學(xué)習(xí)記憶能力,其可能通過(guò)PPAR-γ直接調(diào)節(jié)LPL在腦內(nèi)的表達(dá)來(lái)促進(jìn)Aβ的細(xì)胞內(nèi)吞和進(jìn)一步的降解,從而達(dá)到治療效果。我們的發(fā)現(xiàn)說(shuō)明H102不僅僅能夠直接作用于Aβ,使Aβ的聚集減少,而且能夠通過(guò)影響PPARγ-LPL的表達(dá)來(lái)間接促進(jìn)Aβ的降解,其作用途徑不是單一的,而是多靶點(diǎn)、多方式的。本研究也為AD的發(fā)病機(jī)制探索以及β片層阻斷肽H102對(duì)AD治療作用機(jī)制的研究提供了依據(jù)。
[1]Zhong Z G,Lü L,Chai L M,et al.Effect of panax notoginseng saponins on APP gene transcription in the brain tissue of SAMP8[J]. Zhong Yao Cai,2011,34(1):77
[2]孫欣,楊宇.β淀粉樣蛋白在阿爾茨海默病中所致的細(xì)胞內(nèi)毒性作用[J].中風(fēng)與神經(jīng)疾病雜志,2011,28(3):277
[3]Hardy J,Selkoe D J.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353
[4]Robinson S R,Bishop G M.Abeta as a bioflocculant:implications for the amyloid hypothesisofAlzheimer'sdisease[J].NeurobiolAging,2002,23(6):1051
[5]Schaeffer E L,F(xiàn)igueiro M,Gattaz W F.Insights into Alzheimer disease pathogenesis from studies in transgenic animal models[J]. Clinics(Sao Paulo),2011,66(Suppl 1):45
[6]宋明,李梅,林來(lái)祥,等.H102對(duì)APP轉(zhuǎn)基因小鼠腦內(nèi)IDE和NEP表達(dá)的影響[J].天津醫(yī)科大學(xué)學(xué)報(bào),2010,16(4):566
[7]李梅,林來(lái)祥,徐淑梅.H102對(duì)APP轉(zhuǎn)基因小鼠膽堿能系統(tǒng)及自由基的影響[J].中國(guó)新藥與臨床雜志,2009,28(2):106
[8]孫鳳仙,王曼,徐艷玲,等.β片層阻斷肽聯(lián)合人臍帶間充質(zhì)干細(xì)胞對(duì)APP轉(zhuǎn)基因鼠的治療作用[J].中國(guó)應(yīng)用生理學(xué)雜志,2013,29(3):239,292
[9]王曼,徐淑梅,馬志紅.H102對(duì)APP轉(zhuǎn)基因小鼠突觸相關(guān)蛋白表達(dá)的影響[J].天津醫(yī)藥,2010,38:405
[10]Larson M E,Lesné S E.Soluble Aβ oligomer production and toxicity[J].J Neurochem,2012,120(Suppl 1):125
[11]Tanzi R E,Moir R D,Wagner S L.Clearance of Alzheimer's abeta peptide:the many roads to perdition[J].Neuron,2004,43(5):605
[12]單媛莉,常富業(yè).阿爾茨海默病藥物治療的概述與展望[J].現(xiàn)代中西醫(yī)結(jié)合雜志,2013,22(6):670
[13]趙娟,徐淑梅.β片層阻斷肽對(duì)淀粉樣β蛋白聚集和毒性的抑制作用[J].中國(guó)新藥與臨床雜志,2008,27(9):675
[14]Nishitsuji K,Hosono T,Uchimura K,et al.Lipoprotein lipase is a novel amyloid beta(Abeta)-binding protein that promotes glycosaminoglycan-dependent cellular uptake of Abeta in astrocytes[J].J Biol Chem,2011,286(8):6393
[15]Li C Y,Zhao R,Gao K,et al.Astrocytes:implications for neuroinflammatory pathogenesis of Alzheimer's disease[J].Curr Alzheimer Res,2011,8(1):67
[16]Xiang L L,Yu B X,Zhen T Y,et al.Feasibility of β-sheet breaker peptide-H102 treatment for Alzheimer's disease based on βamyloid hypothesis[J].PLoS One,2014,9(11):e112052
[17]Vitiello G,Grimaldi M,Ramunno A,et al.Interaction of a betasheet breaker peptide with lipid membranes[J].J Pept Sci,2010,16(2):115
[18]Wang H,Astarita G,Taussig M D,et al.Deficiency of lipoprotein lipase in neurons modifies the regulation of energy balance and leads to obesity[J].Cell Metab,2011,13(1):105
[19]Baum L,Wiebusch H,Pang C P.Roles for lipoprotein lipase in Alzheimer'sdisease:an association study[J].Microsc Res Tech,2000,50(4):291
[20]Blain J F,Aumont N,Théroux L,et al.A polymorphism in lipoprotein lipase affects the severity of Alzheimer's disease pathophysiology[J].Eur J Neurosci,2006,24(5):1245
[21]Schild R L,Sonnenberg-Hirche C M,Schaiff W T,et al.The kinase p38 regulates peroxisome proliferator activated receptor-gamma in human trophoblasts[J].Placenta,2005,27(2/3):191
[22]Lapsys N M,Kriketos A D,Lim-Fraser M,et al.Expression of genes involved in lipid metabolism correlate with peroxisome proliferatoractivated receptor gamma expression in human skeletal muscle[J].J Clin Endocrinol Metab,2000,85(11):4293
[23]Auwerx J,Schoonjans K,F(xiàn)ruchart J C,et al.Transcriptional control of triglyceride metabolism:fibrates and fatty acids change the expression of the LPL and apo C-III genes by activating the nuclear receptor PPAR[J].Atherosclerosis,1996,124(Suppl):S29
[24]Coon K D,Myers A J,Craig D W,et al.A high-density wholegenome association study reveals that APOE is the major susceptibility gene for sporadic late-onset Alzheimer's disease[J].J Clin Psychiatry,2007,68(4):613
[25]Ma J J,Chai J,Shang Y Y,et al.Swine PPAR-γ2 expression upregulated in skeletal muscle of transgenic mice via the swine Myozenin-1 gene promoter[J].Transgenic Res,2015,24(3):409
[26]Shibata N,Motoi Y,Tomiyama H,et al.Lack of genetic associations of PPAR-γ and PGC-1α with Alzheimer's disease and Parkinson's disease with dementia[J].Dement Geriatr Cogn Dis Extra,2013,3(1):161
[27]Wang R S,Li J J,Diao S Y,et al.Metabolic stress modulates Alzheimer's β-secretase gene transcription via SIRT1-PPARγ-PGC-1 in neurons[J].Cell Metab,2013,17(5):685
(2016-03-03收稿)
Effects of β-sheet breaker peptide H 102 on LPL and PPAR-γ protein in double transgenic AD m ice
LI Jing,F(xiàn)U Xue-fei,SUN Feng-xian,YUAN Xiao-yong,WANG Chao,XU Shu-mei
(Department of Physiology,Tianjin Medical University,Tianjin 300070,China)
Objective:To observe the effects of H102 on the learning ability and memory and the expression of LPL and PPAR-γ in PS1/ APP transgenic AD mice.M ethods:PS1/APP transgenic AD mice were random ly divided into two groups:model group and H102 treatment group,while C57BL/6J mice were normal group.The treatment group
33 mg/mL liquid for 5 μL/d,while the normal group and model group were given with an equal volume of materials solution for 4 weeks.After that,the spatial learning ability and memory was tested by Morris Water Maze.Immunohistochemical test,Western blot and quantitative real-time PCR were used to test the expression of LPL.The quantitative real-time PCR and immunohistochemical test were also used to examine the expression of PPAR-γ.Results:Immunohistochemical test,Western blot and quantitative real-time PCR indicated the expression of LPL and PPAR-γ in the model group were decreased significantly than the H102 group(P<0.05).Conclusion:β-sheet breaker peptide-H102 may work via regulating the expression of LPL so as to promote the degradation of Aβ,and PPAR-γ may be involved in the procedure.Those findings also prove that LPL in the brain may be highly correlated with the pathogenesis of AD.
β-sheet breaker peptide-H102;Alzheimer's disease;LPL;PPAR-γ;PS1/APP transgene mice
R338
A
1006-8147(2016)05-0396-05
李靖(1990-),女,碩士在讀,研究方向:生理學(xué);通信作者:徐淑梅:E-mail: xushm@tijmu.edu.cn。

